响应面分析法优化黑豆中皂苷的提取工艺及其抗氧化性研究
2017-06-05薛成虎高立国李改琴王二荣
李 霄,薛成虎,弓 莹,高立国,李改琴,王二荣
(榆林学院化学与化工学院 榆林市农产品深加工重点实验室,陕西榆林 719000)
响应面分析法优化黑豆中皂苷的提取工艺及其抗氧化性研究
李 霄,薛成虎,弓 莹,高立国,李改琴,王二荣
(榆林学院化学与化工学院 榆林市农产品深加工重点实验室,陕西榆林 719000)
以黑豆为原料,对黑豆皂苷的提取工艺进行了优化。通过单因素实验,分别考察了提取剂、溶剂浓度、料液比、提取温度、提取时间、原料颗粒度、pH等因素对皂苷得率的影响。并在单因素的基础上,采用Box-Behnken响应面法对黑豆皂苷提取工艺进行优化,建立了二次多项式回归方程的预测模型。研究结果表明,黑豆皂苷的最佳提取工艺是80% 乙醇、提取温度80 ℃、料液比1∶45 (g/mL)、提取时间150 min、原料粒径40 目、pH9,皂苷得率为0.72%。抗氧化活性研究表明黑豆皂苷对DPPH自由基、羟基自由基和超氧阴离子自由基均有良好的清除能力,IC50值分别为0.0506,0.148,0.172 mg/mL。由响应面法优化得到的黑豆皂苷的提取工艺方便可行,得到的黑豆皂苷具有较强的抗氧化活性,值得进一步开发利用。
黑豆,皂苷,提取工艺,响应面法,抗氧化性
黑豆为豆科植物大豆(Glycinemax(L.)merr)的黑色种子。黑豆营养丰富,富含粗蛋白、不饱和脂肪酸和人体必需氨基酸,还含有对人体健康有益的多种生理活性物质,如低聚糖、皂苷、异黄酮等[1-3]。植物皂苷是一种天然生物活性物质,由糖和皂苷元构成,既有药疗又有食用功效,并且具有良好的抗氧化活性,能抑制细胞膜上的脂质过氧化反应、保护机体生物大分子[4-5],还可以有效清除生物体内自由基。据报道,大豆皂苷具有抗病毒、抗氧化[6-8]、抗肿瘤[9-11]、溶血[12-13]、降血脂[14-15]和免疫调节作用[16],还可以作为稳定剂、乳化剂和风味改良剂、发泡剂和表面活性剂等,广泛用作食品、药品以及化妆品的添加剂。另外还有报道称大豆皂苷可防止动脉粥样硬化,延缓细胞衰老,延长生命等作用。
目前对黑豆的研究主要集中于对黑豆多酚[17]、黄酮[18]、异黄酮[19-20]、黑豆色素[21]等成分的提取工艺和抗氧化性的研究,以及黑豆的发酵工艺的研究[22-23],对于黑豆皂苷的提取工艺以及其抗氧化活性报道极少。本实验采用响应面法优化黑豆皂苷的最佳提取工艺,并在多种体系中研究皂苷的体外抗氧化活性,旨在为黑豆皂苷的综合利用提供理论依据。
1 材料与方法
1.1 材料与仪器
黑豆 榆林市市售;齐墩果酸标样:纯度98% 西安汇林生物科技有限公司;邻二氮菲、邻苯三酚、硫酸亚铁铵、磷酸二氢钠、磷酸氢二钠、三羟甲基氨基甲烷、DPPH(二苯基苦基苯肼)、硫代硫酸钠、双氧水、碘化钾、可溶性淀粉、抗坏血酸(VC)、焦性没食子酸、冰乙酸、盐酸(36%~38%)、无水乙醇、甲醇、丙酮、石油醚、乙腈、乙酸乙酯等均为分析纯 购自天津市科密欧化学试剂有限公司和国药集团化学试剂有限公司。
JH722S可见分光光度计 上海菁华科技仪器有限公司;KQ2200DV型数控超声波清洗器 昆山市超声仪器有限公司;202-O台式电热干燥箱 中国天津泰斯特仪器有限公司;SZCL-2数显智能控温磁力搅拌器 巩义市予华仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市科瑞仪器有限公司;HH-1数显恒温水浴锅 上海亚荣生化仪器厂;WK-200B小型高速粉碎机 潍坊市北方制药设备制造有限公司;ESG60-4型电子天平 沈阳龙腾电子有限公司。
1.2 实验方法
1.2.1 皂苷标准曲线的绘制 先准确称取齐墩果酸标准品10 mg,然后把它倒入100 mL容量瓶中,用95%的乙醇溶解并定容到刻度线,配制成0.1 mg/mL的标准溶液,分别准确量取0、0.4、0.6、0.8、1.0、1.2 mL于1~6号的6个10 mL的具塞试管中,在70 ℃恒温水浴锅上面蒸干,然后在试管中加入刚配好的0.2 mL的5%的香草醛-冰醋酸溶液,0.8 mL高氯酸,在60 ℃的恒温水浴锅上加热显色15 min,然后放到冰水中冷却,最后加5 mL冰醋酸,充分摇匀,以空白试剂为对照,在最佳的波长下测定2~6号显色溶液的吸光度A,然后以溶液浓度为横坐标,显色溶液的吸光度A为纵坐标,绘制标准曲线。
1.2.2 皂苷的提取及含量测定 准确量取0.1 mL皂苷提取液于10 mL具塞试管中,在70 ℃恒温水浴锅上面蒸干,然后在试管中加入刚配好的0.2 mL的5%的香草醛-冰醋酸溶液,0.8 mL高氯酸,在60 ℃的恒温水浴锅上加热显色15 min,然后放到冰水中冷却,最后加5 mL冰醋酸,充分摇匀,以空白试剂为对照,在最佳波长下测定吸光度,根据回归方程计算样品溶液中皂苷的含量,根据如下公式计算黑豆中皂苷得率[24-25]。
黑豆中皂苷得率(%)=CV/W÷1000×100
其中,C为样品溶液中总皂苷含量(mg/mL),V为样品溶液的总体积(mL),W为黑豆质量(g)。
1.2.3 单因素实验
1.2.3.1 提取剂对皂苷得率的影响 分别称取5.0 g粒径为40 目的黑豆粉,置于7个200 mL的两口烧瓶中,料液比1∶20 g/mL,分别采用蒸馏水、99.5%丙酮、99.5%乙酸乙酯、99.7%无水乙醇、99.5%甲醇、99.9%乙腈、99.9%石油醚,温度为80 ℃,pH7,回流60 min,对黑豆中皂苷进行提取,按照1.2.2方法测定皂苷得率。
1.2.3.2 乙醇浓度对皂苷得率的影响 分别称取2.0 g粒径为40 目的黑豆粉,置于6个200 mL的两口烧瓶中,料液比1∶40 g/mL,分别采用乙醇浓度分别为50%、60%、70%、80%、90%、99.5%,温度80 ℃,pH7,回流60 min的条件下,对黑豆中皂苷进行提取,按照1.2.2方法测定皂苷得率。
1.2.3.3 料液比对皂苷得率的影响 分别称取2.0 g粒径为40 目的黑豆粉,置于6个200 mL的两口烧瓶中,料液比分别为1∶10、1∶20、1∶30、1∶40、1∶50、1∶60 g/mL,温度80 ℃,80%乙醇,pH7,回流60 min的条件下,对黑豆中皂苷进行提取,按照1.2.2方法测定皂苷得率。
1.2.3.4 提取温度对皂苷得率的影响 分别称取2.0 g粒径为40 目的黑豆粉,置于6个200 mL的两口烧瓶中,料液比为1∶40 g/mL,温度分别在40、50、60、70、80、90 ℃,80%乙醇,pH7,回流60 min的条件下,对黑豆中皂苷进行提取,按照1.2.2方法测定皂苷得率。
1.2.3.5 原料粒径对皂苷得率的影响 分别称取2.0 g粒径分别为20、40、60、80、100 目的黑豆粉,置于5个200 mL的两口烧瓶中,料液比为1∶40 g/mL,温度分别为80 ℃,80%乙醇,pH7,回流60 min的条件下,对黑豆中皂苷进行提取,按照1.2.2方法测定皂苷得率。
1.2.3.6 提取时间对皂苷得率的影响 分别称取2.0 g粒径为40 目的黑豆粉,置于6个200 mL的两口烧瓶中,料液比为1∶40 g/mL,温度为80 ℃,80%乙醇,pH7,分别回流60、90、120、150、180、210 min,对黑豆中皂苷进行提取,按照1.2.2方法测定皂苷得率。
1.2.3.7 提取剂pH对皂苷得率的影响 分别称取2.0 g粒径为40 目的黑豆粉,置于6个200 mL的两口烧瓶中,料液比为1∶40 g/mL,回流150 min,温度为80 ℃的条件下,80%的乙醇溶液的pH分别为1、3、5、7、9、11,对黑豆中皂苷进行提取,按照1.2.2方法测定皂苷得率。
1.2.4 响应面法优化提取工艺 应用Box-Behnken中心组合设计原理,优化黑豆皂苷提取工艺[26],在单因素实验结果的基础上,采用40 目的黑豆为原料,提取剂pH9,提取时间为150 min,以黑豆总皂苷得率为响应值Y,以乙醇浓度(X1)、料液比(X2)、提取温度(X3)作为自变量,设计中心组合实验。实验因素和水平见表1。
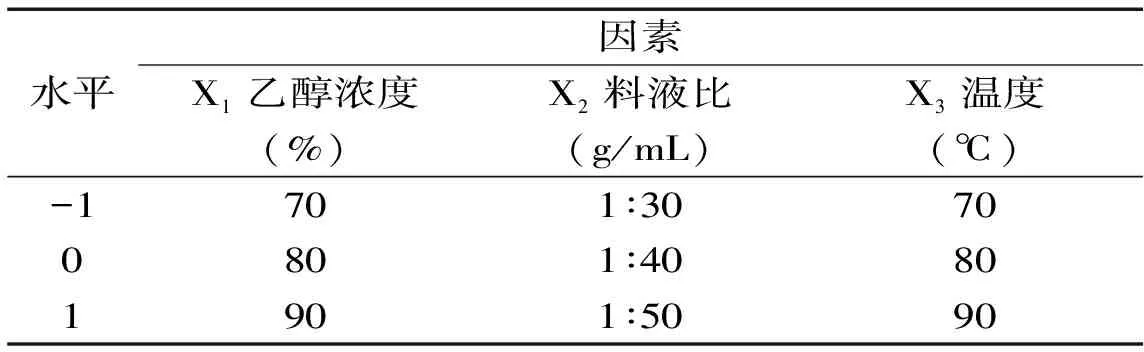
表1 响应面实验因素水平表
1.2.5 黑豆皂苷的抗氧化能力测定
1.2.5.1 羟自由基的生成及清除率的测定 取8支50 mL具塞试管,依次加入1.0 mL 7.5 mmol/L的邻二氮菲,2.0 mL的PBS缓冲溶液(pH为7.4,下同)和1.0 mL 7.5 mmol/L的FeSO4,边加边摇匀后,加入1.0 mL 0.1% H2O2,再用蒸馏水定容至50 mL刻度线,置37 ℃恒温水浴锅反应60 min,在510 nm处测其吸光度A3,按上述操作步骤,用蒸馏水代替1.0 mL 0.1% H2O2,定容至50 mL刻度线,置37 ℃水浴锅反应60 min,在510 nm处测其吸光度A2,在测损伤组的基础上再加不同体积的皂苷提取液,按上述步骤一样,PBS缓冲溶液作为参比,在510 nm处测其吸光度A1;以VC作对照[27]。
清除率(%)=(A1-A3)/(A2-A3)×100
式中:A1-样品组吸光值;A2-未损伤组吸光值;A3-损伤组吸光值。
1.2.5.2 超氧阴离子的生成及清除率测定 吸取4.4 mL 0.05 mol/L pH为8.2的Tris-HCl缓冲溶液,置于25 ℃恒温水浴中预热20 min,分别加入0.1 mL不同浓度的样品溶液,再加入已在25 ℃恒温水浴中预热的2.5 mmol/L的邻苯三酚5.5 mL开始反应,混匀后继续置于25 ℃水浴反应4 min后,加入浓度为10.0 mol/L的HCl溶液2滴终止反应,用蒸馏水作参比,于325 nm处测定吸光值,再以相同浓度的VC作对照实验[28]。超氧阴离子清除率按如下公式计算:
清除率(%)=[1-(A1-A2)/A0]×100
其中:A0-不含样品溶液的吸光值;A1-含有样品溶液的吸光值;A2-含样品溶液但不含邻苯三酚的吸光值。
1.2.5.3 DPPH·的生成及清除率测定 准确吸取不同浓度的样品溶液3.0 mL,分别与2.0 mL 2.00×10-4mol/L DPPH·溶液混合,摇匀后避光放置30 min。以相对应的溶剂(2.0 mL蒸馏水与2.0 mL无水乙醇的混合溶液)为对照,用分光光度计分别测定上述溶液在517 nm处的吸光度值Ai,以相同浓度的VC溶液做对照。准确吸取不同浓度的样品溶液3.0 mL,分别与2.0 mL蒸馏水混合均匀后,以蒸馏水为对照,用分光光度计分别测定各混合液在波长517 nm处的吸光度值Aj,以相同浓度的VC溶液做对照。准确吸取2.00×10-4mol/L DPPH溶液2.0 mL,与水混合均匀后,以相对应的溶剂(2.0 mL蒸馏水与2.0 mL无水乙醇的混合溶液)为对照,用分光光度计测定上述溶液在517 nm处的吸光度值A0
将以上数据代入下列公式计算其清除率[29]。
清除率(%)=[(A0-Ai+Aj)/A0]×100
其中:Ai为皂苷样品溶液和VC溶液与等体积DPPH·溶液混合后在波长517 nm处的吸光度值;Aj为皂苷样品溶液和VC溶液与等体积溶剂混合后在波长517 nm处的吸光度值;A0为DPPH溶液与等体积溶剂混合后在波长517 nm处的吸光度值。
清除率为50%时,所需抗氧化剂的浓度即为半数抑制率IC50值(mg/mL)。
2 结果与分析
2.1 标准曲线绘制
齐墩果酸标准曲线如图1所示,回归方程为:y=14.114x-0.0679,相关系数R2为0.9992。黑豆中皂苷溶液在0.0067~0.02 mg/mL浓度范围内,呈现良好的线性关系,可以用此标准曲线计算黑豆皂苷的含量。
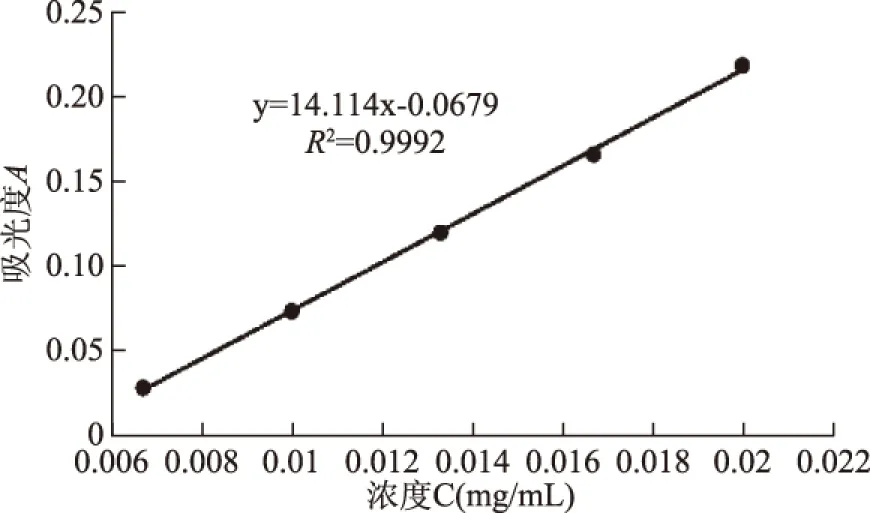
图1 齐墩果酸标准曲线Fig.1 Oleanolic acid standard curve
2.2 各因素对黑豆皂苷得率的影响
2.2.1 提取剂对皂苷得率的影响 以皂苷得率比较不同提取剂的效果如图2所示。实验结果表明:提取剂类型对总皂苷得率影响比较大,其中无水乙醇的提取效果最好。因此,以下实验均采用无水乙醇作为提取剂。
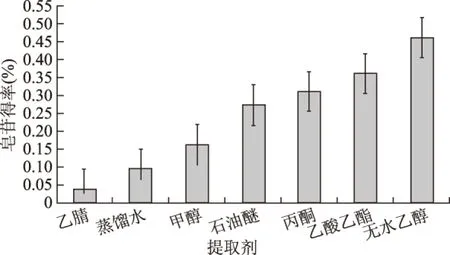
图2 提取剂的选择Fig.2 Selection of extracting solvents
2.2.2 乙醇浓度对皂苷得率影响 如图3所示,结果表明:总皂苷得率随乙醇浓度的升高而升高,乙醇浓度达80%时皂苷得率达最大值。乙醇浓度进一步增大,皂苷含量反而下降,这可能是由于高浓度的乙醇会增加其中蛋白质和糖类等杂质的溶出,与皂苷类化合物竞争乙醇,从而导致皂苷类化合物的得率下降,因此,本实验选80%的乙醇作为提取皂苷的最佳提取浓度,并选定乙醇浓度在70%、80%、90%作为响应面实验的水平。

图3 乙醇浓度对皂苷得率的影响Fig.3 Effect of ethanol concentration on extraction rate of saponins
2.2.3 料液比对皂苷得率的影响 如图4所示,结果表明:随着溶剂比例的增加,黑豆中皂苷的得率逐渐增大,当料液比达到1∶40 g/mL时,皂苷得率达最高,进一步增加溶剂比例,皂苷得率反而下降。可能是由于溶剂量的增加使物料与溶剂接触面积、溶剂传质推动力均增大,有利于总皂苷的溶出,从而皂苷溶出速度和得率变大,当料液比一定时,得率达最高,溶剂比例继续增加,溶剂体积增加使得物料吸附溶剂的量也逐渐变大,从而导致总皂苷被物料吸附而不易溶出。故选取1∶40 g/mL作为提取黑豆皂苷的最佳料液比。并选定料液比1∶30、1∶40、1∶50 g/mL作为响应面实验的水平。
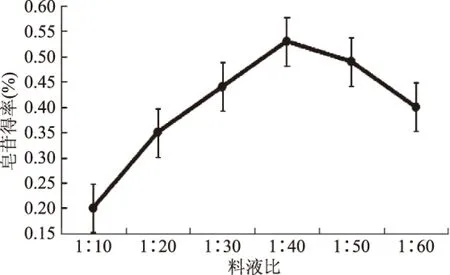
图4 料液比对皂苷得率的影响Fig.4 Effect of solid-liquid ratio on extraction rate of saponins
2.2.4 提取温度对皂苷得率的影响 比较提取温度对皂苷得率的影响如图5所示,结果表明:黑豆中皂苷的得率随着提取温度的升高而增大,当温度达到80 ℃时,皂苷得率达到最大值,提取温度进一步升高,皂苷得率反而下降,因为过高的温度破坏黑豆中活性成分,并且杂质溶出量增大,所以黑豆皂苷得率下降。选择提取温度为80 ℃,并选定温度70、80、90 ℃为响应面实验水平。
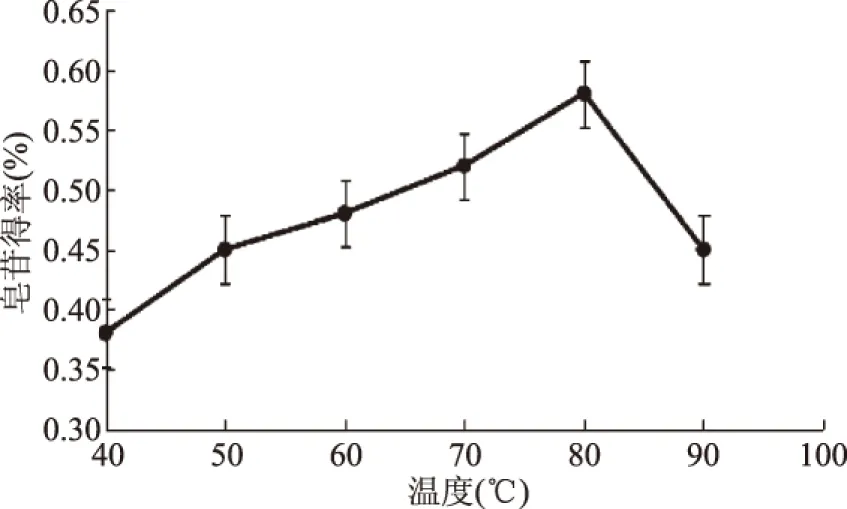
图5 提取温度对皂苷得率的影响Fig.5 Effect of temperature on extraction rate of saponins
2.2.5 黑豆粒径对皂苷得率的影响 如图6所示,实验结果表明:原料粒径大小对皂苷得率影响明显,随着粒径的减小,皂苷得率先增大后减小,在40目时达到最高,这是因为随着粒径逐渐减小,杂质逐渐被分出,原料可以与溶剂充分混合,使得率明显增加,但是,粒径进一步减小,提取液粘度增加,不利于黑豆皂苷的溶出,且部分黑豆颗粒也被阻隔,造成极大的浪费,综合考虑,原料粒径为40目是皂苷提取的最佳粒径。
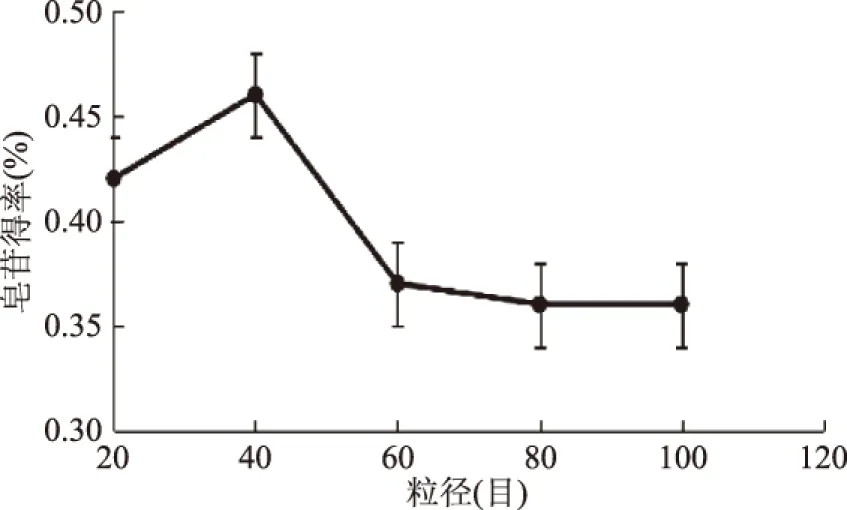
图6 粒径目数对皂苷得率的影响Fig.6 Effect of sieve mesh on extraction rate of saponins
2.2.6 提取时间对皂苷得率的影响 如图7所示,实验结果表明:随着提取时间的延长,黑豆中皂苷的得率逐渐增大,在150 min时皂苷得率最高,但150 min以后,皂苷得率有所下降。可能是因为随着浸提时间的增长,脂溶性物质增加,溶液变粘稠,阻止黑豆皂苷的溶出,从而导致皂苷得率的下降。因此,皂苷提取的最佳提取时间为150 min。
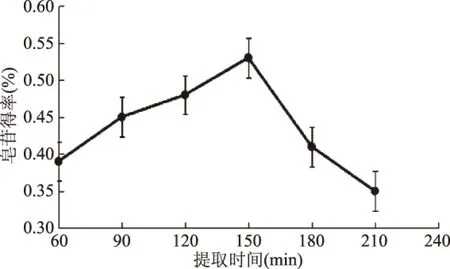
图7 提取时间对皂苷得率的影响Fig.7 Effect of time on extraction rate of saponins
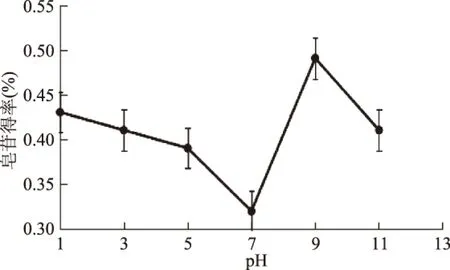
图8 pH对皂苷得率的影响Fig.8 Effect of pH on extraction rate of saponins
2.2.7 提取剂pH对皂苷得率的影响 以皂苷得率比较不同酸碱度的提取剂对皂苷得率的影响,如图8所示,实验结果表明:提取剂在酸性条件下,皂苷得率明显低于提取剂在碱性条件下的得率,且在碱性范围内,随着pH的增大,皂苷得率逐渐增大,在pH9时达到最大,进一步增大pH,皂苷得率反而下降。可能的原因是在酸性条件下皂苷的结构容易被破坏,而在弱碱性条件下皂苷稳定。因此提取剂最佳的pH为9。

表3 回归模型的方差分析
注:p<0.0100表示该指标极显著;p<0.0500表示该指标显著;p>0.0500表示该指标不显著。
2.3 响应面法分析
2.3.1 实验设计与结果 在单因素实验的基础上,确定以颗粒度为40目的黑豆为原料,溶剂pH为9,提取时间为150 min,以乙醇浓度、料液比、提取温度为考察因素,以黑豆皂苷得率为实验指标,根据Box-Behnken组合实验设计原理,设计3因素3水平响应面实验,结果如表2所示。
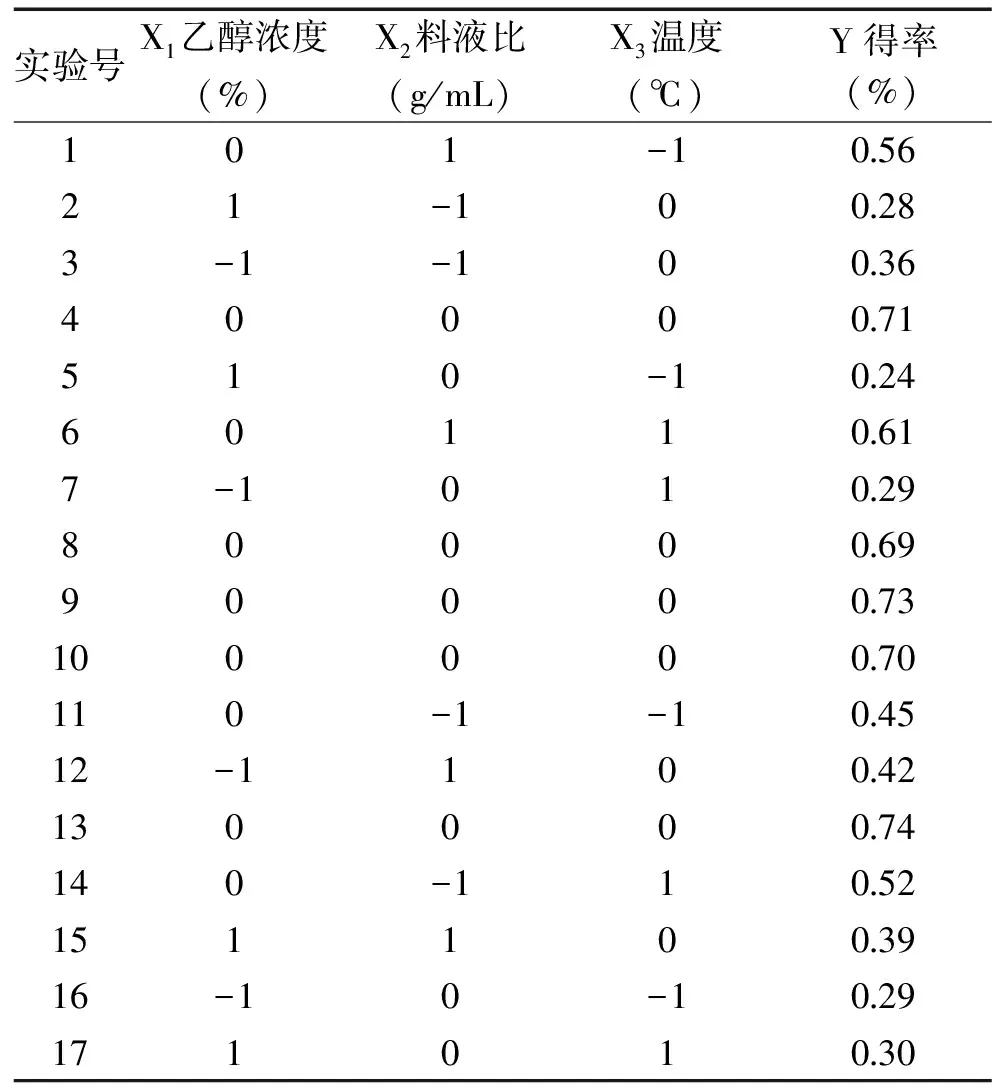
表2 Box-Behnken组合实验设计及结果
2.3.2 方差分析及二次回归模型的拟合 应用Design Expert软件对表2中实验结果进行分析,方差分析结果如表3所示。各因素对黑豆皂苷得率的影响并非简单的线性关系,采用软件对黑豆皂苷得率进行二次多项回归模型拟合,回归方程为:
Y(%)=0.71-0.019X1+0.046X2+0.022X3+0.012X1X2+0.015X1X3-(5.000E-003)X2X3-0.30X12-0.048X22-0.13X32。
方程的显著性分析得F=141.28,相应的概率值p<0.01,表明该方程模型极显著,不同处理间的差异高度显著。失拟项p为0.5110,不显著,表明非实验因素对实验结果影响不大,说明该模型适合黑豆皂苷提取条件的筛选。
在一次项中,料液比X2对提取物得率影响达到极显著水平(p<0.01),在二次项中,乙醇浓度X12,料液比X22,温度X32均达到了极显著水平(p<0.01)。这表明,三个因素与黑豆皂苷得率有直接的关系,是主要的限制因素,其较小变化都会引起得率显著的变化。由p值的大小比较可得提取的影响因素的顺序为:料液比>温度>乙醇浓度。
2.3.3 提取工艺的响应面分析与优化 响应面图形是响应值皂苷得率对应于实验因素乙醇浓度、料液比、温度所构成的三维空间曲面图,可以直观反映各个实验因素之间的交互作用对黑豆皂苷得率的影响。图9显示,皂苷得率与乙醇浓度和温度的等高线呈圆形,二者没有明显的交互作用,温度较低时,得率随乙醇浓度的增大而增大,随着温度的升高,增加幅度减小甚至下降。表明不同的温度下,乙醇浓度对得率的影响不同;由图10可以看出,乙醇浓度和料液比没有明显的交互作用,得率随乙醇浓度增大先增加后减小;图11显示,料液比和温度没有明显的交互作用,较低温度下,随着液料比的增大,黑豆皂苷得率增加,较高温度,得率随液料比增大而减小。
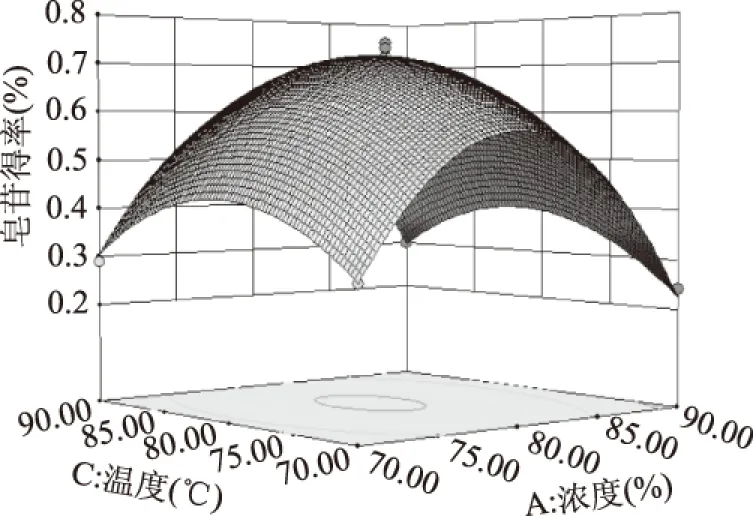
图9 乙醇浓度和温度对皂苷得率交互影响的响应面图Fig.9 Response surface diagram for extraction yield of saponin as a synergetic function of ethanol concentration and temperature
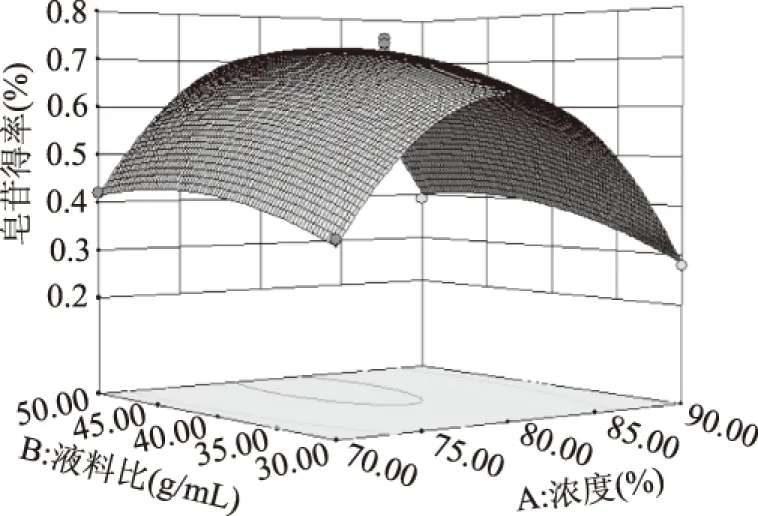
图10 乙醇浓度和料液比对皂苷得率交互影响的响应面图Fig.10 Response surface diagram for extraction yield of saponin as a synergetic function of ethanol concentration and solid-liquid ratio
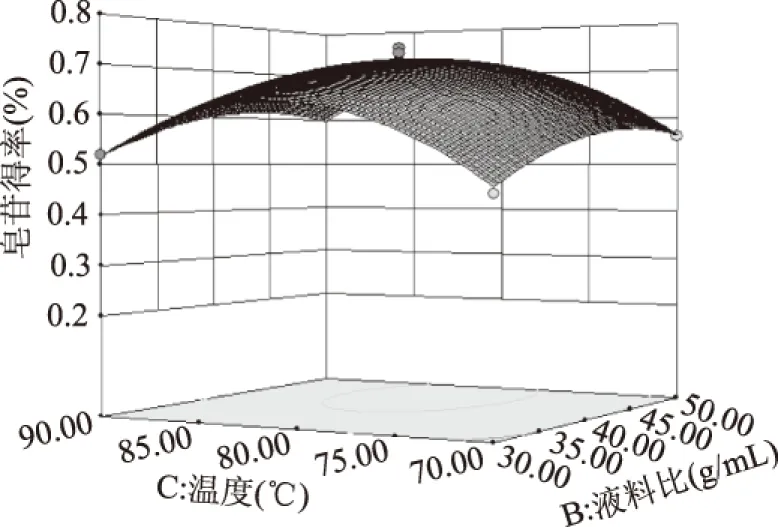
图11 料液比和温度对皂苷得率交互影响的响应面图Fig.11 Response surface diagram for extraction yield of saponin as a synergetic function of solid-liquid ratio and temperature
2.3.4 最佳工艺条件的确定及验证实验 利用Design Expert软件对实验模型进行典型性分析,得到黑豆中皂苷的最优提取条件:以颗粒度为40 目的黑豆粉为原料,溶剂pH为9,提取150 min,乙醇浓度为79.81%,提取温度为80.77 ℃,料液比为1∶44.72 g/mL,黑豆皂苷得率预测值为0.74%。为了验证响应面法的可行性,采用获得的最佳提取工艺条件,考虑到实际操作的便利,按照乙醇浓度为80%,提取温度为80 ℃,料液比为1∶45 g/mL,进行黑豆皂苷的提取实验,重复三次,求平均得率为0.72%。结果表明,黑豆皂苷在优化后的得率与最大得率的预测值很接近,实际值与预测值有很好的拟合性。充分验证了所建模型的有效性,说明回归方程可以反映各因素对皂苷得率的影响。
2.4 黑豆皂苷的抗氧化活性研究
2.4.1 黑豆中皂苷对DPPH·的清除作用 由图12可以看出,黑豆中皂苷对DPPH·清除率随着皂苷浓度的增加而增强,当皂苷浓度为0.057 mg/mL时清除率为70.46%;而随着VC浓度的增加,VC清除率逐渐增加,当VC浓度为0.057 mg/mL时,清除率为73.39%。结果表明,黑豆中皂苷对DPPH·清除率与VC相比略低,但皂苷浓度越高,清除率越好。黑豆皂苷的IC50值为0.0506 mg/mL。

图12 皂苷对DPPH·的清除作用Fig.12 Scavenging effect of saponins on DPPH radicals
2.4.2 黑豆中皂苷对羟自由基的清除作用 由图13可知,随着黑豆中皂苷浓度的增加,对羟基自由基的清除率增加,当皂苷浓度为0.16 mg/mL时对羟基自由基的清除率为51.38%,相同浓度的VC,对羟基自由基的清除率为55.56%。说明皂苷浓度在0~0.16 mg/mL范围内,对羟基自由基的清除能力与VC相比略低,但浓度越大越接近,黑豆皂苷的IC50值为0.148 mg/mL。

图13 皂苷对羟基自由基的清除作用Fig.13 Scavenging effect of saponins on hydroxyl radicals

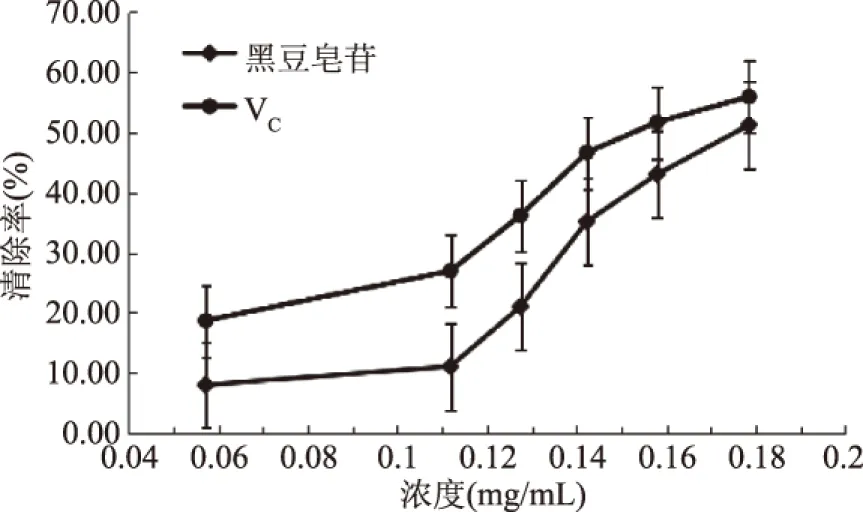
图14 皂苷对超氧阴离子的清除作用Fig.14 Scavenging effect of saponins on superoxide anion radicals
3 结论
根据Box-Behnken组合实验设计原理和响应面法可知,各因素对黑豆皂苷得率的影响并不是简单的线性关系,而是一个多元二次的复杂关系,黑豆皂苷的最佳提取条件组合为:以颗粒度为40目的黑豆粉为原料,80%的乙醇为提取剂,溶剂pH为9,料液比为1∶45 g/mL,提取温度为80 ℃,提取150 min,在此条件下黑豆皂苷的得率为0.72%,这种优化的提取方法可以为黑豆皂苷的工业化生产提供一定的技术指导。
黑豆皂苷清除DPPH自由基、羟基自由基和超氧阴离子的IC50分别是0.0506,0.148,0.172 mg/mL,清除效果表明,黑豆皂苷具有良好的清除自由基的能力,且抗氧化能力与皂苷质量浓度有关。本研究为黑豆皂苷的开发提供一定的参考依据。
[1]丛建民.黑豆的营养成分分析研究[J].食品工业科技,2008(4):262-264.
[2]聂刚,刘朝霞,杜双奎,等.陕北小粒黑豆营养成分分析与评价[J].营养学报,2014,36(5):511-513.
[3]秦琦,张英蕾,张守文.黑豆的营养保健价值及研究进展[J].中国食品添加剂,2015(7):145-150.
[4]李佳,王成章,严学兵,等.植物皂苷生物活性研究进展[J].草业科学,2012,29(3):488-494.
[5]王晶,刘春明,白鹤龙,等.中药中皂苷类化合物的抗氧化活性评价研究[J].时珍国医国药,2010,21(6):1485-1487.
[6]孟凡钢,富健,王新风,等.大豆皂甙研究进展与应用[J]. 中国农业科技导报,2007(4):66-72.
[7]孙权,刘淑萍,金爱花,等.大豆皂甙体外抗氧化活性研究[J].食品科技,2010(3):72-75.
[8]杨光,顾雪峰,韩俊.大豆皂甙的提取、生理功能及应用进展[J].大豆通报,2005(6):23-26.
[9]Rao A V,Sung M K. Saponins as anticarcinogens[J]. J Nutr,1995,125:717.
[10]郁利平,徐桂珍,邓伟国,等.大豆皂甙对S180腹水肉瘤细胞表面电荷的影响及抑瘤作用[J].实用肿瘤学杂志,1992,4:11-12.
[11]郁利平.大豆皂苷对小鼠抑制肿瘤生长的影响[J].中国癌症杂志,1996,6(3):186.
[12]张元,杜江,许建阳,等.吉祥草总皂苷溶血、止咳、化痰、抗炎作用的研究[J].武警医学,2006,17(4):282-284.
[13]王俊伟.大豆皂苷的提取分离及其溶血、止咳祛痰研究[D].合肥:合肥工业大学,2007.
[14]孙加源,杜立坤,杜立杰,等.复方大豆皂甙冲剂治疗高脂血症的临床研究[J].中医药学报,2004,32(1):8-9.
[15]肖军霞,彭光华,张声华.大豆皂甙预防小鼠高脂血症的作用及其分子机制研究[J].营养学报,2005,27(2):147-150.
[16]董文彦,高学敏.大豆皂甙的免疫增强作用[J].中国粮油学报,2001,16(6):9-11.
[17]刘杰,张英蕾,张守文.黑豆多酚类物质研究进展[J].中国食品添加剂,2016(7):207-212.
[18]刘洋,郭晓雨,孙殿奎,等.不同产地黑豆黄酮提取物的抗氧化能力比较研究[J].人参研究,2012(1):21-23.
[19]郭婕,刘中华,袁淑培,等.黑豆中大豆异黄酮微波提取工艺的优化[J].食品工业科技,2015,36(5):255-257.
[20]豆亚静,张晓龙,常丽新,等.响应面优化超声波法提取黑豆异黄酮的工艺研究[J].食品工业科技,2013,34(5):259-263.
[21]朱宏达,张慧,张美荣,等.黑豆红色素的提取工艺及其理化性质的研究[J].中国食品添加剂,2009(1):86-90.
[22]刘畅,江连洲,李小雅,等.响应面法优化黑豆纳豆的制取工艺研究[J].食品工业科技,2015,36(22):262-266.
[23]方道赠,周学海,郑小乐.黑豆酒生产工艺的研究[J].农产品加工,2011(9):64-66.
[24]彭爱红,熊何健,颜宇航.太子参总皂苷的含量测定方法研究[J].四川师范大学学报:自然科学版,2006,29(6):743-746.
[25]李健,张令文,刘宁,等.苦瓜总皂苷提取工艺的研究[J].食品工业科技,2005,26(10):117-119.
[26]陈俭清,高凌飞,任涌志,等.响应面法优化丁香叶总皂苷提取工艺[J].食品工业科技,2016,37(10):320-328.
[27]郭雪峰,岳永德,孟志芬,等.用清除羟自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2010,30(2):508-511.
[28]郭雪峰,岳永德,汤锋,等.用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(8):1823-1826.
[29]王玉丽,任海伟,李志忠,等.用清除DPPH自由基法评价药黑豆色素的抗氧化能力[J].食品工业科技,2009(8):102-105.
Optimization of extraction technology by response surface methodology and inoxidizability of saponins from black bean
LI Xiao,XUE Cheng-hu,GONG Ying,GAO Li-guo,LI Gai-qin,WANG Er-rong
(Yulin Civic Key Laboratory of Further Processing of Agricultural Products,School of Chemistry and Chemical Engineering,Yulin University,Yulin 719000,China)
In this paper,black beans as raw material,the response surface methodology(RSM)was used to optimize the extraction process of saponins from black bean. Based on one-factor-at-a-time experiments,extract yield of the saponins was used as response for establishing a quadratic regression model. The effects of solvent and solvent concentration,solid-liquid ratio,extraction temperature and time,particle size,pH on the yield of saponins from black beans were investigated. The study results showed that the optimum conditions for extraction of saponin from black bean as follows:extraction solvent 80% ethanol,extraction temperature 80 ℃,solid-liquid ratio 1∶45(g/mL),extract for 150 min,particle size 40 mesh of raw materials,pH9,the yield of saponins from black beans was 0.72%. The antioxidant activity study showed that abilities of saponins in black beans to scavenge DPPH and hydroxyl radical and superoxide anion were good and the half-scavenging concentration(IC50)were 0.0506,0.148,0.172 mg/mL respectively. Optimization of the extraction process by RSM of saponins of black bean is convenient and feasible. Saponins of black bean has good antioxidant activity and is worth to develop for application.
black beans;saponins;extraction technology;response surface;oxidation resistance
2016-10-28
李霄(1983-),女,硕士,实验师,主要从事天然产物的提取与分析,E-mail:lixiaoylxy2010@163.com。
榆林市科技局计划项目(2014 cxy-01)。
TS201.2
B
1002-0306(2017)09-0235-07
10.13386/j.issn1002-0306.2017.09.036
