甜茶黄酮回收工艺及抗氧化性研究
2017-06-05刘程程张彩云郑奎玲陈显刚廖莉玲
刘程程,张彩云,郑奎玲,陈显刚,廖莉玲,*
(1.贵州师范大学化学与材料科学学院,贵州贵阳 550001; 2.贵阳护理职业学院,贵州贵阳 550081; 3.贵州省健康茶叶科技有限公司,贵州黔南 558100)
甜茶黄酮回收工艺及抗氧化性研究
刘程程1,2,张彩云1,郑奎玲1,陈显刚3,廖莉玲1,*
(1.贵州师范大学化学与材料科学学院,贵州贵阳 550001; 2.贵阳护理职业学院,贵州贵阳 550081; 3.贵州省健康茶叶科技有限公司,贵州黔南 558100)
在原有生产甜茶素工艺的基础上,探究了总黄酮的回收工艺;同时以维生素C为参照对甜茶总黄酮清除·OH和DPPH·的能力进行了检测。按照工厂的生产工艺在实验室模拟实验,采用紫外可见分光光度法测定各阶段的总黄酮含量。结果表明:采用75%的乙醇洗脱聚酰胺树脂上的黄酮,黄酮的洗脱率为91.33%,洗脱液旋干得到的总黄酮的含量为36.30%。75%的乙醇洗脱液经过FL-3树脂进一步纯化,旋干所得产品总黄酮含量可达62.70%,得率为1%(以甜茶叶计)。对纯化后的甜茶总黄酮样进行紫外扫描光谱和高效液相色谱分析,初步判断样品中含有芦丁、槲皮素。由甜茶总黄酮的抗氧化活性的实验得知,甜茶总黄酮的抗氧化活性很高;清除·OH的能力:粗黄酮>精黄酮>维生素C;在清除DPPH·的能力方面,当浓度大于0.08 mg/mL以后,粗黄酮、精黄酮和维生素C的清除能力区别不大;在低于0.08 mg/mL时,实验结果同样是粗黄酮>精黄酮>维生素C。
甜茶,总黄酮,抗氧化性,回收工艺
甜茶(RubussuavissimusS. Lee),属于蔷薇科悬钩子属多年生多刺灌木,在贵州省主要分布在黔东南、黔北等部分县市,且资源藏量丰富。甜茶生长在海拔1000多米的高山上,在民间被称为“神茶”,是防治心脑血管疾病和抗癌的佳品[1]。黄酮类化合物具有抗炎、抗过敏、抗氧化、抑制脂质过氧化反应、预防心血管疾病等多种生理功能[2]。甜茶的主要活性成分为甜茶素、甜茶多酚、甜茶黄酮,目前的主要研究集中在甜茶素上[3],而含量较多的甜茶多酚、甜茶黄酮在生产甜茶素的过程中则作为废弃物弃掉。已有研究表明,甜茶黄酮具有抗肿瘤、抗氧化等生物活性[4-5]。因此本研究是在原有生产甜茶素工艺的基础上,探究总黄酮的回收工艺,提高甜茶的综合利用,减少资源浪费;同时本研究还对不同含量甜茶黄酮的抗氧化活性进行了研究,以期为甜茶黄酮的开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
甜茶 贵州健康茶科技有限公司;芦丁 贵州迪大科技有限责任公司;槲皮素 上海源叶生物科技有限公司;D101树脂 沧州宝恩吸附材料有限公司;707阴离子树脂、732阳离子树脂 江苏省色可塞思树脂有限公司;聚酰胺100目 国药集团化学制剂有限公司;FL-3 天津欧瑞生物科技有限公司;维生素C 分析纯,成都市科龙化工试剂厂;二苯基苦味酰基苯肼 东京化成株式会社;三羟甲基氨基甲烷 杭州鑫瑞达化工有限公司;邻苯三酚 北京中生瑞泰科技有限公司;其余试剂均为分析纯;实验所用水均为二次蒸馏水。
Agilent6890高效液相色谱 安捷伦科技有限公司;TU-1900双光束紫外可见分光光度计 北京普析通用仪器有限公司;恒温水浴锅、FZ102型微型植物粉碎机、101-1A型电热恒温鼓风干燥箱 天津泰斯特仪器有限公司;A200S型电子天平 Germany;循环水式多用真空泵 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 树脂预处理 聚酰胺树脂的预处理:参考文献[6]中的方法处理。707阴离子树脂、732阳离子树脂的预处理:参考文献[7]中的方法处理。
1.2.2 生产甜茶素的工艺中各阶段总黄酮的含量确定 现有的甜茶素生产工艺流程为:甜茶提取液→过D101树脂→用3 BV的75%乙醇洗脱D101→洗脱液过707阴离子树脂→732阳离子树脂→再过聚酰胺树脂→浓缩后喷雾干燥过柱液→最后得到淡黄色的甜茶素产品。因此我们首先测定生产各环节黄酮的含量,进而考虑其回收工艺。
1.2.2.1 样液的制备 称取一定量甜茶粗粉,按料液比1∶10用蒸馏水回流提取2次,第一次提取时间1 h,第二次提取时间为2 h,滤去滤渣并合并两次的滤液得甜茶提取液。提取液过D101树脂直至吸附饱和,先用水冲洗柱子,直至流出液无色,然后用3 BV的75%乙醇溶液洗脱,得到D101的洗脱液,D101的洗脱液以2 BV/h的流速依次过预处理好的707阴离子树脂(35 mL)、732阳离子树脂(17 mL)和聚酰胺树脂(30 mL)。将从每根树脂的流出液中取出一定量的溶液,显色后测定其中总黄酮的含量。前一柱子的滤出液作为后一柱子的上样液。
总黄酮的损失量=树脂上样液的黄酮的含量-滤出液黄酮的含量
式(1)
1.2.2.2 黄酮含量的测定方法 以芦丁为标准品,用分光光度法测定总黄酮的含量[8]。
芦丁标准曲线的绘制方法:准确配制芦丁标准品0.216 mg/mL,准确吸取不同体积的芦丁溶液置于6只25 mL的容量瓶中,加95%乙醇至6.0 mL;再加入1.0 mL的5% NaNO2溶液,摇匀,静置6 min;加入1.0 mL的10% Al(NO3)3溶液,摇匀,静置6 min;加入10.0 mL的4.0% NaOH溶液,加水稀释至刻度,摇匀,静置15 min,在510 nm波长处测定标准系列的吸光度,以芦丁对照品的浓度为横坐标,吸光度为纵坐标进行线性回归并绘制标准曲线。线性关系为:Y=12.993X+0.0089,R2=0.9997。
样品溶液中总黄酮含量测定:分别准确吸取一定量的样品溶液替代芦丁溶液按照标准曲线绘制方法显色后定容,并以蒸馏水作空白,于510 nm测定其吸光度,将吸光度值代入标准曲线,并按式(2)计算就可得到生产甜茶素的工艺中各阶段总黄酮的含量。
式(2)
式中:X-样品中总黄酮含量(mg),C-校准曲线中黄酮的浓度(mg/mL),V1-定容体积即25 mL,V2-样品溶液总体积(mL),V3-取样体积(mL)。
1.2.3 黄酮的回收及纯化
1.2.3.1 乙醇浓度对聚酰胺树脂洗脱效果的影响 取150 mL D101洗脱液以2 BV/h的流速上聚酰胺树脂(30 mL),吸附饱和后,分别用100 mL的10%、30%、75%、100%的乙醇进行梯度洗脱,每25 mL收集一次。测定每管的总黄酮的含量,绘制洗脱曲线。
1.2.3.2 从聚酰胺树脂上回收黄酮 将预处理好的707阴离子树脂和732阳离子树脂采用湿法装柱的方法装入规格为2 cm×60 cm的层析柱中,装柱的体积分别为120 mL和60 mL;聚酰胺树脂同样采用湿法装柱的方法装入规格为1.5 cm×60 cm的层析柱中,装柱的体积为30 mL。取250 mL的D101树脂的洗脱液,以2 BV/h的流速依次过707阴离子树脂、732阳离子树脂和聚酰胺树脂,并测定732树脂流出液的黄酮含量。
待聚酰胺树脂吸附完后,先用水冲洗柱子,合并水洗液及过柱液测定黄酮含量。接着用75%的乙醇溶液洗脱聚酰胺树脂并测定洗脱液黄酮含量。将洗脱液使用旋转蒸发仪在减压状态下旋干成粉末。精确称取少许旋干物,用无水乙醇溶解并定容于25 mL容量瓶中,测总黄酮的浓度。旋干物中总黄酮的含量按式(3)计算:
含量(%)=C×V/M×100
式(3)
式中:C-校准曲线中黄酮的浓度(mg/mL),V-定容体积即25 mL,M-称取的旋干物质量(mg)。
聚酰胺树脂上洗脱率的计算如式(4):

表1 生产甜茶素的工艺各阶段黄酮的含量
聚酰胺树脂上的洗脱率(%)=75%乙醇洗脱下的黄酮的量/(732树脂过柱液黄酮量-聚酰胺树脂过柱液黄酮量)×100
式(4)
1.2.3.3 用FL-3树脂第二次纯化 取聚酰胺树脂的75%的乙醇洗脱液真空浓缩后(使大部分乙醇挥发出去),再加水配成浓度为2.164 mg/mL的溶液,继续过FL-3树脂,上样体积为3倍柱体积,吸附饱和后,用8.3 BV 40%乙醇进行洗脱,取解吸液颜色深的部分旋干,得到近一步纯化的样品A,按1.2.3测定黄酮含量,按式(5)计算得率。

式(5)
1.2.4 甜茶总黄酮的鉴定
1.2.4.1 样品A的紫外-可见光扫描 取少量样品A溶解于无水乙醇中,在200~600 nm的范围内进行紫外-可见光扫描,波长间隔为5 nm[9]。
1.2.4.2 样品A的高效液相色谱 取少量样品A先用50%(v·v-1)的甲醇溶解。以芦丁、槲皮素为标准品,高效液相色谱条件[10-11]:
色谱柱:Diamonsil(钻石)C18色谱柱250 mm×4.6 mm;流动相为:甲醇∶水=50∶50;流速:1 mL·min-1;柱温:25 ℃;检测波长:254 nm;进样量:5 μL。
1.2.5 抗氧化性研究
1.2.5.1 粗黄酮和精黄酮样品的制备 将D101洗脱液旋干,作为纯化前的甜茶总黄酮备用(粗黄酮);经聚酰胺树脂纯化后的洗脱液旋干,作为纯化后的甜茶总黄酮备用(精黄酮)。
1.2.5.2 清除·OH的测定 在8支25 mL的比色管中依次加入体积同为0.85 mL,物质的量浓度均是7.5 mmol/L的硫酸亚铁铵溶液和水杨酸溶液(95%乙醇配制),1 mL不同浓度(0.1、0.2、0.3、0.4、0.5、0.6 mg/mL)的样品(甜茶粗黄酮、甜茶精黄酮和维生素C),最后在加入样品溶液的6支试管中加入0.85 mL 0.3% H2O2溶液启动反应,用蒸馏水定容至10 mL。剩下2个含有硫酸亚铁铵溶液和水杨酸溶液的试管,一支加入H2O2,另一支加入要测的样品溶液。在36 ℃恒温水浴锅中反应半小时后在510 nm处以蒸馏水作空白测量其吸光度。清除率的计算公式如下:
其中:AO为对照品的吸光度(FeSO4+水杨酸+H2O2);AXO为样品本身的吸光度(FeSO4+水杨酸+样液);AX为加入样品后的吸光度(FeSO4+水杨酸+样液+H2O2)。
1.2.5.3 清除DPPH·的测定 取8支比色管,第一支比色管中准确地加入 0.2 mg/mL的DPPH·无水乙醇溶液1.6 mL;第二支准确移取体积为1 mL的样品液于25 mL具塞比色管;剩下6支比色管中准确地加入0.2 mg/mL的DPPH·无水乙醇溶液1.6 mL和体积为1 mL不同浓度(0.02、0.04、0.06、0.08、0.10、0.12 mg/mL)的样品液(甜茶粗黄酮、甜茶精黄酮和维生素C),都用无水乙醇定容至10 mL,摇匀后在暗处放置半小时用无水乙醇作空白参比,在515 nm处测定的吸光度。清除率的计算公式如下:
其中:AO为对照品的吸光度(DPPH);AiO为样品本身的吸光度(样液);Ai为加入样品后的吸光度(DPPH+样液)。
2 结果与分析
2.1 黄酮的回收
2.1.1 实验室模拟工厂生产甜茶素工艺各阶段黄酮含量的测量结果 由表1中可以看出,聚酰胺树脂黄酮的损失量最多,为223.58 mg,说明黄酮主要是被吸附在聚酰胺树脂上,那么对工厂总工艺中回收总黄酮的工作主要集中在对聚酰胺树脂上吸附黄酮的回收。
2.1.2 乙醇浓度对聚酰胺树脂洗脱效果的影响 由图1中洗脱量可知,聚酰胺树脂不易解吸,需较浓的醇液才能洗脱下来,其中75%乙醇的解吸量最大,所以选用75%的乙醇对聚酰胺进行洗脱。

图1 乙醇浓度对聚酰胺树脂黄酮洗脱效果的影响Fig.1 The influence of ethanol concentration on polyamide resin elution注:图中1~4号为10%乙醇浓度;5~8号为30%乙醇; 9~12号为75%乙醇;13~16号为无水乙醇。
2.1.3 从聚酰胺树脂上回收黄酮 从聚酰胺树脂上洗脱下来的样品中总黄酮的含量为36.30%,洗脱率为91.33%。
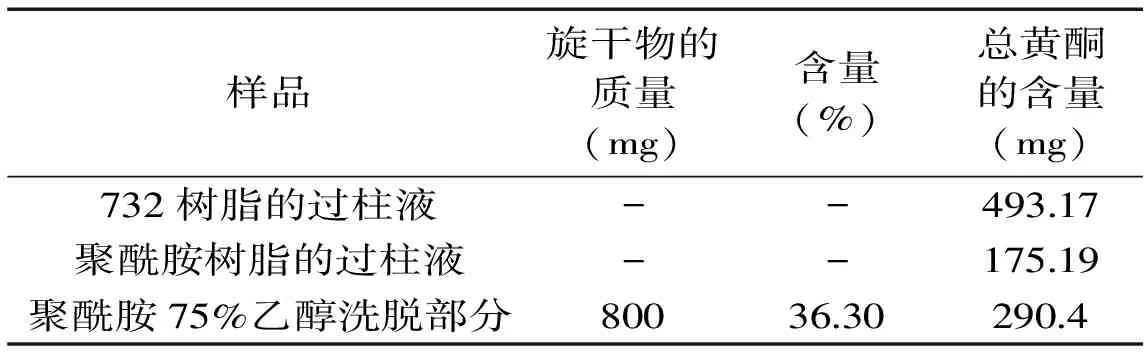
表2 用聚酰胺树脂纯化甜茶总黄酮的结果
注:含量(%)为黄酮量占旋干物总量的百分比;总黄酮的含量为样液所含黄酮的质量;“-”为未测。
2.1.4 用 FL-3树脂第二次纯化 对最终得到的总黄酮样品A进行含量测定,含量为62.70%,以甜茶叶计算得率为1%。
2.2 甜茶总黄酮的鉴定
2.2.1 样品A的紫外-可见光扫描图 黄酮的特征吸收峰在250~300 nm及300~400 nm处存在两个特征峰,从图2中可以看出,该样品在200~250 nm之间有一个明显的吸收峰,在250~300 nm及300~400 nm之间有两个微弱的峰。可以初步判断出有黄酮类物质的存在。

图2 黄酮样品A的紫外-可见光扫描图谱Fig.2 The ultraviolet-visible scanning of flavonoids samples A
2.2.2 样品A的高效液相色谱 由图3~图6可知,芦丁标准品的保留时间为12.375 min,槲皮素标准品的保留时间为31.828 min,而样品分别在12.477 min和31.629 min时有明显的峰,初步说明甜茶总黄酮样品中存在芦丁、槲皮素物质。甜茶黄酮的成分有待于进一步深入研究。
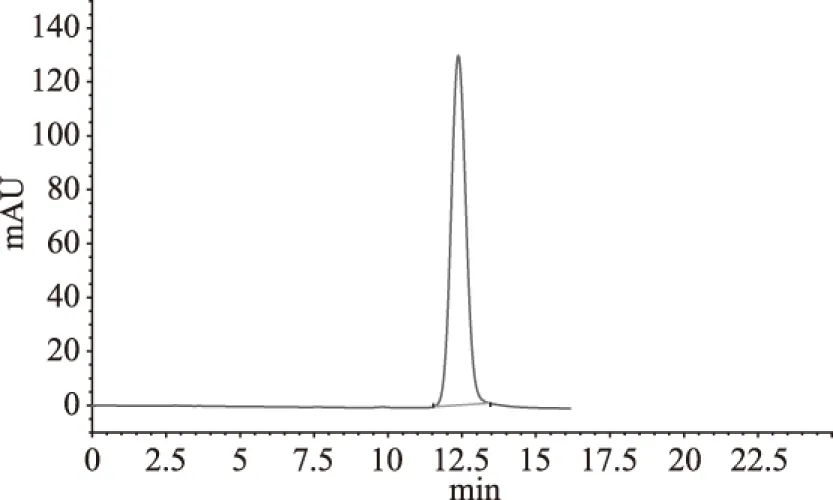
图3 芦丁标准品的高效液相色谱图Fig.3 The HPLC of Rutin standard

图4 槲皮素的高效液相色谱图Fig.4 The HPLC of quercetin standard
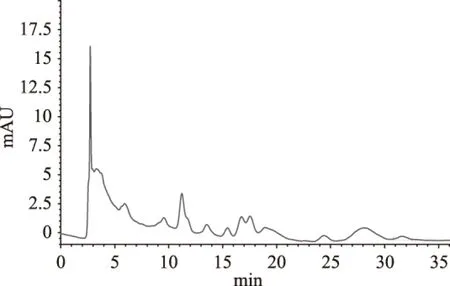
图5 样品A的高效液相色谱图Fig.5 The HPLC of sample A

图6 样品A高效液相色谱图中的局部放大图Fig.6 The partial enlargement of HPLC of samples A
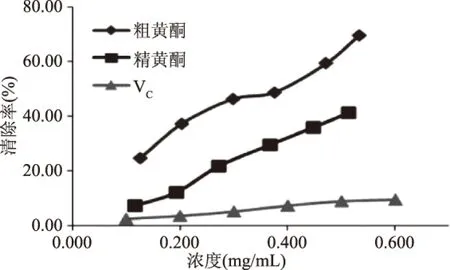
图7 清除·OH的比较Fig.7 The comparison of·OH scavenging ability
2.3 甜茶中黄酮抗氧化性研究
2.3.1 清除·OH的实验结果 由图7可知,随着浓度的增加,清除·OH的能力增加,即抗氧化活性增加,而且精黄酮和粗黄酮的抗氧化活性明显高于维生素C。粗黄酮的抗氧化活性比精黄酮的高,可能是因为粗黄酮中含有多酚类其它物质,具有协同作用,所以抗氧化活性高。
2.3.2 清除DPPH·的实验结果 由图8可知,同清除·OH一样,随着浓度的增加,清除DPPH·的能力增加,抗氧化活性增加,在浓度低于0.08 mg/mL时,粗黄酮增加的速率最大、其次是精黄酮、VC的增速最慢,因此粗黄酮最先达到最大清除率。当浓度达到0.08 mg/mL时,三者的清除能力基本一致。

图8 清除DPPH·的比较Fig.8 The comparison of DPPH· scavenging ability
3 结论与讨论
在原有生产甜茶素工艺的基础上,探究了总黄酮的回收工艺。研究了从聚酰胺树脂上回收黄酮的条件,最后确定用75%(v·v-1)的乙醇作为树脂的解吸剂。75%乙醇洗脱液蒸发挥去大部分乙醇再加水配成总黄酮浓度为2.164 mg/mL的溶液,经过FL-3树脂进一步纯化,得到最终的样品A,含量可达62.7%,得率为1%。
对纯化后的甜茶总黄酮样品A,做紫外扫描光谱和高效液相色谱分析,初步推断样品A中含芦丁、槲皮素。
在甜茶总黄酮的抗氧化活性的实验中,实验结果显示纯化前后的甜茶黄酮类化合物均表现出较强的抗氧化性,可以显著地清除·OH、DPPH·。随着浓度的增加,其抗氧化性会随之增强,但纯化后的总黄酮抗氧化活性有所降低。
[1]柏芸,薛淑静,周明,等.蔷薇科甜茶加工应用研究进展[J].农产品加工:创新版,2010(11):52-55.
[2]赵秀玲.黄酮类化合物的研究进展[J].江苏调味副食品,2010,27(5):17-22.
[3]王立波,毕彩虹.甜茶活性成分最新研究进展[J].粮食与油脂,2007(2):47-49.
[4]吴燕春,吴冬,谢金鲜,等.广西甜茶总黄酮的体外抗肿瘤作用[J].中国实验方剂学杂志,2010,16(7):165-167.
[5]谭冬明,罗星晔,陈全斌.广西甜茶水提取物中不同分离部位的抗氧化性研究[J].中国食品添加剂,2016(6):125-129.
[6]张彩云,崔紫姣,陈显刚,等.FL-3大孔树脂纯化甜茶总黄酮的研究[J].食品工业,2014,35(10):93-95.
[7]鲍晨阳,韦万丽,陈显刚,等.甜茶素和甜茶总多酚的制备[J].食品与发酵工艺,2016,42(5):180-183.
[8]沈小燕,解成喜.天山堇菜中总黄酮的提取和测定[J].分析实验室,2008,27(S2):235.
[9]白新鹏.食品检验新技术[M].北京:中国计量出版社,2010:41-46.
[10]Gao Artur Figueirinha,Antonio Paranhos.Cymbopogon citratus leaves:Characterisa-tion of flavonoids by HPLC·-PDA-ESI/MS/MS and an approach to their potential as a source of bioactive polyphenols[J].Food Chemistry,2008,110(30):718-728.
[11]杨亚玲,赵红芳.固相萃取和高效液相色谱测定甜茶中的黄酮类物质[J].食品科学,2006,27(9):197-199.
Study on recycling technology and antioxidant activities of total flavones of sweet tea
LIU Cheng-cheng1,2,ZHANG Cai-yun1,ZHENG Kui-ling1,CHEN Xian-gang3,LIAO Li-ling1,*
(1.School of Chemistry and Material Science,Guizhou Normal University,Guiyang 550001,China; 2.Guiyang Nursing Vocational College,Guiyang 550081,China; 3.Guizhou Province Health Tea Science and Technology Limited Company,Qiannan 558100,China)
The recycling technology of flavonoids was explored meanwhile unchanging original production of rubusoside. The removal capacity of the purified and unpurified flavonoids of sweet tea on ·OH,DPPH· were studied by vitamin C as reference. Experiments were conducted in the laboratory according to production process in the factories and the contents of the total flavone in different parts were determined by using UV method. The results showed that the elution rate of flavonoids from the polyamide resin was up to 91.33% by 75% ethanol as elution liquid and content of flavonoids was up to 36.3%. 75% ethanol desorption solution was purified by FL-3 resin further,the content of flavonoids in the final product was up to 62.70%,the yield was 1%. There were rutin and quercetin in the final flavonoids product by UV and HPLC analysis. Flavonoids compounds in sweet tea had good oxidation resistance. ·OH scavenging ability were in order:unpurified flavonoids>purified flavonoids>vitamin C. DPPH· scavenging ability of unpurified flavonoids,purified flavonoids and vitamin C were almost the same when the concentration was more than 0.08 mg/mL,ability of DPPH· scavenging were in order:unpurified flavonoids>purified flavonoids>vitamin C when concentration is less than 0.08 mg/mL.
sweet tea;the total flavone;antioxidant activity;the recycling process
2016-10-28
刘程程(1984-),女,硕士,讲师,从事分析化学研究,E-mail:lccangel@163.com。
*通讯作者:廖莉玲(1963-),女,硕士,教授,从事天然产物方面的研究,E-mail:lll6383@163.com。
贵州省科学技术厅中药现代化攻关项目(黔科合ZY字【2012】3012号);贵阳市科技局现代药业计划项目(筑科合同[2012204]号)。
TS201.2
B
1002-0306(2017)09-0201-05
10.13386/j.issn1002-0306.2017.09.030
