pH调节法优化鸢乌贼分离蛋白制备的工艺研究
2017-06-05董淑华李来好杨贤庆郝淑贤李春生
董淑华,黄 卉,李来好,*,杨贤庆,郝淑贤,荣 辉,李春生
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300; 2.上海海洋大学食品学院,上海 201306)
pH调节法优化鸢乌贼分离蛋白制备的工艺研究
董淑华1,2,黄 卉1,李来好1,*,杨贤庆1,郝淑贤1,荣 辉1,李春生1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300; 2.上海海洋大学食品学院,上海 201306)
本文采用pH调节法对鸢乌贼分离蛋白的制备工艺进行优化,以溶解得率与蛋白浓度作为评价因子,分析pH、料液比、溶解时间与溶解温度等工艺条件对可溶性蛋白提取率的影响,从而优化其提取条件,并对不同溶解和沉淀pH条件下的蛋白进行聚丙烯酰胺凝胶电泳分析。结果表明,在pH12.0、料液比1∶9 (g/mL)、溶解温度4 ℃与溶解时间10 min的条件下,制备得到的分离蛋白溶解得率最高(80%);在最佳酸、碱溶解pH前提下沉淀蛋白,pH5.5沉淀条件下回收蛋白的得率最高,且酸沉得到的分离蛋白沉淀得率达60%,大于碱沉;pH对鸢乌贼分离蛋白各组分的影响存在差异。其中,肌球蛋白重链(Myosin heavy chain,MHC)、副肌球蛋白(Paramyosin,PM)在各pH条件下降解速率较快,酸性条件对原肌球蛋白(Tropomyosin,TM)降解效果影响较大,而肌动蛋白(Actin,A)在酸、碱性环境下变化较不明显。该工艺可用于工业化大规模制备鸢乌贼分离蛋白,为分离蛋白的制备及来源提供了新途径。
鸢乌贼,提取,优化,分离蛋白,pH调节法
鸢乌贼(Sthenoteuthisoualaniensis)为柔鱼科莺乌贼,属暖水性大洋生物种,广泛分布于印度洋、太平洋及亚热带海域,在我国南海和印度洋西北部海域分布较广[1]。2014年广西渔船的生产监测统计,中国南海鸢乌贼的年可捕量达(130~200)×104t,生物资源量巨大,可承受较大捕捞压力,是南海大洋性生物资源中最具开发潜力的种类[2-3]。现有研究表明,鸢乌贼不仅是点斑海豚、黄鳍金枪鱼、小型及中型抹香鲸等多种生物的饵料,还可制成水产食品,但由于其肉质较硬,食用价值不高,仍需深加工处理[4-5]。目前国际上对鸢乌贼的研究主要集中在生物学特性及种群资源分布,对其各部位的加工利用研究较少。鸢乌贼胴体肌肉中蛋白质含量占鲜重的17.24%,是海洋中最具潜力的蛋白质资源之一,具有较高的研究价值[6]。提取鸢乌贼蛋白质,开发鸢乌贼蛋白质制品,并将其应用于食品、保健品、化妆品等领域,可充分提高其利用价值。
pH调节法提取动物蛋白源于上世纪90年代,通过调节不同pH使蛋白质溶解,在等电点下沉淀蛋白,最终获得分离蛋白[7]。Hugo Palafox等[8]研究了pH调节法制备鱿鱼分离蛋白的工艺流程,经过极酸性、碱性条件下蛋白质溶解,等电点条件下沉淀蛋白后,最终得到的分离蛋白提取率高达75%。Juan A等[9]对美洲大赤鱿碱溶和等电点沉淀提取的蛋白质进行功能特性评价,发现碱溶条件下的蛋白质具有较强凝胶性与粘弹性。本文在前人研究的基础上,将pH调节法提取蛋白应用于南海新资源鸢乌贼分离蛋白的制备,通过优化pH、料液比、溶解时间、溶解温度四个主要影响因素,最终确定鸢乌贼分离蛋白制备的最佳工艺条件,为进一步探讨其功能、结构性质提供理论基础,为实现大规模工业化生产提供理论支持。
1 材料与方法
1.1 材料与仪器
鸢乌贼 中国水产科学研究院南海水产研究所“南峰号”捕捞于南海海域,重量150~200 g;SDS-PAGE凝胶制备试剂盒 康为世纪生物科技有限公司;考马斯亮蓝试剂R250 南京建成科技有限公司等;盐酸、氢氧化钠 广州化学试剂厂;所有试剂均为分析纯。
GB204电子天平 瑞士METTLER公司;UltraTurrax T50均质机 德国IKA公司;Delta320精密pH计 梅特勒-托利多仪器(上海)有限公司;Kjeltel2300 凯氏定氮仪 丹麦FOSS仪器有限公司;Sigma-3K30 高速冷冻离心机 德国SIGMA公司;Powerpac@HV 等电聚焦电泳仪 美国Bio-rad公司;UV2550紫外可见分光光度计 日本SHIMADZU公司;EPSON 11000XL扫描仪 美国GE公司。
1.2 实验方法
1.2.1 样品前处理 鸢乌贼去头、皮、内脏,取胴体肌肉,洗净、沥干后绞碎分装(100 g/袋),-20 ℃下冻藏备用。
1.2.2 pH对可溶性蛋白提取的影响 参照HugoPalafox[8]方法,稍作修改。鸢乌贼胴体肌肉→4 ℃蒸馏水(料液比1∶9,w/v)→均质→调节pH(2.0~12.0,以1个pH单位变化)→4 ℃低速搅拌提取10 min→离心(10000 r/min,20 min,4 ℃)→收集上清液→考马斯亮蓝法测定上清液蛋白质含量,凯氏定氮法测定最佳pH下的上清液可溶性蛋白的溶解得率。
溶解得率(%)=可溶性蛋白液中粗蛋白的含量(g)/所用原料鸢乌贼中粗蛋白的含量(g)×100
1.2.3 料液比对可溶性蛋白提取的影响 在确定最佳溶解pH基础上,以不同料液比(1∶3、1∶6、1∶9、1∶12 g/mL)、溶解温度4 ℃、溶解时间10 min条件下按照1.2.2进行蛋白质提取,按公式计算得到鸢乌贼可溶性蛋白溶解得率。
1.2.4 溶解时间对可溶性蛋白提取的影响 在确定最佳溶解pH和最佳料液比基础上,以不同溶解时间(10、20、40、60 min)、在4 ℃溶解温度条件下按照1.2.2进行蛋白质提取,按公式计算得到鸢乌贼可溶性蛋白溶解得率。
1.2.5 溶解温度对可溶性蛋白提取的影响 在确定最佳溶解pH、最佳料液比、最佳溶解时间基础上,以不同溶解温度(4、20、35、50 ℃)条件下按照1.2.2进行蛋白质提取,按公式计算得到鸢乌贼可溶性蛋白溶解得率。
1.2.6 沉淀pH条件的确定 根据1.2.2~1.2.5确定的可溶性蛋白最佳溶解pH、料液比、溶解温度和溶解时间条件下,得到上清液可溶性蛋白,加入盐酸或氢氧化钠溶液调节pH使之变化范围在5.0~6.0,4 ℃条件下保持10 min,保证蛋白质能够充分沉淀,离心(4 ℃,10000 r/min,20 min),取沉淀即鸢乌贼分离蛋白。用凯氏定氮法测定粗蛋白含量,计算蛋白质沉淀得率。
沉淀得率(%)=沉淀中粗蛋白的含量(g)/所用原料鸢乌贼中粗蛋白的含量(g)×100
1.2.7 SDS-PAGE分析 为进一步了解酸/碱溶解过程中蛋白质组成变化,分别取最佳溶解时间、溶解温度、料液比条件下pH2~12的上清液可溶性蛋白进行SDS-PAGE分析;同时,考察了等电点沉淀过程中蛋白质的组成变化,分别对最佳酸溶、碱溶后在pH5.0~6.0范围内得到的沉淀蛋白和上清液进行SDS-PAGE分析。根据Laemmli[10]方法稍加修改,分离胶浓度为10%,浓缩胶浓度为5%,样品与5X凝胶上样缓冲液以4∶1比例混合,沸水浴煮沸5 min,1000 r/min离心5 min,上样量8 μL。凝胶电泳在恒压下进行,初始电压为80 V,当样品进入分离胶后电压增至120 V,在达到分离胶底部上方1 cm处,关闭电源,用考马斯亮蓝R-250染色1 h,脱色液脱色后扫描仪扫描电泳条带图。
2 结果与分析
2.1 溶解条件确定
2.1.1 pH对上清液可溶性蛋白浓度和溶解得率的影响 蛋白质的溶解性受pH影响较大,其主要与分子表面电荷有关,组成蛋白质的氨基酸中存在部分可随环境pH变化而电离的基团,使得蛋白质分子所带静电荷随pH变化而变化[11]。由图1可知,可溶性蛋白的浓度随pH的增加呈先降后升的趋势,且pH在11.0、12.0条件下可溶性蛋白的浓度高于pH为2.0、3.0下可溶性蛋白浓度,当pH在5.0~6.0时,可溶性蛋白浓度达到最低。说明极酸性或极碱性环境均有利于蛋白质的充分溶解,但碱性条件下鸢乌贼胴体肌肉蛋白相对于酸性条件溶解效果更好,而偏中性等电点条件下蛋白质溶解度最小,会沉淀析出。这种典型的U型曲线,与已报道的关于提取太平洋鳕鱼蛋白[12]、岩鱼蛋白[13]等相似。因此,初步确定在下一步实验中选取pH2.0、pH3.0、pH11.0、pH12.0为主要溶解条件、pH5.0~6.0为主要沉淀条件。
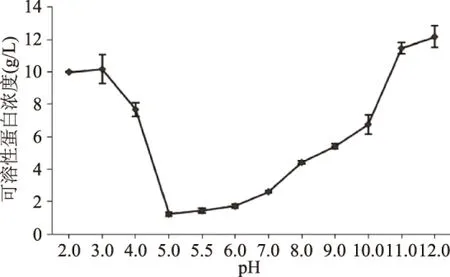
图1 pH对鸢乌贼肌肉可溶性蛋白含量的影响Fig.1 Effect of pH value on the contents of soluble protein in Sthenoteuthis oualaniensis muscle
分别取极酸性、极碱性条件下上清液可溶性蛋白,凯氏定氮法测定其蛋白质溶解得率的结果如图2,在pH为2.0、3.0、11.0、12.0条件下提取的可溶性蛋白得率相差较小,均在80%左右,提取蛋白质得率较高。且在pH为12.0条件下蛋白质溶解得率高达85%以上,在pH为2.0与3.0条件下蛋白质溶解得率均低于80%。这种提取可溶性蛋白得率的差异可能由于pH较低时,天冬氨酸和谷氨酸残基的羧基侧链等对负电荷的中和作用大小和pH较高时胍基或异吡唑或组氨酸、精氨酸的赖氨酰侧链等基团的去质子化作用大小有关[14-15]。
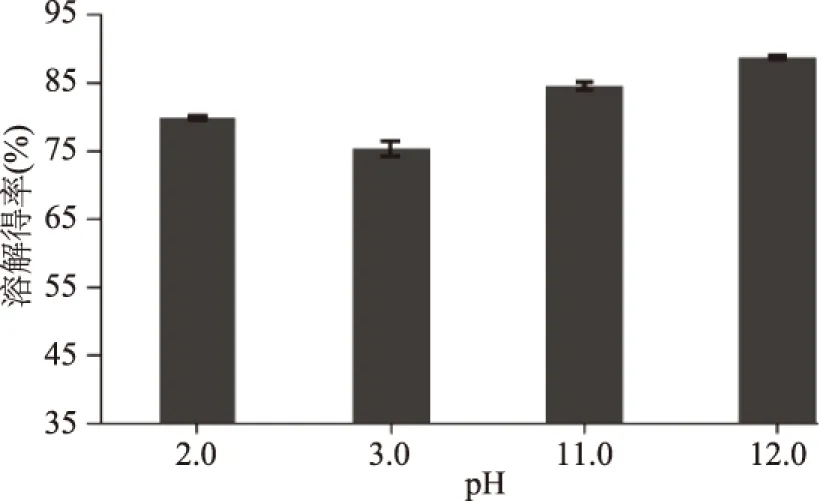
图2 4种pH条件下可溶性蛋白得率Fig.2 The yield of soluble protein in Sthenoteuthis oualaniensis muscle under four pH conditions
2.1.2 料液比对上清液可溶性蛋白溶解得率的影响 由图3可知,一方面,4种pH条件下提取的可溶性蛋白溶解得率随料液比的增加呈先升后趋平缓的趋势,且变化趋势基本相同,影响效果也比较明显。在料液比达到1∶9时,可溶性蛋白的溶解得率升至最大值,后期随着料液比的增加,溶解得率变化不大,甚至出现轻微下降,这可能是因为蛋白质分子表面的亲水基团促使其形成一个水化层,从而使蛋白质分子的溶解度随溶解液体积增加到一定程度后不再增加[16]。另一方面,不同pH条件下提取的可溶性蛋白溶解得率各不相同,比较而言,pH为12.0条件下提取的可溶性蛋白溶解得率最高,pH为3.0条件下提取的可溶性蛋白溶解得率最低。
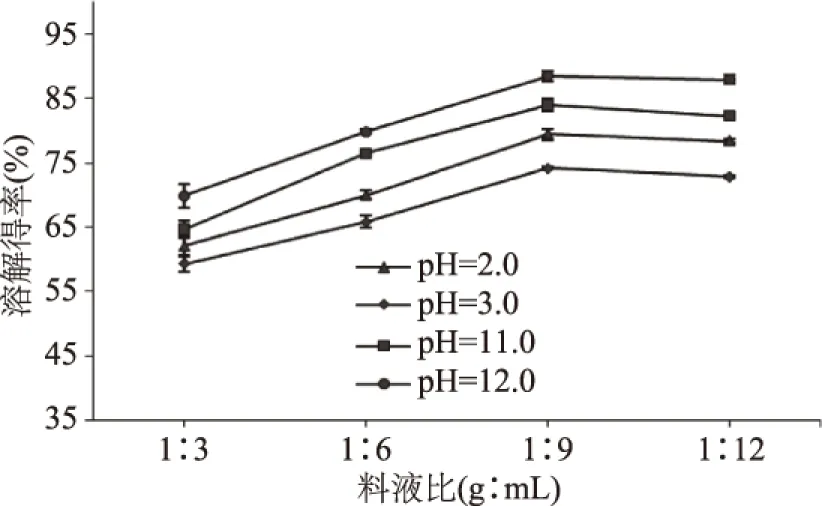
图3 料液比对鸢乌贼可溶性蛋白溶解得率的影响Fig.3 Effect of solid-liquid ratio on the yield of soluble protein in Sthenoteuthis oualaniensis muscle
2.1.3 溶解时间对上清液可溶性蛋白溶解得率的影响 由图4可知,一方面,溶解时间对4种pH条件下提取的可溶性蛋白溶解得率影响并不十分明显,均呈较轻微的下降趋势。溶解时间为10 min时,可溶性蛋白的溶解得率最大,这可能是因为肌肉蛋白在溶液中发生水解。随着溶解时间的延长,蛋白质水解程度越大,从而使测得的溶解得率有所降低[17]。另一方面,不同pH条件下提取的可溶性蛋白溶解得率也相差不大,比较而言,pH为12.0条件下提取的可溶性蛋白溶解得率相对较高,pH为3.0条件下提取的可溶性蛋白溶解得率相对较低。
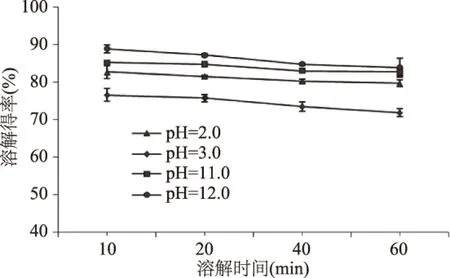
图4 溶解时间对鸢乌贼胴体肌肉可溶性蛋白得率的影响Fig.4 Effect of dissolve time on the yield of soluble protein in Sthenoteuthis oualaniensis muscle
2.1.4 溶解温度对上清液可溶性蛋白溶解得率、浓度的影响 由图5、图6可知,4种pH条件下提取的可溶性蛋白溶解得率和浓度随溶解温度的增加变化并不显著,但总体上呈轻微下降趋势,温度在4 ℃时,蛋白溶解得率和浓度较大。这可能是因为溶解温度尚未达到鸢乌贼胴体肌肉蛋白质变性温度,对蛋白质溶解得率或浓度没有造成过大影响[18];同时,在高温下鸢乌贼胴体肌肉蛋白发生变性,只是使其部分蛋白失活,对其蛋白的溶解得率和浓度影响不大。因此,为保证提取可溶性蛋白的最大活性和最高含量,选取溶解温度为4 ℃。此外,通过图5、图6可知,在pH12.0条件下各个温度点提取的可溶性蛋白溶解得率和浓度达到最大值,温度高于20 ℃时,pH3.0时达到最小值。

图5 溶解温度对鸢乌贼胴体肌肉可溶性蛋白溶解得率的影响Fig.5 Effect of dissolve temperature on the yield of soluble protein in Sthenoteuthis oualaniensis muscle
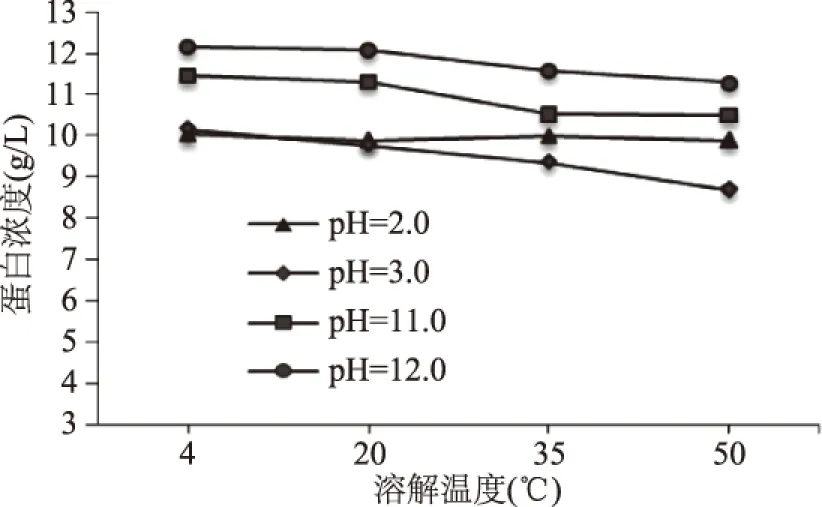
图6 溶解温度对鸢乌贼胴体肌肉可溶性蛋白浓度的影响Fig.6 Effect of dissolve temperature on the concentration of soluble protein in Sthenoteuthis oualaniensis muscle
2.2 沉淀条件的确定
在2.1确定最佳溶解条件的基础上,选用最佳方案提取鸢乌贼胴体肌肉可溶性蛋白上清液,调节pH在5.0~6.0,利用等电点下蛋白质沉淀原理,测定其沉淀蛋白的蛋白质得率,最终确定鸢乌贼胴体肌肉可溶性蛋白的最佳沉淀pH。由图7可知,在pH分别为5.0、5.5与6.0条件下,四种可溶性蛋白的沉淀得率变化一致,均在沉淀pH为5.5时,测得沉淀得率最高,这表明酸溶和碱溶条件下得到的可溶性蛋白等电点均可能在pH5.5左右,结果与罗非鱼、鱿鱼等研究结果均一致[17,19]。同时,在相同的沉淀pH下,酸溶(pH2.0、pH3.0)得到的可溶性蛋白沉淀得率明显高于碱溶(pH11.0、pH12.0),且在等电点pH5.5时,酸溶条件下的可溶性蛋白沉淀得率高于60%,说明即使在碱性条件下鸢乌贼胴体肌肉的溶解性较高,但酸性条件下提取的可溶性蛋白经等电点沉淀效果更好。

图7 不同沉淀pH条件下鸢乌贼胴体肌肉可溶性蛋白的沉淀得率Fig.7 Yield of precipitating protein from Sthenoteuthis oualaniensis muscle with different precipitated pH value
2.3 不同溶解和沉淀pH条件下蛋白的SDS-PAGE分析
鸢乌贼属于暖水大洋性头足类动物,其肌原纤维蛋白含量占总蛋白的60%~70%,主要包括肌球蛋白重链(MHC)、肌动蛋白(A)、原肌球蛋白(TM)及软体动物所特有的副肌球蛋白(PM)[20]。
由图8可知,在酸/碱溶解过程中,鸢乌贼蛋白条带随着pH的变化而变化,在等电点附近条带较深。pH3.0时MHC出现条带,且颜色较浅,说明MHC在整个pH溶解提取过程中降解较完全,但酸性条件下降解速度更慢,这可能是因为MHC在pH调节过程中发生聚沉或被降解成分子量更小的肽段[18,21];PM在各条件下均呈现出颜色较浅的细小条带,pH为11.0、12.0时条带消失,说明在PM受酸碱性条件影响极大,整个pH溶解过程中发生大部分降解,在强碱性条件下完全降解,此研究结果和原理与超高温将蛋白质或肽分解成其他有机化合物相似[22];位于55~43 kDa处的为肌动蛋白(A),虽然条带在pH9.0时颜色较浅,但从整体趋势来看肌动蛋白随pH的变化并不明显,说明酸、碱条件对肌动蛋白的影响较小,这一研究结果与Hugo Palafox[8]相同;原肌球蛋白(TM)在pH6.0时出现明显条带,表明其受中性等电点左右影响最小。

图8 不同溶解pH条件下鸢乌贼可溶性蛋白的SDS-PAGE电泳图Fig.8 SDS-PAGE patterns of soluble protein from Sthenoteuthis oualaniensis muscle with different precipitated pH value注:M为蛋白质Ladder;MHC为肌球蛋白重链(200 kDa);PM为副肌球蛋白(103 kDa);TM为原肌球蛋白(360 kDa);A为肌动蛋白(45 kDa)。
3 结论
通过对pH调节法优化鸢乌贼分离蛋白制备条件的实验分析,最终确定鸢乌贼蛋白在pH5.5附近溶解性最差,在pH2.0、3.0、11.0、12.0时溶解性较好;通过对比酸、碱性条件,确定在溶解pH为12.0、溶解温度4 ℃、料液比1∶9、溶解时间10 min下提取制备的可溶性蛋白得率较高,达到80%以上;在最佳酸溶、碱溶条件下沉淀可溶性蛋白,pH5.5条件下沉淀回收蛋白的得率最高,且酸沉得到的分离蛋白沉淀得率高达60%,远高于碱沉;在pH调节过程中,酸碱条件对鸢乌贼蛋白组分肌动蛋白影响较小,MHC、PM发生明显降解,酸性条件对TM影响较大。鸢乌贼分离蛋白制备的含量及组分在不同pH下变化的差异,使得后期制备得到的分离蛋白在功能及结构性质上有所不同,为获得实用性更好的分离蛋白,应继续研究pH对鸢乌贼分离蛋白结构及功能性质的影响。
[1]刘金立,陈新军,许强华. 印度洋西北部海域鸢乌贼种群遗传结构的RAPD分析[J]. 南方水产,2008,4(2):43-49.
[2]邹建伟,陈立峰,林蒋进,等. 南海外海灯光罩网主要渔场分布及变动研究—基于广西渔船的生产监测统计[J]. 南方水产,2014,10(4):78-84.
[3]张俊,陈作志,陈国宝,等. 南海鸢乌贼水声学测量和评估相关技术研究[J]. 南方水产,2014(6):1-11.
[4]范江涛,冯雪,邱永松,等. 南海鸢乌贼生物学研究进展[J]. 广东农业科学,2013(23):122-128.
[5]江艳娥,陈作志,林昭进,等. 南海中部海域鸢乌贼耳石形态特征分析[J]. 南方水产,2014,10(4):85-90.
[6]于刚,张洪杰,杨少玲,等. 南海鸢乌贼营养成分分析与评价[J]. 食品工业科技,2014,35(18):358-372.
[7]Hultin H O,Kelleher S D. Process for isolating a protein composition from a muscle source and protein composition:U.S. PatentSer 0848911[P]. 1997-2-12.
[8]Palafox H,Córdova-Murueta J H,Navarrete del Toro M A,et al. Protein isolates from jumbo squid by pH-shift processing[J]. Process Biochemistry,2009,44:584-587.
[9]Cortés-Ruiz J A,Pacheco-Aguilar R,Lugo-Sánchez M E,et al. Production and functional evaluation of a protein concentrate from giant squid(Dosidicus gigas)by acid dissolution and isoelectric precipitation[J]. Food Chemistry,2008,110:485-492.
[10]Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227:680-685.
[11]唐小丹. 罗非鱼分离蛋白的制备及其性质研究[D]. 湛江:广东海洋大学,2011.
[12]Choi Y J,Park J W. Acid-aided protein recovery from enzyme-rich Pacific whiting[J]. Journal of Food Science,2002,67(8):2962-2967.
[13]Yongsawatdigul J,Park J W. Effects of alkali and acid solubilization on gelation characteristics of rockfish muscle proteins[J]. Journal of Food Science,2004,69(7):499-505.
[14]Cortes-Ruiz J A,Pacheco-Aguilar R,Garcia-Sanchez G,et al. Functional characterization of a protein concentrate from bristly sardine made under acidic conditions[J]. Journal of Aquatic Food Product Technology,2001,10:5-23.
[15]Undeland I,Kelleher S D,Hultin H O.Recovery of functional proteins from herring(Clupea harengus)light muscle by an acid or alkaline solubilization process[J]. Journal of Agricultural and Food Chemistry,2002,5025:7371-7379.
[16]陈申如,张其标,倪辉. 酸法提取鲢鱼鱼肉蛋白质技术的研究[J]. 海洋水产研究,2004,25(5):61-64.
[17]刘诗长,周春霞,洪鹏志,等. 罗非鱼下脚料分离蛋白的制备及其性质研究[J]. 食品研究与开发,2011,32(6):38-42.
[18]邱月,曾少葵,章超桦,等. 鸢乌贼和杜氏枪乌贼蛋白分离及其性质初探[J]. 食品与发酵工业,2016,42(9):81-86.
[19]Halldórsdóttir S M,Hamaguchi P Y,Sveinsdóttir H,et al. Properties of hydrolysed saithe protein isolates prepared via pH shift process with and without dewatering[J]. LWT-Food Science and Technology,2011,44:1999-2004.
[20]Blanco-Pascual N,Fernández-Martín F,Montero P. Jumbo squid(Dosidicus gigas)myofibrillar protein concentrate for edible packaging films and storage stability[J]. LWT-Food Science and Technology,2014,55(2):543-550.
[21]Abdelmalek B E,Gómez-Estaca J,Sila A,et al. Characteristics and functional properties of gelatin extracted from squid(Loligo vulgaris)skin[J]. LWT-Food Science and Technology,2016,65:924-931.
[22]Asaduzzaman A K M,Chun B. Recovery of functional materials with thermally stable antioxidative properties in squid muscle hydrolyzates by subcritical water[J]. Journal of Food Science and Technology,2015,52(2):793-802.
Preparation process optimization of isolate protein fromSthenoteuthisoualaniensisby pH-regulation method
DONG Shu-hua1,2,HUANG Hui1,LI Lai-hao1,*,YANG Xian-qing1, HAO Shu-xian1,RONG Hui1,LI Chun-sheng1
(1.Key Laboratory of Aquatic Product Processing,Ministry of Agriculture,National R&D Center for Aquatic Product Processing,South China Sea Fisheries Research Institute,Chinese Academy of Fishery Science,Guangzhou 510300,China; 2.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
Regarded yield and concentration of soluble protein as eveluation factors,the optimum preparation process of isolate protein fromSthenoteuthisoualaniensisby pH-regulation method was researched. The effects of pH value,solid-liquid ratio,dissolution time and dissolving temperature on the extraction rate of soluble protein were analyzed,and the extraction conditions were optimized. The soluble protein under different soluble and precipitated pH value were measured by Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis(SDS-PAGE). The results of optimum preparation conditions were as follows,pH12.0,solid-liquid ratio 1∶9(g/mL),dissolving temperature 4 ℃ and dissolution time 10 min. The result showed that dissolution rate of isolated protein was the highest and reached 80% under this condition. The yield of protein recovered was the highest when pH=5.5 with the optimum condition of acid or alkaline dissolution pH value and the precipitation rate of isolated protein precipitated by acid precipitation reached 60%,which was higher than that of alkaline precipitation. The effects of pH values on the components of protein isolates fromSthenoteuthisoualaniensiswere different. Myosin heavy chain(MHC)and paramyosin(PM)were affected by pH values and degradated quickly,actin(A)was less affected by acid and alkaline conditions,tropomyosin(TM)was affected by acidic conditions and the degradation effect was great. The preparation process can be used to large-scale produce isolate protein fromSthenoteuthisoualaniensisand it provides a new isolated protein preparation method.
Sthenoteuthisoualaniensi;extraction;optimization;protein isolate;pH-regulation method
2016-12-06
董淑华(1991-),女,硕士研究生,研究方向:食品科学与工程,E-mail:577548926@qq.com。
*通讯作者:李来好(1963-),男,博士,研究员,研究方向:水产品加工、水产品质量安全与水产标准,E-mail:laihaoli@163.com。
农业部财政重大专项(NFZX2013)。
TS254.1
B
1002-0306(2017)09-0181-05
10.13386/j.issn1002-0306.2017.09.026
