发酵条件对猕猴桃果酒中多酚含量的影响
2017-06-05谢光杰孙时光翟娇娇
张 晶,左 勇,*,谢光杰,张 鑫,孙时光,翟娇娇
(1.四川理工学院生物工程学院,四川自贡 643000; 2.四川化工职业技术学院,四川泸州 646000)
发酵条件对猕猴桃果酒中多酚含量的影响
张 晶1,左 勇1,*,谢光杰2,张 鑫1,孙时光1,翟娇娇1
(1.四川理工学院生物工程学院,四川自贡 643000; 2.四川化工职业技术学院,四川泸州 646000)
本文主要研究猕猴桃果酒发酵对多酚含量的影响。在单因素实验基础上,以多酚含量为响应值,以菌种接种量、SO2添加量、发酵温度和发酵时间为响应因素,利用Box-Behnken中心组合实验设计和响应面分析法对发酵条件进行优化。其最佳发酵条件为:菌种接种量0.2 g·L-1、SO2添加量104.8 mg·L-1、发酵温度21.4 ℃、发酵时间7.6 d,在此条件下,多酚含量可达471.2 mg·L-1,较好地保留了猕猴桃果酒中多酚成分。
猕猴桃果酒,多酚,发酵条件
多酚,是一种广泛存在于植物体内的多元酚化合物[1],由40多种化学成分组成,主要包括类黄酮、酚酸、香豆素、木酚素、单宁及非黄酮类多酚化合物等[2-3]。研究表明,多酚不但具有抗氧化和抗辐射等活性,而且还有强化血管壁、促进肠胃消化、增加身体抵抗能力的作用[4-5],还能利尿、降血压、抑制细菌与癌细胞生长,达到帮助消化的功效[6-7]。医学研究发现,心脏病发生率和死亡率与来自水果、蔬菜等食物中的类黄酮摄入量呈显著负相关[8]。
猕猴桃被誉为“水果之王”,含有丰富的营养物质[9],其中多酚类物质含量较高,主要有儿茶素、表儿茶素、原花青素B2、B3、B4等[10]。目前,猕猴桃在我国种植面积较大,产量较高,经常出现鲜果因销售不及时而腐烂浪费[11]。因此猕猴桃的精深加工,成为急需解决的课题。目前,猕猴桃主要用于鲜食和加工猕猴桃汁,制作果酱和果脯等食品,加工产品单一,利用率较低。随着猕猴桃果酒产业的发展,对猕猴桃果酒工艺的研究较多,但是对发酵条件影响多酚类物质的保留,报道较少。杜丽娟等[12]通过RP-HPLC方法对自制猕猴桃酒中多酚物质进行检测,得出样品中主要有原儿茶酸、儿茶素、香草酸等13种多酚物质。黎星辰等[13]通过测定6种不同酵母发酵的猕猴桃酒多酚物质含量和抗氧化能力,以确定适用于猕猴桃酒的发酵的菌株。在猕猴桃果酒发酵过程中,如何保证其原有的营养成分特别是果酒中的多酚物质不被破坏和流失,成为猕猴桃果酒加工过程中重要的课题。为保证猕猴桃果酒品质,特别是果酒发酵过程中的多酚含量,本研究以多酚得率为响应值,从菌种接种量、SO2添加量、发酵温度、发酵时间等方面,优化猕猴桃果酒发酵条件,以期获得含有高含量多酚的猕猴桃果酒,确定其最佳发酵工艺条件。提高猕猴桃酒多酚含量,不仅可以提升产品附加值,又能开发具有保健功效的产品,对提高猕猴桃酒价值具有重要意义。
1 材料与方法
1.1 材料与仪器
绿心猕猴桃 自贡某超市;白砂糖 市售;菌种 安琪高活性干酵母。
HL MJ-250恒温恒湿箱 上海雷韵实验仪器制造有限公司;AR1140电子天平 奥豪斯公司;立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;PHS-3C酸度计 奥豪斯仪器(上海)有限公司;手持糖度计 成都格纳丝商贸有限公司;27000005-1酒精计预制 沈丘北郊玻璃仪器厂;JYL-350榨汁机 山东九阳小家电有限公司。
1.2 实验方法
1.2.1 猕猴桃果酒工艺流程 猕猴桃鲜果→挑选→清洗→打浆(加入SO2)→酶解→接种酵母→前发酵→倒罐→后发酵→陈酿→降酸→过滤→调配→密封装瓶→果酒成品[14-15]。
1.2.2 操作要点 参考文献[16]。
绿心猕猴桃的前处理、打浆、酶解:挑选完好的绿心猕猴桃并清洗干净,将猕猴桃放入打浆机中,同时加入SO2,进行破碎打浆处理,向果浆中加入果胶酶,搅拌,酶解3.5 h,其间每隔0.5 h搅拌1次。
前发酵:调节果浆初始糖度,将酵母接种至猕猴桃果浆中,搅拌均匀,用8层灭菌纱布封口,然后在一定条件下进行发酵。
后发酵:前发酵结束时进行倒罐,将上层猕猴桃果酒倒出,封罐进行后发酵,陈酿。
降酸,过滤,调配:陈酿所得到的猕猴桃原酒酸度较高,需要进行降酸处理,然后进行过滤,并根据猕猴桃干、甜酒类型进行适当调配。
1.2.3 多酚含量测定 采用高锰酸钾滴定法[17]。
1.2.4 实验设计
1.2.4.1 单因素实验 酵母接种量的影响研究:向装有300 mL猕猴桃果浆的锥形瓶中分别接种安琪酵母0.1、0.2、0.3、0.4、0.5、0.6 g,SO2添加量80 mg·L-1,发酵温度24 ℃,发酵8 d;SO2添加量的影响研究:向装有300 mL猕猴桃果浆的锥形瓶中分别添加20、40、60、80、100、120 mg·L-1SO2,酵母接种量0.3 g,发酵温度24 ℃,发酵8 d;发酵温度的影响研究:向装有300 mL猕猴桃果浆的锥形瓶中添加酵母0.3 g,SO2添加量80 mg·L-1,发酵温度分别控制在20、22、24、26、28、30 ℃,发酵8 d;发酵时间的影响研究:向装有300 mL猕猴桃果浆的锥形瓶中接种酵母0.3 g,SO2添加量80 mg·L-1,发酵温度24 ℃,发酵时间分别控制为6、8、10、12、14、16 d。
1.2.4.2 响应面实验设计 在单因素实验基础上,根据Box-Behnken[18]响应面设计原理,设计4因素3水平响应面组合,因素水平表见表1。
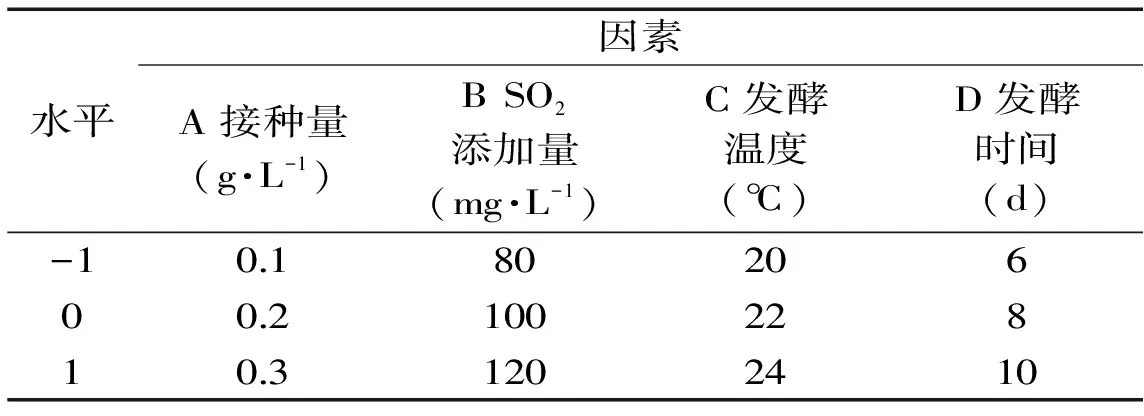
表1 Box-Behnken实验因素与水平
1.3 数据统计分析
采用Design Expert V8.0.6[19]分析软件对实验结果进行响应面回归分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 菌种接种量对猕猴桃果酒多酚含量的影响 由图1可知,随着酵母接种量的增加(0.1~0.4 g·L-1),果酒中多酚含量呈先增加后快速降低的趋势,当接种量超过0.4 g·L-1时,多酚含量变化趋于平缓,最佳接种量为0.2 g·L-1左右,此时多酚含量最高。可能随着接种量的增加,酵母菌代谢活跃,生成各种酶类,其中氧化酶类可能会破坏多酚物质,使得其含量降低。
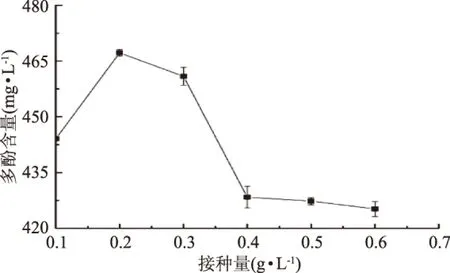
图1 接种量对多酚含量的影响Fig.1 The influence of inoculation on the polyphenol content
2.1.2 SO2添加量对猕猴桃果酒多酚含量的影响 由图2可知,随着SO2添加量的增加,多酚含量逐渐升高后趋于平缓,当SO2添加量达到100 mg·L-1时,多酚含量趋于最高值。果酒酿造中,SO2有杀菌、澄清、抗氧化等作用,这方面与多酚具有类似的作用,由于SO2比多酚类化合物对氧气具有更强的结合能力,所以SO2的加入保护了多酚物质的氧化分解,多酚类物质被保留下来,使得果酒中多酚含量较高。

图2 SO2添加量对多酚含量的影响Fig.2 The influence of SO2 addition on the polyphenol content
注:共有29个实验,其中24个为分析实验,5个为中心实验,以估计误差。
2.1.3 发酵温度对猕猴桃果酒多酚含量的影响 由图3可知,随着温度逐渐升高,多酚含量快速下降。原因在于温度愈高,多酚类化合物越容易发生自身的氧化聚合,低温则可抑制部分酶(主要是多酚氧化酶和花青素褪色酶)的活性,减弱氧化作用,从而有效延缓多酚类化合物的氧化、聚合和降解,保留果酒中的多酚物质。所以,为保证果酒中多酚含量,发酵应在低温条件下进行。
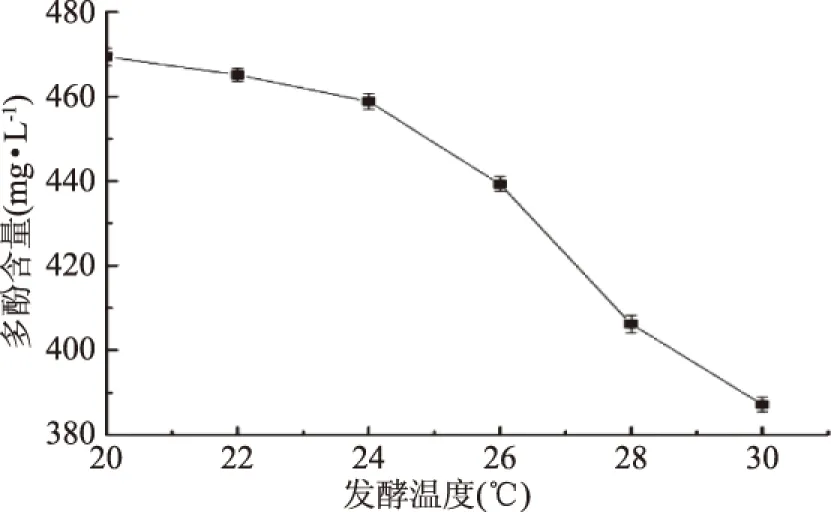
图3 发酵温度对多酚含量的影响Fig.3 The influence of fermentation temperature on the polyphenol content
2.1.4 发酵时间对猕猴桃果酒多酚含量的影响 由图4可以看出,随着发酵时间的延长,果酒中多酚含量逐渐降低,且发酵时间在10~14 d这个时间段,下降幅度较大,为保证果酒中多酚含量,发酵时间应控制在10 d以内。由此可推测,随着发酵时间的增加,酵母菌体开始大量死亡,细胞破裂,氧化酶进入发酵液中,多酚类等物质大量受到氧化破坏,因而使得果酒中多酚含量急剧下降,因此延长发酵时间不利于果酒中多酚含量的维持。

图4 发酵时间对多酚含量的影响Fig.4 The influence of fermentation time on the polyphenol content
2.2 响应曲面结果
2.2.1 Box-Behnken实验结果及方差分析 Box-Behnken实验结果结果见表2。
在各因素对猕猴桃果酒多酚含量影响的基础上,利用Design Expert.V8.0.6对表2的结果进行分析,得到4个因素与多酚含量的回归方程如下:
多酚含量=466.82-7.55A+20.33B-9.28C-7.72D+1.05AB-16.32AC-6.27AD+5.80BC+7.90BD+16.28CD-38.64A2-19.96B2-9.16C2-14.16D2
通过对响应面模型进行方差分析,结果见表3。

表3 回归模型方差分析结果
注:*表示在α=0.05水平上显著;**表示在α=0.01水平上极显著。
从表3可以看出,回归模型(p<0.0001),失拟不显著,相关系数R2=96.99%,说明方程与实际情况拟合较好。通过方差分析,SO2添加量与发酵温度对猕猴桃果酒中多酚含量有显著影响,根据F值的大小可知,各因素对最终多酚含量的影响程度大小依次为:SO2添加量>发酵温度>发酵时间>接种量。
2.2.2 因素交互作用对猕猴桃发酵后多酚含量的响应面分析 通过Design Expert V8.0.6软件分析,得出图5~图7所示的响应曲面图,从图上我们可以直观的看出各因素对响应值的影响,以及整个过程中因素间的交互作用。
由图5可知,其等高线趋于圆形,酵母接种量与SO2添加量交互作用不显著,但可明显看出随着SO2的增加,多酚含量随之增加。实验结果表明在发酵过程中,适当添加SO2有助于多酚物质的保留。
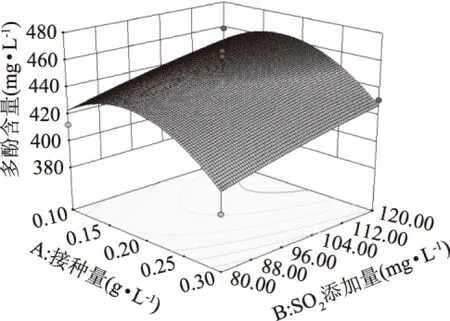
图5 接种量与SO2添加量的响应面分析图Fig.5 The response surface analysis chart of inoculum size and volume of SO2 added
由图6可知,SO2添加量与发酵温度交互作用不显著。从软件上分析可得出,当接种量为0.2 g·L-1,发酵时间为8 d,SO2在104~120 mg·L-1之间,发酵温度在20~22 ℃ 之间时,多酚含量大于440 mg·L-1。
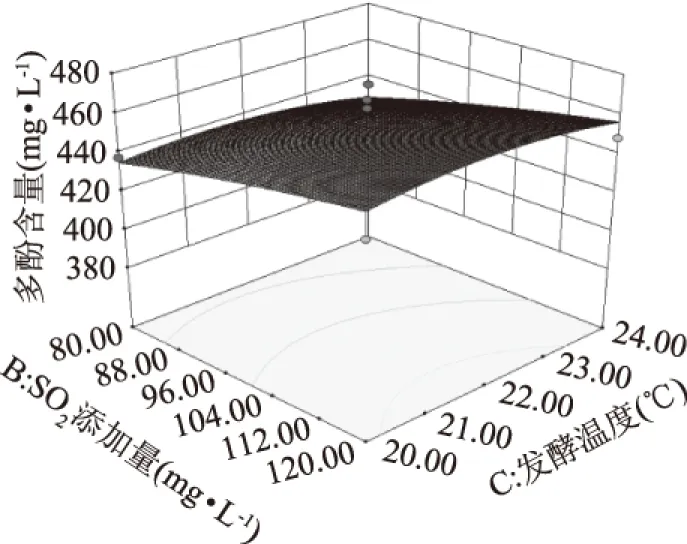
图6 SO2添加量与发酵温度的响应面分析图Fig.6 The response surface analysis chart of SO2 added amount and the fermentation temperature
从图7的等高线可以看出,等高线趋于椭圆形,发酵温度与时间交互作用极显著,亦可以看出多酚含量随着温度的增加,其下降趋势明显。实验结果表明发酵温度对多酚含量有较大的影响。
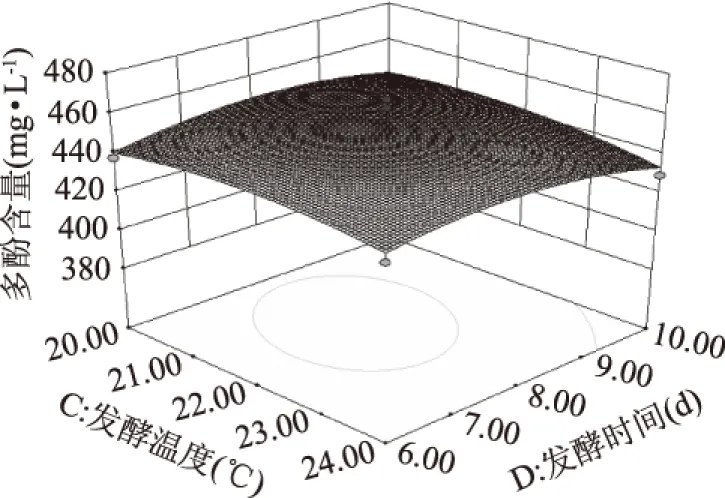
图7 发酵温度与发酵时间的响应面分析图Fig.7 The response surface analysis chart of fermentation temperature and fermentation time
2.3 验证实验
采用Design Expert V8.0.6软件,以猕猴桃果酒获得较高多酚含量为目的,通过分析,最佳发酵条件为:菌种接种量0.2 g·L-1、SO2添加量为104.82 mg·L-1、发酵温度21.4 ℃、发酵时间为7.6 d,在此条件下得到猕猴桃发酵后多酚含量的预测值为473.7 mg·L-1。按照接种量0.2 g·L-1、SO2添加量104.8 mg·L-1、发酵温度21.4 ℃、时间7.6 d进行验证实验,获得猕猴桃果酒中平均多酚含量为471.2 mg·L-1,与预测值较为吻合,说明所建立的数学模型准确可靠。
3 结论
在猕猴桃果酒发酵过程中,各因素对多酚含量的影响程度大小分别为:SO2添加量>发酵温度>发酵时间>接种量。应用响应曲面法研究猕猴桃果酒在不同发酵条件下的多酚含量,回归方程拟合较好,其最佳发酵条件为:菌种接种量0.2 g·L-1、SO2添加量104.8 mg·L-1、发酵温度21.4 ℃、发酵时间为7.6 d,在此条件下,猕猴桃果酒中多酚含量较高,可达471.2 mg·L-1,且发酵生产的猕猴桃果酒,能够满足果酒其它指标的要求。
[1]左丽丽,王振宇,樊梓鸾,等.猕猴桃多酚的生理功能研究进展[J].食品研究与开发,2013,34(11):117-120,127.
[2]梁晨,张倩雯,盛启明,等. 不同品种蓝莓酒抗氧化能力及其多酚含量分析[J]. 中国酿造,2013(8):46-49.
[3]张敬敏,吕玲玲,郭磊. 樱桃核中类黄酮的提取及其抗氧化性研究[J]. 中国酿造,2010(6):65-68.
[4]Forester Sc,Waterhouse Al. Metabolites are key to understanding health effects of wine polyphenolics[J]. The Journal of Nutrition,2009,139(9):1824-1831.
[5]Georgiev V,Ananga A,Tsolova V. Recent advances and uses of grape flavonoids as nutraceuticals[J]. Nutrients,2014,6(1):391-415.
[6]A P Kulkami Sma,S Divakar. Isolation and identifieation of a Radical scavenging antioxidant-Puniealagin from Pith and carpellarymembran of Pomegranate fruit[J]. Food Chemistry,2004,87:551-557.
[7]N Filomena LBM,W L Sharon. The influence of pomegranate fruitextract in eomParison to regular Pomegranate juice and seed oil on nitrie oxide and arterial funetion in obese Zuekerrats[J]. Nitric Oxide,2007(17):50-54.
[8]苏宜香. 营养学(一)[M]. 北京:北京大学医学出版社,2006:149-151.
[9]张超,徐洲,游玲,等.野生猕猴桃果酒带渣发酵的研究[J].食品研究与开发,2012,33(8):23-27.
[10]周跃勇,王岸娜,吴立根.从猕猴桃中提取多酚的研究[J].食品研究与开发,2007,28(3):56-60.
[11]成宇峰,岳泰新,张振文.不同工艺酿造猕猴桃新酒抗氧化性的研究[J].酿酒科技,2015(6):20-22.
[12]杜丽娟,薛洁,王异静.反相高效液相色谱法测定猕猴桃酒中的多酚物质[J].酿酒,2008,35(1):72-74.
[13]黎星辰,唐敏,曹琳,等.不同酿酒酵母对猕猴桃酒理化性质、抗氧化能力及感官的影响[J].食品科技,2016,41(6):16-20.
[14]张志敬. 猕猴桃果酒的研制[J]. 食品研究与开发,2002,23(5):38-40.
[15]彭帮柱,岳田利,袁亚宏,等. 猕猴桃果酒酿造工艺参数优化及其香气成分分析[J]. 农业工程学报,2007,23(2):229-232.
[16]罗秦,孙强,叶欣,等.红心猕猴桃果酒酿造工艺探究[J]. 食品工业,2014,35(5):144-147.
[17]张毛莉,罗仓学. 石榴皮中总酚含量测定方法[J]. 食品工业科技,2011,33(5):383-388.
[18]杨文雄,高彦祥. 响应面法及其在食品工业中的应用[J]. 中国食品添加剂,2005(2):68-71.
[19]Montgomery Dc. Design and Analysis of Experiments[M]. London: John Wiley and Sons Inc,1991.
Influence of fermentation conditions on the yield of polyphenols in kiwi fruit wine
ZHANG Jing1,ZUO Yong1,*,XIE Guang-jie2,ZHANG Xin1,SUN Shi-guang1,QU Jiao-jiao1
(1.College of Bioengineering,Sichuan University of Science and Engineering,Zigong 643000,China; 2.Sichuan Vocational College of Chemical Technology,Luzhou 646000,China)
Factors on the yield of polyphenols in kiwi fruit wine were mainly studied in this paper. Based on single-factor test,yeast inoculum,SO2dosage,temperature and time were chosen as independent variables,and yield of polyphenols was the response variable. Box-Behnken experimental design and response surface methodology were applied to optimize the fermentation conditions. The results showed that the optimum fermentation conditions were determined as inoculation 0.2 g·L-1,SO2dosage 104.8 mg·L-1,fermentation temperature of 21.4 ℃,fermentation time 7.6 d. Under the optimal conditions,the yield of polyphenols in kiwi fruit wine reached up to 471.2 mg·L-1. Polyphenols were preserved preferably in kiwi fruit wine.
kiwi fruit wine;polyphenols;fermentation conditions
2016-10-08
张晶(1992-),男,硕士,主要从事发酵食品方面的研究,E-mail:451298213@qq.com。
*通讯作者:左勇(1972-),男,硕士,教授,主要从事发酵食品方面的研究,E-mail:sgzuoyong@tom.com。
四川省科技厅产业链项目(2016FZ0034);四川省企业技术创新项目(2015XM122);四川理工学院研究生创新项目(Y2016011);四川省大学生创新创业训练项目(201510622604)。
TS254.1
A
1002-0306(2017)09-0160-05
10.13386/j.issn1002-0306.2017.09.022
