豆类胰蛋白酶抑制剂亚基特性研究
2017-06-05俞红恩康玉凡
俞红恩,康玉凡
(中国农业大学农学院,北京 100193)
豆类胰蛋白酶抑制剂亚基特性研究
俞红恩,康玉凡*
(中国农业大学农学院,北京 100193)
本研究选取豌豆、绿豆、豇豆、芸豆、红小豆、蚕豆、黑大豆、鹰嘴豆、黎豆、苦豆10种豆,测得10种豆中胰蛋白酶抑制剂(trypsin inhibitor,TI)含量范围为47.4~148.9 TIU/g,苦豆和品红05200的含量最高,分别为148.9、121.8 TIU/g。Gelatin-PAGE活性染色表明10种豆的亚基数目范围为5~13个,品种间TI亚基种类、丰度存在一定差异。通过极端热、酸、碱、盐、振荡条件分别处理10种豆粉粗提液,在亚基层面分析不同豆类胰蛋白酶抑制剂的稳定性特征,为进一步探究胰蛋白酶抑制剂稳定性机理提供初步结构数据,为豆类在食品加工及饲料养殖方面提供指导。
豆类,胰蛋白酶抑制剂亚基,多型性,稳定性
胰蛋白酶抑制剂泛指能抑制胰蛋白酶类的多肽或蛋白质[1],它具有极为重要的生理活性功能,在医学上可用来治疗Ⅱ型糖尿病、抑制或杀死癌细胞[2]、治疗辐射损伤[3]、通过抑制激肽释放酶和纤溶酶达到手术止血作用[4];在农业生产上抗病虫害的侵染等[5];在食品加工上豆类胰蛋白酶抑制剂能抑制蛋白酶的水解,作为食品添加剂食用能有效防止鱼、肉产品的软化[6],从而达到改善肉类产品的质构与口感的功效。
豆类种子中的胰蛋白酶抑制剂是一种重要的贮藏蛋白,含量高达豆类总蛋白的1%~10%。在豆类种子成熟时,胰蛋白酶抑制剂的含量达到最高;种子萌发时,胰蛋白酶抑制剂逐渐被降解,含量也随之下降[7]。我国主要栽培的豆类有豌豆、绿豆、芸豆、豇豆、红小豆、黑大豆及蚕豆等,非主栽的豆类有海红豆、鹰嘴豆、黎豆、苦豆等,大量研究表明[1-2,6,8],豆类种子中不仅含有丰富的胰蛋白酶抑制剂,并且大部分种子中TI具有较高的耐热、酸、碱、盐等稳定性,但目前缺乏主栽及非主栽豆类种子中胰蛋白酶抑制剂亚基数目、含量及其稳定特性的基础数据储备,这些研究数据对豆类胰蛋白酶抑制剂资源的进一步开发与利用以及科学加工食用豆类产品都具有极为重要的参考价值。
1 材料与方法
1.1 材料与仪器
豌豆、绿豆、芸豆、红小豆、蚕豆、豇豆、黑大豆、鹰嘴豆、黎豆、苦豆种子 四川、白城、青岛、甘肃、吉林等农科院;胰蛋白酶(1∶10000,Trypsin>10000 N.F.U/mg)、苯甲酰-DL-精氨酸-对硝基酰胺盐(BAPNA) 美国Sigma公司;明胶 化学纯;其余试剂为分析纯或生物试剂。
旋风磨 瑞典Foss公司;JY600C型电泳仪 北京君意仪器公司;THZ-C型恒温振荡器 北京佳源兴业科技有限公司;GL-3250B型恒温磁力搅拌器 海门市其林贝尔仪器制造有限公司。
1.2 实验方法
1.2.1 胰蛋白酶抑制剂的粗提取 用旋风磨研磨完整种子并过80目筛,将过筛豆粉置于4 ℃冰箱中备用。取5 g豆粉加入10倍蒸馏水于150 mL烧杯中室温下振荡搅拌提取60 min,4 ℃下10000 r/min离心20 min取上清液,即为提取液[8]。
1.2.2 胰蛋白酶抑制剂活性测定
1.2.2.1 测定原理 胰蛋白酶可催化水解BAPNA,引起410 nm处吸光度的增加,而胰蛋白酶抑制剂可抑制胰蛋白酶的活性,使410 nm波长处吸光度增加的幅度有所减少,以其减少的程度表示此抑制剂的抑制能力,从而计算抑制活性[9]。
1.2.2.2 溶液配制 Tris-HCl缓冲液:0.222 g CaCl2溶于100 mL 0.05 mol/L、pH8.2 Tris-HCl缓冲液;BAPNA溶液(现用现配):先以0.5 mL二甲基亚砜溶解0.02 g BAPNA,再用已预热37 ℃的Tris-HCl缓冲液定容至50 mL;胰蛋白酶溶液:0.004 g胰蛋白酶用0.001 mol/L的HCl溶解并定容至50 mL;30%乙酸:分别量取30 mL冰乙酸及70 mL蒸馏水,混匀[8]。
1.2.2.3 测定步骤 微反应板上依次加入50 μL样品液,50 μL胰蛋白酶液,37 ℃保温10 min后,加入125 μL BAPNA溶液,37 ℃保温30 min,加入25 μL乙酸溶液终止反应。在410 nm波长下用酶标仪测定吸光度[11]。
1.2.2.4 计算方法 胰蛋白酶抑制剂活性以每克样品中胰蛋白酶被抑制的程度表示
式(1)
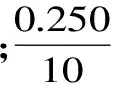
1.2.3 胰蛋白酶抑制剂亚基测定
1.2.3.1 溶液配制胰蛋白酶液 0.008 g胰蛋白酶溶于40 mL,0.001 mol/L的盐酸,放置30 min,加水定容至100 mL;脱酶液:6.058 g Tris,11.7 g NaCl,1.11 g CaCl2加水至800 mL,调pH至7.5,定容至1 L;洗脱液:14.625 g NaCl定容至1 L。
1.2.3.2 Gelatin-PAGE电泳 按5倍提取液加1倍蒸馏水进行稀释,与等体积的非还原电泳样品缓冲液充分混合,取10 μL进行Gelatin-PAGE电泳。采用不连续垂直平板电泳系统,5%的浓缩胶,12%的分离胶,浓缩胶电流为20 mA,分离胶电流为40 mA,电泳毕,先用胰蛋白酶液酶解20 min;倒掉酶液,倒置培养皿37 ℃静置酶解1.5 h;而后用脱酶液连续漂洗3次,2 min/次;考马斯亮蓝R-250染色1 h,脱色液隔夜脱色[12-14]。
1.2.4 胰蛋白酶抑制剂亚基的稳定性 选取实验材料分别为A.海门白玉豌、B. 潍绿7号、C. 豇豆09-1451、D.奶花芸豆、E.白红8号、F.青蚕13号、G. 黑大豆、H. 鹰嘴豆、I. 黎豆、J.苦豆,分别进行1.酸、2.碱、3.盐、4.热、5.振荡、6.对照处理。
1.2.4.1 酸性条件对抑制剂亚型的影响 取0.5 mL提取液加入0.5 mL 0.05 mol/L、pH1.7的KCl-HCl缓冲液,静置8 h。4 ℃下10000 r/min离心10 min取上清,然后检测TI残余活性及酶谱变化。
1.2.4.2 碱性条件对抑制剂亚型的影响 取0.5 mL提取液加入0.5 mL 0.05 mol/L、pH13的KCl-NaOH缓冲液,静置8 h。4 ℃下10000 r/min离心10 min取上清,然后检测TI残余活性及酶谱变化。
1.2.4.3 高盐条件对抑制剂亚型的影响 取0.5 mL提取液加入0.5 mL 2.4 mol/L NaCl溶液,静置8 h。4 ℃下10000 r/min离心10 min取上清,然后检测TI残余活性及酶谱变化。
1.2.4.4 高温条件对抑制剂亚型的影响 取0.5 mL提取液加入0.5 mL 蒸馏水,于100 ℃水中30 min,取出立即冰水冷却。4 ℃下10000 r/min离心10 min取上清,然后检测TI残余活性及酶谱变化。
1.2.4.5 过夜振荡对抑制剂亚型的影响 取0.5 mL提取液加入0.5 mL 蒸馏水,于涡旋仪涡旋振荡8 h。4 ℃下10000 r/min离心10 min取上清,然后检测TI残余活性及酶谱变化。
1.3 数据统计方法
实验数据运用SPSS software(Ver.20.0)进行分析,凝胶活性电泳图谱运用Quantity one(V4.6.2)进行光密度扫描分析。
2 结果与分析
2.1 不同豆类胰蛋白酶抑制剂含量
由表1可知,不同豆类中TI含量存在较大的差异,如豇豆种子中TI平均含量114 TIU/g,而蚕豆种子中TI平均含量60 TIU/g;有些豆类不同品种间TI含量也存在较大差异,如加拿大豌豆与海门白玉豌、中绿5号与白绿8号间TI含量差高达40%左右;豇豆、小豆、芸豆品种间TI含量十分接近。豆类品种繁多,且TI含量存在显著差异,江均平等[8]对3种黑大豆、17种小豆、26种绿豆的TI含量进行测定,发现绿豆平均含量比红小豆、黑大豆低5倍以上。胰蛋白酶抑制剂具有双重功效,既是一种抗营养因子又是一种生理活性蛋白,豆类在食品、饲料、保健等领域应用广泛。因此,可根据豆类种子用途(提取、食用或饲料加工)选取TI含量适宜的原材料。
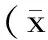
表1 不同豆类胰蛋白酶抑制剂活性±s,n=3)
注:同列数据后的不同小写字母表示在0.05水平差异显著,上标1:豌豆;2:绿豆;3:豇豆;4:芸豆;5:小豆;6:蚕豆;7:黑大豆;8:鹰嘴豆;9:黎豆;10:苦豆。2.2 不同豆类胰蛋白酶抑制剂多型性
采用非还原Gelatin-PAGE电泳方法对选取的豌豆、绿豆、豇豆、芸豆、小豆、蚕豆各3个品种及黑大豆、鹰嘴豆、黎豆、苦豆各1个品种的TI亚基进行分析,结果如图1、图3及图4所示,并对得到的电泳图谱进行光密度扫描分析。

图1 豌豆、绿豆、豇豆、芸豆、小豆、蚕豆TI活性电泳图谱Fig.1 TIS zymogram of pea,mung bean,cowpea,kidney bean,adzuki bean and broad bean on Gelatin-PAGE注:1.加拿大青豌豆;2.陇豌3号;3.海门白玉豌;4.中绿5号;5.白绿8号;6.潍绿7号;7.豇豆09-1452;8.红白花豇豆;9.吉豇1号;10.奶花芸豆;11.中花芸豆;12.英国红;13.品红05200;14.冀红12号;15.白红3号;16.青蚕13号;17.临蚕6号;18.成胡10号. A1~A13:豌豆TIS;B1~B6:绿豆TIS;C1~C8:豇豆TIS;D1~D8:芸豆TIS;E1~E8:小豆TIS;F1~F10:蚕豆TIS。
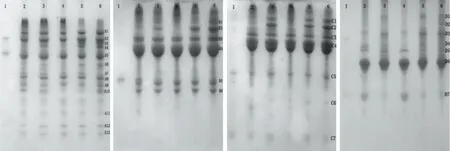
图2 A,B,C和D的TIS酸、碱、盐、热、振荡及对照处理活性显色电泳图Fig.2 TIS activity staining PAGE of crude extract by heat,acid,alkali,salt,oscillation and control from A,B,C and D注:A:海门白玉豌;B:潍绿7号;C:豇豆09-1451;D奶花芸豆。
豌豆有13个亚基,A1、A2为主要构成亚基,相对含量分别约为25.6%、19.0%,A4、A5、A8相对含量次之,A7、A9、A11、A13亚基在豌豆品种中微量存在,不同豌豆品种中每种亚基的相对含量差别不大;绿豆有6个亚基,其中B4为主要构成亚基,相对含量为43.5%~50.8%,其余4个亚基含量次之;豇豆有8个亚基,其中C4为主要构成亚基,在3个品种中的相对含量为30.2%~39%,C1~C3含量次之,C6~C8亚基含量极低;芸豆由8个亚基构成,D4是其主要组分,中花芸豆D5、D6、D7亚基的相对含量较奶花芸豆和英国红高,而奶花芸豆和英国红D8亚基相对含量较中花芸豆高;小豆有8个亚基,其中E4为主要构成亚基,3个小豆品种E4亚基的相对含量十分接近,28%左右,E1、E2、E3亚基相对含量次之,其他亚基微量;蚕豆有9~10个亚基,成胡10号有10个亚基,而临蚕6号及青蚕13号有9个亚基,蚕豆品种间亚基数目及亚基类型差异较大;黑大豆有11个亚基,其中G9与G10为主要亚基构成,相对含量分别为24.0%、22.8%。在非主栽豆类品种中,鹰嘴豆有5个亚基,其中H2、H3亚基含量最高,相对含量分别为27.3%、31.9%,其余亚基微量;黎豆有6个亚基,I4和I5亚基含量最高,相对含量分别为36.9%、24.2%,其他亚基相对含量极低;苦豆有6个亚基,其中J3、J5是其主要构成亚基,其他亚基微量。
2.3 不同豆类胰蛋白酶抑制剂亚型的稳定性
非还原Gelatin-PAGE电泳结果如图2所示。
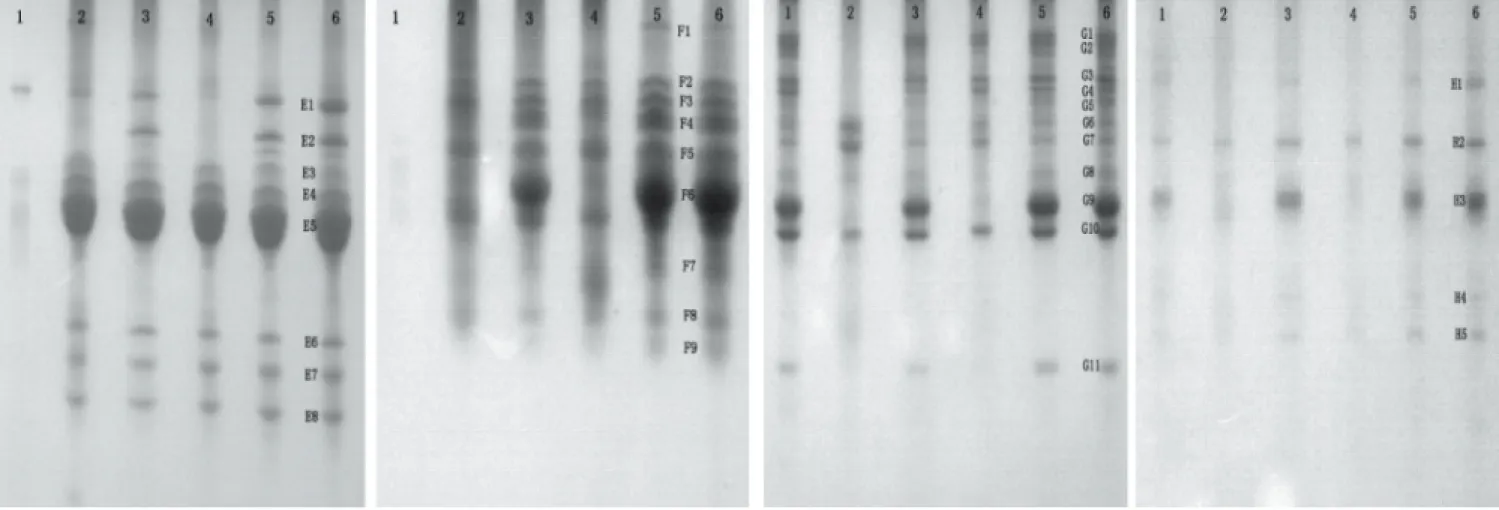
图3 E,F,G和H的TIS酸、碱、盐、热、振荡及对照处理活性显色电泳图Fig.3 TIS activity staining PAGE of crude extract by heat,acid,alkali,salt,oscillation and control from E,F,G and H注:E白红3号;F:青蚕13号;G:黑大豆;H:鹰嘴豆。
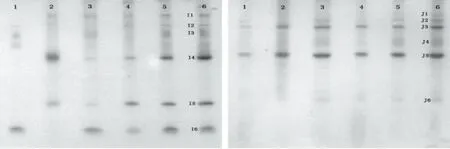
图4 I和J的TIS酸、碱、盐、热、振荡及对照处理活性显色电泳图Fig.4 TI activity staining PAGE of crude extract by heat,acid,alkali,salt,oscillation and control from I and J注:I:黎豆;J:苦豆。
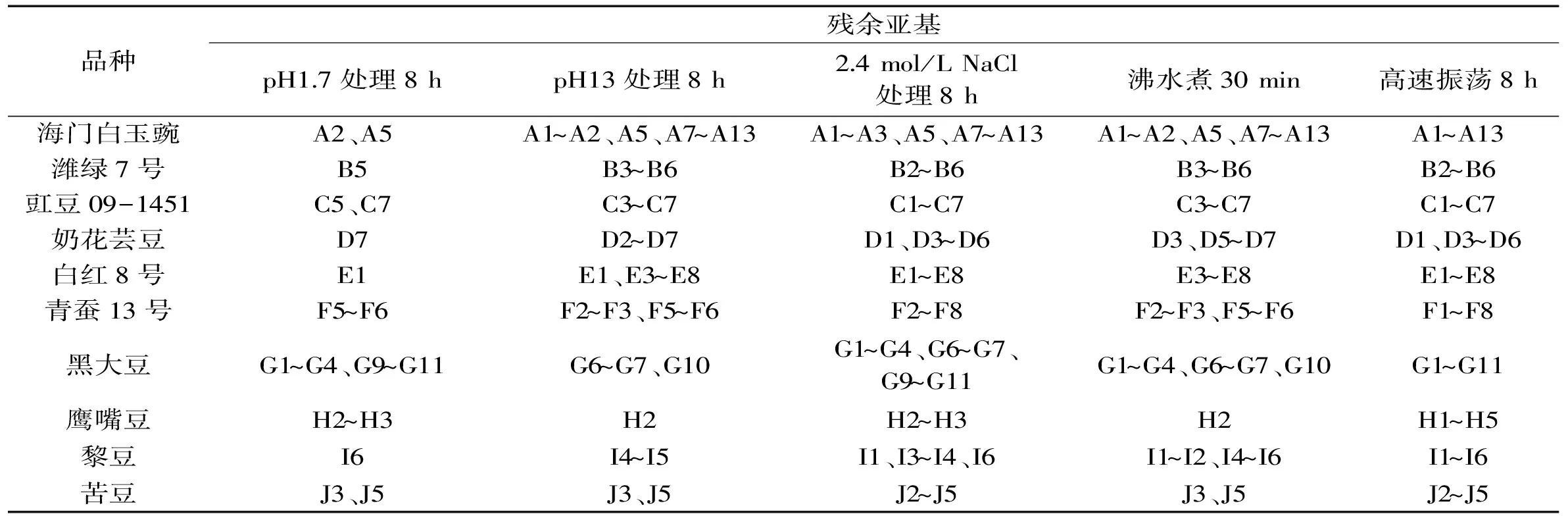
表2 豆类胰蛋白酶抑制剂亚基酸、碱、盐、热、振荡稳定性
通过对图2~图4的电泳图谱进行光密度扫描分析,得表2及图5结果。表2在定性方面总结了不同豆类TI能耐受极端酸碱盐热振荡环境的亚基类型,图5则从定量方面总结了不同处理对TI亚基相对含量的影响。表3从TI整体活性方面探究了极端环境处理后,部分亚基被破坏,TI活性功能的变化。
由图2~图5、表2~表3的分析可知,粗提液经极端酸、碱、盐、热及振荡环境处理后,其TI残余活性、TI亚基相对含量及TI亚基数目变化的结果相吻合,因此,TI表现出的稳定特性是由其具备相应稳定特性的亚基决定的。潍绿7号、豇豆09-1451、奶花芸豆及白红8号TI耐受强酸环境的能力远低于耐受强碱环境;10种豆TI均能在高盐环境中保持较高的稳定性;潍绿7号及奶花芸豆耐受高温煮沸的能力最强;除奶花芸豆外,其余9种豆TI均能在高强度振荡环境中保持高活性。TI是一种蛋白质,当样品溶液的pH低于TI等电点时,TI便呈正离子状态;当溶液的pH高于TI的等电点时,TI则成负离子状态,在等电点附近,水化作用最弱,溶液越不稳定[15];TI属于丝氨酸族蛋白酶抑制剂[16],半胱氨酸、丝氨酸、精氨酸等构成其活性部位,高温条件下,因半胱氨酸残基和二硫键对热敏感而易被破坏[17],且研究发现[18],在蛋白质表面丝氨酸含量下降明显;在高盐环境中,盐分子与溶液中的水进行水化作用,降低水分子的活度系数[19],致使蛋白质沉淀。
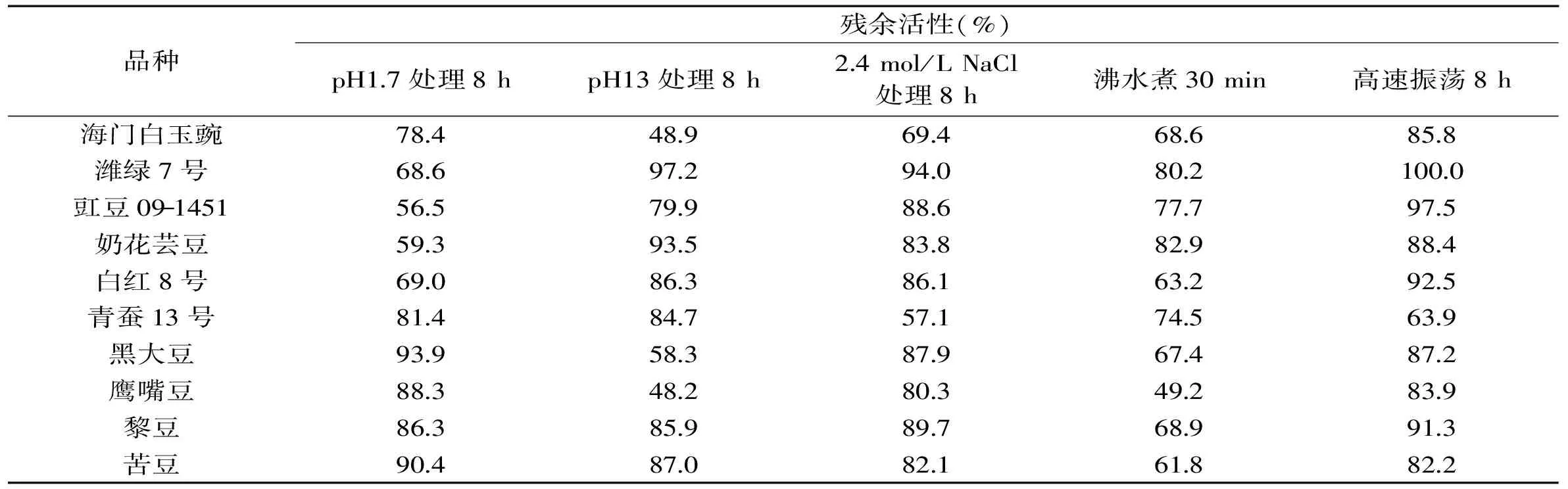
表3 豆类胰蛋白酶抑制剂酸、碱、盐、热、振荡稳定性
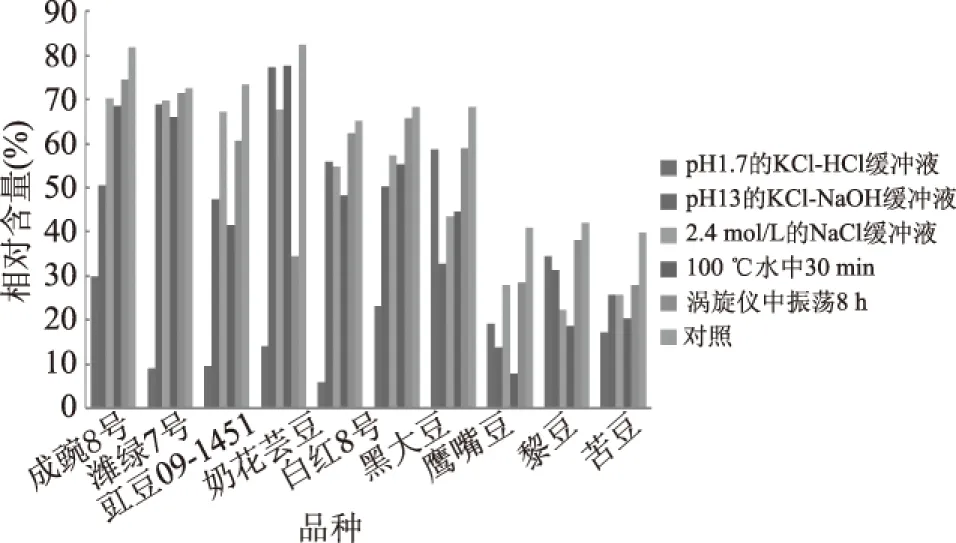
图5 豆类胰蛋白酶抑制剂亚基相对含量Fig.5 Subunit relative proportion of legume trypsin inhibitor
3 讨论与结论
3.1 豆类胰蛋白酶抑制剂亚基的数目及含量
实验材料选取来自全国不同地区的豆类种子,TI亚基活性电泳图谱显示豌豆有13种TIS、绿豆有6种TIS、豇豆、芸豆、小豆有8种TIS,而蚕豆有9~10种亚基,成胡10号有10种亚基,临蚕6号及青蚕13号有9种亚基。E1-Shamei Z等[20]发现豆类胰蛋白酶抑制剂亚基的数目及含量与豆类品种、病害程度、生理状况有极大关联。研究胰蛋白酶抑制剂的多型性有着非常重要的生理生物学意义,豆类胰蛋白酶抑制剂在降血糖、抑癌、抗病虫微生物侵害、种子萌发等方面有着重大意义,有研究表明PTI的一种亚型能剂量依赖性地抑制人体早期结肠癌细胞HT29[21]。因此,通过对豆类胰蛋白酶抑制剂亚基的进一步探究,分离纯化相关功能亚基,更有针对性地应用于医疗领域,并对其结构进行研究,有助于探究胰蛋白酶抑制剂降血糖、抑癌等生物学功能机制。
3.2 豆类胰蛋白酶抑制剂亚基的稳定性
大量研究[22-27]表明小豆、绿豆、豇豆、芸豆、豌豆等均具有较高的热、高盐稳定性,本研究在亚基层面解释了豆类胰蛋白酶抑制剂表现出较强热、高盐稳定性的本质是由特定的亚基决定的。在探究TI亚基稳定性的电泳图谱上,显现出亚基缺失或新增,在极端pH环境下,由高静电荷所引起的强分子间排斥力可能会导致蛋白分子的增大或展开[28]。李一莉等[29]研究发现通过对绿豆胰蛋白酶抑制剂的Lys活性碎片序列进行重组去残基,合成一个22肽的胰蛋白酶抑制剂,其活性与天然的26肽相当,这是目前人工合成的最小的多肽类抑制剂。这表明,在一些极端环境下,胰蛋白酶抑制剂亚基也会自发的重组、断裂,可能会形成具有新型功能或强化某项功能的高效型胰蛋白酶抑制剂,这也为开发或改进胰蛋白酶抑制剂结构功能提供新依据,使其更好地应用于医药、食品行业。
[1]王荣春,孙建华,何述栋. 胰蛋白酶抑制剂的结构与功能研究进展[J]. 食品科学,2013,34(9):364-367.
[2]Fang E F,Hassanien A A,Wong J H,et al. Isolation of a new trypsin inhibitor from the Faba bean(Viciafabacv. Giza 843)with potential medicinal applications[J]. Protein Pept Lett,2011,18(1):64-72.
[3]Katoh H,Ishikawa H,Hasegawa M,et al. Protective effect of urinary trypsin inhibitor on the development of radiation-induced lung fibrosis in mice[J]. J RadiatRes(Tokyo),2010,51(3):325-332.
[4]Sylvie R,Bertil K. The Annals of pharmacotherapy[J]. AnejtMsiolog,1996,12(8):37-39.
[5]Lopes J,Valadares N,Moraes D,et al. Physico-chemical and antifungal properties of protease inhibitors from Acacia plumose[J]. Phytochemistry,2009,70,871-879.
[6]Sun L C,Yoshida A,Cai Q F,et al. Mung bean trypsin inhibitor is effective in suppressing the degradation of myofibrillar proteins in the skeletal muscle of blue scad(Decapterusmaruadsi)[J]. Journal of Agricutural and Food Chemistry,2010,58(24):12986-12992.
[7]廖海,杜林方,周嘉峪. 植物中蛋白类蛋白酶抑制剂研究进展[J].天然产物研究与开发,2001,14(7):80-83.
[8]江均平,李春红,张涛,等. 绿豆胰蛋白酶抑制剂的含量、多型性及稳定性[J]. 食品科学,2013,34(11):32-35.
[9]L M Perez,B L Alvarez,F Codony,et al. A new microtitre plate screening method for evaluating theviability of aerobic respiring bacteria in high surfacebiofilms[J],Letters in Applied Microbiology,2010,51(3):331-337.
[10]燕方龙,华蕾. 大豆制品中胰蛋白酶抑制剂的抑制活性测定[M]. 理化检验:化学分册,2007:226-228.
[11]李德发. 大豆抗营养因子[M]. 中国科学技术出版社,2003,330-335.
[12]R Felicioli,Garzelli,L Vaccari,et al. Activity staining of protein inhibitors of proteases on gelatin-containing polyacrylamide gel electrophoresis[J]. Analytical Biochemistry,1997,244(1):176-179.
[13]黄国伟,巫光宏,何嘉雯,等. 测定豆类胰蛋白酶抑制剂活性和种类的电泳方法改良[J]. 大豆科学,2010,(2):315-318.
[14]江均平,李春红,张涛,等. 红小豆栽培品种胰蛋白酶抑制剂的含量及特性研究[J]. 中国粮油学报,2013,28(9):27-29.
[15]李智,林广素. 豆奶粉的稳定性研究[J]. 广西轻工业,2007,2(2):15-16,53.
[16]张兵,赵明沂,张嵘. 丝氨酸蛋白酶抑制剂的研究进展[J]. 沈阳药科大学学报,2014,31(10):836-840.
[17]Kim Hw,Ishikawa K. The Role of Disulfide Bond in HyperthermophilicEndocellulase[J]. Extremophiles,2013,17(4):593-599.
[18]Chakravarty S,Varadarajan R. Elucidation of Determinants of Protein Stability through Genome Sequence Analysis[J]. Febs Letters,2000,470(1):65-69.
[19]陈霞,姜晓雷,李明达,等. 离子强度和pH对大麦中热稳定蛋白稳定性的影响[J]. 食品工业科技,2010,31(20):87-89,175.
[20]Ei-Shamei Z,Wu J W,Haard N F. Influence of wound injury on accumulation of proteinase inhibitors in leaf and stem tissues of two processing tomato cultivars[J]. Journal of Food Biochemistry,1996,20:155-171.
[21]Clemente A,Manzano M,Jimenez E,et al. The anti-proliferative effect of TI1B,a major Bowman-Birkisoinhibitor from pea(PisumsativumL.),on HT29 colon cancer cells is mediated through protease inhibition[J]. British Journal of Nutrition,2012,108(1):135-144.
[22]Haward T. Trypsin inhibitor content of New Zealand grown pea cultivars[D]. New Zealand:Lincoln University,1996.
[23]张伦,刘盈盈,杨玲,等. 紫花芸豆胰蛋白酶抑制剂粗提条件优化及稳定性研究[J]. 西南农业学报,2009,22(4):27-31.
[24]赵欣,付煊赫,张宗申,等. 鹰嘴豆种子胰蛋白酶抑制剂的分离纯化与鉴定[J]. 中国生物化学与分子生物学报,2011,27(3):287-292.
[25]Sappasith Klomklao,Soottawat Benjakul,Hideki Kishimura,et al. Extraction,purification and properties of trypsin inhibitor from Thai mung bean(Vigna radiate(L.)R. Wilczek)[J]. Food Chemistry,2011,129(4):1348-1354.
[26]Benjakul S,Visessanguan W,Thummaratwasik P. Isolation and characterization of trypsin inhibitors from some Thai legume seeds[J]. Journal of Food Science and Technology,2000,24,107-127.
[27]Benjakul S,Karoon S,Suwanno A. Inhibitory effects of seed extracts on fish proteinases[J]. Journal of the Science of Food and Agriculture. 1999,79,1875-1881.
[28]Damodaran S,Xu,Sq. The role of electrostatic forces in anomalous adsorption behavior of phosvitin at the air/water interface[J]. Journal of Colloid and Interface Science,1996,178(2):426-435.
[29]李一莉,林晓红,崔敷,等. 绿豆胰蛋白酶抑制剂片段及其类似物的合成[J]. 中国科学(B辑),1994,24(1):42-47.
Subunit properties of legume trypsin inhibitor
YU Hong-en,KANG Yu-fan*
(College of Agronomy,China Agricultural University,Beijing 100193,China)
This study selected 10 varieties of cultivated beans,inclucling mung bean,cowpea,kidney bean,adzuki bean and broad bean,black soybean,chickpea,mucuna,fenugreek as matarials. Trypsin inhibitor(TI)activity,polymorphism and stability of beans were tested. The beans TI activity were 47.4~148.9 TIU/g. Fenugreek and Pinhong05200 had the highest TI activity,which were 148.9,121.8 TIU/g,respectively. Inhibitor activity staining Gelatin-PAGE showed that beans had 5~13 TI bands. The number and the relative content of subunit of legume TI were determined respectively,and there were many differences of subunit properties in diverse cultivars. Through the treatment of extreme heat,acid,alkali,salt and oscillation,the stability characteristics of trypsin inhibitor were analyzed in the level of subunit aiming at provide preliminary structural data for further research on the mechanism of the stability of the trypsin inhibitor and provide guidance for beans in the food processing and forage breeding.
legume;subunit of trypsin inhibitor;polymorphis;mstability
2016-09-13
俞红恩(1992-),女,硕士,研究方向:豌豆胰蛋白酶抑制剂提取纯化与特性,E-mail:15600912395@163.com。
*通讯作者:康玉凡(1963-),女,博士,教授,研究方向:种子生物学及豆类芽菜理论与技术,E-mail:yfkang@cau.edu.cn。
国家现代农业产业技术体系建设专项资金(CARS-09-06B)。
TS201.3
A
1002-0306(2017)09-0133-06
10.13386/j.issn1002-0306.2017.09.017
