果胶协同干热变性对甘薯淀粉分子结构的影响
2017-06-05陈梦雪张静雅李光磊
陈梦雪,冯 亮,李 飞,张静雅,李光磊,*
(1.河南科技学院食品学院,河南新乡 453003; 2.开封技师学院,河南开封 475000)
果胶协同干热变性对甘薯淀粉分子结构的影响
陈梦雪1,冯 亮2,李 飞1,张静雅1,李光磊1,*
(1.河南科技学院食品学院,河南新乡 453003; 2.开封技师学院,河南开封 475000)
本文利用扫描电镜、紫外光谱、粒度分析仪等分析手段研究果胶浓度、干热温度和干热时间对甘薯淀粉分子结构的影响。结果表明:经过不同时间干热处理,淀粉与果胶共混的颗粒随着时间的延长而形成小团块且逐渐增多、变大;甘薯淀粉与果胶共混干热后,添加不同浓度果胶的淀粉分子链间的聚合度减小(由未添加果胶的620~626 nm降低到浓度为0.05%的603~608 nm),随着温度的增加和时间的延长可使淀粉分子间的聚合度增大,紫外光谱的最大吸收波长均发生蓝移现象;淀粉颗粒中位径、大颗粒体积分数随着果胶浓度、温度、时间的增加而增大,在干热时间为3 h时淀粉颗粒的中位径最大(为15.47 μm),大颗粒体积分数最大可达到6.27%,比在1 h时的大颗粒体积分数高出1.81%;淀粉与果胶共混物的直链淀粉的溶出量随着果胶浓度(0.01%~0.04%)、干热温度和干热时间(1~4 h)的增加而得到更好的抑制。果胶协同干热处理对开发新型甘薯变性淀粉具有重要意义。
甘薯淀粉,果胶,干热处理,淀粉分子结构
我国甘薯的年产量在7909万t,是继水稻、小麦、玉米之后,位于我国粮食产量的第四位[1]。天然淀粉均具有易老化、溶解性差和透明度差等因素,生产中常将其进行变性处理,以改善淀粉的某些功能性和提高淀粉的利用率[2]。研究发现采用运动发酵单孢菌对甘薯淀粉进行发酵可制得酒精[3-4]。甘薯淀粉在医学中应用也非常广泛,如以糊精葡聚糖转移酶处理甘薯淀粉可制备环糊精为医学所广泛使用[5]。
干热处理是一种物理改性淀粉的新方法,是对原料在“干”(水分含量<10%)的状态下进行热处理(120~200 ℃)完成变性的过程[6-7]。干热处理无化学试剂残留、安全无污染,是一种很有发展前途的变性淀粉生产方法。近年来研究发现,在干热的条件下将淀粉与食用胶共混处理,可以有效的改善淀粉的物理性质,提高食品的质量或食品体系的稳定性[8-9]。Wing[10]等研究发现淀粉与柠檬酸盐混合后干热处理,能够使淀粉的羟基与柠檬酸的羟基交联,形成新的化学键。Chung[11]等研究黄原胶对干热法大米淀粉(蜡质、普通)与磷酸盐(STMP∶STPP=99∶1)交联反应的影响。结果表明添加黄原胶有利于交联反应,可减少交联反应磷酸盐的用量。李坚斌[12]还用体外模拟的方法测定果胶和木薯淀粉共混干热后在人体小肠内的缓释性能。实验证明,用果胶和淀粉的共混物干热后形成交酯,且骨架释放度较高,控释效果好。果胶具有来源广泛、安全性高、无化学残留和无污染等优点[13]。
本文主要研究果胶浓度、干热温度和干热时间对甘薯淀粉颗粒形貌、碘吸收光谱等的影响,旨在明确果胶协同干热处理对甘薯淀粉分子结构的影响,为果胶协同干热变性在甘薯淀粉深加工中的应用提供理论支持。
1 材料与方法
1.1 材料与仪器
甘薯淀粉 食品级,上海塞翁福农业发展有限公司;果胶 美国唐瑞斯食品物料公司;盐酸、氢氧化钠等试剂均为分析纯。
日立SU 8010发射扫描电镜 天美(中国)科学仪器有限公司;TU-1810PC紫外分光光度计 北京普析通用公司;BT-9300H激光粒度分布仪 丹东百特仪器有限公司;DHA-9140型恒温鼓风干燥箱 上海三发科学仪器有限公司;Model PHS-3C PH Meter 上海盛磁仪器有限公司。
1.2 实验方法
1.2.1 甘薯淀粉与果胶的干热处理 称取一定质量的果胶(实验设计浓度为0.02%),缓慢加入84 mL蒸馏水中搅拌至溶解。待混合均匀后加入49 g淀粉,用0.2 mol/L HCl或1 mol/L NaOH调节至pH为11,室温下搅拌1 h。再将混合物置于烘箱中40 ℃干燥(水分含量小于10%),研磨粉碎后过100目筛,即得到淀粉与果胶的共混物。将淀粉与果胶干燥后的混合物置于烘箱中130 ℃下干热处理4 h,即得到甘薯淀粉与果胶共混干热的样品。分别于未加胶干热(未添加果胶,且在130 ℃时处理4 h后得到的对照样品)和加胶未干热(添加果胶浓度为0.02%,未进行干热处理,混合均匀后直接烘至水分为10%以下)进行对比。
1.2.2 淀粉颗粒形貌观察 将干热处理后的淀粉与果胶共混物用双面胶固定在样品台上,然后将载物台置于镀金仪器中,用离子刻蚀镀膜仪中喷金处理(厚约10 nm)。后将载物台置于扫描电子显微镜(SEM)的腔室中,1000倍下观察甘薯淀粉的颗粒形貌。
1.2.3 淀粉与碘吸收光谱分析 取0.25 g(干基)淀粉样品,用1 mL无水乙醇润湿,加入10 mL 0.5 mol/L KOH溶液,在沸水浴中振荡(约15 min)至样品完全分散溶解,冷却后定容至100 mL。取出0.5 mL样液加入10 mL蒸馏水,用0.1 mol的HCl调至pH为3,加入0.5 mL的碘试剂,用蒸馏水定容至100 mL,静置15 min即可。用紫外可见分光光度计于波长400~800 nm下扫描分析。
1.2.4 淀粉颗粒粒度分布测定 以蒸馏水作为分散剂,开启超声波振荡,加入适当质量的淀粉,使遮光率在15%~18%时为宜,使淀粉颗粒分散均匀。测定粒度范围及分布,实验平行测定三次,取平均值。淀粉颗粒折射率为1.53,分散剂折射率为1.33。
1.2.5 渗漏直链淀粉含量的测定 准确称取一定量样品置于三角瓶中,加入蒸馏水配制成总固形物含量为2%的甘薯淀粉-果胶共混体系,沸水浴中糊化20 min,冷却后在13000×g离心20 min,将离心后的上清液转移至100 mL容量瓶中并稀释至刻度。准确吸取1 mL定容后的溶液,加入2 mL 1 mol/L醋酸和2 mL 0.1 mol/L碘液,用蒸馏水定容至100 mL作为待测样品[14]。所有样品室温下避光静置20 min,在波长620 nm处测定吸光度,用直链淀粉标准品得出标准曲线(y=1.2713x+0.0233,R2=0.9986),计算不同试样中渗漏的直链淀粉含量。
1.2.6 干热处理因素设计
1.2.6.1 不同果胶浓度对甘薯淀粉分子结构的影响 以干热处理温度为130 ℃,时间为4 h,pH11为固定实验条件,果胶浓度分别为0.01%、0.02%、0.03%、0.04%、0.05%五个水平,研究不同果胶浓度对甘薯淀粉碘吸收光谱、淀粉颗粒粒度分布以及渗漏直链淀粉含量的影响。
1.2.6.2 不同干热处理温度对甘薯淀粉分子结构的影响 以果胶浓度为0.01%,时间为4 h,pH11为固定实验条件,干热处理温度为110、120、130、140、150 ℃五个水平,研究不同干热处理温度对甘薯淀粉碘吸收光谱、淀粉颗粒粒度分布以及渗漏直链淀粉含量的影响。
1.2.6.3 不同干热处理时间对甘薯淀粉分子结构的影响 以果胶浓度为0.02%,处理温度为130 ℃,pH11为固定实验条件,干热处理时间为1、2、3、4、5 h五个水平,研究不同干热处理时间对淀粉颗粒形貌、甘薯淀粉碘吸收光谱、淀粉颗粒粒度分布以及渗漏直链淀粉含量的影响。
1.2.7 数据处理及分析 本实验数据采用Origin 8.0对数据作图,采用SPSS Statistics18统计分析软件进行处理。
2 结果与分析
2.1 果胶协同干热变性对甘薯淀粉颗粒形貌的影响
如图1所示,甘薯原淀粉颗粒大小不一、表面光滑无裂纹、形状呈圆形、椭圆形、多边形等不规则独立的个体[15]。经干热1 h后,淀粉颗粒与果胶粘结在一起,且少部分淀粉颗粒表面有细微的裂纹或孔洞,有粘结物,这有可能是胶体分子和淀粉颗粒析出的直链淀粉分子环绕淀粉颗粒所形成的[16]。干热2 h后,淀粉与果胶的粘结物形成的团块增多。干热3 h后,淀粉与果胶之间形成更大的团块,且颗粒表面的粘结物减少。这主要是因为淀粉分子中的羟基与果胶分子中的羧基发生了交联反应,且随着干热处理时间的延长,果胶分子与淀粉分子交联的程度也越来越紧密。这与汝远[17]用扫描电镜(SEM)观察玉米淀粉与离子胶共混干热后的淀粉颗粒与离子胶之间出现明显的粘结现象,且随着干热时间的延长,淀粉与胶体之间结合更为紧密的结论是一致的。

图1 干热时间对果胶与甘薯淀粉协同干热处理后淀粉颗粒形貌的影响(×1000倍)Fig.1 Effects of dry-heat time on the shape of starch granules after synergistic dry heat treatment of pectin and sweet potato starch(×1000)
2.2 果胶协同干热变性对甘薯淀粉碘吸收光谱的影响
2.2.1 果胶浓度对甘薯淀粉碘吸收光谱的影响 紫外光谱是电子光谱,它是由电子的跃迁运动而产生的。这种电子跃迁包括振动跃迁和转动跃迁,紫外光谱是宽阔的谱带,不像振动和转动光谱那样细窄。淀粉由直链和支链淀粉组成,两者都是由许多葡萄糖残基组成的。淀粉具有螺旋结构,当与碘形成复合物时,呈现的颜色取决于淀粉内部间的聚合度。聚合度小于6无色,7~13为淡红色,20为紫色,30为蓝紫色,40以上为蓝色。
由图2可知,不同果胶浓度的甘薯淀粉碘吸收光谱与未加果胶干热的基本相似。但最大吸收峰的波长发生了变化。由未加果胶干热的620~626 nm降低到603~608 nm(0.05%)。通过添加不同浓度的果胶干热处理后,淀粉与果胶之间发生了不同程度的交联,也正是因为交联反应使得淀粉中直链的发生降解,影响碘分子进入其内部,碘络合物分子数目也逐渐减少,淀粉分子聚合度减小,表现为淀粉与碘的最大吸收峰向短波长方向移动。
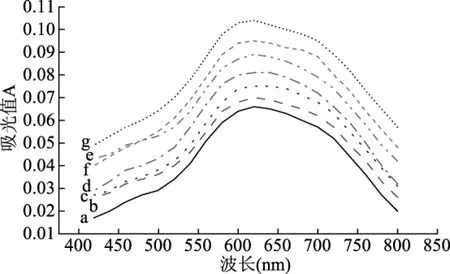
图2 果胶浓度对甘薯淀粉碘吸收光谱的影响Fig.2 Effects of pectin concentration on iodine absorption spectrum of sweet potato starch注:a-未加胶干热;b-加胶未干热;c-0.01%;d-0.02%;e-0.03%;f-0.04%;g-0.05%。
2.2.2 干热处理温度对甘薯淀粉碘吸收光谱的影响 由图3可知,不同干热温度的甘薯淀粉碘吸收光谱与未加果胶干热的基本相似。干热可降解支链淀粉,促进碘分子进入淀粉内部,碘络合物分子数目随着干热温度的升高而逐渐增加,淀粉分子间聚合度增加,淀粉与碘的最大吸收波长也随着温度的增加而呈现出小程度的蓝移,由未添加果胶干热的620~626 nm增加到631~637 nm(150 ℃)。
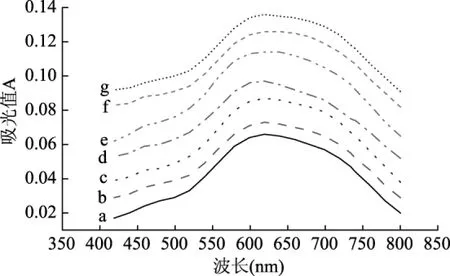
图3 干热处理温度对甘薯淀粉碘吸收光谱的影响Fig.3 Effects of dry heating temperature on iodine absorption spectrum of sweet potato starch注:a-未加胶干热;b-加胶未干热;c-110 ℃;d-120 ℃;e-130 ℃;f-140 ℃;g-150 ℃。
2.2.3 干热处理时间对甘薯淀粉碘吸收光谱的影响 由图4可知,不同干热时间的甘薯淀粉碘吸收光谱与加胶未干热的基本相似。其最大碘吸收波长随着时间的延长而出现较小程度的蓝移,由加果胶未干热的613~618 nm增加到623~628 nm(5 h)。这主要是由于干热时间的延长使得淀粉的长链结构部分发生断裂,支链淀粉被打断,改变了直链淀粉的分子构象,相应的络合碘分子数目逐渐增加,淀粉与碘的最大吸收波长向长波长方向移动。
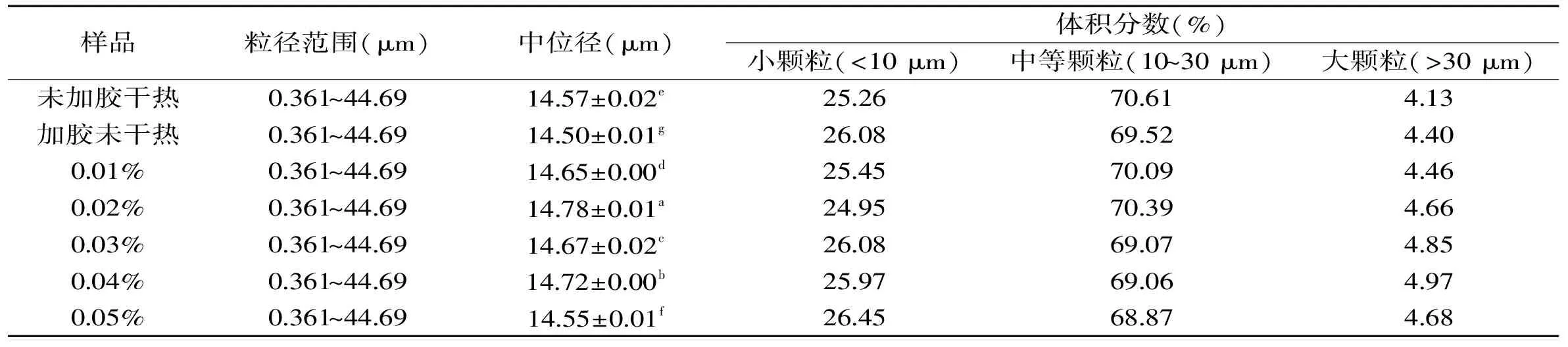
表1 果胶浓度对甘薯淀粉粒度分布特征的影响
注:同列数据,字母相同表示差异不显著(p>0.05),不同表示差异显著(p<0.05),表2、表3同。

表2 干热处理温度对甘薯淀粉粒度分布特征的影响
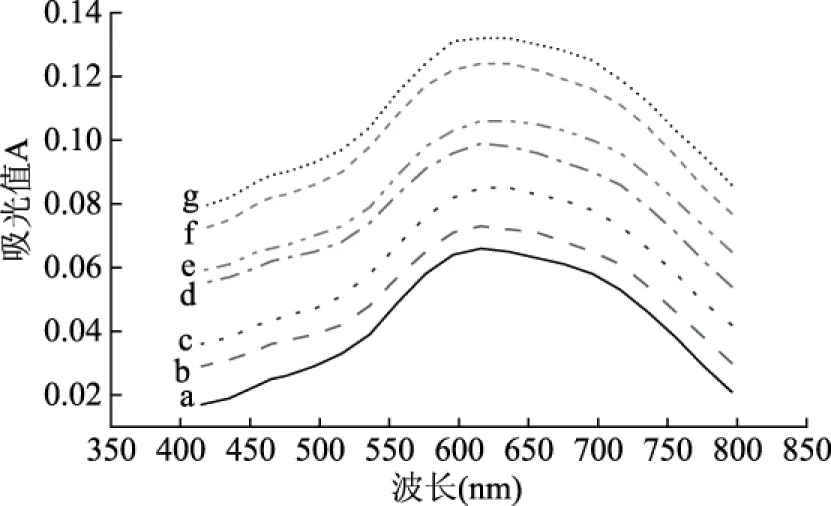
图4 干热处理时间对甘薯淀粉碘吸收光谱的影响Fig.4 Effects of dry heating time on iodine absorption spectrum of sweet potato starch注:a-未加胶干热;b-加胶未干热;c-1 h;d-2 h;e-3 h;f-4 h;g-5 h。
2.3 果胶协同干热变性对甘薯淀粉粒度分布特征的影响
2.3.1 果胶浓度对甘薯淀粉粒度分布特征的影响 由表1可以看出,未加果胶干热处理和加果胶干热处理的甘薯淀粉的中位径D50分别为14.57 μm和14.50 μm,两者之间差异显著。粒径小于10 μm的小颗粒淀粉分别占总颗粒的25.26%和26.08%。随着果胶浓度的增加,淀粉颗粒的中位径呈现先增加后降低的趋势(0.02%为最大),且大颗粒所占比例增大(0~0.04%)。这主要是因为果胶分子与淀粉分子经过干热处理使它们之间发生交联反应,且可能是两个或多个淀粉分子与果胶分子连接,淀粉分子连接在外,受热膨胀,但连接的程度低。在果胶浓度为0.02%时,淀粉颗粒的中位径最大为14.78 μm,比加胶未干热的淀粉中位径大0.28 μm。通过添加不同浓度的果胶,淀粉分子与果胶分子之间发生不同的交联反应,淀粉粒径向大颗粒转移。
2.3.2 干热处理温度对甘薯淀粉粒度分布特征的影响 从表2看出,不同温度共混干热处理后,淀粉与果胶共混物的粒径范围都在0.361~44.69 μm之间,中位径方面,110 ℃与120 ℃、120 ℃与130 ℃的中位径差异不显著,在干热时间为140 ℃时,中位径最大为14.94 μm,且大颗粒所占比例最大(为5.07%)。这主要是由于温度的升高使得淀粉分子与果胶分子之间运动剧烈,淀粉分子受热膨胀速度加快,淀粉分子与果胶分子间形成交酯的速度也随之增加,淀粉分子与果胶分子之间的交联的 程度也更加紧密,表现为淀粉的粒径向大颗粒方向转移[18]。
2.3.3 干热处理时间对甘薯淀粉粒度分布特征的影响 从表3可知,甘薯淀粉与果胶共混物经不同时间干热后,粒径范围并无明显变化,均在0.361~44.69 μm之间。在干热时间为3 h时,中位径最大为15.47 μm,大颗粒所占比例也最大约为6.27%。干热时间为2 h时,小颗粒所占比例最大为26.17%,比未加果胶干热的甘薯淀粉增大了0.91%。通过不同时间的干热处理,淀粉分子与果胶分子之间形成交酯的程度均高于添加果胶未干热的对照样品。
2.4 果胶协同干热变性对甘薯淀粉链段运动性的影响
2.4.1 果胶浓度对甘薯淀粉链段运动性的影响 淀粉的糊化主要有两个方面:一方面是水分进入淀粉粒的微晶束中,与淀粉分子相结合产生膨胀;另一方面,淀粉经进一步加热,水分子进入淀粉粒的内部与之结合,淀粉颗粒进一步膨胀,黏度增加[19]。淀粉链段的运动、伸展与淀粉的黏度密切相关。
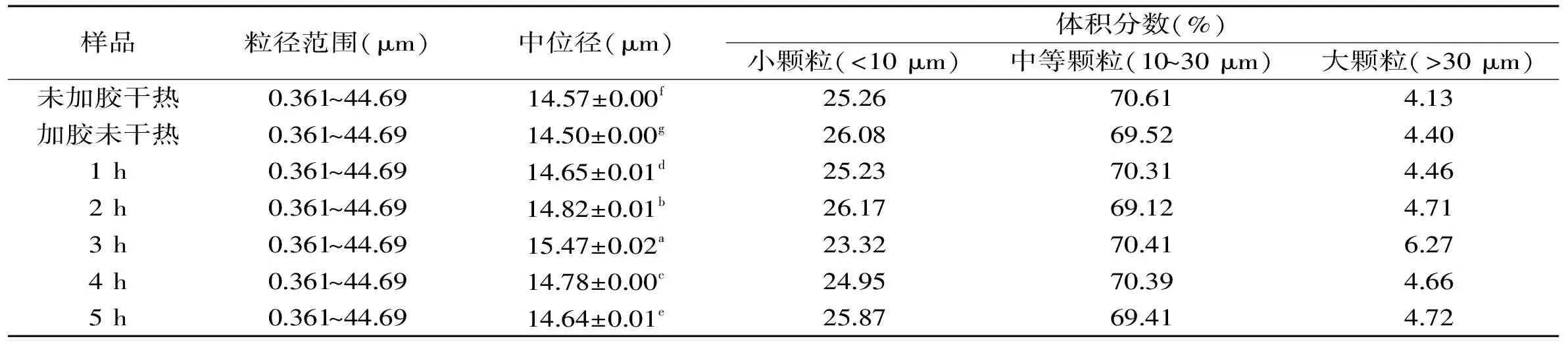
表3 干热处理时间对甘薯淀粉粒度分布特征的影响
由图5可知,甘薯淀粉与不同浓度的果胶共混干热后过干热处理后,随着果胶浓度的增加,体系中渗漏出来的直链淀粉含量先逐渐降低。这是由于果胶吸收体系中的水分使得淀粉颗粒膨胀受阻,且由于果胶对淀粉颗粒的包裹作用使得水分进入淀粉颗粒的运动性减弱,直链淀粉渗漏量减小。在果胶浓度在0.05时,体系中的直链淀粉含量又大量的渗出,这有可能是高温使得淀粉膨胀破裂,破坏了淀粉分子间的缔合状态,淀粉分子之间运动加剧,空间阻碍性增大,高浓度的果胶分子也不能淀粉分子结合,造成直链淀粉的渗出。
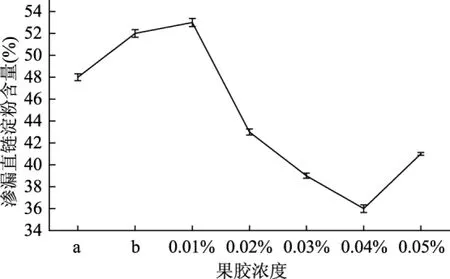
图5 果胶浓度对甘薯淀粉渗漏直链淀粉含量的影响Fig.5 Effect of pectin concentration on the leakage amount of amylase of sweet potato注:a-未加胶干热;b-加胶未干热,图6、图7同。
2.4.2 干热处理温度对甘薯淀粉链段运动性的影响 由图6可知,甘薯淀粉与果胶共混物经不同干热温度处理后,直链淀粉的溶出量逐减小。淀粉在进一步糊化时,随着温度的升高,淀粉颗粒迅速膨胀,破坏淀粉分子间的缔合状态,部分直链淀粉渗漏。通过添加果胶可以延缓淀粉的糊化,阻碍了淀粉颗粒中直链淀粉的渗漏;另一方面,阻止了渗漏出的淀粉链段进一步远程扩散,从而不同程度的减少直链淀粉在整个共混体系中的渗漏量[14]。
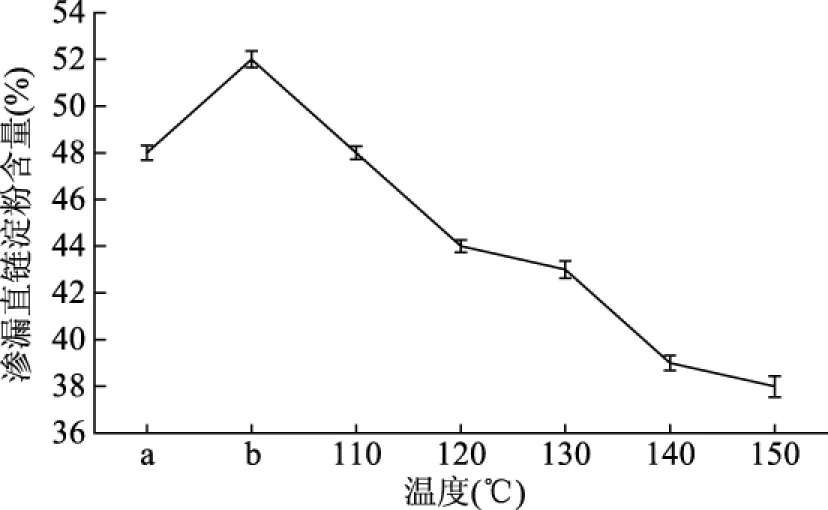
图6 干热处理温度对甘薯淀粉渗漏直链淀粉含量的影响Fig.6 Effect of dry heating temperature on the leakage amount of amylase of sweet potato
2.4.3 干热处理时间对甘薯淀粉链段运动性的影响 由图7可知,甘薯淀粉与果胶共混经不同时间干热处理,随着时间的延长,渗漏量明显要低于未加果胶体系的,这与Funami等人测定的结果相似[20]。随着时间的延长,外界的热迫使氢键断裂,破坏淀粉内的分子缔合状态,导致部分直链淀粉渗出,同时添加果胶可以包裹淀粉分子,减弱淀粉链段的运动率,降低直链淀粉的渗漏。在干热时间为5 h时,由于干热时间的延长,使得淀粉与果胶共混物的黏度急剧下降,淀粉分子运动加剧,导致渗漏直链淀粉含量渗出,因此,干热时间为4 h时能有效的抑制直链淀粉的渗漏。
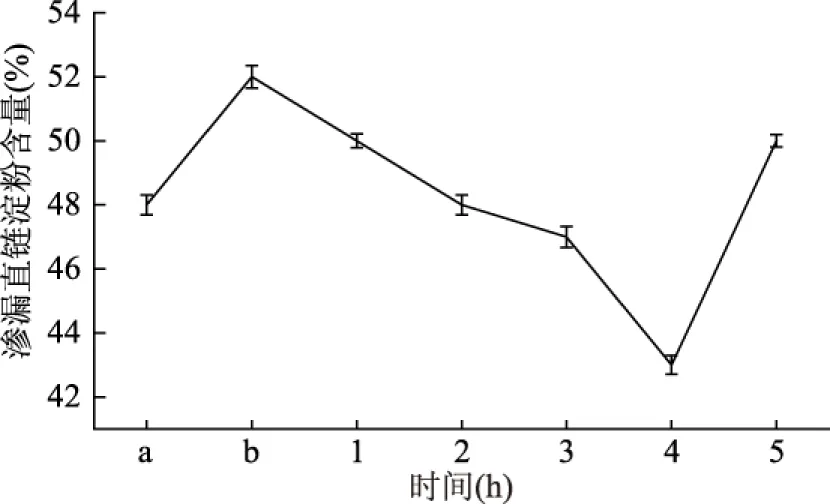
图7 干热处理时间对甘薯淀粉渗漏直链淀粉含量的影响Fig. 7 Effect of dry heating time on the leakage amount of amylase of sweet potato
3 结论
干热处理后淀粉中直链淀粉分子被果胶分子包裹形成粘结的团块,且随着干热时间的延长,团块逐渐增多且变大。甘薯淀粉与果胶共混经不同果胶浓度、干热温度和干热时间干热后,其碘吸收光谱和未加胶干热淀粉基本一致,但其最大吸收波长发生蓝移。甘薯淀粉与果胶共混后的粒径范围并无变化,在果胶浓度为0.02%、干热温度为140 ℃、干热时间为3 h时中位径最大,且大颗粒所占比例增大,粒径范围并没有显著变化。甘薯淀粉与果胶共混物经干热后,直链淀粉的渗漏量随着果胶浓度(0.01%~0.04%)、干热温度和干热时间(1~4 h)的延长而降低。
干热处理使果胶和淀粉共混物的颗粒增大、且能有效抑制淀粉分子链间直链淀粉的溶出,这对增加食品中慢消化淀粉和抗性淀粉的比例,改善甘薯的功能特性,拓宽甘薯的利用价值具有深远的意义。
[1]李光磊,陈梦雪,曾洁,等.韧化处理对甘薯淀粉分子结构的影响[J].食品工业科技,2016,37(17):106-110.
[2]Barbara P,Samule C Zeeman.Formation of starch in plant cells[J].Cellular and Molecular Life Sciences,2016,73:2781-2807.
[3]Srichuwong S,Orikasa T,Matsuki J,et al.Sweet potato having a low temperature gelatinizing starch as a promising feedstock for bioethanol production[J].Biomass & Biotechnology,2012,39:120-127.
[4]朱英波,史风玉,武云鹤,等.甘薯淀粉同步糖化发酵生产燃料乙醇的研究[J]. 江苏农业科学,2012,40(5):246-249.
[5]Alves-Prado H F,Carneiro A J,Pavezzi F C,et al.Production of cyclodextrins by CGTase from bacillus clausii using different starches as substrates[J].Applied Biochemistry and Biotechnongy,2008,146:3-13.
[6]Chiu C W,Schiermeyer E,Thomas D J,et al. Thermally inhibited starches and flours and process for their production[P].U S patent,1998:5725676.
[7]张帆,林鸳缘,郑宝东,等.干热变性淀粉的研究进展[J]. 福建轻纺,2011(5):3.
[8]Lim S T,Han J A,Lim H S,et al.Modifidation of starch by dry heating with ionic gums[J].Cereal Chemistry,2002,79(5):601-606.
[9]Lim S T,BeMiller J N,Lim S T.Effect of dry heating with ionic gums at controlled pH on starch paste viscosity[J].Cereal Chemistry,2003,80(2):198-202.
[10]Chung H J,Min D,Kim J Y,et al. Effect of minor addition of xan than on cross-linking of rice starches by dry heating with phosphate salts[J]Jourmal of Applied Polymer Science,2007,105(4):2280-2286.
[11]Wing R E.Starch citrate:Preparation and ion exchange properties[J].Starch-Starke,1996:48(7/8):275-279.
[12]李坚斌,李辰,杨勇,等.改性果胶/淀粉制备小肠靶向载体材料研究[J].现代化工,2015,35(9):97-100.
[13]孙绪兵,廖丽敏,付孝锦.果胶改性及应用研究[J].食品工业科技,2015,36(20):384-391.
[14]朱玲,张雅媛,洪雁,等.木薯淀粉-黄原胶复配体系中淀粉糊化机理[J].食品科学,2011,32(3):81-85.
[15]李光磊,庞玲玲,李一卓,等.甘薯淀粉辛烯基琥珀酸酯物化性质的研究[J]. 现代食品科技,2014,30(2):37-41.
[16]张帆,张怡,郭泽镔,等. 干热变性莲子淀粉特性的研究[J].热带作物学报,2012,3(2):364-369.
[17]茹远.热处理对玉米淀粉结构和性质的影响[D].泰安:山东农业大学,2015.
[18]Li Yue,Zhang Hui-en,Charles F S,et al.Effect of dry heat treatment with xanthan on waxy rice starch[J].Carbohydrate Polymers,2013,92:1647-1652.
[19]张梦雅.食用胶干热变性马铃薯淀粉的研究[D].西安:陕西科技大学,2013.
[20]Funami T,Kataoka Y,Omoto T,et al.Effect of non-ionic polysaccharide on gelatinization and dretrogradation behavior of wheat starch[J].Food Hydrocolloids,2005,19:1-13.
Synergistic effects of pectin and dry-heat on molecular structure of sweet potato starch
CHEN Meng-xue1,FENG Liang2,LI Fei1,ZHANG Jing-ya1,LI Guang-lei1,*
(1.Henan Institute of Science and Technology,Xinxiang 453003,China; 2.Kaifeng Technician Institute,Kaifeng 475000,China)
The effects of pectin concentration,dry-heat temperature and dry-heat time on the molecular structure of sweet potato starch were studied by electron microscopy,ultraviolet-visible spectroscopy and particle size analyzer. The results showed that the granules blended with starch and pectin formed a small clump with the extension of time,and became bigger after heat treatment at different time. The degree of polymerization between starch and pectin was decreased with the increase of pectin concentration(from 620~626 nm without adding to 603~608 nm with pectin concentration of 0.05%),and the degree of polymerization between starch chains weakened with the increase of temperature and time,the maximum absorption wavelength of UV spectrum showed a blue shift. The particle size(D50)and the volume fraction of big starch particles of starch granules increased with the increase of pectin concentration,temperature and time. The particle size(D50)of starch granules was the largest at dry-heat time of 3 h(15.47 μm),and the volume fraction of big starch particles could reach 6.27%,which was 1.81% higher than that at 1 h. The declined leakage of amylose was better inhibited by the increase of pectin concentration(0.01%~0.04%),dry-heat temperature and time(1~4 h). Dry-heat treatment is a new method of physical modification of starch,which is of great significance to improve sweet potato starch utilization rate and develop new type modified starch.
sweet potato starch;pectin;dry heating treatment;starch molecular structure
2016-11-21
陈梦雪(1992-),女,硕士,研究方向:粮食资源深度利用,E-mail:cmx1992gb@163.com。
*通讯作者:李光磊(1970-),男,博士,副教授,研究方向:淀粉科学与技术,E-mail:lgl70_hist@163.com。
河南科技学院自然科学重大培育项目(2013ZD04);河南省科技攻关计划(172102110164)。
TS201.1
A
1002-0306(2017)09-0060-06
10.13386/j.issn1002-0306.2017.09.003
