羧甲基果聚糖的胶原肽修饰及其活性研究
2017-06-05孙媛霞
曾 艳,张 颖,门 燕,孙媛霞
(中国科学院天津工业生物技术研究所,天津 300308)
羧甲基果聚糖的胶原肽修饰及其活性研究
曾 艳,张 颖,门 燕,孙媛霞*
(中国科学院天津工业生物技术研究所,天津 300308)
为考察羧甲基果聚糖及其衍生物在功能性食品、生物医学及化妆品方面的应用可行性,通过羧基与氨基的交联反应制备了胶原肽修饰的羧甲基果聚糖,并测试了产物的抗氧化、吸湿保湿活性以及其对人皮角质HaCaT细胞生长增殖的影响。发现羧甲基果聚糖经胶原肽修饰后抗氧化性明显提高,25 mg/mL时的ABTS+·清除率为62.31%,比修饰前提高了6.11倍。尽管胶原肽的引入会对吸湿保湿性造成影响,修饰后的羧甲基果聚糖仍然保留良好的吸湿保湿性能。在相对湿度43%和81%中放置72 h的吸湿率分别为11.96%和21.54%,在干燥硅胶环境中放置72 h的保湿率为60.48%。此外,修饰产物在0~1 mg/mL的浓度范围内无细胞毒性,可以促进HaCaT细胞增殖。HaCaT细胞在0.5 mg/mL修饰产物刺激下的存活率为124.2%。胶原肽修饰能提高羧甲基果聚糖的生物活性,拓展其在功能性食品、医药制品和化妆品上的应用潜力。
羧甲基果聚糖,胶原肽,化学修饰,抗氧化性,吸湿保湿活性,细胞增殖
由于多糖的活性直接或间接地受其分子结构影响,而化学官能团在糖链上的引入,对多糖的生物活性与理化功能提升具有积极作用,因此,化学修饰是多糖构效关系研究和多糖类药物研制的重要手段[1]。其中,羧甲基化修饰不仅能有效改善多糖的水溶性、乳化性、抗氧化性和抗肿瘤能力等理化性质,还具有成本低、操作简单及生成物毒性小等优点,在多糖的化学修饰中得到广泛应用,如羧甲基纤维素已作为增稠剂用于食品和药剂配方中[2]。
作为胶原蛋白的酶解产物,胶原肽在保留胶原蛋白有关特性如参与细胞迁移分化增殖、生物相容性良好等的同时,还兼具分子量小、更容易被人体吸收的优点[3]。国外期刊报道表明,通过共价键在多糖骨架上引入胶原肽形成的交联产物,其水溶性、抗氧化性、吸湿保湿性良好,能促进皮肤成纤维细胞增殖,在保健食品、化妆品、医药卫生等领域显现出良好的应用潜力[4-6]。然而,关于胶原肽修饰多糖的国内研究报道甚少,相关工作有待进一步深入。
本实验以解淀粉芽孢杆菌PB6高产胞外果聚糖[7]为原料,通过羧基化修饰在果聚糖骨架上引入羧基后,进一步借助羧基与氨基的交联反应,制备胶原肽修饰的羧甲基果聚糖;并对胶原肽修饰的羧甲基果聚糖的抗氧化、保湿吸湿活性以及其对皮肤角质细胞增殖影响进行测试,探讨其在功能性食品、医药制品和化妆品方面的应用可行性。
1 材料与方法
1.1 材料与仪器
1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基硫代琥珀酰亚胺钠盐(NHS)、2-吗啉乙磺酸(MES) 分析纯,上海阿拉丁生化科技股份有限公司;氢氧化钠、氯乙酸、碳酸钾、硫酸铵、荧光素钠、硫酸亚铁二甲基亚砜(DMSO) 分析纯,国药试剂化学试剂有限公司;2,2-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2-Azinobis(3-ehtylbenzothiazolin-6-sulfnicAcid)Diammonium Salt,ABTS)、2,2′-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-azobis(2-methylpropionamidine)dihydrochloride,AAPH)、2,4,6-三(2-吡啶基)三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ) 分析纯,美国Sigma-Aldirch公司;胶原肽 以鳕鱼皮为原料实验室自制[8],分子量分布400~1500 Da;果聚糖 由实验室借助解淀粉芽孢杆菌发酵生产自制[7];人皮肤永生化角质细胞(HaCaT细胞;KCB200442YJ) 北京北纳创联生物技术研究院;双抗(Penicillin/Streptomycin)、0.25% 胰蛋白酶 美国Corning 公司;DMEM 高糖基础培养基、胎牛血清(FBS) 美国Gibco公司。
UV-1800紫外分光光度计 日本岛津公司;Spectra Max M5多功能酶标仪 美国Molecular Devices公司;Sorvall Evolution RC高速落地离心机 美国Thermo Scientific公司;IKA RV10旋转蒸发仪 德国IKA集团;SHZ-D(Ⅲ)循环水式真空泵 河南省予华仪器有限公司;FD-1-50真空冷冻干燥机 北京博医康实验仪器有限公司;VERTEX70型傅里叶变换红外光谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 羧甲基果聚糖的制备 参考Liu等的方法[9],取2 g果聚糖溶于80 mL异丙醇中,逐步滴入30 mL的20% NaOH溶液,常温搅拌1 h后加入4 g氯乙酸,60 ℃下搅拌4 h,调pH至中性,将混合物转移至8000~10000 Da的透析袋中,去离子水透析4 d 后,收集透析液,冷冻干燥后得到白色固体,即为羧甲基果聚糖。
1.2.2 羧甲基果聚糖的胶原肽修饰 取1.2 g羧甲基果聚糖溶于0.2 mol/L的MES缓冲液(100 mL,pH6.5)中,加入0.76 g的EDC试剂和0.24 g的NHS试剂,常温搅拌20 h后,迅速加入0.9 g胶原肽,继续搅拌10 min,调节体系pH到6,透析72 h,浓缩冷冻干燥。得到的白色固体即为胶原肽修饰的羧甲基果聚糖。
1.2.3 取代度测试 根据Fan等方法计算取代度,其中取代度定义为羧甲基果聚糖中每个重复结构单元中羧甲基被胶原肽取代的数目[10]。在1~30 mg/L浓度下,胶原肽在200 nm的紫外吸收值与其浓度成正比,其浓度-紫外吸收标准曲线见式(1)。以羧甲基果聚糖为空白对照,测定30 mg/L胶原肽修饰羧甲基果聚糖产物在200 nm的紫外吸收,通过式(1)计算折算其胶原肽的当量浓度,再根据式(2)计算取代度DS。
A=38.03C-0.0007
式(1)
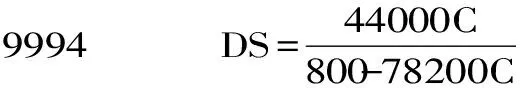
式(2)
1.2.4 红外光谱检测 称取干燥后的样品2 mg与150 mg 的KBr混合研磨后压片,上机扫描分析,扫描范围400~4000 cm-1。
1.2.5 抗氧化性测试 通过ABTS+·清除能力、氧自由基清除能力和铁还原能力实验测试抗氧化性。
1.2.5.1 ABTS+·清除能力测定 采用张换等[11]的方法测定样品对ABTS+·的清除能力。将ABTS+·(7 mmol/L,5 mL)和过硫酸钾溶液(140 mmol/L,88 μL)混合,室温避光反应12~16 h,制备ABTS+·储备液。使用磷酸盐缓冲液(10 mmol/L,pH7.4)将储备液稀释至其在734 nm波长处吸光度(A)为0.70±0.02。取100 μL不同质量浓度(0~25 mg/mL)的待测样品水溶液,加入3 mL 的ABTS+·溶液,避光反应6 min,记录其在734 nm波长处的吸光度为A样品。以100 μL纯水代替样品,相同操作,记录其在734 nm波长处的吸光度为A空白。按式(3)计算样品清除ABTS+·的清除率。

式(3)
1.2.5.2 氧自由基清除能力测定(oxygen radical absorbance capacity,ORAC) 采用Yan Zeng等[12]的方法,使用Spectra Max M5多功能酶标仪进行测试。于96孔板微孔中加入荧光素钠盐(70 nmol/L,120 μL)和20 μL待测样品,在37 ℃条件下孵育10 min,迅速加入AAPH(12.8 mmol/L,60 μL)后,每隔1 min测量样品在485 nm激发条件下,528 nm处荧光发射的强度变化。以水溶性的VE衍生物Trolox(终浓度:1~8 μmol/L)替代不同质量浓度(0.5~10 mg/mL)的样品水溶液,同板同时操作,用于绘制标准曲线。测定时间为90 min,各样品不同时间的荧光强度分别记为F0、F1、F2…F90。其中,F0为0 min时的荧光值,Fn为第n min的荧光值。按式(4)计算样品荧光变化零阶矩曲线下面积(areaunder curve,AUC)。
式(4)
根据标准曲线方程式(5)计算样品对应的Trolox浓度,即ORAC值,以mmol Trolox/g表示。
AUC=5.298C+30.291R2=0.9984
式(5)
式(5)中,C为Trolox浓度(μmol/L)。
1.2.5.3 铁离子还原能力测定(ferric reducing antioxidant power,FRAP) 采用张颖等[1]的方法测试铁离子还原能力。配制新鲜FRAP反应液:300 mmol/L乙酸钠缓冲液(pH3.6),10 mmol/L的TPTZ溶液(40 mmol/L HCl为溶剂)以及20 mmol/L的FeCl3溶液,三者以体积比10∶1∶1混合后,于37 ℃水浴保温。取100 μL样品溶液与3 mL铁还原(FRAP)试剂混匀后于37 ℃水浴中反应5 min,测定体系在593 nm的吸光值A。同时取浓度0~1.0 mmol/L的FeSO4溶液替代样品反应绘制标准曲线。通过标准曲线方程式(6)计算样品对应的FeSO4浓度,即FRAP值,以μmol Fe2+/g表示。
A=0.4148C+0.0489R2=0.9995
式(6)
式(6)中,C为Fe2+浓度(mmol/L)。
1.2.6 吸湿保湿性测试 参考Ping Shao等[13]的方法,在室温20 ℃下进行吸湿保湿性测定。
1.2.6.1 吸湿性测试 准确称取0.5 g在100 ℃下干燥4 h的样品,分别置于以碳酸钾饱和溶液维持相对湿度43%和以硫酸铵饱和溶液维持相对湿度81%的干燥器中,间隔一定时间称量放置前的样品质量(W0)和放置后的样品质量(Wn),根据式(7)计算吸湿率:
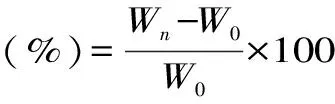
式(7)
1.2.6.2 保湿性测试 准确称取0.5g在100 ℃下干燥4h的样品,加入样品10%质量分数的水分,置于装有干燥变色硅胶的干燥器中,间隔一定时间称量样品放置前的水分质量(H0)和放置后的水分质量(Hn),根据式(8)计算保湿率:
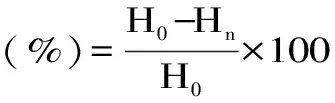
式(8)
1.2.7 皮肤成纤维细胞生长增殖测试 参考陈俊等[14]的方法,进行皮肤成纤维细胞生长和增殖测试实验。
1.2.7.1 细胞培养 人皮角质HaCaT细胞置于DMEM培养液(含10%FBS与1%双抗)中,于37 ℃、5%CO2饱和湿度孵育箱培养,每隔2~3d换一次培养液,待细胞融合率达90%时,用0.25%胰蛋白酶消化,并进行传代培养,取对数期生长状态良好的细胞进行细胞活力测试。
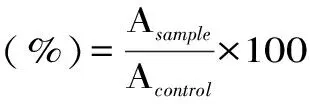
1.2.7.2 细胞活力测试HaCaT细胞以6×103个/孔密度接种于96孔板,于37 ℃、5%CO2饱和湿度孵育箱培养24h后,使用含0、0.05、0.1、0.5、1.0mg/mL样品的DMEM培养液(含10%FBS与1%双抗)等体积地取代原培养液(200μL),继续培养48h。弃去培养液,每孔加入10μL的MTT溶液(终浓度为0.5mg/mL),继续孵育4h后,4500r/min离心10min,弃去上清,加入150μLDMSO,溶解活细胞与MTT生成的甲臜,震荡10min,利用酶标仪测试各孔在490nm的吸光值A。按式(9)计算细胞活力:
式(9)
1.2.8 数据处理方法 测试结果以平均值±标准偏差表示,并采用SPSS 19.0统计学软件进行单因素方差两两比较分析,p<0.05时有统计学差异。
2 结果与分析
2.1 结构表征
胶原肽(COP)、羧甲基果聚糖(CP)和胶原肽修饰的羧甲基果聚糖(COP-CP)的红外光谱见图1。羧甲基果聚糖CP除具有多糖类的红外特征吸收峰(如3421 cm-1的O-H伸缩振动吸收峰与2937 cm-1的C-H伸缩振动吸收峰)外,还在1601 cm-1出现羧基基团的C-O 伸缩振动吸收峰,在1412 cm-1处出现与羧基相连的-CH2-的剪式振动吸收峰,说明-CH2COO-基团被成功引入到果聚糖上[15]。而胶原肽修饰羧甲基果聚糖的产物,在保有羧甲基果聚糖的红外特征吸收峰外,还出现了可在胶原肽红外光谱中观察到的1654 cm-1与1546 cm-1处酰胺基和伯胺基伸展振动峰,这一结果与Fan等报道一致[10],说明羧甲基果聚糖被胶原肽成功修饰。
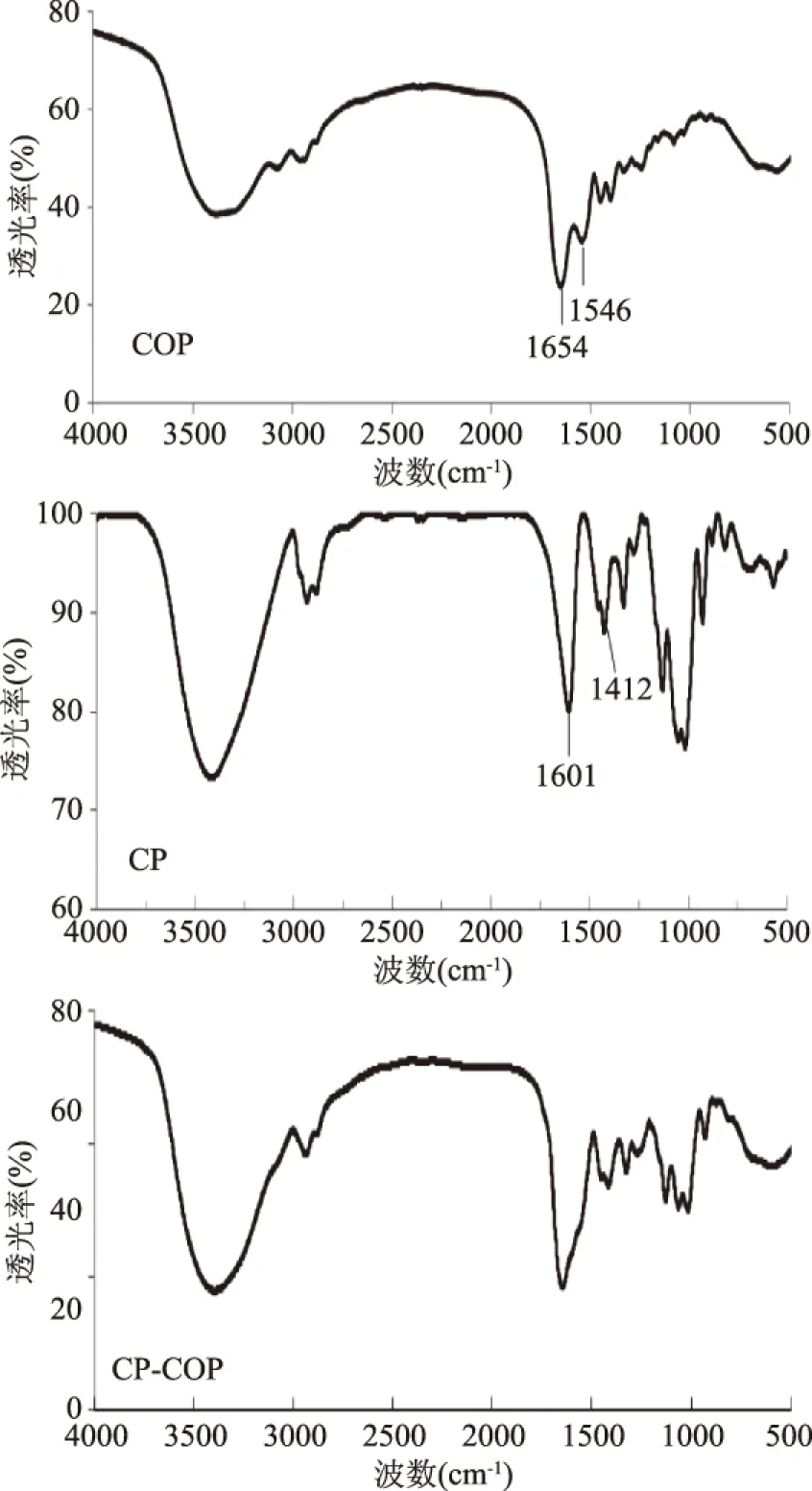
图1 胶原肽修饰羧甲基果聚糖的傅里叶红外光谱表征Fig.1 FT-IR analysis of carboxymethylatedlevan modified with collagen peptides
电位滴定实验[16]测定羧甲基果聚糖中的羧甲基取代度为0.289。通过测试羧甲基果聚糖在胶原肽修饰前后的200 nm紫外吸收变化,计算出胶原肽在羧甲基果聚糖修饰中的取代度为0.0374,这说明有12.94%的羧甲基官能团被胶原肽完全取代。考虑到不同多糖在同一反应条件下的化学修饰程度不同,虽然实验中的羧甲基果聚糖制备及后续的胶原肽修饰均参考相关文献的最优条件进行,推测反应参数的后期优化仍然可以调整修饰产物中胶原肽取代羧甲基的比例,从而对修饰后的羧甲基果聚糖的功能活性造成影响。
2.2 抗氧化性
作为多糖的重要生物学活性之一,多糖的抗氧化性及其作用机理在功能食品与药品开发上倍受关注,相关研究日趋广泛和深入。有研究表明羧甲基化修饰不能确保多糖的抗氧化性提高,甚至可能造成相反效果[17]。与此报道结果类似,本实验中的解淀粉芽孢杆菌果聚糖经羧甲基化修饰后,抗氧化能力基本没有变化(果聚糖数据未给出)。而胶原肽的引入会明显提高羧甲基果聚糖的抗氧化能力。
如图2所示,随样品浓度的增加,胶原肽修饰的羧甲基果聚糖对ABTS+·的清除能力也在不断增强,两者呈剂量关系。在25 mg/mL下,胶原肽修饰的羧甲基果聚糖对ABTS+·的清除率为62.31%,比修饰前提高了6.11倍。除ABTS+·的清除能力有显著提高(p<0.05)外,胶原肽修饰后的羧甲基果聚糖氧自由基清除能力ORAC值与铁离子还原能力FRAP值也显著提高,分别增长了3.02倍和40%(p<0.05)。不同来源胶原肽的抗氧化活性有所不同。如贾建萍等报道鳕鱼皮胶原肽具有较强的清除ABTS+·的能力,而驴皮胶原肽具有较强的还原力[18]。由于本实验中的胶原肽来源于鳕鱼皮,因此其提高羧甲基果聚糖的铁还原能力效果有限。后期可以针对羧甲基果聚糖修饰产物的抗氧化性具体要求,对不同来源的胶原肽进行筛选,从中选择合适的原料修饰羧甲基果聚糖。
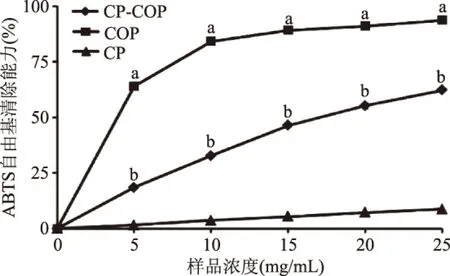
图2 胶原肽修饰羧甲基果聚糖产物对ABTS+·的清除率Fig.2 ABTS+·radical scavenging ability of carboxymethylatedlevan modified with collagen peptides 注:使用不同小写字母标记同一浓度下不同样品测试值的显著差异(p<0.05),图4同。

表1 胶原肽修饰羧甲基果聚糖的氧自由基清除能力ORAC值与铁离子还原能力FRAP值
注:使用不同字母标记测试值的显著差异(p<0.05)。
2.3 吸湿保湿性
由于吸湿保湿剂具有防止水分损失的作用,经常用于果饯和焙烤食品中。除此之外,吸湿保湿剂还有助于皮肤角质层在干燥的空气中保持正常水分(质量分数为:10%~20%),防止皮肤因水分不足而产生皱裂、粗糙等。本实验以甘油(glycerol)为对照,测试了胶原肽(COP)、羧甲基果聚糖(CP)和胶原肽修饰的羧甲基果聚糖(CP-COP)的吸湿和保湿能力。
如图3a所示,在饱和K2CO3(相对湿度43%)低湿环境下,COP、CP-COP、CP和glycerol在实验24 h的吸湿率分别为9.37%、11.03%、14.24%和15.71%,各样品吸湿率的差异显著(p<0.05)。之后,除对照glycerol的吸湿能力随时间延长继续增强外,其余样品的吸湿率几乎保持不变。样品的吸湿性大小顺序为:glycerol>CP>CP-COP>COP,其中CP-CPO在放置72 h的吸湿率为11.96%。但值得注意的是,在测试前期12 h内CP的吸湿速率和效果均要优于glycerol,而CP-COP的吸湿速效与glycerol持衡。样品在饱和(NH4)2SO4(相对湿度81%)高湿环境中的吸湿率变化如图3b所示,随时间延长,COP、CP和CP-COP的吸湿率增大,在36 h基本达到平台期。而对照glycerol的吸湿率在测试时间内一直保持稳定增加。样品在36 h的吸湿性大小顺序依旧为:glycerol(36.16%)>CP(24.08%)>CP-COP(21.35%)>COP(21.22%)。然而CP-COP与CP、COP在吸湿率上的差异并不显著(p>0.05),其中CP-COP在放置72 h的吸湿率为21.54%。说明与低湿环境相比,CP、CP-COP和COP三者在高湿环境中的吸湿能力差异变小。此外,COP、CP和CP-COP的在低湿与高湿环境下的吸湿能力均高于报道的拟目乌贼生殖腺碱提多糖以及常规保湿剂聚乙二醇6000、壳聚糖[19]。
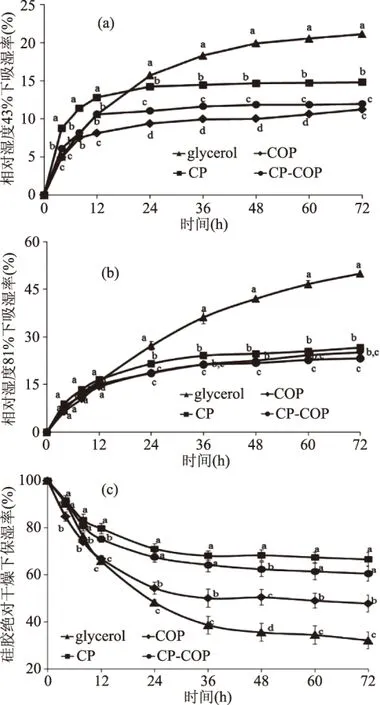
图3 胶原肽修饰羧甲基果聚糖产物在不同湿度环境下的吸湿保湿性能Fig.3 The moisture absorption and moisture retention abilities of carboxymethylatedlevan modified with collagen peptides under different humidity environment注:(a)RH 43%湿度环境,(b)RH 81%湿度环境,(c)干燥环境;使用不同小写字母标记同一时间下不同样品测试值的显著差异(p<0.05)。
在变色硅胶维持的无水干燥条件下,各样品的保湿率均有减小(图3c)。其中,COP、CP和CP-COP的保湿率下降趋势在36 h后趋于饱和,而对照glycerol的保湿率仍随时间延长明显降低。在72 h时glycerol、COP、CP-COP和CP的保湿率分别为32.09%、47.76%、60.48%和66.55%,其中,CP-COP与CP的保湿率无显著差异(p>0.05)。这说明胶原肽(COP)、羧甲基果聚糖(CP)和胶原肽修饰的羧甲基果聚糖(CP-COP)均具有较强的保湿能力,其保湿效果不仅优于对照甘油,也高于报道的罗耳阿太菌胞外多糖[20]和红枣水解多糖[21]。
羧甲基果聚糖经胶原肽修饰后,虽然抗氧化能力明显提高,但吸湿、保湿性能有所下降。这是因为被胶原肽修饰后,羧甲基果聚糖中能与水形成氢键、稳定结合的极性羧基官能团的数目在减少。实验中胶原肽对羧甲基官能团的取代度为12.94%,其相应修饰产物在吸湿、保湿性能上的变化明显小于在抗氧化性上的变化。说明胶原肽修饰对羧甲基果聚糖的影响主要表现在抗氧化性上,而通过控制胶原肽修饰的反应条件,可以调控羧甲基果聚糖衍生产物在抗氧化性与吸湿、保湿性能之间的协衡关系。
2.4 对皮肤成纤维细胞生长和增殖影响
角质细胞作为真皮内主要的修复细胞,对皮肤适度的自我代谢有重要作用,其增殖生长对于维持皮肤的正常结构和生理功能具有重要意义。如白晓智等发现,白芷活性提取物浓度为0.05~0.5 mg/mL时,均能促进人角质形成HaCaT细胞增殖,抑制其凋亡,有利于皮肤创面愈合[22]。本实验使用MTT法考察胶原肽(COP)、羧甲基果聚糖(CP)和胶原肽修饰的羧甲基果聚糖(CP-COP)对人皮肤角质细胞(HaCaT细胞)生长影响,结果如图4所示。在0~1 mg/mL浓度范围内,COP、CP和CP-COP不仅无明显毒性,还可以促进HaCaT细胞增殖,具有较好的生物相容性。其中,COP与CP-COP在0~0.5 mg/mL的促进细胞增殖能力与其浓度呈剂量关系。在0.5 mg/mL下,COP、CP-COP两者与CP的促增殖效果存在显著差异(p<0.05),三者作用下的HaCaT细胞存活率分别为128.7%、124.2%与111.9%。说明胶原肽修饰能增强羧甲基果聚糖促进人皮肤角质细胞增殖的效果,更有利于其在皮肤修复方面的生物活性提升。此外,本实验中胶原肽修饰羧甲基果聚糖对HaCaT细胞增殖的促进效果与张鑫等报道类似。其发现林蛙皮多肽质量浓度为50~3000 mg/L时,对HaCaT细胞均有显著性促进增殖的作用。在50~800 mg/L范围内,随着多肽质量浓度的升高,活性多肽对HaCaT细胞的促进增殖作用呈现剂量依赖效应[23]。
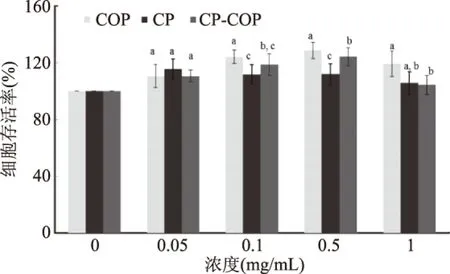
图4 胶原肽修饰羧甲基果聚糖产物对HaCat细胞增殖的影响Fig.4 Effect of carboxymethylatedlevan modified with collagen peptides on theproliferation of HaCat cells
3 结论
胶原肽对羧甲基果聚糖的修饰,能大幅度提高羧甲基果聚糖的抗氧化性。不仅如此,修饰产物还保留了良好的保湿吸湿活性,与皮肤亲合性好,对细胞无毒性,能有效促进人皮角质细胞增殖。基于上述特性,胶原肽修饰能提高羧甲基果聚糖应用于功能性食品、医药制品和化妆品上的潜力。
[1]张颖,曾艳,张丽姣,等. 解淀粉芽孢杆菌果聚糖的化学修饰与抗氧化、抗肿瘤活性研究[J]. 食品工业科技,2016,37(13):96-100.
[2]陈慧,陈义勇. 白背毛木耳多糖APP3a羧甲基化修饰工艺研究[J]. 食品工业科技,2016,37(1):258-262.
[3]M C Gómez-Guillén,B Giménez,M E López-Caballero,et al. Functional and bioactive properties of collagen and gelatin from alternative sources:A review[J].Food Hydrocolloids,2011,25(8):1813-1827.
[4]Lewis A. Reis,Loraine L.Y. Chiu,Yan Liang,et al. A peptide-modified chitosan-collagen hydrogel for cardiac cell culture and delivery[J]. Acta Biomaterialia,2012,8(3):1022-1036.
[5]Lihong Fan,Mi Cao,Song Gao,et al. Preparation and characterization of sodium alginate modified with collagenpeptides[J]. Carbohydrate Polymers,2013,93(2):380-385.
[6]Lihong Fan,Mi Cao,Song Gao,et al. Modification of carboxymethyl cellulose grafted with collagenpeptide and its antioxidant activity[J].Carbohydrate Polymers,2014,112(4):32-38.
[7]张丽姣,曾艳,张颖,等.解淀粉芽孢杆菌胞外多糖发酵条件的优化[J]. 食品工业科技,2015,36(9):214-219.
[8]李星硕,朱玥明,管于平,等. 产胶原酶菌株的筛选鉴定、发酵优化及胶原酶纯化[J]. 微生物学报,2016,56(6):1034-1043.
[9]Xiao-xiao Liu,Zhen-jiang Wan,Lin Shi,et al. Preparation and antiherpeticactivities of chemically modified polysaccharides fromPolygonatumcyrtonema Hua[J].Carbohydrate Polymers,2011,83(2):737-742.
[10]Lihong Fan,Jun Tong,Chang Tang,et al. Preparation and characterization of carboxymethylated carrageenanmodified with collagen peptides[J]. International Journal of Biological Macromolecules,2016,82:790-797.
[11]张换,曾艳,管于平,等. 响应面法优化海带多糖的酶法提取工艺及其抗氧化研究[J]. 食品科技,2013,38(5):197-202.
[12]Yan Zeng,Xiaoxi Zhang,Yuping Guan,et al. Characteristics and Antioxidant activity of Maillard reaction products from psicose-lysine and fructose-lysine model systems[J]. Journal of Food Science,76(3):398-403.
[13]Ping Shao,Xiaoxiao Chen,Peilong Sun. Improvement of antioxidant and moisture-preserving activities of Sargassumhorneri polysaccharide enzymatic hydrolyzates[J].International Journal of Biological Macromolecules,2015,74:420-427.
[14]陈俊,叶燕军,王宝周,等. 鱼皮胶原肽对人皮肤角质细胞生长的影响[J]. 现代食品科技,2015,31(3):55-59.
[15]V Pushpamalar,S J Langford,M Ahmad,et al. Optimization of reaction conditions for preparing carboxymethyl cellulose from sago waste[J]. Carbohydrate Polymers,2006,64(2):312-318.
[16]A Comparison of some methods for the determination of the degree of substitution of carboxymethylstarch[J]. Starch - Starke,2005,57(2):79-83.
[17]曹刚,李大为,任锦,等. 羧甲基绞股蓝多糖的制备及其抗氧化活性研究[J]. 化学与生物工程,2010,27(10):33-36.
[18]贾建萍,鲁健章,周彦钢,等. 不同来源胶原肽的抗氧化活性及吸湿保湿性能[J]. 食品科学,2010,31(21):169-172.
[19]戴宏杰,孙玉林,杨梅语,等.拟目乌贼生殖腺碱提多糖的抗氧化及吸湿保湿特性[J]. 食品科学,2016,37(2):31-38.
[20]魏明,李鸿梅,马艳秋,等. 响应面优化罗耳阿太菌胞外多糖提取工艺及其保湿、黏度特性分析[J]. 食品科学,2015,36(8):67-73.
[21]纵伟,付玉洁,张康逸,等.红枣多糖水解工艺优化及其产物吸湿性能、保湿性能研究[J]. 轻工学报,2016,31(1):23-28.
[22]白晓智,胡大海,王耀军,等. 白芷活性提取物对人角质形成细胞生物学特性的影响[J]. 中国修复重建外科杂志,2012,26(3):322-325.
[23]张鑫,李思明,邓晨,等. 林蛙皮多肽对HaCaT细胞增殖及凋亡的影响[J]. 中国兽医学报,2014,34(6):946-954.
Preparation and characterization of carboxymethylatedlevan modified with collagen peptides
ZENG Yan,ZHANG Ying,MEN Yan,SUN Yuan-xia*
(Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
To investigate the possible application of carboxymethylatedlevan and its derivative on functional food,cosmetics and medicine,collagen peptides were used to modify carboxymethylated levan through the cross-linking reaction between carboxyl group and amino group. Moreover,the antioxidant activity and the moisture absorption and retention capacities of the modified product,as well as its effect on the viability of human skin keratinocyte cells(HaCaT cells)were evaluated. After modified withcollagen peptides,the antioxidant activity of carboxymethylatedlevan was obviously improved. The scavenging rate of the product on ABTS+· was 6.11 times higher than that before modification,with the scavenging rate of 62.31% at 25 mg/mL. Though collagen peptides had some negative effect on the moisture absorption and retention capacities of the product,its modified carboxymethylatedlevan still had good moisture absorption and retention capacities. The moisture-absorbing rate of the product under the relative humidity of 43% and 81% was 11.96% and 21.54% at 72 h,respectively. The moisture retention capacity after desiccation in the silica gel chamber for 72 h was 60.48%. Furthermore,carboxymethylatedlevan modified with collagen peptides showed no cytotoxicity in the concentration of 0~1 mg/mL and could promote the proliferation of HaCaT cells. Under the stimulation of the modified product at 0.5 mg/mL,the cell viability of HaCaT cells reached 124.2%. The results showed that the modification with collagen peptides could improve the bioactivity of carboxymethylatedlevan,and extend its potential application on functional food,medicine and cosmetics.
carboxymethylatedlevan;collagen peptides;chemical modification;antioxidant activity;moisture absorption and retention capacities;cell viability
2016-12-08
曾艳(1982-),女,博士,副研究员,研究方向:天然功能活性物质开发,E-mail:zeng_y@tib.cas.cn。
*通讯作者:孙媛霞(1963-),女,博士,研究员,研究方向:功能糖与天然活性物质,E-mail:sun_yx@tib.cas.cn。
863计划(2013AA102105;2014AA022108)。
TS201.1
A
1002-0306(2017)09-0049-06
10.13386/j.issn1002-0306.2017.09.001
