绵羊肺炎支原体多表位融合基因 MO-meAg1的构建、表达及重组蛋白免疫原性分析
2017-06-05田路路孟庆玲刘田莉卢海亭张星星贡莎莎才学鹏陈创夫
田路路,孟庆玲,乔 军,陈 诚,刘田莉,卢海亭,张星星,贡莎莎,才学鹏 ,陈创夫
(1.石河子大学 动物科技学院,新疆石河子 832003; 2.中国农业科学院 兰州兽医研究所,兰州 730046)
绵羊肺炎支原体多表位融合基因 MO-meAg1的构建、表达及重组蛋白免疫原性分析
田路路1,孟庆玲1,乔 军1,陈 诚1,刘田莉1,卢海亭1,张星星1,贡莎莎1,才学鹏2,陈创夫1
(1.石河子大学 动物科技学院,新疆石河子 832003; 2.中国农业科学院 兰州兽医研究所,兰州 730046)
为获得具有良好免疫原性的绵羊肺炎支原体(MO)重组蛋白,利用ABCpred等软件预测分析MO EF-P、PDHA、P97相似蛋白和EF-Ts蛋白的优势线性抗原表位,构建多表位融合基因 MO-meAg1,合成后将其亚克隆至表达载体pET-32a(+),构建原核表达载体pET-32a(+)- MO-meAg1。将pET-32a(+)- MO-meAg1转化至感受态细胞E.coliBL21(DE3),IPTG诱导表达后检测重组蛋白反应原性和免疫原性。SDS-PAGE结果显示,MO-meAg1重组蛋白分子质量约34.5 ku;Western blot分析结果显示,该重组蛋白可被MO阳性血清特异性识别,具有良好的反应原性。小鼠免疫试验结果表明,重组蛋白MO-meAg1具有较强的免疫原性,诱导机体产生的抗血清其间接血凝效价可达1∶128以上。获得的多表位融合蛋白MO-meAg1为绵羊支原体肺炎的免疫学诊断及新型疫苗研究奠定基础。
绵羊肺炎支原体;抗原表位;多表位融合基因;表达
支原体是迄今为止已知的一类缺少细胞壁并能够自我复制的最小原核微生物。中国目前流行的羊支原体肺炎主要是由绵羊肺炎支原体(Mycoplasmaovipneumoniae,MO)引起的,绵羊或山羊均有易感性,其主要感染1~3月龄羔羊。支原体感染可引起绵羊或山羊出现胸膜肺炎,临床症状主要表现为流鼻涕、咳嗽、呼吸困难、生长发育迟缓、渐进性消瘦等[1-2],感染MO的羊主要出现肺间质增生性肺炎[3]。该病在全球均有分布,给世界养羊业造成巨大的经济损失[4-5]。
支原体缺乏细胞壁,MO主要抗原成分存在于细胞膜上,主要为蛋白质和脂质。近年来,国内外研究者对MO的抗原特性进行探索,初步证实P97、P113、延伸因子Tu (EF-Tu)、丙酮酸脱氧酶E1-α亚单位(PDHA)等蛋白均具有一定的免疫原性[6-9],然而由于支原体的抗原成分比较复杂,至今尚未鉴定出MO保护性抗原。为获得具有强免疫原性的MO抗原蛋白,本研究在构建MO基因组表达文库的基础上,利用筛选出的MO免疫相关抗原基因,通过预测优势抗原表位构建多表位融合基因 MO-meAg1,制备重组蛋白MO-meAg1,证实该重组蛋白具有较强的免疫原性和反应原性,为MO诊断试剂和新型疫苗的研发奠定基础。
1 材料与方法
1.1 质粒、菌种及试剂
E.coliDH5α、E.coliBL21(DE3)和pET-32a(+) 质粒由石河子大学动物科技学院寄生虫实验室保存。DNA Marker、核酸限制性内切酶EcoRⅠ、XhoⅠ、T4DNA Ligase和蛋白Marker购自TaKaRa公司;质粒小量提取试剂盒和琼脂糖凝胶回收试剂盒购自诺维森(北京)生物科技有限公司;MO正向间接血凝诊断试剂盒由中国农科院兰州兽医研究所提供。丙烯酰胺(Acrylamide)、硝酸纤维素膜购自北京博奥拓达科技有限公司;辣根过氧化物酶标记的兔抗羊IgG购自中彬金桥公司; Western blot膜封闭液、增强型HRB-DAB底物显色试剂盒购自天根生化科技(北京)有限公司;昆明系雌鼠由石河子大学实验动物养殖中心提供。
1.2 MO蛋白优势线性抗原表位的预测
运用在线软件ABCpred(http://www.imtech.res.in/raghava/abcpred/)、BepiPred 1.0 Server(http://www.cbs.dtu.dk/services/BepiPred)、Immunomedicine Group(http://imed.med.ucm.es/Tools/antigenic.pl)及DNAStar-Protean[10]分析绵羊肺炎支原体SC01株基因序列(登录号:NZ_AFHO00000000)的EF-P、PDHA、P97相似蛋白和EF-Ts蛋白的抗原表位,预测筛选优势抗原表位,选取排列组合得分较高的1组,用于构建多表位融合基因。
1.3 多表位融合基因的构建策略
将筛选出的MO抗原蛋白优势表位根据不同表位(氨基酸序列)对应的核苷酸序列,通过与柔性肽编码序列按照一定顺序进行连接,运用在线软件Racc(http://nihserver.mbi.ucla.edu/RACC/)[11]对多表位融合基因中的大肠杆菌稀有密码子预测分析,将稀有密码子优化为大肠杆菌偏爱密码子后,得到含有MO多表位的融合抗原基因(命名为MO-meAg1),送至华大基因生物公司进行基因合成。
1.4 多表位融合基因重组表达载体的构建与鉴定
利用Primer 5.0软件对合成的多表位融合基因序列设计特异性引物,引入EcoRⅠ和XhoⅠ限制性酶切位点,用于扩增多表位融合基因 MO-meAg1,引物由华大基因生物公司合成。上游引物MO-meAg1-E-F:5′-CCGGAATTCATGA ATTTTGAAAAGAAACCTG-3′;下游引物MO-meAg1-X-R:5′-CCGCTCGAGTTATTCTGTTGTCTCAGCATCT-3′ (下划线处分别为EcoRⅠ和XhoⅠ酶切位点,斜体为保护性碱基)。PCR采用20 μL反应体系:ddH2O 7 μL,2×PCR Mix 10 μL,模板2 μL,上、下游引物各0.5 μL。扩增条件:预变性95 ℃ 5 min;变性94 ℃ 40 s,退火60 ℃ 40 s,延伸72 ℃ 50 s,30个循环;最后72 ℃延伸10 min。反应结束后,10 g/L琼脂糖凝胶电泳后回收目的片段,对PCR回收产物与pET-32a(+) 质粒同时进行双酶切,分别回收目的片段和载体片段,4 ℃过夜连接,将连接产物转入感受态细胞E.coliDH5α,培养后挑取单个菌落进行PCR鉴定。取阳性克隆提取质粒进行双酶切鉴定,用10 g/L琼脂糖凝胶电泳检测,鉴定正确的重组表达质粒命名为pET-32a(+)- MO-meAg1。
1.5 多表位融合基因重组菌的诱导表达及免疫印迹分析
将鉴定正确的重组质粒pET-32a(+)- MO-meAg1转入感受态细胞E.coliBL21(DE3)中,次日挑取单个菌落37 ℃摇菌过夜,取 200 μL菌液接种于20 mL含Amp抗性的液体LB培养基,培养至OD600 nm达到0.6~0.8时,加20 μL 1.0 mmol/L IPTG诱导 2、4、6和8 h,各收1 mL菌液,同时设置空载体和未加IPTG诱导的重组菌做阴性对照,12 000 r/min离心1 min,留菌体进行SDS-PAGE电泳分析;以绵羊MO阳性血清为一抗,辣根过氧化物酶标记的兔抗羊IgG为二抗,进行Western blot 分析。
1.6 多表位融合基因重组蛋白的免疫原性分析
将10只25日龄的昆明系小鼠分成试验组和对照组,试验组: MO-meAg1重组蛋白溶液与弗氏完全佐剂按体积比1∶1乳化;对照组:PBS缓冲液与弗氏完全佐剂按体积比1∶1乳化。采用皮下多点注射方式进行首次免疫,免疫剂量为200 μL。首次免疫后14 d采用同样免疫方式进行二免,佐剂换成弗氏不完全佐剂。二免后7 d采血,分离血清,参照MO间接血凝诊断试剂盒,测定小鼠血清抗体效价。
2 结果与分析
2.1 抗原表位预测及多表位融合基因的合成
运用在线软件ABCpred、BepiPred 1.0 Server、Immunomedicine Group和DNAStar-Protean预测EF-P、PDHA、P97相似蛋白和EF-Ts蛋白的抗原表位,筛选出优势抗原表位(表1)。按一定顺序进行连接,选择各项比分较高的1组,得到多表位融合基因 MO-meAg1(图1),将其稀有密码子替换为大肠杆菌偏爱密码子,送至华大基因生物公司进行基因合成。
2.2 多表位融合基因重组表达载体的鉴定
用特异性引物成功扩增得到396 bp的 MO-meAg1基因,用限制性核酸内切酶EcoRⅠ和XhoⅠ对目的片段与pET-32a(+)质粒于37 ℃分别双酶切,分别回收,用T4DNA连接酶过夜连接,将链接产物转化入感受态细胞E.coliDH5α中,通过菌液PCR筛选出阳性重组菌(图2)。双酶切得到目的片段和pET-32a(+)片段(图3),表明重组表达质粒pET-32a(+)- MO-meAg1构建成功。
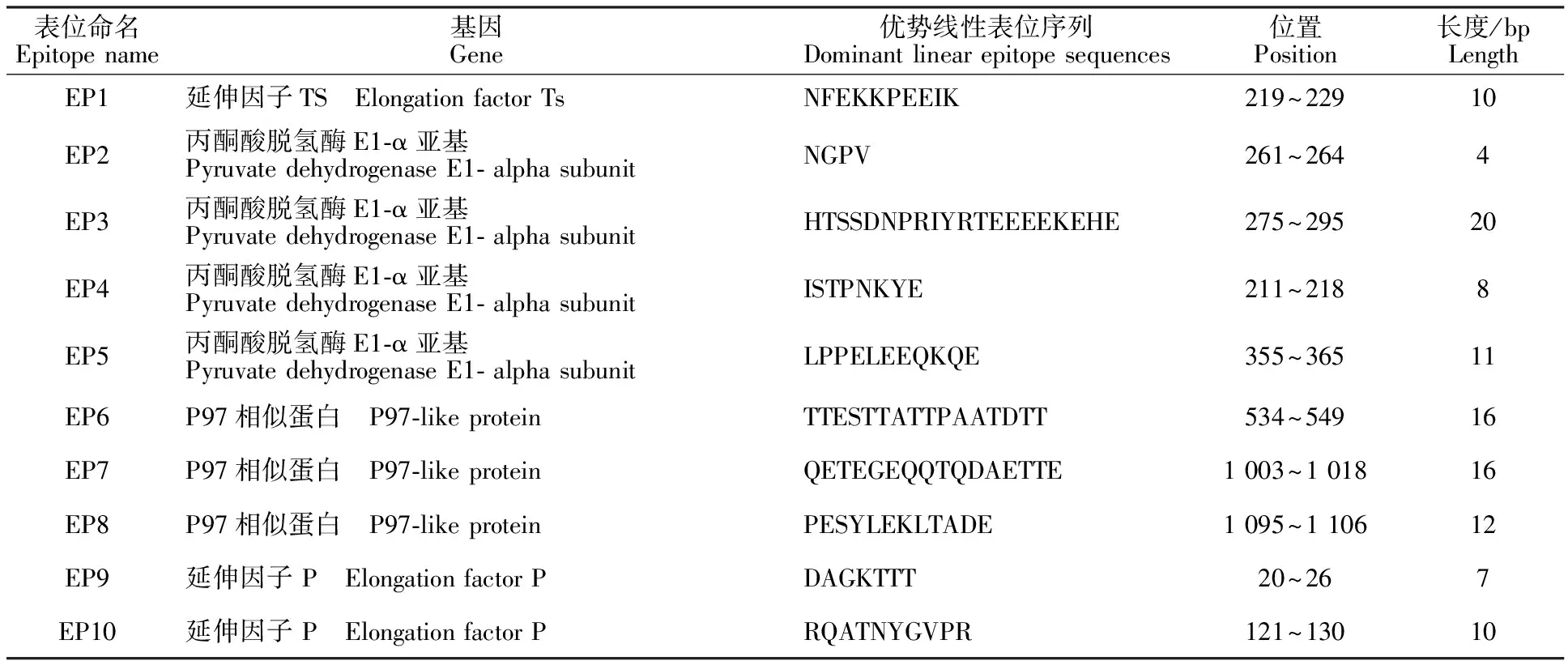
表1 抗原蛋白的优势线性表位序列

从上至下每3行为一组,在同一组中第1行为氨基酸序列,第2行为优化后的核苷酸序列,第3行为原始核苷酸序列 From top to bottom each of three line is a group, in the same group the first line is amino acid sequence, the second line is optimized nucleotide sequence, and the nucleotide sequence of the third line is original nucleotide sequence;柔性氨基酸序列(字符边框) Flexible amino acid sequence(Character border); 大肠杆菌稀有密码子(红色字体) E.coli rare codon(Red font); 优化后的核苷酸序列(双画线) Optimized nucleotide sequence (Double line)
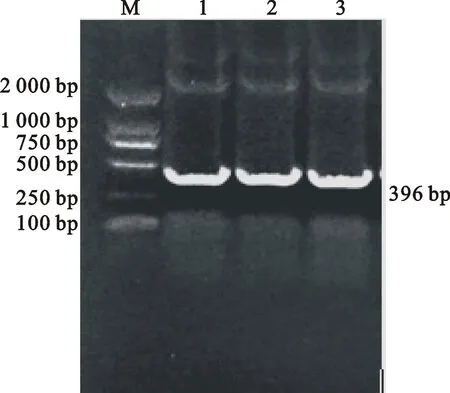
M.Marker DL2000;1~3.PCR产物 PCR products

M.Marker DL 5000; 1~3.pET-32a(+)- MO-meAg1双酶切产物 The products from pET-32a(+)-MO-meAg1 by double enzyme digestion
2.3 表达产物的SDS-PAGE和Western blot分析
重组表达质粒pET-32a(+)- MO-meAg1转化至大肠杆菌,筛选阳性菌株,pET-32a(+)- MO-meAg1重组菌在IPTG诱导后8 h时目的蛋白表达量达最高,重组蛋白分子质量为35.4 ku,主要以包涵体形式存在,且表达量较高。Western blot结果表明重组蛋白可被MO阳性血清识别,说明表达产物具有良好的反应原性(图4)。
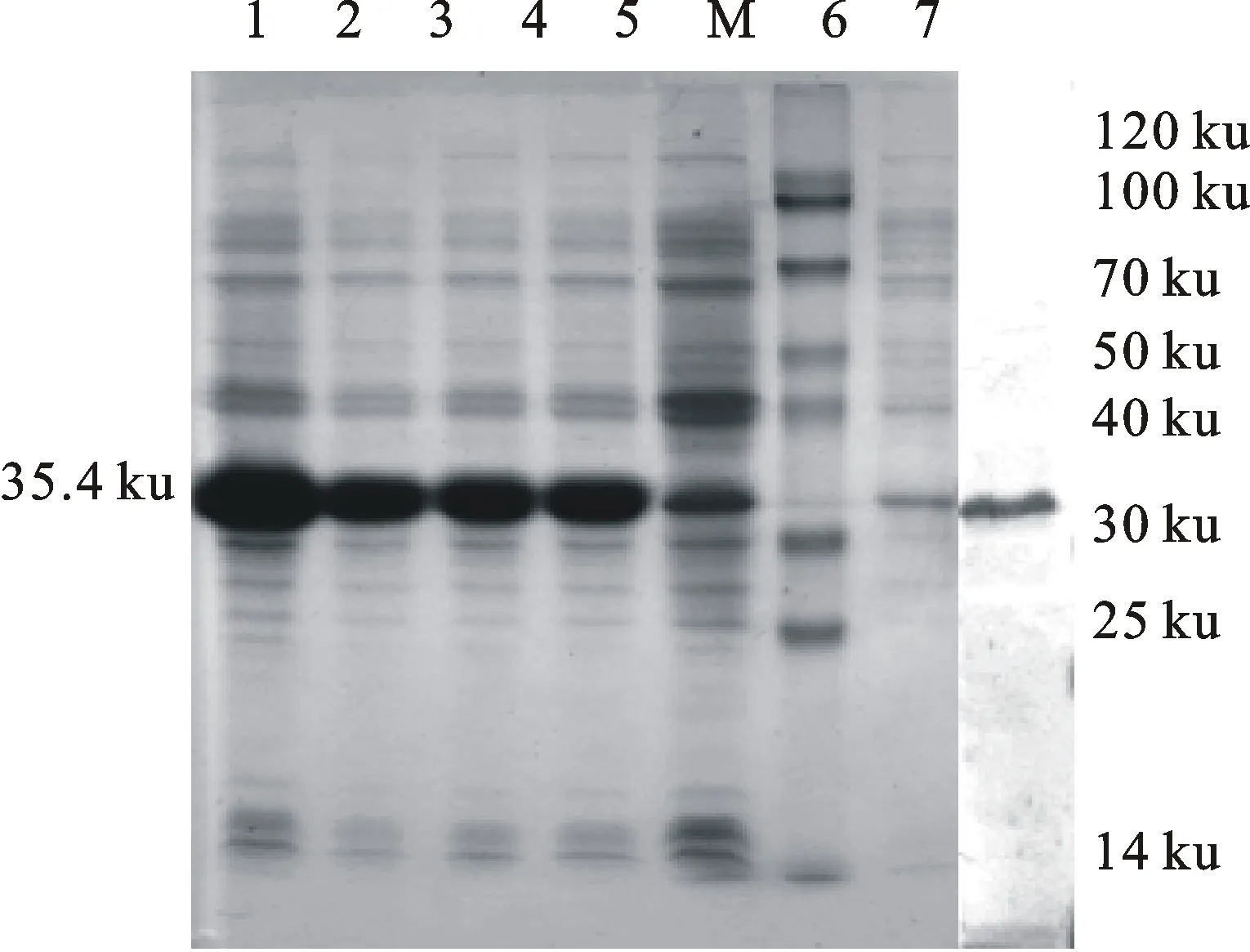
M.蛋白分子质量标准 Protein Marker; 1~4.pET-32a(+)- MO-meAg1重组菌IPTG诱导8 h、6 h、4 h、2 h的表达产物 pET-32a(+)- MO-meAg1 plasmid induced 8,6,4,2 h by IPTG; 5.空白对照 Negative control; 6.pET-32a(+)质粒诱导表达产物 pET-32a(+)plasmid induced by IPTG; 7.纯化的重组蛋白的Western blot分析结果 Western blotting of the purified recombinant using antiserum of M.ovipneumoniae
2.4 重组蛋白的小鼠免疫试验
将纯化的MO-meAg1重组蛋白与弗氏完全佐剂进行乳化,采取皮下多点注射,对25日龄的昆明系雌鼠进行第1次免疫接种;14 d后,将重组蛋白与弗氏不完全佐剂进行乳化,对小鼠第2次免疫,二免后7 d采集血液,分离血清,经MO间接血凝检测,MO-meAg1能刺激机体产生相对很强的免疫反应,抗体效价高于1∶128(图5)。
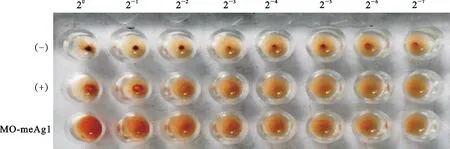
(-).阴性对照 Negative control; ( + ).阳性对照 Positive control;MO-meAg1.重组蛋白免疫后小鼠的血清 Serum of mice immunized with recombinant protein; 20~2-7.血清滴度 Serum titer
3 讨 论
MO感染可降低绵羊的免疫力,继发其他病原菌感染,造成较高的死亡率。因此,开展绵羊支原体肺炎的防控研究具有重要意义。近年来,尽管国内外一直致力于MO疫苗的研究工作,但尚未取得突破性进展。裴艳涛[12]通过SDS-PAGE和蛋白双向电泳技术分析MO Y-98和HD-1株的菌体蛋白,结果显示菌体蛋白的分子质量为14~100 ku,主要由9~10种蛋白质组成;蛋白质组学双向电泳结果显示,有 21个蛋白为Y-98和HD-1株共同蛋白;免疫印迹试验初步确定,分子质量为74.2、53.6、40.5和26.5 ku的蛋白质具有抗原性,可能为Y-98的主要抗原蛋白。许健等[13]利用双向电泳及免疫印迹的方法对MO MoGH3-3株抗原蛋白进行筛选,筛选到延伸因子Tu (Elongation factor Tu,EF-Tu)、丙酮酸脱氧酶E1-a亚单位(PDHA)2个抗原蛋白;将PDHA蛋白进行原核表达,并利用绵羊肺炎支原体高免血清进行免疫印迹,结果证实该重组蛋白PDHA具有较好的免疫学活性。许健等[8]将PDHA基因进行密码子优化后,对全基因合成并首次成功克隆表达MOPDHA基因,重组蛋白免疫小鼠发现血清抗体显著升高,证明重组 PDHA 蛋白具有较好的免疫学活性。
构建多表位抗原被认为是一种能增强蛋白抗原性的策略之一。该方法已经用于多种病原的保护性抗原研究中[14-17]。采用人工合成的方法将多个不同优势抗原表位串联起来,构建具有多种表位肽的复合多价表位疫苗,该方法可以有效增强抗原多肽的免疫原性。多表位抗原可同时携带多个目标抗原以及辅助型表位[18-19],然而表位的预测、筛选方法以及表位的排列顺序需优化组合,才能达到预期的效果。吴绍强等[20]利用分子生物学软件分析FMDV结构蛋白VP1~VP3上可能的抗原表位,并人工合成 8 条表位多肽,通过ELISA试验和合成肽免疫小鼠检测,结果显示其中 6 条多肽能产生相应的抗体。张轩[21]对MO的EF-Tu基因进行优化、合成并进行原核表达,Western blot 检测和动物免疫试验,证明其具有较好的免疫原性;将筛选出的MO EF-Tu、PDHA 和 HSP70 的优势表位串联融合,制成多表位疫苗,该重组蛋白能刺激机体产生很好的体液免疫,还能诱导机体发生细胞免疫。
本研究在构建MO基因组表达文库的基础上,利用筛选出的MO免疫相关蛋白基因,选取分布于MO EF-P、PDHA、P97相似蛋白和EF-Ts上的优势表位,经柔性氨基酸串联融合,成功构建多表位融合基因 MO-meAg1,并制备重组蛋白MO-meAg1。Western blot结果显示,可被MO阳性血清特异性识别,具有较强的反应原性。小鼠免疫试验发现,该重组蛋白能诱导机体产生较强的特异性抗体,为MO诊断试剂和新型疫苗的研发奠定前期基础。
Reference:
[1] WOUBIT S,LORENZON S,PEYRAUD A,etal.A specific PCR for the identification ofMycoplasmacapricolumsubsp.capripneumoniae,the causative agent of contagious caprine pleuropneumonia (CCPP) [J].VeterinaryMicrobiology,2004,104(1/2):125-132.
[2] BOCKLISCH H,PFUTZNER H,ZEPEZAUER V.Natural and experimental infections of lambs withMycoplasmaovipneumoniae[J].ArchivfurexperimentelleVeterinarmedizin,1989,43(5):755-761.
[3] THIAUCOUYT F,BOISKE G.Contagious caprine pleuropneumonia and other pulmonary mycoplasmoses of sheep and goats [J].Revuescientifiqueettechnique(InternationalOfficeofEpizootics),1996,15(4):1397-1414.
[4] PARHAM K,CHURCHWARD C P,MCAULIFFE L,etal.A high level of strain variation within theMycoplasmaovipneumoniaepopulation of the UK has implications for disease diagnosis and management [J].VeterinaryMicrobiology,2006,118(1/2):83-90.
[5] MACKAY J M K,NISBET D I,FOGGIE A.Isolation of pleuropneumonia-like organisms (Genusmycoplasma) from case of sheep pulmonary adenomatosis (SPA) [J].VeterinaryRecord,1963,75(21):550-551.
[6] 杨发龙,张焕容,汤 承,等.绵羊肺炎支原体 p113基因的序列分析及功能预测 [J].华南农业大学学报,2013,34(1):117-121.
YANG F L,ZHANG H R,TANG CH,etal.Sequence analysis and functional prediction ofMycoplasmaovipneumoniaep113 gene [J].JournalofSouthChinaAgriculturalUniversity,2013,34(1):117-121(in Chinese with English abstract).
[7] 尹正军,岳 华,汤 承.绵羊肺炎支原体延伸因子Tu基因的分子特性分析 [J].畜牧兽医学报,2015,46(2):288-294.
YIN ZH J,YUE H,TANG CH.Molecular characterization of the elongation factorTugene inMycoplasmaovipneumoniae[J].ActaVeterinariaetZootechnicaSinica,2015,46(2):288-294(in Chinese with English abstract).
[8] 许 健,储岳峰,高鹏程,等.绵羊肺炎支原体(Mycoplasmaovipneumoniae)丙酮酸脱氢酶E1-α亚单位基因(pdha)的克隆、表达及其免疫学活性测定 [J].农业生物技术学报,2012,20(3):275-282.
XU J,CHU Y F,GAO P CH,etal.Cloning and expression of Pyruvate Dehydrogenase E1-α Subunit gene(pdha) inMycoplasmaovipneumoniaeand its immunologic activity evaluation [J].JournalofAgriculturalBiotechnology,2012,20(3):275-282 (in Chinese with English abstract).
[9] 王建昌.绵羊肺炎支原体山东株的分离鉴定和标准株外膜蛋白特性研究 [D].山东泰安:山东农业大学,2007.
WANG J CH.Isolation and identification ofMycoplasmaovipneumoniaefrom Shandong and studies on out membrane protein of standard strain Y98 [D].Tai’an Shandong:Shandong Agricultural University,2007(in Chinese with English abstract).
[10] MA X M,ZHOU X T,ZHU Y J,etal.The prediction of T-and B-combined epitope and tertiary structure of the Eg95 antigen ofEchinococcusgranulosus[J].ExperimentalandTherapeuticMedicine,2013,6(3):657-662.
[11] SHARP P M,LI W H.Codon usage in regulatory genes inEscherichiacolidoes not reflect selection for ‘rare’ codons [J].NucleicAcidsResearch,1986,14(19):7737-7749.
[12] 裴艳涛.绵羊肺炎支原体标准株Y98蛋白质组双向电泳图谱的构建及其抗原性研究 [D].河北保定:河北农业大学,2004.
PEI Y T.The establissshment of two-dimensional electrophoresis and study on the Antigenicity ofMycoplasmaovipneumoniaeY98 [D].Baoding Hebei:Agricultural University of Hebei Province,2004(in Chinese with English abstract).
[13] 许 健,储岳峰,高鹏程,等.绵羊肺炎支原体免疫蛋白质组学的初步研究 [J].中国兽医科学,2012,42(2):150-153.
XU J,CHU Y F,GAO P CH,etal.Preliminary study on immunoproteomics ofMycoplasmaovipneumoniae[J].ChineseVeterinaryScience,2012,42(2):150-153(in Chinese with English abstract).
[14] PAUL S,PIONTKIVSKA H.Discovery of novel targets for multi-epitope vaccines:screening of HIV-1 genomes using association rule mining [J].Retrovirology,2009,6 (1):1-12.
[15] LI P,CAO R B,ZHENG Q S,etal.Enhancement of humoral and cellular immunity in mice against Japanese encephalitis virus using a DNA prime-protein boost vaccine strategy [J].VeterinaryJournal,2010,183(2):210-216.
[16] SANTIVANEZ S J,ARIAS P,PORTOCARRERO M,etal.Serological diagnosis of lung cystic hydatid disease using the synthetic p176 peptide [J].ClinicalandVaccineImmunology,2012,19(6):944-947.
[17] 何 玲,陈瑞爱,罗满林,等.多表位基因工程疫苗的研究进展 [J].广东畜牧兽医科技,2011,36(2):3-5.
HE L,CHEN R A,LUO M L,etal.Advance on research of transgenic multi-epitope vaccine [J].GuangdongJournalofAnimalandVeterinaryScience,2011,36(2):3-5(in Chinese).
[18] 张有峰,王红宁,黄 勇,等.多表位疫苗的构建策略及其在动物疫苗中的应用 [J].中国农业科技导报,2008,10(2):29-33.
ZHANG Y F,WANG H N,HUANG Y,etal.Construction strategy for multi-epitope vaccine and its application in animal vaccine [J].JournalofAgriculturalScienceandTechnology,2008,10(2):29-33(in Chinese with English abstract).
[19] 朱翠明.肺炎支原体P1C蛋白免疫学活性及plcDNA融合疫苗的初步研究 [D].长沙:中南大学,2012.
ZHU C M.Study on immunocompetence ofMycoplasmapneumoniaeP1C protein and plc DNA vaccine fused with interleukine 2 or B subunit ofEscherichiacoliheat-labile enterotoxin [D].Changsha:Central South University,2012(in Chinese with English abstract).
[20] 吴绍强,李亚静,王彩霞.南非Ⅱ型口蹄疫病毒抗原表位的筛选及抗原性分析 [J].中国兽医学报,2010,30(12):1638-1641.
WU SH Q,LI Y J,WANG C X.Screening of major epitopes of foot-and-mouth disease virus type SATⅡ and their antigenicity analysis [J].ChineseJournalofVeterinaryScience,2010,30(12):1638-1641(in Chinese with English abstract).
[21] 张 轩.绵羊肺炎支原体多表位疫苗的研究及免疫试验 [D].北京:中国农业科学院,2013.
ZHANG X.Research and immune experiments of multi-epitope vaccine ofMycoplasmaovipneumoniae[D].Beijing:Chinese Academy of Agricultural Sciences,2013(in Chinese with English abstract).
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Construction,Expression and Reactionogenicity of Multi-epitope Fusion Gene ofMycoplasmaovipneumoniae
TIAN Lulu1,MENG Qingling1,QIAO Jun1,CHEN Cheng1,LIU Tianli1,LÜ Haiting1, ZHANG Xingxing1,GONG Shasha1,CAI Xuepeng2and CHEN Chuangfu1
(1.College of Animal Science and Technology,Shihezi University,Shihezi Xinjiang 832003,China; 2.Lanzhou Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Lanzhou 730046,China)
To develop highly specific and sensitive antigen ofMycoplasmaovipneumoniae(MO),the dominant linear antigen epitopes of EF-P,PDHA,P97-like protein and EF-Ts using ABCpred softwares were analyzed,and then multi-epitope fusion gene MO-meAg1 was constructed.It was synthesized and subcloned to pET-32a (+) to generate pET-32a(+)- MO-meAg1.Then the pET-32a(+)- MO-meAg1 was transformed into competent cells ofE.coliBL21 (DE3) for expression after inducing by IPTG.The reactogenicity and immunogenicity of recombinant were analyzed,respectively.The results of SDS-PAGE showed that expressed MO-meAg1 was about 35.4 ku.The analysis of Western blot showed that recombinant MO-meAg1 can be specifically recognized by anti-MO positive serum,displaying strong reactionogenicity.The results of immunization test in mice showed that recombinant MO-meAg1 had high immunogenicity,which can induce the specific antibody with indirect hemagglutination titer of 1∶128.The results showed that MO-meAg1 is a promising antigen,which provided a potentially valuable antigen for the development of the immunological diagnostic method and vaccine against MO infection.
Mycoplasmaovipneumoniae; Antigen epitopes; Multi-epitope fusion gene; Expression
TIAN Lulu,female,master student.Research area:pathogenic molecular biology.E-mail:928929323@qq.com
QIAO Jun,male,Ph.D,professor.Research area:pathogenic molecular biology.E-mail:qj710625@163.com
日期:2017-05-22
2016-04-27
2016-05-12
国家国际科技合作专项(2014DFR31310);国家自然科学基金(31360596,30960274)。
田路路,女,硕士研究生,从事病原分子生物学研究。E-mail:928929323@qq.com
乔 军,男,博士,教授,主要从事畜禽病原分子生物学研究。E-mail:qj710625@163.com
S858.26
A
1004-1389(2017)05-0678-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170522.0857.010.html
Received 2016-04-27 Returned 2016-05-12
Foundation item The International Science and Technology Cooperation Program of China(No.2014DFR31310);National Natural Science Foundation of China (No.31360596,30960274).
