阿尔山白桦根际土壤固氮菌多样性及特性1)
2017-06-05牛艳芳闫伟陈立红
牛艳芳 闫伟 陈立红
(内蒙古农业大学,呼和浩特,010019)
阿尔山白桦根际土壤固氮菌多样性及特性1)
牛艳芳 闫伟 陈立红
(内蒙古农业大学,呼和浩特,010019)
采用阿须贝无氮培养基分离纯化白桦(Betulaplatyphylla)根际土壤固氮菌,根据菌落形态、16S rDNA序列分析及生理生化特性进行固氮菌的鉴定,从而探讨阿尔山国家森林公园自然保护区白桦根际土壤固氮菌的多样性,并对典型固氮菌进行pH、温度和解磷能力的测定。结果表明:分离出的31株固氮菌分属于Pseudomonas、Variovorax、Burkholderia、Rhizobium、Paenibacillus、Arthrobacter、Rhodococcus、Bosea、Labrys、Phyllobacterium、Mesorhizobium、Mucilaginibacter12个不同的类群。不同类群的固氮菌pH和温度生长范围有所不同;分离得到的典型固氮菌中,有3株具有解磷活性。
阿尔山;白桦;根际;固氮菌;16S rDNA
土壤微生物中对植物起促生作用的主要是一些根际促生菌,可通过生物固氮、溶磷等分解和转化作用改变植物根际的营养,促进根系对营养元素的吸收。植物在生长的过程中需要的大量氮元素,约有60%来自生物固氮[1-4]。从1958年,科学家Dobereiner和Ruschei从甘蔗的根际分离到具有固氮能力的微生物至今,发现和研究得较多的与植物联合固氮的微生物种、属有20多种[5-7]。目前,根际固氮菌研究的热点主要集中于农业作物和固氮树种[8-13]。而对非固氮树种的研究较少,且都集中在联合固氮细菌回接对这些树种的促生效应上[14-16],而关于白桦根际固氮菌的相关报道很少[17-18]。
阿尔山植被类型多样,其根际微生物群落结构也必定十分丰富,存在着大量有利于植物生长的、固氮能力较强的PGPR,但目前尚缺乏对阿尔山植物根际固氮菌的相关研究。因此,本研究采集了阿尔山的主要木本植物白桦(Betulaplatyphylla)的根际土壤,采用稀释涂布分离法分离纯化固氮菌,根据菌落形态、16S rDNA序列分析及生理生化特征进行固氮菌的鉴定,并测定其生物学特性,分析白桦根际土壤固氮菌的多样性及生物学特性,丰富白桦根际土壤固氮菌资源,为研究白桦固氮机制提供参考。
1 研究区概况
阿尔山国家森林公园(46°39′~47°39′N,119°28′~121°23′E)位于蒙古高原大陆性气候区,属于寒温带湿润区,地处大兴安岭中段,被呼伦贝尔、锡林郭勒、科尔沁、蒙古四大草原所环抱,具有典型的火山地貌类型。阿尔山特殊的地理位置和独特的生态地位塑造了阿尔山独特的生物类群。一年四季常受西伯利亚寒流的侵袭,冬季寒冷漫长,夏季短促凉爽,植物生长期短,植被类型属寒温带针阔混交林,主要植被多由西伯利亚植物区蒙古植物区系组成,以木本植物为主体。主要树种有兴安落叶松(Larixgmelinii)、白桦、樟子松(Pinussylvestrisvar.mongolica)、山杨(Populussp.)等[19-20]。
2 材料与方法
2.1 标准样地选择
在前期的踏查基础上,于2015年8选择阿尔山国家森林公园自然保护区纯白桦林为研究样地。样地坡度23.75°,西南坡向,中坡位,海拨1 112 m,林分密度1 300株·hm-2,郁闭度0.83,林木平均胸径17.0 cm,平均树高20.9 m。
2.2 样品的采集
在选取样地内,采用5点采样法(4个顶点加1个中心点),每个采样点选取1株白桦,去掉表面的腐殖质,用无菌的铁锹挖取30 cm深的土壤,找到白桦根系,将带有根系的土壤装入无菌密封袋,带回实验室,冰箱中4 ℃保存备用。
2.3 根际土壤固氮菌的分离纯化
采用稀释涂布分离法,利用阿须贝无氮培养基分离和纯化土壤样品中的固氮菌。称取土样10 g,放入装有90 mL无菌水的加玻璃珠的三角瓶中,在摇床上150 r·min-1,振荡20 min。依次制成10-3、10-4、10-5稀释度的土壤悬液,分别接种到培养皿中,用无菌玻璃棒涂布均匀,28 ℃恒温培养6~7 d。每个稀释度重复3次。利用划线法将培养出的固氮菌菌落进行分离,4~5代可以分离到纯种的固氮菌。将纯化后的固氮菌继续在无氮培养基上转接3次,保证分离到的固氮菌仍具有固氮活性,将分离后的固氮菌保存到试管,置于冰箱4 ℃保存备用[21-23]。
2.4 固氮菌16S rDNA序列分析
利用细菌基因组试剂盒(天根生化科技有限公司)提取固氮菌基因组DNA(具体操作方法见说明书)[24]。以细菌基因组DNA为模板,采用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)/1492R(5′-GGTTACCTTGTTACGACTT-3′)(上海生工生物工程有限公司合成)扩增16S rDNA。反应体系(总体积50 μL):25 μL DaeamTapGreen PCR Master Mix(2X),2.0 μL 10 μmol·L-1引物27F,2.0 μL 10 μmol·L-1引物1492R,2.0 μL模板DNA,19 μL ddH2O。扩增反应条件:95 ℃ 3 min;95 ℃ 30 s,45 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 15 min。扩增后序列由上海生物工程有限公司进行序列的测定。
测定的序列经DNAMAN6.0校正后引入EzTaxon与已发表菌种的16S rDNA序列进行同源性比较,找出相似度较高的序列,用MEGA4软件采用邻接法构建系统发育树,自展值(Bootstrap)为1 000。分析根际土壤固氮菌的系统发育地位[25-29]。
2.5 典型固氮菌生理生化鉴定
将筛选出的代表菌株选用多种不同的生理生化实验鉴定固氮菌[30]。
2.6 典型固氮微生物特性分析
pH对菌株活性的影响:将筛选出的代表菌株分别接种于pH为3、4、5、6、7、8、9、10、11的培养基中,28 ℃培养5 d,观察菌落生长情况[31]。
温度对菌株活性的影响:将筛选出的代表菌株分别接种于阿须贝培养基,置于5、15、28、37、45 ℃等不同温度下培养5 d,观察菌落生长情况[31]。
解磷能力的测定:采用溶磷圈法将筛选出的菌株接种到无机磷培养基中,培养箱中28 ℃培养10 d,观察菌株周围是否有透明圈出现。如有出现,测定透明圈和菌落的直径大小,二者比值的大小表示菌株解磷能力的强弱[32-33]。
3 结果与分析
3.1 根际土壤固氮菌的形态
根据菌落大小、颜色、透明度、边缘是否整齐等特征,最终从白桦根际土壤中分离出具有典型形态的固氮菌31株,用XH表示。从图1可以看出,固氮菌的菌落形态多样,有的菌落大,有的菌落小;有的菌落乳白色,有的菌落透明;有的菌落边缘整齐,有的菌落边缘不整齐;有的菌落隆起,有的菌落扁平;有的菌落表面湿润光滑,有的菌落表面干燥。
3.2 16S rDNA琼脂糖凝胶电泳
以细菌通用引物27F和1492R为引物,对白桦根际土壤中分离出的31株固氮菌的16S rDNA基因片段进行扩增,所得片段条带清晰(图2),大小约为1.5 kb,符合细菌16S rDNA的大小。16S rDNA序列委托上海生物工程有限公司测序。
3.3 白桦根际土壤固氮菌系统发育树的构建
经EzTaxon研究表明,从白桦根际土壤分离出的31株固氮菌的16S rDNA基因序列与相关模式菌株的16S rDNA基因序列相似性为96.38%~100%。由系统发育树(图3)可以看出,31株固氮菌分属于12个不同的属,其中假单胞菌(Pseudomonas)为优势属,占总固氮菌数的45.2%。
3.4 白桦根际土壤典型固氮菌生理生化特性
从经16S rDNA鉴定后分属于12个不同类群的菌株中选出代表菌株进行生理生化试验,其结果见表1。从表1可以看出,不同类群的固氮菌其生理生化特性不同,但所有菌株都能利用葡萄糖和甘露醇作为碳源生长,过氧化氢酶为阳性。菌株XH10、XH14、XH21、XH22、XH24、XH25、XH26均能利用乳糖生长,而菌株XH4、XH5、XH16、XH18、XH20不能利用乳糖;菌株XH16、XH18、XH20不能利用蔗糖生长,其余菌株均能利用蔗糖生长;甲基红和VP反应只有菌株XH18为阳性,其余均为阴性;吲哚反应菌株XH20、XH22、XH24为阳性,其余均为阴性;淀粉水解反应菌株XH22、XH24为阳性,其余均为阴性;尿素水解反应菌株XH22、XH24、XH25为阳性,其余均为阴性;油脂水解反应菌株XH5、XH14、XH18、XH21、XH22、XH26均为阳性,菌株XH4、XH10、XH16、XH24均为阴性,菌株XH20、XH25未检出;明胶液化反应菌株XH10、XH18、XH22、XH24均为阳性,其余菌株为阴性。
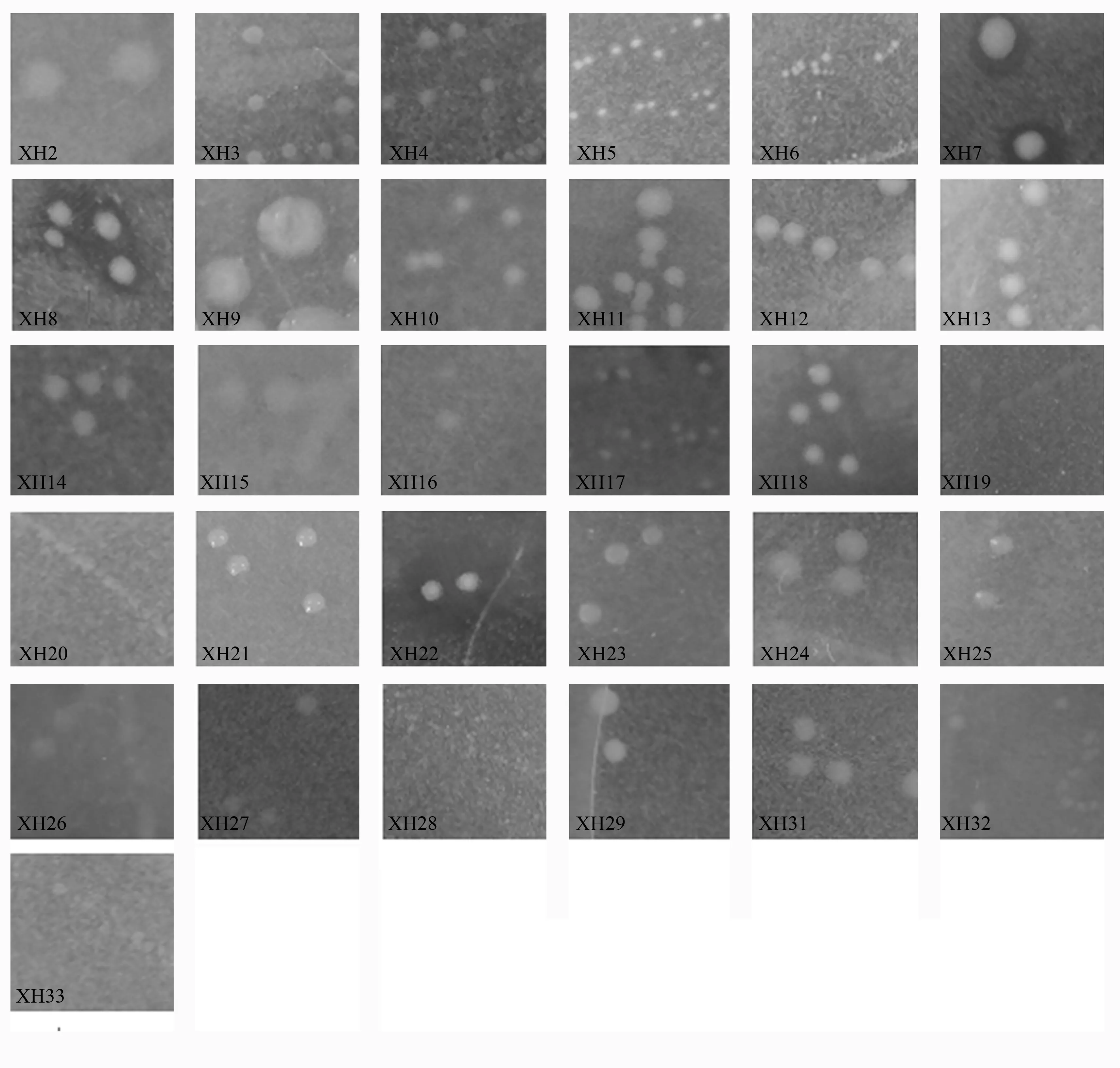
图1 白桦根际土壤固氮菌菌落形态
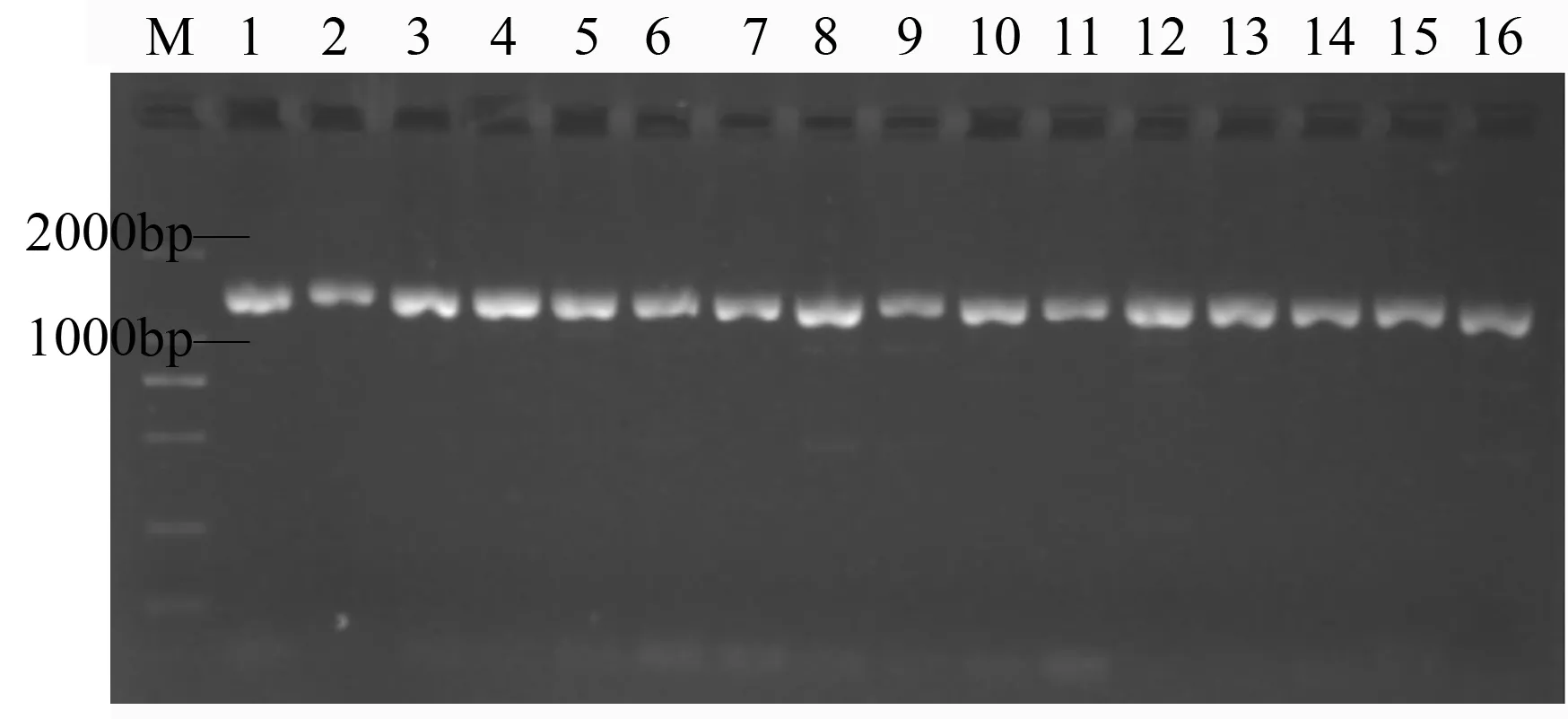
图2 部分白桦根际固氮菌16S rDNA电泳图谱
根据《伯杰氏细菌鉴定手册(第9版)》和《常见细菌系统鉴定手册》,结合16S rDNA序列分析,最终确定,分离自阿尔山白桦根际土壤的31株固氮菌分属于Pseudomonas、Variovorax、Burkholderia、Bosea、Labrys、Phyllobacterium、Mesorhizobium、Rhizobium、Paenibacillus、Arthrobacter、Rhodococcus、Mucilaginibacter12个不同的类群(表2)。
3.5 白桦根际典型固氮菌特性
pH对菌株活性的影响:将不同类群的固氮微生物分别接种于pH为3、4、5、6、7、8、9、10、11的培养基中,28 ℃培养5 d,观察菌落生长情况。从表3中可以看出,不同类群的固氮菌pH的生长范围不同,其中菌株XH22的pH生长范围最大,在3~11都能生长,菌株XH4、XH16、XH26的pH生长范围是4~9;菌株XH5、XH10、XH20的pH生长范围是3~9;菌株XH14的pH生长范围是5~10,菌株XH18的pH生长范围是5~9;菌株XH21的pH生长范围是5~11,菌株XH24和XH25的pH生长范围是4~10,但所有菌株的最适生长pH值均集中在6~8。
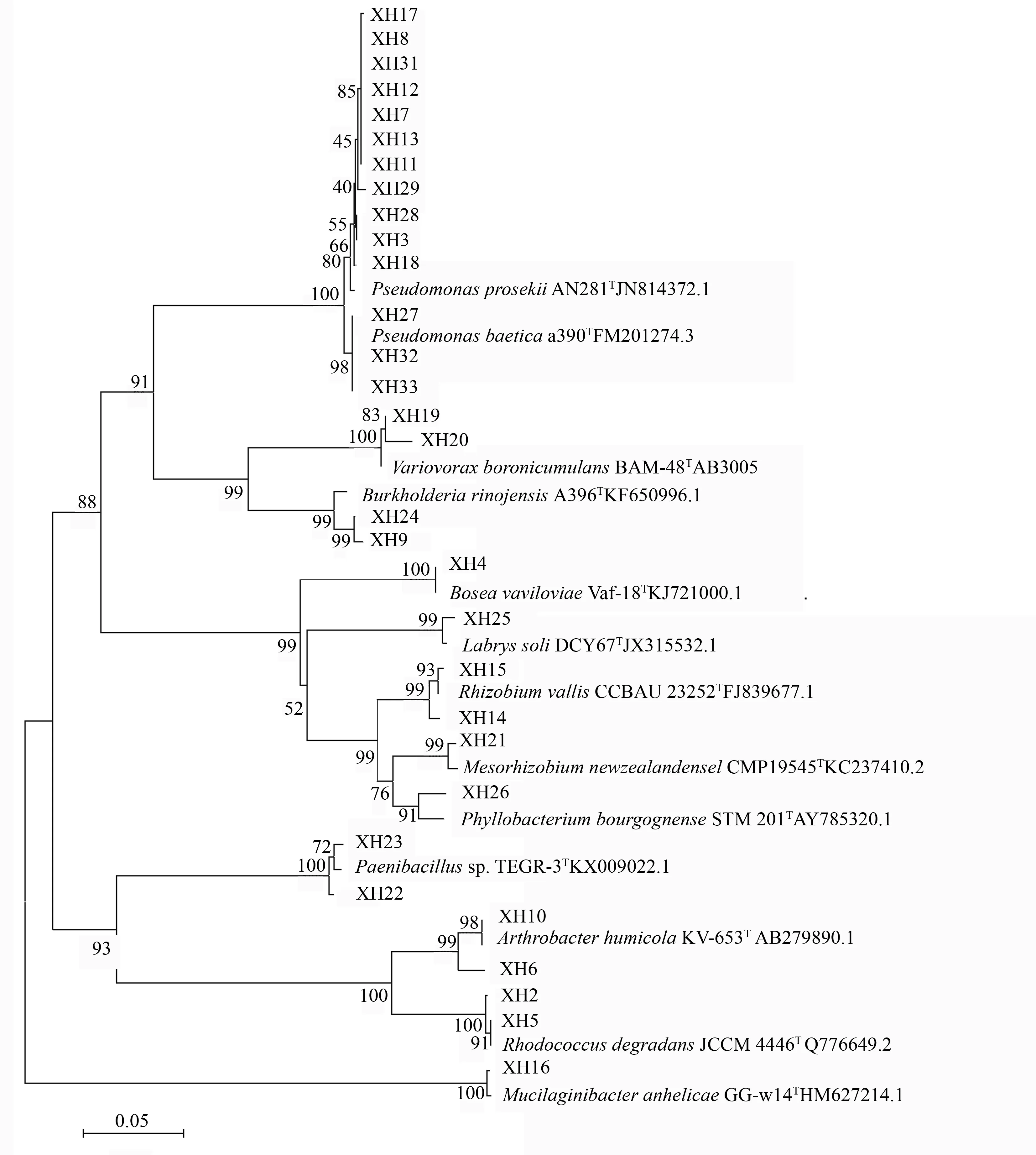
图3 基于16S rDNA的白桦根际土壤固氮菌系统发育树

表1 白桦根际土壤典型固氮菌生理生化特性
注:“+”表示反应阳性,“-”表示反应阴性,ND表示未检出。
温度对菌株活性的影响:从表4中可以看出,不同类群的固氮菌其温度生长范围不同,菌株XH14和XH26温度生长范围最大,在4~45 ℃均可以生长,其余菌株的温度生长范围基本都集中于15~37 ℃,但最适生长温度都是28 ℃。

表2 白桦根际土壤固氮菌鉴定结果
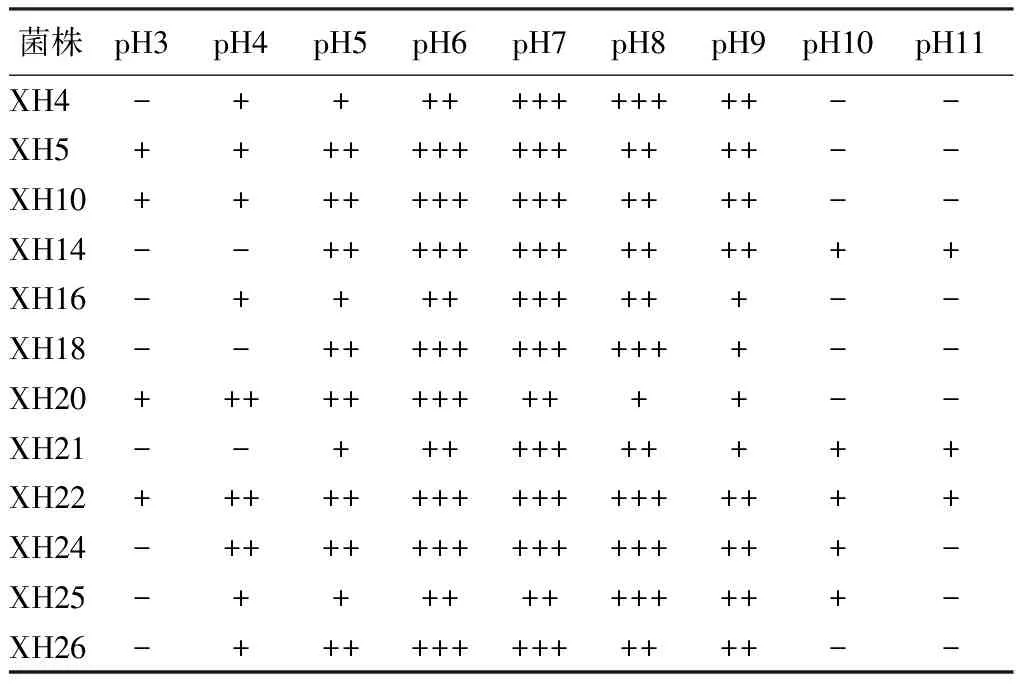
表3 白桦根际典型固氮菌不同pH下的生长情况
注:“-”表示不生长,“+”表示生长,“++”表示生长较好,“+++”表示生长旺盛。
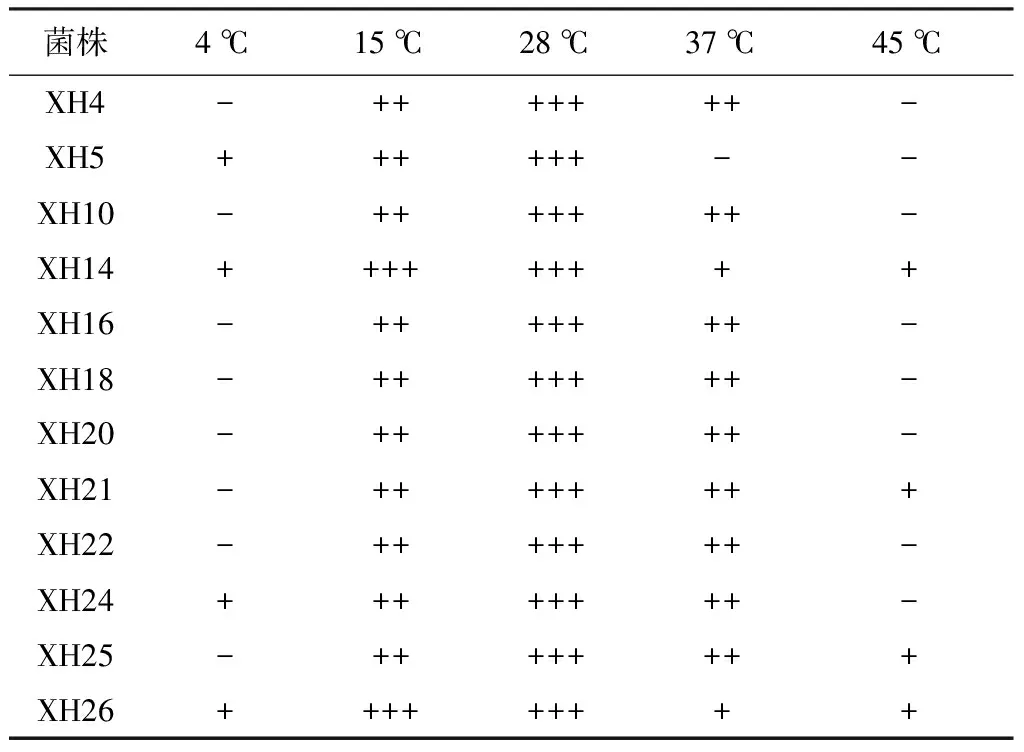
表4 白桦根际典型固氮菌不同温度下的生长情况
注:“-”表示不生长,“+”表示生长,“++”表示生长较好,“+++”表示生长旺盛。
解磷能力:有许多固氮菌除了具有固氮能力外,还具有解磷作用。本试验对筛选菌株是否具有解磷作用进行了验证。结果表明,在解磷能力方面,从定性试验来看,菌株XH18、XH22、XH24均具有解磷作用,解磷能力由强到弱依次为XH22、XH18、XH24(表5)。
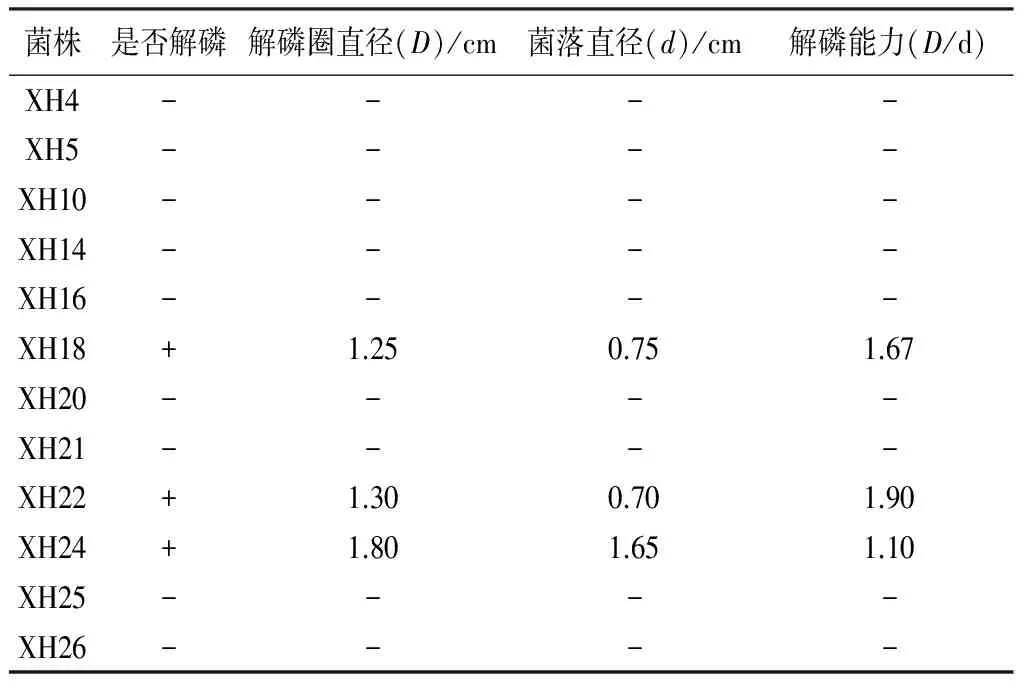
表5 白桦根际土壤典型固氮菌解磷能力
注:表中“+”表示能够解磷,“-”表示不能解磷。
4 结束语
阿尔山国家森林公园白桦根际土壤固氮菌具有丰富的多样性,分离出的31株固氮菌分别属于12个不同的类群,其中Pseudomonas为优势类群。不同固氮菌的生长pH和温度有差异性,12个不同类群的固氮菌中只有Pseudomonas、Paenibacillus、Burkholderia具有解磷作用。该研究丰富了我国白桦木本植物根际固氮菌资源,为研究木本植物固氮提供了理论依据。
[1] CHAUHAN H, BAGYARAJ D J, SELVAKUMAR G, et al. Novel plant growth promoting rhizobacteria-Prospects and potential[J]. Applied Soil Ecology,2015,95:38-53.
[2] XIA Y, XU Q, LIN Y, et al. Research progress of mechanism of action of plant growth promoting rhizobacteria[J]. Agricultural Science & Technology,2014,15(1):87-90,110.
[3] HUANG X F, ZHOU D M, ZHOU J H, et al.Bacillusspp. from rainforest soil promote plant growth under limited nitrogen conditions[J]. Journal of Applied Microbiology,2015,118(3):91.
[4] XUN F F, XIE B M, LIU S S, et al. Effect of plant growth-promoting bacteria (PGPR) and arbuscular mycorrhizal fungi (AMF) inoculation on oats in saline-alkali soil contaminated by petroleum to enhance phytoremediation[J]. Environ Sci Pollut Res,2015,22(1):598-608.
[5] 张晓波.草地早熟禾根际促生菌(PGPR)特性及根际微生物区系研究[D].北京:北京林业大学,2008.
[6] 李玫.我国红树林主要造林树种PGPR研究及应用[D].北京:中国林业科学研究院,2009.
[7] 刘婷.高寒草甸优势植物根际促生菌资源评价及菌种鉴定[D].兰州:甘肃农业大学,2016.
[8] 李琼洁,程杰杰,孙帅欣,等.玉米联合固氮菌KosakoniaradicincitansGXGL-4A的分离鉴定与固氮特性研究[J].微生物学通报,2016,43(11):2456-2463.
[9] 于晓波,苏本营,龚万灼,等.玉米-大豆带状套作对大豆根瘤性状和固氮能力的影响[J].中国农业科学,2014,47(9):1743-1753.
[10] 姚拓,龙瑞军,王刚,等.兰州地区盐碱地小麦根际联合固氮菌分离及部分特性研究[J].土壤学报,2004,41(3):444-448.
[11] 刘丹丹,李敏,刘润进.我国植物根围促生细菌研究进展[J].生态学杂志,2016,35(3):815-824.
[12] 谢越盛,许泉,王大成,等.植物根际促生枯草芽孢杆菌JC01筛选[J].微生物学通报,2016,43(10):2187-2196.
[13] WANG B B, SHEN Z Z, ZHANG F G, et al.Bacillusamyloliquefaciensstrain W19 can promote growth and yield and suppress fusarium wilt in banana under greenhouse and field conditions[J]. Pedosphere,2016,26(5):733-744.
[14] 袁辉林,康丽华.植物促生菌对桉树幼苗生长及其氮素来源的影响[J].热带作物学报,2016,37(12):2256-2260.
[15] 赵秀云,韩素芬.杨树根际固氮菌的分离、筛选和鉴定[J].南京林业大学学报,2000,24(3):17-20.
[16] 左杰,王宗永,周国英,等.杉木人工林林下固氮植被的筛选研究[J].江西农业大学学报,2014,36(4):795-801.
[17] 田国杰,王晗,陈立红.内蒙古赤峰地区主要树种根际固氮菌的分离和鉴定[J].内蒙古林业科技,2016,42(1):21-26.
[18] 牛艳芳,陈立红,闫伟.大兴安岭根河落叶松和白桦根际固氮菌的多样性分析[J].内蒙古林业科技,2016,42(3):5-9.
[19] 李菁,骆有庆,石娟.基于生物多样性保护的兴安落叶松与白桦最佳混交比例:以阿尔山林区为例[J].生态学报,2012,32(16):4943-4949.
[20] 李菁.内蒙古阿尔山林区植物、节肢动物生物多样性与森林健康评价[D].北京:北京林业大学,2012.
[21] 刘晓璐,杨柳青,吕乐,等.烟草根际固氮菌的筛选、鉴定及优化培养[J].中国烟草学报,2015,21(1):89-94.
[22] 刘莹莹,王继雯,岳丹丹,等.一株固氮芽孢杆菌的分离与鉴定[J].中国农学通报,2015,31(26):60-65.
[23] DING Y, WANG J, LIU Y, et al. Isolation and identification of nitrogen-fixing bacilli from plant rhizospheres inBeijingregion[J]. J Appl Microbiol,2005,99(5):1271-1281.
[24] 倪桂萍,王延平,王华田,等.杨树人工林土壤细菌DNA的提取与扩增[J].山东大学学报(理学版),2013,48(5):23-28.
[25] 代金霞,王玉炯,武雪娟,等.柠条根瘤内生细菌的抗逆性及遗传多样性[J].应用生态学报,2012,23(2):519-524.
[26] 董鑫,刘晓云,张斌,等.云南省田菁根瘤菌及根瘤内生细菌遗传多样性研究[J].热带作物学报,2010,31(1):88-92.
[27] 杨鸿儒,袁博,赵霞,等.三种荒漠灌木根际可培养固氮细菌类群及其固氮和产铁载体能力[J].微生物学通报,2016,43(11):2366-2373.
[28] 阳洁,秦莹溪,王晓甜,等.广西药用野生稻内生细菌多样性及促生作用[J].生态学杂志,2015,34(11):3094-3100.
[29] 胡佳频,汤鹏,易浪波,等.钾长石矿区土壤固氮菌的多样性分析[J].中国微生态学杂志,2015,27(10):1127-1130,1135.
[30] 侯伟,彭桂香,许志钧,等.广东箣竹内生固氮菌生理特性及促生效果研究[J].林业科学研究,2008,21(1):101-105.
[32] 张亮,杨宇虹,李倩,等.自生固氮菌活化土壤无机磷研究[J].生态学报,2013,33(7):2157-2164.
[33] 周德明,李蓉.杉木根际固氮菌筛选及其溶磷性与分泌IAA特性研究[J].四川师范大学学报(自然科学版),2012,35(4):562-566.
Diversity and Characterization of Nitrogen-fixing Bacteria inBetulaplatypyllaRhizosphere in Arxan//
Niu Yanfang, Yan Wei, Chen Lihong
(Inner Mongolia Agricultural University, Hohhot 010019, P. R. China)//
Journal of Northeast Forestry University,2017,45(5):101-105,120.
The nitrogen-fixing bacteria were isolated and purified from the rhizosphere ofBetulaplatyphyllaby Ashby nitrogen-free culture medium, and identified in the 16S rDNA and physiology-biochemical. The diversity of nitrogen fixing bacteria was studied inB.platyphyllarhizosphere in Arxan National Forest Park. The optimum pH, temperature and phosphate solubilizing capacity of the typical nitrogen fixing bacteria were measured. The 31 nitrogen-fixing bacteria were isolated, belonging to 12 groups, which werePseudomonas,Variovorax,Burkholderia,Rhizobium,Paenibacillus,Arthrobacter,Rhodococcus,Bosea,Labrys,Phyllobacterium,MesorhizobiumandMucilaginibacter. The pH and temperature range of nitrogen-fixing bacteria were different in different groups, and phosphate-solubilizing activity was found in three strains of typical nitrogen-fixing bacteria.
Aershan;Betulaplatypylla; Rhizosphere; Nitrogen-fixing bacteria; 16S rDNA
1)国家自然科学基金项目(31260173)。
牛艳芳,女,1977年6月生,内蒙古农业大学林学院,博士研究生。E-mail:niuyanfang@126.com。
陈立红,内蒙古农业大学农学院,教授。E-mail:chenlihong@imau.edu.cn。
2017年1月21日。
S718.8
责任编辑:程 红。
