酸雨胁迫对尾叶桉抗逆生理及APX-类基因转录水平的影响1)
2017-06-05黄俊文黄真池曾彩萍谢观燕庞恒声
黄俊文 黄真池 曾彩萍 谢观燕 庞恒声
(岭南师范学院,湛江,524048)
酸雨胁迫对尾叶桉抗逆生理及APX-类基因转录水平的影响1)
黄俊文 黄真池 曾彩萍 谢观燕 庞恒声
(岭南师范学院,湛江,524048)
以尾叶桉(Eucalyptusurophylla)1月龄树苗为材料,用不同pH值(5.6、4.0、2.5、2.0)的模拟酸雨连续喷雾灌根处理15 d,检测净光合速率、蒸腾速率、气孔导度、胞间二氧化碳摩尔分数、水分利用效率、叶绿素质量分数、丙二醛质量摩尔浓度、电导率、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性等生理指标及抗坏血酸过氧化物酶类基因(APX)的转录变化。酸雨处理后,叶绿素质量分数无明显变化,净光合速率、蒸腾速率、水分利用效率下降,丙二醛质量摩尔浓度、电导率显著升高,SOD活性、POD活性、CAT活性都明显升高,均在pH值为2.0有最大值,pH=2.0时,7个APX-类基因的转录水平分别为对照的1.76、2.65、3.68、7.34、0.58、1.82、1.46倍。结果表明,酸雨会抑制尾叶桉的光合作用,引起活性氧(ROS)代谢失衡,导致膜脂过氧化,且酸雨强度越大其作用越明显;SOD活性、POD活性、CAT活性增强,APX-类基因表达上调是尾叶桉应对酸雨胁迫的保护机制;抗逆生理和APX-类基因的转录水平存在对应关系。
酸雨;尾叶桉;抗逆;APX-基因;转录
酸雨是pH值小于5.6的大气降水的总称,是大气污染的一种。20世纪80年代以来,随着经济的飞速发展,我国酸雨污染日趋严重,现已成为继欧洲和北美之后的世界第三大酸雨重灾区[1-2]。华南地区是我国较严重的一个酸雨区,其中广东省被国务院划定的酸雨控制区占全省国土面积的71.6%,占全国酸雨控制区总面积的16%[3]。严重的酸雨对生态的影响和造成的巨大经济损失,已成为制约我国农林业生产和社会经济发展的重要因素之一[4]。已有的研究表明,酸雨会通过降低叶绿素质量分数、影响光合作用、增大叶片细胞膜透性等干扰植物正常生命活动,破坏叶片结构,使叶片退绿早落,甚至导致森林退化[5-7]。
酸雨胁迫下,植物的过氧化物酶的活性会增强[11],也会对植物细胞质膜质子泵、钙泵等有影响[9-10]。逆境胁迫会导致植物ROS(reactive oxygen species)过度积累,使其代谢失衡,从而使细胞内的大分子物质及其他组分受损,对植物造成氧化伤害,阻碍植物的正常代谢和生长,甚至死亡[11]。植物细胞中ROS的代谢平衡与其正常的分裂、分化、发育及抗逆等有重要关系[12]。当外界环境改变,植物体内的ROS平衡被打破时,植物将通过酶促和非酶促抗氧化系统清除多余的ROS,以维持自身正常生理代谢活动。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)是一种在逆境条件下清除细胞内氧自由基、增强植物抗逆性的关键酶。属于I型血红素过氧化物酶,专一性地以抗坏血酸为电子供体,将H2O2分解为H2O和O2,以消除H2O2对细胞的毒害作用,在维持植物细胞ROS平衡过程中发挥着重要的作用[13-15]。植物APX-基因家族由叶绿体、线粒体、过氧化物酶体及细胞质基因亚家族组成[16],植物细胞发育、生物及非生物因素胁迫均可调节其表达[17]。
桉树原产于澳洲,是桃金娘科(Myrtaceae)杯果木属(Angophora)、伞房属(Corymbia)及桉属(Eucalyptus)植物的统称,共有1039个种、亚种和变种[18]。桉树是世界公认的三大人工林树种之一,其生长速度快、轮伐期短、耐干旱、耐瘦瘠、适应性广,且用途广泛,经济效益高。据统计,全世界桉树人工林面积超过2 000万hm2[19],桉树已成为我国南亚热带主要造林树种,各类试验林、大面积的速生丰产林基地较多[20]。酸雨在华南地区尤为严重,对桉树种植危害严重。
目前,模拟酸雨对植物影响的报道主要以园林植物和草本作物为材料[21],且集中在对植物光合作用影响的研究[22-23],以桉树为材料的此类研究鲜有报道。本研究探讨酸雨胁迫对桉树抗逆生理及APX-类基因转录活性的影响,探究植物应对酸雨胁迫的反应机理,为酸雨污染的评估与防治提供参考。
1 材料与方法
尾叶桉1月龄无性系幼苗,栽种于250 mL轻型基质(V(蛭石)∶V(泥炭土)=1∶1)中,自然光照。缓苗5 d期间用1 g·L-1的复合肥水溶液浇灌,缓苗后选取长势基本一致的盆栽苗25盆,随机分为5组,每组5盆,进行人工酸雨喷雾和灌根处理。
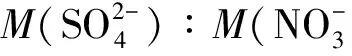
光合参数测定:光合参数利用Li-6400光合测定仪在晴天的09:00—11:00测定净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,μmol·m-2·s-1)、气孔导度(Gs,mol·m-2·s-1)和胞间二氧化碳摩尔分数(Ci,μmol·mol-1),并计算叶片水分利用效率(WU,E=Pn/Tr)。叶绿素质量分数测定采用乙醇浸泡法测定[27]。丙二醛质量摩尔浓度的测定采用硫代巴比妥酸比色法[28]。电导率的测定使用电导仪法[29]。
酶活性测定:称取0.2 g叶片,加入2.0 mL磷酸缓冲液(50 mmol·L-1,pH值7.8)冰浴匀浆,4 ℃,10 000 r·min-1离心15 min得上清为酶液。酶液蛋白质浓度采用考马斯亮蓝法测定[30]。SOD活性测定采用氮蓝四唑法,POD活性测定采用愈创木酚法,CAT活性测定采用紫外吸收法[28]。
RNA提取及反转录:取50 mg去中脉叶片,于冰浴中用1 mL RNAiso-mate for Plant Tissue匀浆。按RNAiso Plus试剂说明书步骤提取总RNA,并用Nanodrop 2 000 c和1.2%琼脂糖电泳检测总RNA质量和浓度。参考Huang et al.[31]的方法进行反转录,得到cDNA,备用。所用试剂均为宝生物工程(大连)有限公司产品。
目的基因选择及引物设计:从GenBank中检索得到7个APX-基因,并用primer3plus设计qPCR引物,以RTEF基因为内参基因[32]。引物序列见表1。

表1 7种APX-基因及内参基因的荧光定量PCR引物序列
qPCR扩增:取cDNA于Chromo 4TMSystem(Bio-Rad)中进行qPCR,各反应体系均为25 μL(SYBR Premix Ex TaqTMⅡ〔TliRNaseH Plus〕〔2×Conc〕12.5 μL,10 μmol·L-1Primer F和Primer R各1 μL,ddH2O 8.5 μL,稀释后的cDNA模板2 μL)。参考黄真池等[33]方法进行扩增,采用相对定量的Pfaffl法[34],计算各基因不同值酸雨处理后的相对表达值。
2 结果与分析
2.1 不同pH值酸雨处理后尾叶桉抗逆生理指标的变化
轻度酸雨(pH值5.6)胁迫下,净光合速率和气孔导度先呈下降趋势;当酸雨加重至中度(pH值4.0),气孔导度几乎不变,但净光合速率继续下降;当胁迫达到重度(pH值2.5),净光合速率与气孔导度均升高,其中气孔导度达到最大值;当pH值2.0时,气孔导度与净光合速率均下降至最小值。蒸腾速率在pH值5.6时有最小值,后呈上升趋势,在pH值2.5时有最大值,后下降。胞间二氧化碳摩尔分数随pH值的下降不断升高,在pH值2.5时有最大值。水分利用效率则随pH值的下降而不断下降,在pH值2.5时有最小值,但在pH值2.0时小幅上升(表2)。
随着酸雨的加重,叶绿素质量分数出现小幅度的波动,但无显著性差异;丙二醛质量摩尔浓度和相对电导率呈上升趋势,且随着pH值的下降其上升速率越来越大;酸雨会导致尾叶桉的膜脂过氧化,损伤生物膜结构,对植物的伤害与pH值的下降呈显著的正相关(表2)。
酸雨处理影响尾叶桉保护酶的活性(表2)。随着酸雨强度的增大,SOD、POD、CAT活性均呈上升趋势,当酸雨达到重度(pH值2.0)时,SOD的活性较对照显著上升了1.28倍,POD上升了2.83倍,CAT上升了1.77倍,3种保护酶的活性显著升高(P<0.05)。
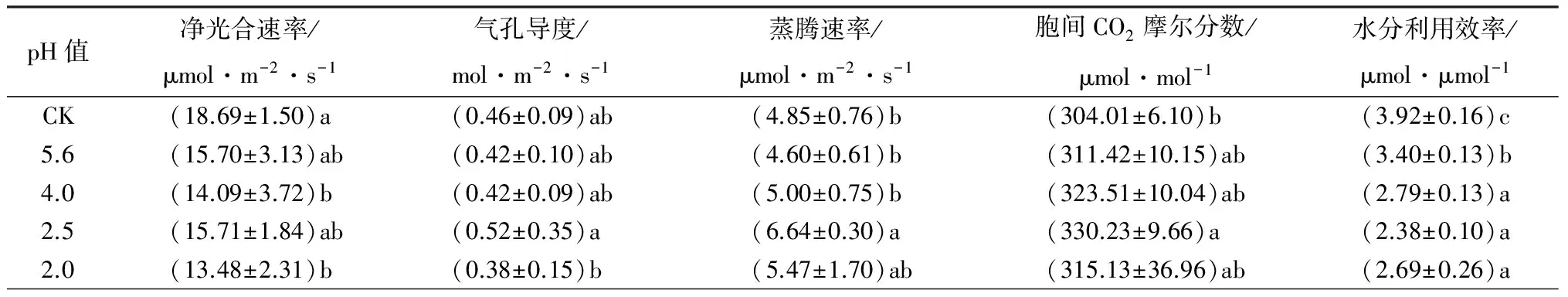
表2 酸雨胁迫后尾叶桉抗逆生理指标变化
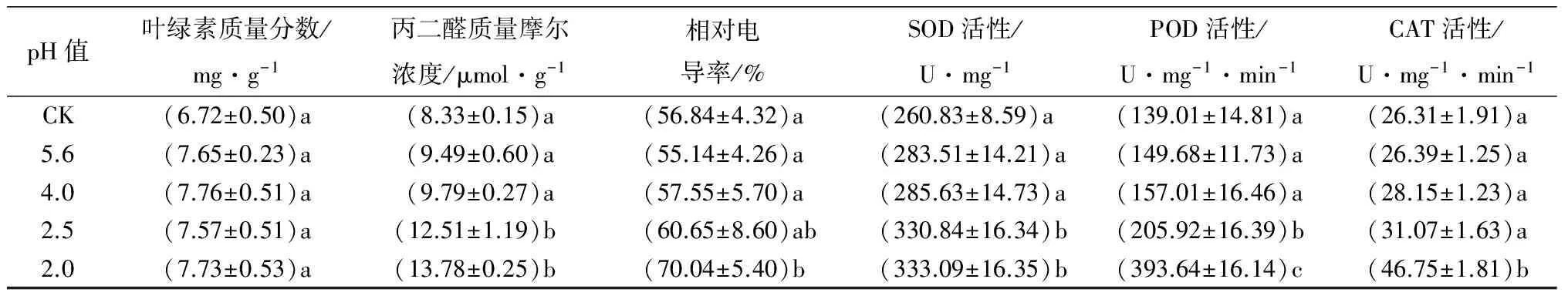
pH值叶绿素质量分数/mg·g-1丙二醛质量摩尔浓度/μmol·g-1相对电导率/%SOD活性/U·mg-1POD活性/U·mg-1·min-1CAT活性/U·mg-1·min-1CK(6.72±0.50)a(8.33±0.15)a(56.84±4.32)a(260.83±8.59)a(139.01±14.81)a(26.31±1.91)a5.6(7.65±0.23)a(9.49±0.60)a(55.14±4.26)a(283.51±14.21)a(149.68±11.73)a(26.39±1.25)a4.0(7.76±0.51)a(9.79±0.27)a(57.55±5.70)a(285.63±14.73)a(157.01±16.46)a(28.15±1.23)a2.5(7.57±0.51)a(12.51±1.19)b(60.65±8.60)ab(330.84±16.34)b(205.92±16.39)b(31.07±1.63)a2.0(7.73±0.53)a(13.78±0.25)b(70.04±5.40)b(333.09±16.35)b(393.64±16.14)c(46.75±1.81)b
注:表中数据为平均值±标准差;表中数据根据植物鲜质量测得;同列不同字母表示差异显著(P<0.05)。
2.2 不同pH值酸雨处理后尾叶桉APX-类基因的转录水平的变化
酸雨处理后,APX-基因的转录整体都随着酸雨的程度加深(pH值的下降)而升高,但在中等强度(pH值4.0)时转录水平出现最小值,后随着酸雨的程度加深而显著升高(表3)。其中重度酸雨(pH值2.0)胁迫时,7种APX-基因(APX1、2、3、5、6、9、10)的转录水平分别为对照的1.76、2.65、3.68、7.34、0.58、1.82、1.46倍,其中6种(APX1、2、3、5、9、10)基因的转录水平较对照显著提高,但APX6基因却低于对照。各APX-基因的转录活性均有其独特性和差异性。
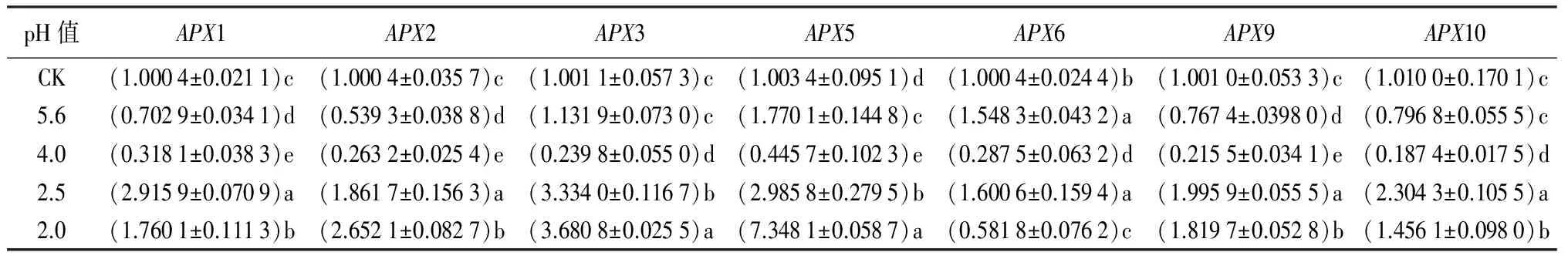
表3 不同pH值酸雨处理后尾叶桉APX-类基因的转录水平的变化
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05)。
3 结论与讨论
酸雨处理后,尾叶桉的光合作用受到抑制。其净光合作用速率和蒸腾速率下降,但气孔导度和胞间二氧化碳摩尔分数上升,说明是非气孔限制因素抑制光合作用[35]。同时,尾叶桉的水分利用效率降低,一定程度上也使光合作用受阻[36]。丙二醛质量摩尔浓度和相对电导率显著上升说明酸雨会破坏尾叶桉的ROS代谢平衡,产生大量的过氧化物使其生物膜系统过氧化,也可能使细胞的光合机构受损,影响光系统及电子传递链的正常运转,抑制光合作用[37-38],且酸雨的强度越大,其抑制越显著。
酸雨处理后,尾叶桉SOD、POD、CAT的活性随酸雨强度的增大而显著上升。酸雨胁迫会破坏细胞内的ROS代谢平衡,保护酶系统积极应答[39],上述3种保护酶的活性显著上升以清除多余的ROS,维持该代谢平衡[40]。其中,POD的活性上升最为显著,POD的功能具有两面性,既可以高效清除ROS,也可以在hydroxylic cycle中催化ROS的形成[41],但在外界引起的ROS代谢异常中,其功能主要表现在清除多余的ROS方面。酸雨处理后,7种APX-基因中有6种的转录水平随着酸雨强度的增大而升高,在pH值2.5或pH值2.0时转录水平最高,但都在pH值4.0时转录水平最低。该现象说明pH值4.0是一个转折点,pH值>4.0时酸雨破坏ROS代谢平衡的程度较小,当pH值<4.0时,ROS平衡失衡严重,需要更多APX清除ROS。但APX6基因在pH值4.0和pH值2.0时的转录水平均低于对照,说明了APX的表达机制非常复杂[42],这种现象的发生可能与APX-基因家族在细胞内的分布、表达场所和响应机制的不尽相同有关。
对比尾叶桉的抗逆生理及APX-类基因的转录水平的变化,可发现两者存在一定的相关性。酸雨胁迫使尾叶桉的ROS代谢紊乱,抗逆生理方面,保护酶系统积极响应,SOD、POD、CAT等的活性随着胁迫的增大而显著提升;转录方面,7种APX-基因总体的转录水平均随着胁迫强度的增大而上升,和抗逆生理方面形成对应关系。
本研究表明,酸雨会抑制尾叶桉的光合作用,引起ROS(reactive oxygen species)代谢失衡,导致膜脂过氧化;SOD、POD、CAT三者活性的增强,APX-类基因表达的上调是尾叶桉应对酸雨胁迫的保护机制;抗逆生理和APX-类基因的转录水平存在对应关系。本研究可为植物对酸雨胁迫的响应机制研究及对林业酸雨防治提供参考。
[1] 杨昂,孙波,赵其国.中国酸雨的分布、成因及其对土壤环境的影响[J].土壤,1999(1):13-18.
[2] 花日茂,李湘琼.我国酸雨的研究进展(综述)[J].安徽农业大学学报,1998,25(2):206-210.
[3] 彭靖.广东省能源结构与大气污染分析[J].广东科技,2003(7):58-59.
[4] 冯宗炜.酸雨对生态系统的影响[M].北京:中国科学技术出版社,1993.
[5] 汪赛,伊力塔,余树全,等.模拟酸雨对青冈光合及叶绿素荧光参数的影响[J].应用生态学报,2014,25(8):2183-2192.
[6] 冯丽丽,姚芳芳,王希华,等.低硫氮比酸雨对亚热带典型树种气体交换和质膜的影响[J].生态学报,2011,31(7):1911-1917.
[8] VELIKOVA V, YORDANOV I, EDREVA A. Oxidative stress and some antioxidant systems in acid rain-treated bean plants: protective role of exogenous polyamines[J]. Plant Science,2000,151(1):59-66.
[9] LI Y H, YAN C L, LIU J C, et al. Effects of lanthanum on the redox systems in plasma membranes ofCeriumequisetifoliaseedlings under acid rain stress[J]. Journal of RareEarths,2003,21(5):577-581
[10] LIU E U, LIU C P. Effects of simulated acid rain on the antioxidative system inCinnamomumphilippinenseseedlings[J]. Water, Air, & Soil Pollution,2011,215(1/2/3/4):127-135.
[11] DAT J, VANDENABEELE S, VRANOVE, et al. Dual action of the active oxygen species during plant stress responses[J]. Cellular and Molecular Life Sciences CMLS,2000,57(5):779-795.
[12] TSUKAGOSHI H, BUSCH W, BENFEY P N. Transcriptional regulation of ROS controls transition from proliferation to differentiation in the root[J]. Cell,2010,143(4):606-616.
[13] WELINDER K G. Superfamily of plant, fungal and bacterial peroxidases[J]. Current Opinion in Structural Biology,1992,2(3): 388-393.
[14] ROXAS V P, LODHI S A, GARRETT D K, et al. Stress tolerance in transgenic tobacco seedlings that overexpress glutathione S-transferase/glutathione peroxidase[J]. Plant and Cell Physiology,2000,41(11):1229-1234.
[15] ZHAI C Z, ZHAO L, YIN L J, et al. Two wheat glutathione peroxidase genes whose products are located in chloroplasts improve salt and H2O2tolerances in Arabidopsis[J]. PloS One,2013,8(10):e73989.
[16] SHIGEOKA S, ISHIKAWA T, TAMOI M, et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany,2002,53(372):1305-1319.
[17] BAXTER A, MITTLER R, SUZUKI N. ROS as key players in plant stress signalling[J]. Journal of Experimental Botany,2014,65(5):1229-1240.
[18] 祁述雄.中国桉树[M].2版.北京:中国林业出版社,2002.
[19] 欧阳乐军,沙月娥,黄真池,等.广州一号桉树高效组培再生体系的建立[J].东北林业大学学报,2012,40(7):14-17.
[20] 吴博.中国桉树发展概论[C]//中国林学会桉树专业委员会.国际桉树学术研讨会论文集.北京:中国林业出版社,1992:13-22.
[21] 王强,金则新,彭礼琼.模拟酸雨对乌药幼苗生理生态特性的影响[J].浙江大学学报(理学版),2013,40(4):447-448.
[22] 王雯,李曼,王丽红,等.酸雨对全生育时期水稻叶绿素荧光的影响[J].生态环境学报,2014,23(1):80-85.
[23] 胡月,张倩,孙东彬,等.模拟酸雨对桑树叶片光合日变化的影响[J].草业科学,2015(11),1862-1870.
[24] 樊琦,范绍佳,钟流举,等.华南地区典型酸雨过程气象条件的数值模拟[J].中国环境科学,2008,28(3):279-283.
[25] 秦鹏,杜尧东,刘锦銮,等.广东省酸雨分布特征及其影响因素[J].热带气象学报,2006,22(3):297-300.
[26] 吴晓燕,张胜东,王海,等.湛江市酸雨变化趋势及防治对策[J].太原师范学院学报(自然科学版),2010,9(1):139-141.
[27] 王晓荣,胡兴宜,唐万鹏,等.模拟长江滩地水淹胁迫对3种树种幼苗生理生态特征的影响[J].东北林业大学学报,2015,43(1):45-49.
[28] 蔡庆生.植物生理学实验[M].北京:中国农业大学出版社,2013.
[29] 姚侠妹,张瑞娥,偶春,等.外源5-氨基乙酰丙酸对盐胁迫下栀子幼苗生理特性的影响[J].东北林业大学学报,2015,43(4):37-41.
[30] 曾富华.生物化学实验技术教程[M].北京:高等教育出版社,2011.
[31] HUANG Z, OUYANG L, LI Z, et al. A urea-type cytokinin, 2-Cl-PBU, stimulates adventitious bud formation ofEucalyptusurophyllaby repressing transcription of rboh1 gene[J]. Plant Cell, Tissue and Organ Culture (PCTOC),2014,119(2):359-368.
[32] 黄真池,欧阳乐军,张龙,等.桉属植物内参基因的筛选及评估[J].西北农林科技大学学报(自然科学版),2013,41(10):67-72.
[33] 黄真池,彭信海,欧阳乐军.冷处理下3种桉树过氧化物酶基因的转录变化[J].东北林业大学学报,2015,43(10):30-34.
[34] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research,2001,29(9):e45.
[35] FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology,1982,33(1):317-345.
[36] 王美云,李少昆,赵明.关于玉米光合作用与叶片水分利用效率关系的研究[J].作物学报,1997,23(3):345-352.
[37] 魏国强,朱祝军,方学智,等.NaCl胁迫对不同品种黄瓜幼苗生长,叶绿素荧光特性和活性氧代谢的影响[J].中国农业科学,2004,37(11):1754-1759.
[38] 赵丽英,邓西平,山仑.活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[39] 张仁和,郑友军,马国胜,等.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J].生态学报,2011,31(5):1303-1311.
[40] 吴建慧,杨玲,孙国荣.低温胁迫下玉米幼苗叶片活性氧的产生及保护酶活性的变化[J].植物研究,2004,24(4):456-459.
[41] MAZORRA L M, HOLTON N, BISHOP G J, et al. Heat shock response in tomato brassinosteroid mutants indicates that thermotolerance is independent of brassinosteroid homeostasis[J]. Plant Physiology and Biochemistry,2011,49(12):1420-1428.
[42] 李泽琴,李静晓,张根发.植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J].遗传,2013,35(1):45-54.
Effect of Physiological Indexes of Stress-resistance and Transcriptional Levels ofAPX-genes atEucalyptusurophyllaunder Acid Rain Stress//
Huang Junwen, Huang Zhenchi, Zeng Caiping, Xie Guanyan, Pang Hengsheng
(Lingnan Normal University, Zhanjiang 524048, P. R. China)//
Journal of Northeast Forestry University,2017,45(5):35-38.
With one-month-old seedlings ofEucalyptusurophyll, we studied the effect of acid rain on photosynthetic physiology and ROS metabolism by treating with simulative acid rain (pH 5.6, 4.0, 2.5, 2.0) for 15 d. Then, we detected the physiology indexes related to photosynthetic physiology and ROS metabolism, and evaluated the transcriptional levels of sevenAPX-genes by real-time quantitative PCR. The chlorophyll content didn’t show obvious change, and the net photosynthetic rate, transpiration rate and water use efficiency were decreased. The malondialdehyde content and conductivity were increased sharply. The activities of protective enzymes, including superoxide dismutase, peroxidase and catalase were increased significantly and arrived to the peak at pH 2.0. The transcription activities ofAPX1,APX2,APX3,APX5,APX6,APX9, andAPX10 were 1.76, 2.65, 3.68, 7.34, 0.58, 1.82 and 1.46 times higher than the control (transcription level of the reference gene normalized to 1), respectively. The acid rain inhibited photosynthesis, caused ROS metabolism imbalances, and led to membrane lipid peroxide. The raise of protective enzymes activities andAPX-genes transcription strengthened the resistance to acid rain atEucalyptusspecies. The physiological indexes of stress-resistance and the transcriptional levels ofAPX-genes had some relationships under the stress of acid rain.
Acid rain;Eucalyptusurophylla; Stress-resistance;APX-genes; Transcription
1)国家自然科学基金项目(31570660)、广东省自然科学基金项目(2014A030307005;2015A030313560;2016A030313668)、湛江市科研项目(2014A03014)和大学生创新创业项目(201610579358)。
黄俊文,男,1994年11月生,岭南师范学院生命科学与技术学院,本科生。E-mail:junwenH.yeah.net。
黄真池,岭南师范学院生命科学与技术学院,副教授。E-mail:zjyzhzc@163.com。
2016年11月27日。
Q945.78
责任编辑:任 俐。
