生物絮团对鲤鱼养殖池塘浮游植物群落结构的影响
2017-06-05杨希李涛白海锋高志袁永锋贾秋红
杨希+李涛+白海锋+高志+袁永锋+贾秋红+高宏伟

摘要:为了解生物絮团技术在净化池塘水质的同时对池塘初级生产力的影响,于2015年9月-10月对陕西团头鲂良种场鲤鱼池塘的浮游植物群落结构进行了调查研究。结果显示:生物絮团池塘共出现浮游植物6门28种,其中绿藻门有17种,占总种类数的65.4%,硅藻门有5种,占总种类数的19.2%,浮游植物群落结构类型属绿藻-硅藻型。浮游植物生物密度变化范围为1 372.82×104~3 093.71×104ind./L,平均值为2 217.07×104 ind./L;生物量变化范围为3.53~12.87 mg/L,平均值为7.88 mg/L。浮游植物生物密度和生物量均在9月15日出现峰值,峰值期以后浮游植物密度和生物量在时间和空间上差异性显著(P<0.05)。研究表明,生物絮团技术对池塘浮游植物群落结构影响较大,随着絮团的逐渐形成浮游植物群落结构出现明显变化,池塘藻相演替速度加快。
关键词:生物絮团;鲤鱼;浮游植物;群落结构
生物絮团技术是一种新型养殖技术,通过向养殖水体中补充有机碳源,调整碳氮比,使水体中的异养微生物通过同化作用吸收水中氨氮、亚硝酸氮等物质,从而达到净化水质的效果。而微生物的大量繁殖过程絮凝了水中的丝状藻类、原生动物、有机碎屑等物质形成絮状物,这种生物絮团又可作为饵料蛋白,使蛋白得到二次利用,从而节省了成本,提高了养殖效益[1]。生物絮团因具有调节水质、减少病害发生、提高饲料蛋白利用率、降低养殖成本以及提高养殖动物消化和免疫性能等优点被广泛应用于生产实践[2]。目前,对于生物絮团技术在水产养殖上的应用研究较多[3-5],但是对其在养殖过程中的应用对浮游植物的影响研究未见报道。浮游植物是水生态系统中重要的初级生产者,是食物链中最低营养级,在决定水域生产性能上具有重要意义。浮游植物的种类组成、生物量、多样性等特征与水环境之间关系密切,浮游植物对水质变化比较敏感,常常被用作水环境质量一项重要评价指标,水质的变化直接影响浮游植物群落结构的演替方向[6]。本研究通过对生物絮团池塘浮游植物群落的研究,科学地评价其生态环境状况,以期为提高生物絮团在池塘养殖中的生态效应,促进池塘生态养殖技术推广提供理论数据。
1材料与方法
1.1试验池塘
试验池塘选择在西安草滩渭河南岸养殖区。池塘长方形,东西走向,日照充足,池壁用混凝土护坡,池底存有10 cm淤泥。池塘面积0.4 hm2,水深1.6 m。池塘主养鲤鱼,规格为500~1 000 g/尾,养殖密度为15 000~22 500尾/hm2,池塘中混养少量鲢鱼和鲫鱼。池塘水源为深井水,池塘配有微孔增氧设备。
1.2试验方法
1.2.1试验设计
生物絮团采用鲤鱼池塘原池培养,根据鲤鱼每天的投饲量,全池泼洒饲料级蔗糖,维持池塘水体中碳氮比(C/N)为20∶1,定期(7~10 d)泼洒枯草芽孢杆菌。试验期间间断性开启微孔增氧设备,维持水体溶解氧不低于5.0 mg/L。试验设置对照组,对照组和实验组各设置两个平行池塘。试验期间不换水,仅根据池塘水位适当添加新水,以弥补蒸发和渗漏引起的水分损失。在日常管理中,试验塘和对照塘尽量做到一致,避免因池塘管理造成的误差。
1.2.2样品采集与鉴定
浮游植物样品采集方法参照《湖泊生态调查观测与分析》[7]。依据池塘情况,每5 d采样一次,同时监测池塘水质,采样时间选择在上午8:30-9:30,采样地点设置在池中央和池边。水样用5 000 mL有机玻璃采水器在水面下50 cm处采水样1 000 mL,现场用鲁哥氏液(加入量1%~1.5%)进行固定,固定好的样本随后带回实验室静置24 h,用虹吸管浓缩至50 mL。依据相关参考文献[8-10],在生物显微镜(放大倍数×400~×1 000)下鉴定种类并计数。
1.3数据处理与分析
浮游植物生物密度计算公式:
N=(V1 ×n)/(V×V2 )[11]
式中: N为1 000 mL水样中浮游植物个体数(ind./L);V1为水样沉淀浓缩后的体积(L);
n为计数所得的藻类个体数(ind.);V为采集到水样的体积(1 000 mL);V2为计数体积(L)。
浮游植物生物量依据藻类种类湿重换算统计。
试验数据采用SPSS 19.0软件包进行数据统计分析。生物絮团池与对照池,以及生物絮团池塘不同时间的浮游植物平均密度、平均生物量的比较均采用单因素方差分析进行。
2结果与分析
2.1水质指标
试验期间,生物絮团池塘水温变化范围为23.6~26.7 ℃,呈现随气温逐渐下降的趋势;透明度变化范围为22~35 cm,随时间的推移呈下降趋势;pH变化幅度为6.8~7.7,溶解氧为662~9.33 mg/L,电导率为803~875 μs/cm,三者保持较稳定状态;氨氮含量为0.406~2.162 mg/L,亞硝酸氮为0.066~0.242 mg/L,两者表现出先升高后下降的波动趋势。从整体来看,在时间尺度上,除氨氮和亚硝酸氮外,其余水质指标无显著性差异(P>0.05)。对比对照池塘,生物絮团池塘透明度、氨氮、亚硝酸氮三项指标差异显著(P<0.05)。
2.2浮游植物群落结构
生物絮团池塘和对照池塘在试验期间共鉴定出浮游植物6门30种。其中绿藻门20种,占总种类数的66.7%;硅藻门有5种,占16.7%;其他门共占16.6%,分别为蓝藻门2种,隐藻门1种,甲藻门1种,裸藻门1种(见图1)。生物絮团池塘浮游植物以绿藻门和硅藻门为主,其次是蓝藻门,藻相呈绿藻-硅藻型。对照池塘以绿藻门和蓝藻门为主,其次是硅藻门,藻相呈现绿藻-蓝藻型。两组池塘在种类数上差异不显著(P>005),变化范围为21~30种,种类总体呈逐渐上升的趋势。
从时间尺度上看,生物絮团池塘浮游植种类变化呈现波浪型,在試验第15 d(9月15日)出现高峰值(28种),其中绿藻门17种,占总种类数的654%,硅藻门5种,占19.2%,而在试验结束时(10月1日)出现低谷值(21种)。在时间尺度上,生物絮团池塘浮游植物种类数存在显著性差异(P<0.05),对照池差异不显著(P>0.05)(图2)。
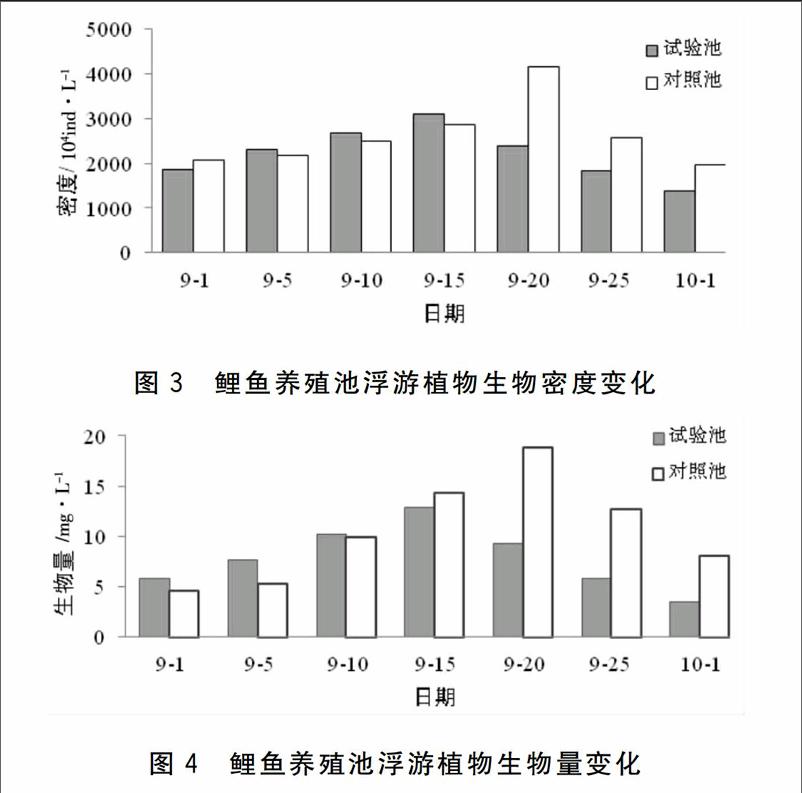
试验期间生物絮团池塘和对照池塘浮游植物密度均呈先升后降的趋势,生物絮团池塘7月15日密度达到最大值,显著高于其他时间(P<005),而对照池塘密度高峰期出现9月20日(见图3)。生物絮团池塘浮游植物生物密度平均值为2 217.07×104 ind./L,在时间上的变化范围为1 372.82×104~3 093.71×104 ind./L;对照池塘浮游植物密度平均值为2 610.55×104 ind./L,变化范围在1 965.23×104~4 156.88×104 ind./L。两者密度均值差异不显著(P>0.05),但是从9月15日以后,两者浮游植物密度在时间尺度上出现显著性差异(P<0.05)。
从图4可见,试验期间试验池塘和对照池塘浮游植物生物量的变化趋势与密度基本一致。试验池塘浮游植物生物量范围在3.53~12.87 mg/L之间,平均值为7.88 mg/L。对照池塘的生物量在9月20日出现最高值,为18.85 mg/L,此后一直降低,试验结束时生物量显著降低,出现最低值,为4.62 mg/L(P<0.05)。从时间上来看,试验池塘和对照池塘生物量在9月15日之前无显著性差异(P>0.05),9月20日之后出现显著性差异(P<0.05)。
3讨论
浮游植物是水生态系统的初级生产者,能通过食物链将营养物质传递到更高营养层,对生态系统的物质循环和能量流动起到积极的推动作用[12]。浮游植物的群落结构以及光合作用受到养殖水环境的影响巨大,这些环境因子包括水温、透明度、氮、磷以及养殖动物等。
氮、磷是生命组织中的必需元素,对浮游植物来说,适量的氮、磷能促进其生长。有研究显示,通常情况下水中的浮游植物在吸收氮元素时,氨氮优先于其他氮形式,并且氨氮的含量往往直接影响浮游植物的生长[13]。在一定范围内浮游植物生物密度随着N/P的升高而增加,一旦远离正常比值(16)时,浮游植物的生长繁殖将受到抑制[14]。从本试验可以看出,生物絮团池塘的浮游植物的种类数、生物密度和生物量均在9月15日之后开始降低或减少,而对照组这种下降点则延迟了一段时间。这种差异分析认为,生物絮团一般从开始形成到成熟需要10~15 d的时间[15],在这段时间里水体中的氨氮、亚硝酸氮含量变化不大,当生物絮团系统处于稳态后,其对池塘水中氨氮和亚硝酸氮的去除率逐渐增大,导致池塘中可供浮游植物生长所需的营养元素减少,从而使浮游植物在试验中后期出现渐减的现象。
生物絮团技术的应用需要充足的溶解氧,因此在实施过程中需要不断地充气搅水,使生物絮团悬浮于水中,以方便鱼类摄食,另一方面防止絮团下沉。调查发现,在试验池由于生物絮团的悬浮导致水体透明度相比对照池降低,从而影响了浮游植物的光合作用。有研究表示[16],透明度是影响水体中浮游植物种类和数量变化的重要因素之一。此外透明度能够直观反映水体中的悬浮物数量,其与浮游植物生物量成负相关[17]。本试验发现,由于透明度和水温的变化影响,试验池塘浮游植物群落结构发生了变化,藻相从喜温、适宜较高透明度的绿藻-蓝藻型演变到适应新环境的绿藻-硅藻型。
以上研究表明,生物絮团技术在鲤鱼养殖过程中对水中氨氮和亚硝酸氮的去除以及水质净化具有显著效果。但是其对养殖水体浮游植物群落结构也存在显著影响,尤其对池塘浮游植物的光合作用影响较大,众所周知,池塘养殖水体中的溶解氧绝大部分来源于水体浮游植物光合作用。因此,在水产养殖中积极应用推广生物絮团技术时,合理地控制生物絮团生物量和有效的管理模式是生物絮团技术生态高效养殖模式的关键,也是今后研究的主要方向。
参考文献:
[1]
罗文,王广军,龚望宝,等.生物絮团技术对彭泽鲫生长及养殖水质的影响[J].南方农业学报,2014,45(2):318-322
[2] 白海锋,袁永锋,贾秋红,等.生物絮团对养鱼池塘水质净化效果试验[J].水产养殖,2015,(9):32-33
[3] 邓应能,赵培,孙运忠,等.生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果[J].渔业科学进展,2012,33(2):69-75
[4] 李朝兵,王广军,余德光,等.生物絮团对鳙生长、肌肉氨基酸成分及营养评价的影响[J].江苏农业科学,2012,40(11):242-245
[5] 夏耘,邱立疆,郁二蒙,等.生物絮团培养过程中养殖水体水质因子及原核与真核微生物的动态变化[J].中国水产科学,2014,21(1):75-83
[6] 刘冬艳,孙军,张利永.胶州湾浮游植物水华期群落结构特征[J].应用生态学报,2003,14(11):1963-1966
[7] 黄祥飞.湖泊生态调查观测与分析[M].北京:中国标准出版社,1999
[8] 周凤霞,陈剑虹.淡水微型生物与底栖动物图谱[M].4版.北京:化学工业出版社,2011
[9] 韩茂森,束藴芳.中国淡水生物图谱[M].北京:海洋出版社,1995
[10] 梁象秋,方纪祖,杨和荃.水生生物学(形态和分类)[M].北京:中国农业出版社,1996
[11] 赵文.水生生物学[M].北京:中国农业出版社,2005
[12] 贾秋红,陈晓霞,王博涵,等.异育银鲫苗种培育池塘浮游植物群落结构动态变化[J].河北渔业,2016(1):9-11
[13] 刘峰,高云芳,王立欣,等.水域沉积物氮磷赋存形态和分布的研究进展[J].水生态学杂志,2011,32(4):137-144
[14] Schanz F, Juon H. Two different methods of evaluating nutrient limitation of periphyton bioassays,using water from the River Rhine and eight of its tributaries[J]. Hydrobiologia,1983,102:187-195
[15] 李志斐,王广军,余德光,等.生物絮团对养殖水体水质和微生物群落功能的影响[J].上海海洋大学报,2015,24(4):503-512
[16] 蒋嫣红,程婧蕾,王丽卿.公园水体浮游植物与环境因子的关系[J].生态学杂志,2012,31(3):606-613
[17] 何志辉,李永涵.无锡市河埒口高产鱼池水质的研究Ⅱ.浮游生物[J].水产学报,1983,7(4):287-298
