土壤中可降解LDPE菌株的分离诱变及相关研究
2017-06-05杨佳雯苏春阳刘佩勇
李 颖,杨佳雯,苏春阳,余 辉,刘佩勇
(东北大学生命科学与健康学院,沈阳 110169)
土壤中可降解LDPE菌株的分离诱变及相关研究
李 颖,杨佳雯,苏春阳,余 辉,刘佩勇
(东北大学生命科学与健康学院,沈阳 110169)
聚乙烯塑料由于经济方便及稳定性良好,被广泛应用于国民经济和人类生活的各个方面,同时其也带来了严重的“白色污染”。本次实验主要通过采集垃圾场不同深度的塑料袋周围土壤,并从中分离提取出可降解低密度聚乙烯(LDPE)的菌株,再进行诱变处理,经过初筛、复筛后,以特制的堆肥装置检验其降解LDPE的能力,最终筛选出降解能力最强的菌株。本次实验有望发现并改造出降解LDPE的新型微生物,以期为建设绿色生态型社会提供一定参考。
生物降解;LDPE;土壤菌株;诱变育种;相关研究
聚乙烯塑料为人类生活中最常见的材料之一,但由于塑料对化学试剂和自然环境中生物攻击的不敏感性[1],导致了塑料垃圾的堆积及海洋环境与土壤环境的污染[2-4],带来了严重危害生态环境的“白色污染”。废弃的聚乙烯得不到有效处理,长期堆积造成的多样危害性主要体现在“视觉污染”和“潜在污染”上[5]。
长久以来,世界各国都在致力于对聚乙烯类塑料废品处理方式的研发,其中生物降解塑料的研发更是解决环境污染问题的关键所在[6]。现阶段,对生物降解聚乙烯高分子材料的研发方向重点朝四个方面拓展[7]。为了更好地处理聚乙烯制品,本实验研究了具有LDPE降解活力的土壤菌株,并成功从土壤中分离出了两种可降解LDPE菌株,进行培养条件的优化和突变育种,最终筛选出降解能力最优的菌株。这对于有效处理废弃聚乙烯高分子材料、实现碳的循环利用及改善生态环境具有十分重要的意义。
1 材料和方法
1.1 低密度聚乙烯
1.2 土壤样品采集及土壤稀释液的制备
从沈阳老虎冲垃圾场取塑料袋表面土层、距土壤表面10 cm、20 cm、30 cm深处的土层一共4份土样(每个土层的土样取3份之后混合),标记深度不同的土样,用40目的土壤筛处理后,去除杂质放入冰箱中保存备用。取每个土层的新鲜土样10 g,制成10-1、10-2、10-3、10-4、10-5系列5个浓度梯度的稀释液并放于4 ℃的冰箱中保存待用。
1.3 实验材料预处理
将LDPE粉末紫外杀菌3 h后,挑取少量灭菌的粉末分别接入牛肉膏蛋白胨培养基、马丁氏琼脂培养基中,在37 ℃下培养2 d (28 ℃下培养7 d)检验消灭真菌的彻底性[8]。
1. 4 可降解聚乙烯土壤菌株的筛选
1.4.1 选择培养
用三角靶接种四个土层、10-1~10-5五个梯度稀释液在基础无碳源琼脂固体培养基[9],其中每份培养基(pH 7.3)含有0.1 g LDPE粉末(Mw=2 000),每个梯度做3个重复,在37 ℃下培养2 d。选出2个长势较好的菌株,接种到含0.1 g LDPE粉末的基础无碳源液体培养基中在37 ℃、150 r·min-1下振荡培养2 d,得到混合液I和II。将混合液I于4 ℃冰箱保存备用。
1.4.2 驯化培养
用三角靶蘸取混合液II中的菌液接种于基础无碳源琼脂固体培养基(pH 6.0)上,每份培养基中加入0.1 g LDPE粉末,在37 ℃下恒温培养2 d。再挑取长出的若干菌落分别接种于基础无碳源液体培养基(pH 6.3)中,每份培养基含0.2 g LDPE粉末,在37 ℃、150 r·min-1的转速下振荡培养2 d,得到混合液。将所有上面培养得到的混合液统称为混合液A。蘸取混合液I、混合液A中的菌液接种于基础无碳源琼脂固体培养基上,于37 ℃下培养2 d。再在基础无碳源琼脂固体培养基上进行划线分离纯化不同菌株,直至每个平板上长出单一的优势菌株。
1.4.3 二次驯化培养
将分离纯化后的菌株分别接种于含0.2 g LDPE粉末的50mL基础无碳源液体培养基中,在37 ℃下静置培养2 d,在此期间持续补充新鲜无菌的培养液。随后蘸取菌液接种于含0.2 g粉末的基础无碳源琼脂培养基中,在37 ℃培养2 d。最后挑取培养基上的菌落接种在马丁氏琼脂培养基斜面上,在4 ℃下冷藏保存备用。
1.5 可能对菌种产生影响的诱变方式
1.5.1 紫外诱变
紫外诱变需在黑暗中进行,其他的操作均在红光下进行。取3 mL二次驯化培养所得的菌悬液于培养皿内,照射时间分别为:10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s(照射距离20 cm),每照射10 s后将菌液搅匀,照射时间累计。将诱变后的菌悬液避光放置1 h,将放置后的菌液涂布进行初筛和复筛[10]。
1.5.2 微波诱变
诱变时将二次驯化培养所得的菌悬液试管插入盛有适量冰水的三角瓶里。在无菌条件下,取3 mL菌悬液装入事先灭菌的试管中并加塞防菌,将盛有冰水的三角烧瓶移入微波炉中进行诱变实验,实验研究诱变功率为700 W的不同诱变时间(40 s、70 s、100 s、130 s、190 s、250 s)作用下微波对菌悬液的诱变效果。
1.5.3 盐酸羟胺诱变
称取水浴灭菌的盐酸羟胺,配制0.2 g· L-1、0.4 g· L-1、0.6 g· L-1、0.8 g· L-1、1.0 g· L-1浓度的盐酸羟胺溶液。取3 mL二次驯化培养所得的菌悬液接入有1%含量的盐酸羟胺PE液体培养基中培养至对数期后,利用分光光度计测量此培养液在OD260处的光密度值,观察菌的生长量,确定盐酸羟胺最佳诱变浓度。
1.5.4 复合诱变
在确定了单因子诱变的最佳诱变剂量后,先后进行盐酸羟胺-微波复合诱变、盐酸羟胺-紫外复合诱变、微波-紫外复合诱变。为研究微波诱变和盐酸羟胺诱变两种诱变剂作用顺序不同对菌株生长情况的影响,以相同的剂量改变诱变剂作用顺序,确定最优诱变顺序。考虑到紫外诱变光复活的可能性较大,故未先进行紫外诱变。
1.6 LDPE粉末的降解实验
实验采用改进后的堆肥装置进行LDPE粉末降解能力的测试。在原有装置[12]的基础上,改造成密闭装置,通过水柱液面变化指示结束时间,解决了原装置堆肥时间不易确定、CO2来源不明、需要进行额外的滴定操作等问题,直接以土壤质量的减少量表征筛选菌株对LDPE粉末的生物降解能力。
准确称取灭菌LDPE塑料粉末样品30 g,按干重比为1∶7加入灭菌后的土壤,加入3 mL二次驯化菌悬液后,混匀装入容积为500 mL的棕色瓶中,将其置于28 ℃的培养箱中进行堆肥实验。整个密闭装置(见图1)靠中间的锥形瓶连通,菌株在右侧的土壤中生长繁殖释放出的CO2用第二个瓶内的NaOH来吸收,进而使装置内气压减小,左侧导管内液面上升,堆肥一定天数后,观察到左侧细口瓶导管中液面无明显变化即可进行取样分析,回收洗涤聚乙烯粉末,干燥后称重。
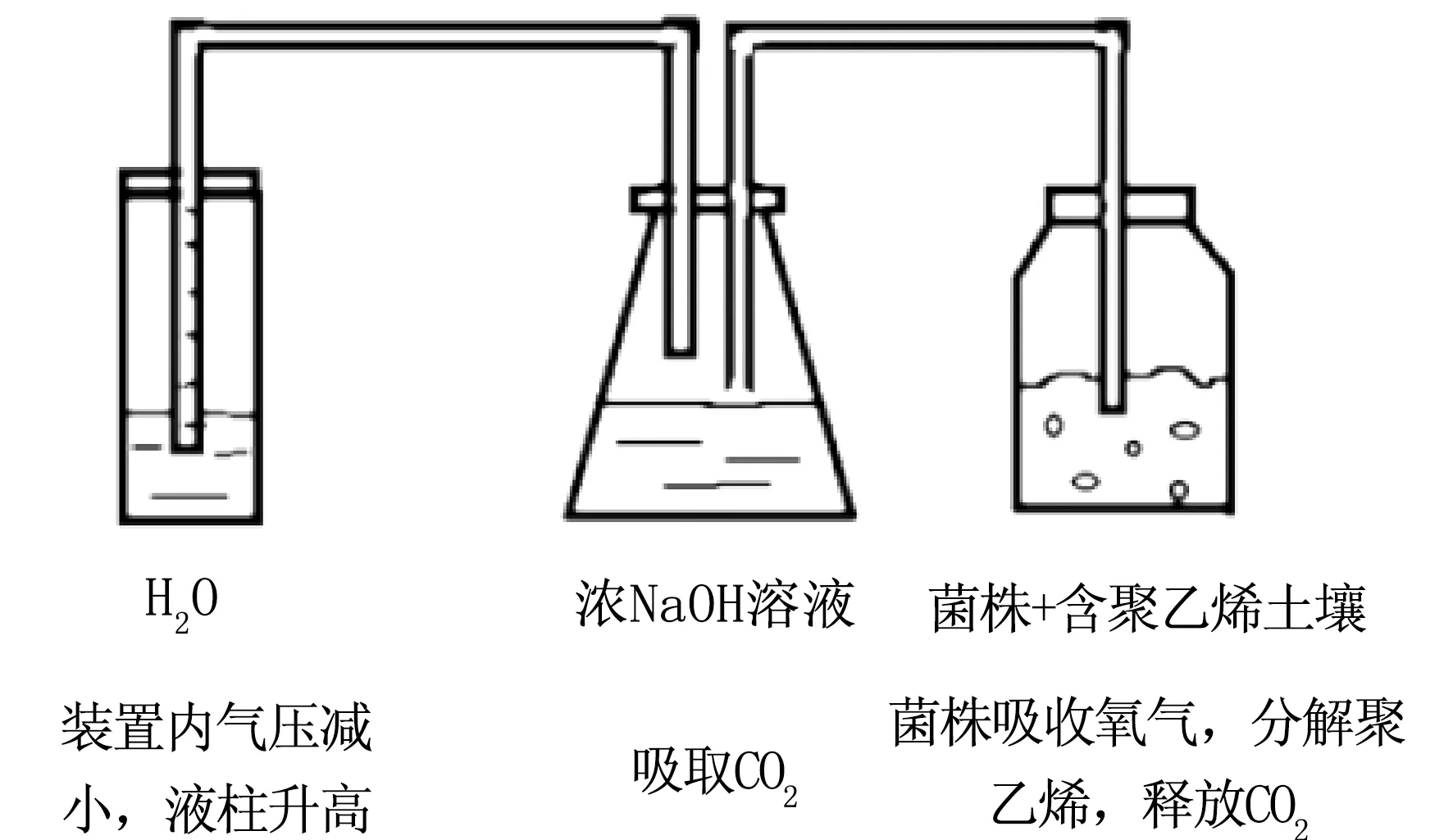
图1 改进后堆肥环境检测菌株对LDPE粉末的降解能力Fig.1 Degradation ability of improved composting environment detection strains on LDPE powder注:装置从右至左依次是:500 mL棕色广口瓶、250 mL锥形瓶和250 mL细口瓶,均用塞子进行密封。其中分别装有待测菌悬液及含LDPE土壤、2 mol·L-1NaOH、200 mL无菌水。
2 结果与分析
2. 1 菌种的提取
经过选择培养、驯化培养和二次驯化培养,初步得到四个土层、五个浓度中的菌株在以LDPE粉末为唯一碳源的基础培养基上的生长情况。经过重复试验,发现许多菌株在不同土层和不同浓度均有生长。考虑到菌落的生长情况及分离的难易程度,实验组选择从距地表20 cm深处的塑料袋附近土壤样品分离出的菌株进行后续试验,且大部分菌株在土壤悬液稀释度为10-5时较易分离提取。
2.2 可降解LDPE土壤菌株的性状特征
本实验从土壤样品中分别成功分离出可在以LDPE粉末为唯一碳源的基础培养基上生长的四种细菌XA-绿、XA-灰、XI-绿、XI-黑(图2~图5)和三种真菌ZI-黑、ZI-粉、ZI-褐(图6~图8)。经过综合对比降解能力后,择优对其中的两种菌株(XA-绿菌株及ZI-粉菌株)进行研究。
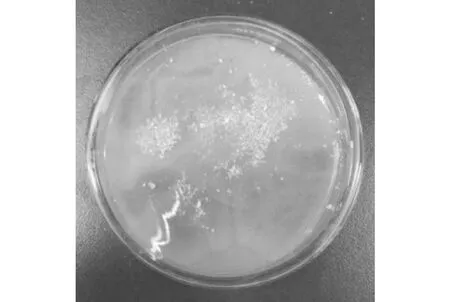
图2 XA-绿菌株*Fig.2 XA-green strain*
图3 XA-灰菌株Fig.3 XA-gray strain

图4 XI-绿菌株Fig.4 XI-green strain

图5 XI-黑菌株Fig.5 XI-black strain

图6 ZI-黑菌株Fig.6 ZI-black strain
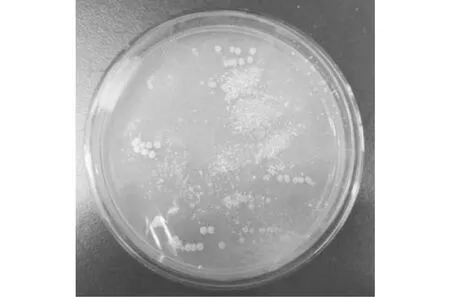
图7 ZI-粉菌株*Fig.7 ZI-powder strain*
图8 ZI-褐菌株Fig.8 ZI-brown strain注:*为所综合对比降解能力后,择优选出的菌种。
XA-绿菌株为革兰氏阳性菌株,菌落呈灰绿色,镜下观察营养菌丝产生发育良好而不易断裂的有分枝的菌丝体,由气生孢子发芽而繁殖。纤细,为多核菌丝。分离时菌落分散成地衣状,发育后期呈绒毛状。具有分生孢子梗和孢子的产生。ZI-粉菌株为革兰氏阳性菌株,菌落表面较干燥前期呈白色,后期呈粉色乃至褐色,有孢子产生。两种菌株均在28 ℃避光条件下对LDPE粉末具有降解能力。
2.3 菌株初步鉴定
通过对菌落形态以及显微镜下对菌丝和菌丝体形态的观察,同时结合《伯杰细菌手册》[11]和《真菌鉴定手册》[12]的相关描述,初步确定XA-绿菌株为细菌界、放线菌门、放线菌纲、放线菌目中的链霉菌科中的链霉菌属;ZI-粉菌株为真核生物界、真菌门、子囊菌纲、半子囊菌亚纲中的酵母目。
2.4 诱变对菌株生长情况的影响
2.4.1 紫外诱变对菌株生长情况的影响
表1为不同时间紫外诱变下的菌株生长状况,由表1可知,ZI-粉菌在紫外诱变40 s和80 s时所长出的菌落个数最多,即生长情况最佳,故初步确定40 s和80 s为ZI-粉菌株最佳紫外诱变剂量,而XA-绿菌株并未见到有菌落生长。
2.4.2 微波诱变对菌株生长情况的影响
进行微波诱变并培养72 h后观察到结果如表2所示,分析可知,ZI-粉菌株和XA-绿菌株在微波诱变250 s时所长出的菌落个数最多,即生长情况最佳,故确定250 s为菌株最佳微波诱变剂量。
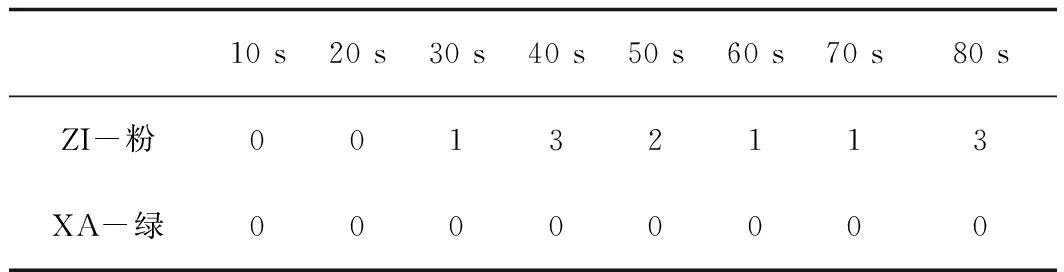
表1 不同时间紫外诱变下的菌株生长状况 培养时间:72 hTab.1 Growth status of strains under UV induction at different times Culture time:72 h
注:“0、1、2、3”表示长有菌株的培养皿个数。

表2 不同时间微波诱变下的菌株生长状况 培养时间:72 hTab.2 Growth status of strains under microwave induction at different times Culture time:72 h
注:“0、1、2、3”表示长有菌株的培养皿个数。
2.4.3 盐酸羟胺诱变对菌株生长情况的影响
将进行盐酸羟胺诱变后的菌液培养72 h,以其在260 nm处的吸光度值反映菌株的生长情况。由图9可知,ZI-粉菌株和XA-绿菌株在0.03 g· L-1盐酸羟胺诱变下的OD260最大,即生长情况最佳,故确定0.03 g· L-1盐酸羟胺为最佳诱变剂量。同时分析得出,在0.03 g· L-1盐酸羟胺诱变下,XA-绿菌株生长状况优于ZI-粉菌株。
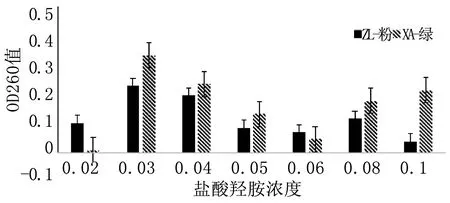
图9 不同浓度盐酸羟胺诱变下的菌株生长状况Fig.9 Growth status of strains at different concentrations of hydroxylamine hydrochloride
2.4.4 复合诱变对菌株生长情况的影响
根据单因子诱变所得的生长最优菌株,进行复合诱变。以吸光度表征突变株生长情况。由表3可知,先经0.03 g· L-1盐酸羟胺诱变、后经250 s微波诱变的ZI-粉菌株和先经250 s微波诱变、后经0.03 g· L-1盐酸羟胺诱变的XA-绿菌株OD260值较大,即生长状况最佳。

表3 复合诱变吸光度的检测 培养时间:72 hTab.3 Detection of complex induced absorbance Culture time:72 h
注:ND为没有数据,因为紫外诱变下并无XA-绿菌株生长。
2.5 不同诱变方式产生的菌株对LDPE粉末的降解情况
以粉末的质量减少[13]表征菌株对LDPE的降解能力,由表4可知,ZI-粉菌株比XA-绿菌株降解能力强。单因子诱变后筛选得到的菌株,降解能力只有小幅提升,而先经0.03 g· L-1盐酸羟胺诱变、后经250 s微波诱变的XA-绿菌株,相同时间内降解同样质量的LDPE效率提升为出发菌株的5.75倍。

表4 不同诱变剂处理后的菌株对LDPE粉末的降解量Tab.4 Degradation of LDPE powders by strains treated with different mutagens
注:1:对照组;2:紫外40 s;3:紫外80 s;4:微波250 s;5:0.03 g/L盐酸羟胺;6:微波250 s+0.03 g/L盐酸羟胺;7:0.03 g/L盐酸羟胺+微波250 s。
ND为没有数据,因为紫外诱变下并无XA-绿菌株生长。而复合诱变则根据菌株生长情况只对XA-绿菌株进行了检测,故没有ZI-粉菌株的相关数据。
3 结论与展望
本次研究通过对低密度不含任何添加物的纯聚乙烯粉末降解微生物的分离、筛选、鉴定以及其降解特性的研究,最终从垃圾场土壤中分离出了2株低分子量的聚乙烯降解菌,其中ZI-粉属于真菌门,为真核微生物;XA-绿属于放线菌门,为原核微生物。分别对其进行诱变选育后,通过堆肥装置筛选出了高效降解聚乙烯粉末的菌种。综合比较单一诱变和复合诱变对LDPE降解能力的强弱,可知经过复合诱变的XA-绿菌株对LDPE的降解效率最高,为出发菌株的5.75倍。
今后的研究中拟采用提取未知菌种基因组的方法,经过PCR扩增得到16SrRNA,通过16SrRNA测序,比对基因库进一步确定未知菌的种属。此外,经过诱变得到的菌株具有更高效的降解能力和区别于原菌株的形态学特征,有望经过进一步鉴定得到新的菌种。
[1] M Matsunaga,P J Whitney. Surface changes brought about by corona Discharge treatment of polyethylene film and the effect on subsequent microbial colonisation[J]. Polymer Degradation & Stability,2000,70(03):325-332.
[2] A G Driedger,HH Dürr,K Mitchell,P Van Cappellen. Plastic debris in the Laurentian Great Lakes:a review[J]. Journal of Great Lakes Research,2015,41(01):9-19.
[3] C J Moore. Synthetic polymers in the marine environment:a rapidly increasing,long-term threat [J]. Environmental Research,2008,108(02):131-139.
[4]A L Lusher,M McHugh,R C Thompson. Occurrence of microplastics in the gastrointestinal tract of pelagic and demersal fish from the English channel[J]. Marine Pollution Bulletin,2013,67(1-2) :94-99.
[5] C C Sung,Y Tachibana,M Suzuki,WC Hsieh,K Kasuya. Identification of a poly(3-hydroxybutyrate)-degrading bacterium isolated from coastal seawater in Japan as Shewanella sp[J]. Polymer Degradation & Stability,2016,(129):268-274.
[6]齐宇虹,陈建华.光/生物双降解薄膜的降解性能研究[J].塑料,2007,36(04):54-58.
[7]罗贝旭. 聚乙烯降解菌的筛选、鉴定和降解特性的研究[D].成都:四川师范大学,2013.
[8]戈进杰.生物降解高分子材料及其应用[M].北京:化学工业出版社,2003.
[9]杜予民,张甲耀,郑连爽. 淀粉聚乙烯膜在受控条件下的好氧生物降解[J]. 环境科学,2000,21(03):107-109.
[10]何红.降解淀粉填充聚乙烯的白浅灰链霉菌的诱变育种及发酵条件优化研究[D].成都:四川师范大学,2015.
[11]布瑞德. 伯杰细菌手册[K].北京:科学出版社,1984.
[12]魏景超. 真菌鉴定手册[K].上海:上海科学技术出版社,1979.
[13] C C Sung,Y Tachibana,M Suzuki,WC Hsieh,K Kasuya. Identification of a poly(3-hydroxybutyrate)-degrading bacterium isolated from coastal seawater in Japan as Shewanella sp[J]. Polymer Degradation & Stability,2016,(129):268-274.
Isolation and mutation of degradable LDPE strain in soil and its correlative studies
LI Ying,YANG Jia-wen,SU Chun-yang,YU Hui,LIU Pei-yong
(College of Life Science and Health,Northeastern University,Shenyang 110169,China)
Polyethylene plastic is widely used in all aspects of national economy and human life due to its economic convenience and stability,which has also brought serious “white pollution”. This experiment mainly made the collection of garbage at different depths around the soil,and extracted from degradable low density polyethylene (LDPE) strains,and then made mutagenic treatment to test its ability on the degradation of LDPE with a special composting device,and finally screened the strain with strongest degradation ability. This experiment is expected to discover and transform the new type of microorganism to degrade LDPE,so as to provide some reference for the construction of green ecological society.
Biodegradation; LDPE; Soil strain; Mutagenic breeding; Related research
2016-01-17
本项目来源于东北大学第十届大学生创新项目:土壤中可降解LDPE菌株的分离诱变及相关研究(161121)
刘佩勇(1975-),女,东北大学生命科学与健康学院副院长,博士,副教授,e-mail:liupy@mail.neu.cn。
TQ325
A
1674-8646(2017)06-0174-05
