婴儿双歧杆菌与秋水仙碱抗小鼠肝纤维化的作用研究
2017-06-05郑鹏远唐芙爱赵治国
刘 超,郭 琦,郑鹏远,刘 霞,于 泳,唐芙爱,赵治国
郑州大学第二附属医院 1.消化内科;2.超声科,河南 郑州 450014;3.郑州大学第五附属医院消化内科
婴儿双歧杆菌与秋水仙碱抗小鼠肝纤维化的作用研究
刘 超1,郭 琦2,郑鹏远3,刘 霞1,于 泳3,唐芙爱1,赵治国1
郑州大学第二附属医院 1.消化内科;2.超声科,河南 郑州 450014;3.郑州大学第五附属医院消化内科
目的研究婴儿双歧杆菌与秋水仙碱抗小鼠肝纤维化的作用。方法将实验小鼠随机分为正常组、模型组、婴儿双歧杆菌组和秋水仙碱组,正常组静脉注射生理盐水,模型组、婴儿双歧杆菌组和秋水仙碱组静脉注射12.5 mg/kg刀豆蛋白溶液,1次/周,每日给予正常组和模型组蒸馏水灌胃给药,婴儿双歧杆菌组给予0.5 g/kg婴儿双歧杆菌溶液灌胃给药,秋水仙碱组给予0.75 g/kg秋水仙碱溶液灌胃给药,持续7周后,检测小鼠肝脏重量指数,小鼠血清肝功能生化指标(ALT、AST、ALB)、透明质酸(HA)、Ⅲ型前胶原肽(PC Ⅲ)的浓度,小鼠肝脏组织Ⅰ型胶原(Col Ⅰ)、Ⅲ型胶原(Col Ⅲ)、基质金属蛋白酶抑制因子-1(TIMP-1)、基质蛋白金属酶-1(MMP-1)、MMP-2、MMP-9、肿瘤坏死因子α(TNF-α)、IL-6、IL-10的浓度。结果婴儿双歧杆菌与秋水仙碱均能显著降低肝纤维化小鼠的肝脏重量指数(P<0.05),改善肝纤维化小鼠血清肝功能生化指标(P<0.05),降低肝纤维化小鼠血清HA、PC Ⅲ浓度(P<0.05),降低肝纤维化小鼠肝脏组织Col Ⅰ、Col Ⅲ、MMP-2、MMP-9、TIMP-1浓度(P<0.05),提高肝纤维化小鼠肝脏组织MMP-1浓度(P<0.05),降低肝纤维化小鼠肝脏组织TNF-α、IL-6浓度(P<0.05),升高肝纤维化小鼠肝脏组织IL-10浓度(P<0.05)。结论婴儿双歧杆菌与秋水仙碱均具有明确的抗小鼠肝纤维化作用,均可应用于治疗小鼠肝脏肝纤维化。
婴儿双歧杆菌;秋水仙碱;小鼠;肝纤维化
肝纤维化是指各种病因导致的肝脏内结缔组织异常增生和假小叶的形成,最终发展至肝硬化,而肝纤维化是一个可逆的过程,防治肝纤维化的发生、发展是防治肝硬化的重要方法[1-2]。目前研究[3-4]表明婴儿双歧杆菌与秋水仙碱均具有抗小鼠肝纤维化的作用,本实验通过建立小鼠肝纤维化模型,研究婴儿双歧杆菌与秋水仙碱抗小鼠肝纤维化的作用,分析婴儿双歧杆菌与秋水仙碱抗小鼠肝纤维化的治疗意义,为应用婴儿双歧杆菌抗肝纤维化治疗提供可靠的实验依据。
1 材料与方法
1.1 实验材料4周龄雄性Balb/c小鼠,购自河南省实验动物中心,合格证号SCXK(豫)2010-0002。刀豆蛋白(美国Sigma公司),秋水仙碱片(西双版纳版纳药业有限公司),婴儿双歧杆菌粉(山东科兴生物制品有限公司),小鼠透明质酸(HA)、Ⅲ型前胶原肽(PC Ⅲ)、Ⅰ型胶原(Col Ⅰ)、Ⅲ型胶原(Col Ⅲ)、基质金属蛋白酶抑制因子-1(TIMP-1)、基质蛋白金属酶-1(MMP-1)、MMP-2、MMP-9、肿瘤坏死因子α(TNF-α)、IL-6、IL-10 ELISA检测试剂盒(上海西唐生物科技有限公司),日立7080全自动生化分析仪(日本日立贸易有限公司)。
1.2 实验分组雄性Balb/c小鼠适应性饲养1周后,按用随机数字表法分为:正常组、模型组、婴儿双歧杆菌组、秋水仙碱组,每组12只。于造模第1天,正常组静脉注射5 ml/kg剂量的生理盐水,模型组、婴儿双歧杆菌组和秋水仙碱组静脉注射5 ml/kg剂量的刀豆蛋白溶液,此后每周注射1次,连续7周。于造模第1天起,每日给予正常组和模型组蒸馏水灌胃给药,给药剂量10 ml/kg,婴儿双歧杆菌组给予婴儿双歧杆菌溶液灌胃给药,给药剂量10 ml/kg,婴儿双歧杆菌溶液剂量0.5 g/kg,秋水仙碱组给予秋水仙碱溶液灌胃给药,给药剂量10 ml/kg,秋水仙碱溶液剂量0.75 g/kg,1次/d,持续7周。于末次给药后,各组小鼠禁食、不禁水12 h,称重后摘眼球取血,将收集的全血放置于1.5 ml离心管静置60 min后,4 ℃ 3 500 r/min离心15 min,取血清保存于-20 ℃冰箱,用于血清指标检测。取血完毕后脱颈椎处死小鼠,摘取小鼠肝脏组织,生理盐水冲洗干净后称重。每只小鼠取3片肝叶,将其中一片肝叶置于10%甲醛溶液固定,经HE染色后可见模型组小鼠肝脏细胞排列紊乱,肝小叶结构破坏,汇管区结缔组织增生,炎性细胞浸润,纤维间隔形成,证实肝纤维化存在。另外2片肝叶经液氮急冻后放置于-80 ℃低温冰箱中保存,用于肝脏组织指标检测。
1.3 检测指标
1.3.1 小鼠肝脏重量指数:电子天平称量小鼠空腹体质量及肝脏重量,计算肝脏重量/空腹体质量(mg/g)。
1.3.2 小鼠血清肝功能指标:取小鼠血清,全自动生化分析仪检测血清ALT、AST、ALB浓度。
1.3.3 小鼠肝脏纤维化因子及炎症因子:取小鼠血清,ELISA法检测血清中HA和PC Ⅲ的含量。取肝脏组织匀浆,ELISA法检测ColⅠ、Col Ⅲ、TNF-α、IL-6、IL-10的含量。
1.3.4 小鼠肝组织细胞外基质相关因子:取肝脏组织匀浆,ELISA法检测小鼠肝脏组织中TIMP-1、MMP-1、MMP-2、MMP-9的含量。

2 结果
2.1 4组小鼠肝脏重量指数的比较与正常组(3.62±0.41)相比,模型组小鼠肝脏重量指数(6.24±1.08)显著升高(P<0.01)。与模型组相比,婴儿双歧杆菌组(5.43±0.56)及秋水仙碱组(4.72±0.87)小鼠肝脏重量指数均显著降低(P<0.05)。
2.2 4组小鼠肝脏血清生化指标比较与正常组相比,模型组小鼠血清ALT、AST浓度显著升高,ALB浓度显著降低(P<0.01)。与模型组相比,婴儿双歧杆菌组与秋水仙碱组小鼠ALT、AST浓度显著降低,ALB浓度显著升高(P<0.05,见表1)。



组别ALT(U/L)AST(U/L)ALB(g/L)正常组38.10±5.80128.44±30.4537.18±6.35模型组70.19±7.98#194.28±30.28#15.92±4.56#秋水仙碱组52.45±8.12△145.61±48.04△27.12±5.05△婴儿双歧杆菌组58.09±7.34*170.31±18.45*24.34±4.82*
注:与正常组相比,#P<0.01;与模型组相比,*P<0.05,△P<0.01。
2.3 婴儿双歧杆菌与秋水仙碱对肝纤维化小鼠血清HA和PC Ⅲ的影响与正常组相比,模型组小鼠血清HA和PC Ⅲ的浓度均显著升高(P<0.01)。与模型组相比,婴儿双歧杆菌组与秋水仙碱组小鼠血清HA和PC Ⅲ的浓度均显著降低(P<0.05,见表2)。
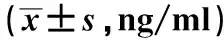
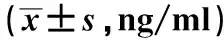

组别HAPCⅢ正常组106.34±28.92111.43±31.94模型组236.18±48.85#275.36±36.82#秋水仙碱组198.74±36.18△213.34±42.18△婴儿双歧杆菌组204.23±41.34*225.95±38.14*
注:与正常组相比,#P<0.01;与模型组相比,*P<0.05,△P<0.01。
2.4 婴儿双歧杆菌与秋水仙碱对肝纤维化小鼠肝脏Col Ⅰ和Col Ⅲ的影响与正常组相比,模型组小鼠肝脏组织ColⅠ和Col Ⅲ浓度显著升高(P<0.01)。与模型组相比,婴儿双歧杆菌组与秋水仙碱组小鼠肝组织中Col Ⅰ和Col Ⅲ含量均显著降低(P<0.05,见表3)。



组别ColⅠColⅢ正常组58.32±8.1635.14±7.11模型组121.34±23.82#78.31±11.34#秋水仙碱组80.32±15.31△46.18±9.83△婴儿双歧杆菌组98.74±20.04*58.25±12.84*
注:与正常组相比,#P<0.01;与模型组相比,*P<0.05,△P<0.01。
2.5 婴儿双歧杆菌与秋水仙碱对肝纤维化小鼠肝脏TNF-α、IL-6和IL-10的影响与正常组相比,模型组小鼠肝组织TNF-α、IL-6浓度显著上升(P<0.01),IL-10浓度显著下降,差异有统计学意义(P<0.05)。与模型组相比,婴儿双歧杆菌组与秋水仙碱组小鼠肝脏TNF-α、IL-6的浓度均显著降低,IL-10浓度显著升高(P<0.05,见表4)。



组别TNF-αIL-6IL-10正常组298.33±30.75321.65±40.72283.44±26.71模型组456.78±60.81#510.66±78.42#158.22±29.81#秋水仙碱组382.17±50.12△443.19±62.11△200.33±37.12△婴儿双歧杆菌组379.12±60.18*429.16±33.12*212.34±38.12*
注:与正常组相比,#P<0.01;与模型组相比,*P<0.05,△P<0.01。
2.6 婴儿双歧杆菌与秋水仙碱对肝纤维化小鼠肝脏TIMP-1、MMP-1、MMP-2、MMP-9的影响与正常组相比,模型组小鼠肝组织TIMP-1、MMP-2、MMP-9浓度显著升高,MMP-1浓度显著降低(P<0.01)。与模型组相比,婴儿双歧杆菌组与秋水仙碱组小鼠肝脏TIMP-1、MMP-2、MMP-9浓度均显著降低,MMP-1浓度显著升高(P<0.05,见表5)。



组别TIMP-1MMP-1MMP-2MMP-9正常组34.25±5.89463.84±60.15134.52±20.8271.34±13.25模型组77.64±13.82#195.63±70.22#385.24±76.34#186.13±30.88#秋水仙碱组53.8±11.06△317.62±52.05△259.34±52.13△108.64±25.85△婴儿双歧杆菌组62.18±7.28*298.62±43.05△192.54±21.43△154.88±41.62*
注:与正常组相比,#P<0.01;与模型组相比,*P<0.05,△P<0.01。
3 讨论
研究[5]表明,益生菌可以通过免疫调节机制改善小鼠肠道疾病状况,相关的动物实验研究也显示益生菌对肝炎、肝硬化等肝病具有治疗作用[6],提示益生菌可能通过免疫调节机制抑制免疫反应诱发的肝纤维化。婴儿双歧杆菌是一种重要的益生菌,目前在临床上主要用于预防和治疗多种肠道疾病[7-8],通过补充婴儿双歧杆菌来调节肠道菌群平衡,抑制肠道中某些致病菌,维持正常肠道蠕动,用于治疗与肠道菌群失调相关的腹泻、便秘、功能性消化不良等疾病。研究[9]表明,秋水仙碱具有抗小鼠肝脏纤维化的作用,可以明显改善肝纤维化小鼠各种明显异常的肝纤维化指标,明显减轻肝纤维化程度。但秋水仙碱具有较大的细胞毒性,常见的不良反应包括:消化道反应、骨髓毒性反应、肝脏损伤、肾脏损伤,严重时可导致骨髓抑制、肾脏衰竭等致命性并发症,美国食品药物管理局(FDA)已经要求停止营销包含单一成分秋水仙碱的口服药品。
本实验通过建立肝纤维化小鼠动物模型,研究婴儿双歧杆菌与秋水仙碱抗小鼠肝纤维化的作用及其治疗意义,从检测小鼠肝脏重量指数、血清肝功能、肝组织纤维化因子、肝组织细胞外基质因子、肝组织炎症因子等指标的结果来分析两者抗小鼠肝纤维化的机制及其意义。本实验结果显示:经检测小鼠肝脏重量指数,小鼠血清ALT、AST、ALB、HA、PC Ⅲ浓度,小鼠肝组织ColⅠ、Col Ⅲ、TIMP-1、MMP-1、MMP-2、MMP-9、TNF-α、IL-6、IL-10浓度等指标,与正常组小鼠相比,模型组小鼠肝纤维化的各项指标均明显异常,说明刀豆蛋白作为诱导剂导致了模型组小鼠肝纤维化的发生,模型组小鼠肝组织病理切片HE染色结果也证实了小鼠肝纤维化的存在。在给予试验小鼠刀豆蛋白的同时,经应用婴儿双歧杆菌与秋水仙碱后,婴儿双歧杆菌组与秋水仙碱组小鼠肝纤维化的各项指标均有明显改善,说明婴儿双歧杆菌与秋水仙碱对肝纤维化小鼠均有明确的治疗作用。
本实验以刀豆蛋白作为诱导剂建立免疫性肝纤维化小鼠动物模型。经检测肝纤维化小鼠的肝组织中TNF-α和IL-6浓度显著升高,IL-10浓度显著降低,表明调节炎症因子的表达可能是免疫性肝纤维化的发生机制。婴儿双歧杆菌可激活机体吞噬细胞的功能,增强机体抗感染能力和非特异性免疫反应,具有免疫调节作用[10]。本实验研究结果显示婴儿双歧杆菌抗免疫性肝纤维化小鼠动物模型肝纤维化的作用,其机制可能与调节肝纤维化小鼠TNF-α、IL-6和IL-10表达有关,婴儿双歧杆菌可能是通过免疫调节机制改善肝纤维化小鼠动物模型的疾病状况[11]。
本实验通过建立肝纤维化小鼠动物模型,证实婴儿双歧杆菌与秋水仙碱均具有抗小鼠肝纤维化的作用,相比具有明确毒副作用的秋水仙碱,婴儿双歧杆菌具有安全、有效的特点,可以推荐应用于肝纤维化的临床治疗。
[1]Mormone E, George J, Nieto N. Molecular pathogenesis of hepatic fibrosis current therapeutic approaches [J]. Chem Biol Interact, 2011, 193(3): 225-231.
[2]曾璐, 周本杰. 肝纤维化发病机制和治疗方法的研究进展[J]. 广东医学, 2014, 35(24): 3918-3921. Zeng L, Zhou BJ. Research progress on pathogenesis and treatment of hepatic fibrosis [J]. Guangdong Medical Journal, 2014, 35(24): 3918-3921.
[3]吴丽, 魏伟. 肝纤维化的动物模型及治疗药物研究[J]. 中国药理学通报, 2004, 20(5): 481-485. Wu L, Wei W. Animal models and antifibrotic therapy of hepatic fibrosis [J]. Chinese Pharmacology Bulletin, 2004, 20(5): 481-485.
[4]李鸿立, 田聆, 魏于全, 等. 刀豆素蛋白A诱导小鼠肝纤维化模型的建立[J].免疫学杂志, 2004, 20(5): 390-392. Li HL, Tian L, Wei YQ, et al. Concanavalin A induced murine model for hepatic fibrosis [J]. Immunological Journal, 2004, 20(5): 390-392.
[5]王玉玉, 张军, 郑鹏远, 等. 双歧杆菌、酪酸梭菌及谷氨酰胺对慢性应激模型小鼠肠黏膜屏障的影响[J]. 郑州大学学报(医学版), 2014, 49(2): 153-157. Wang YY, Zhang J, Zheng PY, et al. Influence ofBifdobacteriuminfantis,Clostridiumbutyricum and glutamine on the intestinal barrier in mice following chronic psychological stress [J]. Journal of Zhengzhou University (Medical Sciences), 2014, 49(2): 153-157.
[6]刘思濛, 郑鹏远, 李付广, 等. 婴儿双歧杆菌对肠易激综合征小鼠肠道黏膜CRF受体表达及肥大细胞活化的影响[J].中华微生物学和免疫学杂志, 2014, 34(8): 571-515. Liu SM, Zheng PY, Li FG, et al. Effects ofBifidobacteriuminfantison intestinal corticotropin releasing factor receptors and mast cells activation in a murine model of irritable bowel syndrome [J]. Chin J Microbiol Immunol, 2014, 34(8): 571-515.
[7]Zuo L, Yuan KT, Yu L, et al. Bifidobacterium infantis attenuates colitis by regulating T cell subset responses [J]. World J Gastroenterol, 2014, 20(48): 18316-18329.
[8]张玲琳, 苗俊杰, 李鸣, 等. 婴儿早期肠道双歧杆菌构建规律的初探[J]. 中国当代儿科杂志, 2015, 17(3): 207-212. Zhang LL, Miao JJ, Li M, et al. Colonization and development of intestinal biifdobacteria in early infancy [J]. Chinese J Contemp Pediatr, 2015, 17(3): 207-212.
[9]何雅军, 舒建昌, 吕霞, 等. 秋水仙碱预防肝纤维化作用的观察[J]. 广东药学院学报, 2006, 22(2): 168-170. He YJ, Shu JC, Lv X, et al. Observation of prophylactic effect on hepatic fibrosis of colchicine in rats [J]. Journal of Guangdong College of Pharmacy, 2006, 22(2): 168-170.
[10]范金波, 侯宇, 周素珍, 等. 双歧杆菌增强小鼠机体的免疫功能[J]. 微生物学报, 2015, 55(4): 484-491. Fan JB, Hou Y, Zhou SZ, et al. Effect of Bifidobacterium on the immunity in BALB/c mice [J]. Acta Microbiologica Sinica, 2015, 55(4): 484-491.
[11]贾玉杰, 赵芳, 张彩华, 等. 中药肝复康对TNF-α介导的炎症性肝损伤和大鼠肝纤维化的抑制作用[J]. 中国微生态学杂志, 2016, 28(2): 146-150. Jia YJ, Zhao F, Zhang CH, et al. Effects of Gan-fu-kang on TNF-α mediated liver inflammatory injury and fibrosis in rats [J]. Chin J Microecol, 2016, 28(2): 146-150.
(责任编辑:王全楚)
Preventive effects of Bifidobacterium infantis and colchicine on liver fibrosis of mice
LIU Chao1, GUO Qi2, ZHENG Pengyuan3, LIU Xia1, YU Yong3, TANG Fuai1, ZHAO Zhiguo1
1.Department of Gastroenterology; 2.Department of Ultrasound, the Second Affiliated Hospital, Zhengzhou University, Zhengzhou 450014; 3.Department of Gastroenterology, the Fifth Affiliated Hospital, China
Objective To research the preventive effects and mechanism of Bifidobacterium infantis and colchicine on liver fibrosis of mice.Methods The liver fibrosis model of mice was induced by concanavalin injection. The mice were randomly divided into four groups: normal group, model group, Bifidobacterium infantis group and colchicine group. The concanavalin solution (12.5 mg/kg) was given by intravenous injection to the model group, Bifidobacterium infantis group and colchicine group once a week, the Bifidobacterium infantis group was given Bifidobacterium infantis (0.5 g/kg) by intragastric administration once a day, the colchicine group was given colchicines (0.75 g/kg) by intragastric administration once a day. After 7 weeks, liver weight index, liver function, concentrations of HA and PC Ⅲ in serum, Col Ⅰ, Col Ⅲ, MMP-1, MMP-2, MMR-9, TIMP-1, tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), interleukin-10 (IL-10) in mice liver tissues were detected.Results In the liver fibrosis model of mice induced by concanavalin, Bifidobacterium infantis and colchicine could decrease liver weight index (P<0.05), improve the liver function (P<0.05), decrease the serum concentrations of HA and PC Ⅲ (P<0.05), decrease the concentrations of Col Ⅰ, Col Ⅲ, MMP-2, MMR-9, TIMP-1, tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) (P<0.05), increase the concentrations of MMP-1, interleukin-10 (IL-10) (P<0.05).Conclusion Bifidobacterium infantis and colchicine could prevent liver fibrosis of mice, can be used in the treatment the liver fibrosis model of mice.
Bifidobacterium infantis; Colchicine; Mouse; Liver fibrosis
国家自然科学基金项目(81370494)
刘超,硕士,主治医师,研究方向:胃肠道肿瘤与免疫。E-mail:liuch23@sina.com
郑鹏远,博士,主任医师,研究方向:胃肠道感染与免疫。E-mail:medp7123@126.com
10.3969/j.issn.1006-5709.2017.03.014
R575
A 文章编号:1006-5709(2017)03-0296-04
2016-08-31
