金丝桃素对乙肝病毒启动子活性的影响
2017-06-05蓝天云赵兴旺陈勇彬杨翠萍
蓝天云,赵兴旺,范 红,陈勇彬,杨翠萍,李 岩
1.昆明理工大学医学院,云南 昆明 650032; 2.云南省第一人民医院消化内科; 3.中国科学院昆明动物研究所
论著·肝相关疾病
金丝桃素对乙肝病毒启动子活性的影响
蓝天云1,2,赵兴旺1,2,范 红1,2,陈勇彬3,杨翠萍3,李 岩1,2
1.昆明理工大学医学院,云南 昆明 650032; 2.云南省第一人民医院消化内科; 3.中国科学院昆明动物研究所
目的探讨金丝桃素对乙肝病毒(hepatitis B virus,HBV)启动子活性的影响。方法分别将构建好的带有病毒启动子的双荧光素酶报告基因系统及含有1.3倍HBV基因组的质粒转染到293T、L02及HepG2细胞中,并对细胞进行分组给药。以去离子水为空白对照组,1.0 μmol/L的拉米夫定为阴性对照组,浓度梯度的金丝桃素作为实验组;给药48 h后,收集细胞进行双荧光素酶指标检测及pgRNA表达水平的荧光定量PCR检测。结果在病毒启动子活性检测的结果中,金丝桃素组与拉米夫定组和空白对照组的结果一致,启动子活性变化不明显(P>0.05)。在pgRNA表达水平检测结果中,金丝桃素组与拉米夫定组和空白对照组在非肝源细胞株293T细胞中表达水平无显著变化(P>0.05),但在肝源细胞株L02、HepG2中,金丝桃素组pgRNA的表达水平较其他两组明显下降(P<0.05)。结论金丝桃素可能不是通过影响病毒启动子,而是通过其他相关途径来发挥抗病毒的作用。
乙型肝炎病毒;pgRNA;金丝桃素;启动子
金丝桃素[hypericin,4,4’,5,5’,7,7’-六羟基-2,2’-二甲基(中位)萘骈二蒽酮]是一种具有广泛抗包膜病毒作用的化合物,它是贯叶连翘等金丝桃素属植物的主要活性成分之一[1-3]。本课题的前期研究结果表明金丝桃素具有强效的抗乙型肝炎病毒(hepatitis B virus,HBV)作用,给药后的HepG2.2.15细胞中HBV表面抗原与e抗原及病毒DNA的表达水平均明显下降[4]。而后续研究显示,其抗病毒靶点与传统的核苷类化合物不同,其不能竞争性地抑制病毒转录/反转录酶的活性,以降低病毒的复制水平[4-6]。这提示我们,金丝桃素可能作用于其他病毒复制周期中的环节。
HBV前体RNA(pregenomic RNA,pgRNA)是HBV复制中间非常重要的中间体,它是病毒中心抗原与e抗原的蛋白翻译模板,同时也是病毒DNA的反转录模板,它的下降会同时带动病毒的抗原与基因组表达的双下降[7]。在前期的抗病毒实验中,我们发现金丝桃素处理后的HepG2.2.15细胞中,pgRNA的表达水平显著下降,提示金丝桃素可能通过降低pgRNA的表达来抑制病毒的复制[4]。而pgRNA是由病毒基因组C区启动子控制表达的[8],因此,为了确定金丝桃素是否对pgRNA的表达水平有抑制作用,我们对金丝桃素对病毒启动子的活性进行了检测。
1 材料与方法
1.1 材料人胚胎肾细胞293T、人肝癌细胞HepG2由昆明动物所馈赠;人肝细胞L02由云南省第一人民医院馈赠。金丝桃素(95%,HPLC)购自Sigma公司;拉米夫定由武汉同济医院肝病研究所馈赠。质粒p3.6Ⅱ、pHBV1.3由武汉同济医院肝病研究所馈赠;质粒pGL3-Basic、pRL-TK由昆明动物所馈赠。TOP10感受态细胞购自天根生物科技有限公司。高糖DMEM 培养液及胎牛血清购自GIBCO公司;胰酶购自碧云天公司;双荧光素酶检测试剂盒及反转录试剂盒、SYBRGreen荧光定量PCR检测试剂盒购自Promega公司;AxyPrep液体病毒DNA/RNA提取试剂盒及总RNA提取试剂盒、内切酶NheⅠ-HIFI、KpnⅠ-HIFI及快速连接酶均购自NEB公司。质粒提取试剂盒购自天根生物科技有限公司。转染试剂为lipofectamine3000。
1.2 实验方法
1.2.1 质粒构建:以p3.6Ⅱ为模板,进行PCR扩增,具体引物[9]见表1,PCR扩增程序为:95 ℃ 2 min,随后95 ℃ 2 min、60 ℃ 30 s、72 ℃ 1 min进行30个循环,72 ℃ 10 min,4 ℃终止并保存。PCR扩增反应结束后使用DNA纯化试剂盒对目的片段进行纯化。随后,将纯化后的目的片段与质粒载体使用Kpn Ⅰ-HIFI、
NheⅠ-HIFI内切酶进行酶切。酶切完成后,将获得的酶切产物进行电泳分离,琼脂糖凝胶浓度为1%,120 V电泳30 min,紫外发光仪检测目的片段,将与目的片段长度相对应的胶块割下,使用胶回收试剂盒对胶块中的DNA片段进行回收。将回收的目的片段与质粒使用快速连接酶室温5 min进行链接。将链接混合物加入刚刚融化的100 μl感受态细胞中混匀,冰浴30 min,42 ℃水浴1 min后迅速置于冰上放置5 min进行转化。加入不含抗生素的LB液体培养基500 μl,37 ℃,150 r/min摇菌1 h;取200 μl感受态细胞均匀涂抹于含有1% Amp的LB平板培养皿上,待液体干后,将培养皿倒置于37 ℃培养箱内培养14 h后取出,挑取单个克隆菌落,加入4 ml含有1% Amp的LB液体培养基中,250 r/min,摇菌16 h;取2 ml达到时间的菌液用质粒小抽试剂盒进行抽提,所得的质粒进行目的片段测序,以证明质粒准确插入目的片段;选取构建正确的质粒,则将剩余的菌液加入200 ml含有1% Amp的LB液体培养基中,250 r/min摇菌8 h;将菌液取出,使用无内毒素质粒大抽试剂盒进行质粒提取,测定所得质粒浓度。
表1 PCR引物序列表
Tab 1 PCR primers
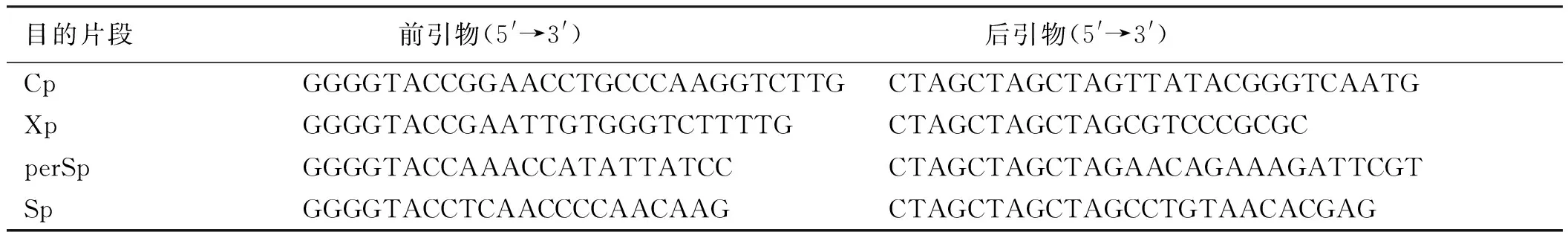
目的片段前引物(5'→3')后引物(5'→3')CpGGGGTACCGGAACCTGCCCAAGGTCTTGCTAGCTAGCTAGTTATACGGGTCAATGXpGGGGTACCGAATTGTGGGTCTTTTGCTAGCTAGCTAGCGTCCCGCGCperSpGGGGTACCAAACCATATTATCCCTAGCTAGCTAGAACAGAAAGATTCGTSpGGGGTACCTCAACCCCAACAAGCTAGCTAGCTAGCCTGTAACACGAG
1.2.2 质粒转染与化合物干预:报告基因检测组的待转录细胞以2.4×105个/孔接种于24孔板中,培养24 h左右;依照转录说明书对细胞进行转录,质粒总量为0.5 μg/孔,萤火虫荧光素酶表达质粒与海参荧光素酶表达质粒的比值为300∶1;pgRNA表达检测的待转录细胞以1.2×106个/孔接种于6孔板中,培养24 h左右;依照转录说明书对细胞进行转录,质粒总量为2.5 μg/孔。细胞转染12 h后更换培养基,将同组转录细胞再进行分组,分成实验组、阳性对照组与空白对照组,实验组细胞分别加入终浓度为0.1 μmol/L、0.5 μmol/L、1.0 μmol/L、5.0 μmol/L的金丝桃素,阳性对照组按照3TC半数有效浓度1.0 μmol/L为终浓度加入细胞的培养基中,去离子水加入空白对照组的细胞培养基中,每个浓度孔设3个复孔。细胞放入培养箱中继续培养,48 h后进行指标检测。
1.2.3 双荧光检测:细胞转染48 h后,弃细胞培养基,将细胞用1×PBS漂洗1次,之后使用lysis buffer对细胞进行裂解,每孔加入20 μl的lysis buffer,摇床震荡20 min。取裂解样品10 μl,加入测试所需的不透光96孔板中,放入多功能酶标仪进行检测。
1.2.4 总RNA的提取与目标mRNA表达水平检测:收集各组细胞,使用AxyPrep总RNA小量制备试剂盒提取所收集细胞中的总RNA。具体步骤如下:收集各组细胞,加入400 μl细胞裂解液,漩涡振荡,加入150 μl裂解中和液,漩涡振荡,12 000×g,离心5 min,取上清,加入250 μl异丙醇,混合均匀后转移至制备管中,6 000×g,离心1 min,弃滤液,加入500 μl洗涤液,12 000×g离心1 min,弃滤液,加入500 μl去盐液,12 000×g,离心1 min,重复洗涤1次后12 000×g,离心1 min,使用100 μl RNase-free水洗脱。取各组所提取的总RNA 1 μg进行反转录,反转录程序为25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃终止并保存;所得到的cDNA,使用染料法荧光定量PCR检测pgRNA的表达水平,荧光定量PCR引物为:前引物3′-CTCAATCTCGGGAATCTCAATGT-5′;后引物3′-TGGATAAAACCTAGCAGGCATAAT-5′[10],PCR扩增反应程序为95 ℃ 2 min后,95 ℃ 15 s与60 ℃ 1 min交替循环40次,60 ℃终止并保存。

2 结果
2.1 金丝桃素对病毒启动子活性的影响在转染的各细胞系中,空白对照、3TC、金丝桃素对病毒Cp、Xp、perSp、Sp启动子控制的荧光素酶的表达水平无明显影响,三组比较,差异均无统计学意义(P>0.05,见图1)。
2.2 金丝桃素对不同细胞pgRNA表达的影响Real-time PCR结果显示,在转染1.3倍的HBV基因组质粒后,与空白对照组相比,非肝源细胞株293T细胞中pgRNA的表达在加入金丝桃素后无显著变化(P>0.05),3TC组结果相同(见图2A)。而在肝源细胞株L02、HepG2细胞中,金丝桃素组pgRNA较空白对照组及3TC组明显下降,差异有统计学意义(P<0.05,见图2B、2C)。
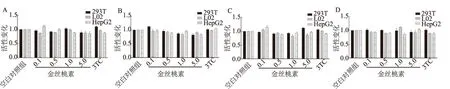
图1 病毒启动子活性检测
A:Cp启动子的活性变化;B:Xp启动子的活性变化;C:perSp启动子的活性变化;D:Sp启动子的活性变化
Fig 1 Activity of HBV promoter
A: activity of Cp promoter; B: activity of Xp promoter; C: activity of preSp promoter; D: activity of Sp promoter
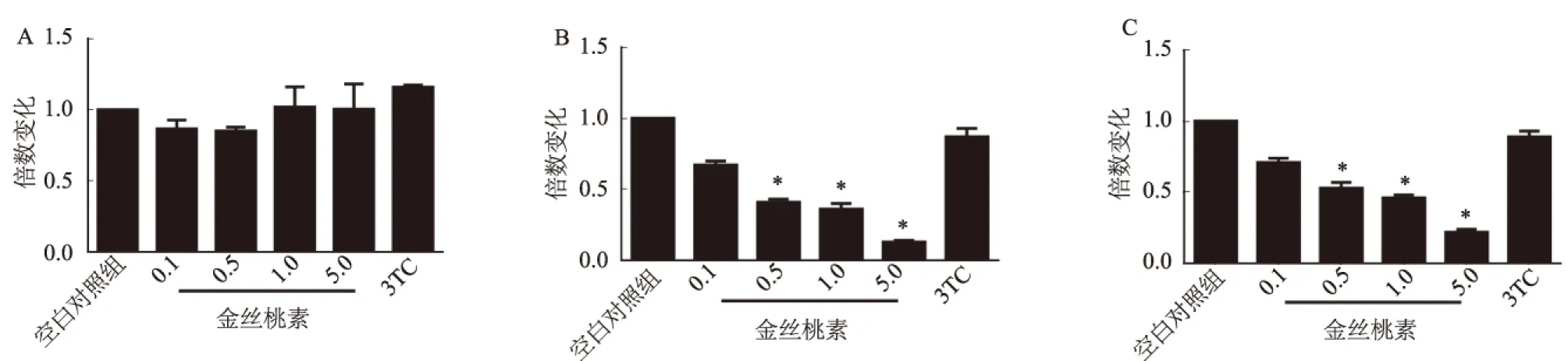
注:与空白对照组和3TC组比较,*P<0.05。
图2 pgRNA的表达变化
A:293T细胞中pgRNA的表达水平;B:L02细胞中pgRNA的表达水平;C:HepG2细胞中pgRNA的表达水平
Fig 2 Expression of pgRNA after drug treatment
A: expression of pgRNA in 293T after drug treatment; B: expression of pgRNA in L02 after drug treatment; C: expression of pgRNA in HepG2 after drug treatment
3 讨论
实验结果显示,启动子Cp、Xp、perSp及Sp在金丝桃素给药后无明显变化,由此可知,金丝桃素对于病毒各开放阅读框对应的启动子没有明显的抑制作用。但对于转染HBV基因组的肝源性细胞,在金丝桃素给药后,其pgRNA的表达明显下调,而非肝源性细胞中没有这种现象,可能与其嗜肝性相关[11]。说明金丝桃素可能作用于病毒入侵宿主细胞中除转录外的某些步骤,诸如直接在胞外杀灭病毒,阻碍胞内成熟病毒体包装等,从而阻碍了病毒二次入侵宿主细胞,从而降低细胞内病毒基因组的数量。
关于金丝桃素的抗病毒作用机制,目前并没有确切的解释。研究[12]表明其具有广泛的抗包膜病毒的作用,但是对于无包膜病毒,其并没有有效的抑制病毒作用。因此,目前金丝桃素是艾滋病、流感等疾病领域的新兴药物,具有强效的抗艾滋病病毒的作用,但是机理并不清楚。有研究[13]表明其抗病毒作用是通过阻碍病毒基因组的转录与翻译环节进行的。也有研究[14]认为,金丝桃素之所以可以抑制包膜病毒的复制,是因为其对于病毒包膜有一定的瓦解作用,使病毒在侵染宿主细胞之前就被杀灭,也有观点[15]称,金丝桃素的作用靶点并不在于成熟的病毒包膜,而在于破坏病毒组装时的蛋白结合,从而导致病毒的组装失败,使病毒不能顺利地从宿主细胞中释放,从而不能更大规模的侵染其他健康细胞。
本实验证明了金丝桃素的抗乙肝病毒作用与病毒的转录无影响,但具体的作用机制仍不清楚,还需要进一步验证。
[1]Thong PS, Olivo M, Chin WW, et al. Clinical application of fluorescence endoscopic imaging using hypericin for the diagnosis of human oral cavity lesions [J]. Br J Cancer, 2009, 101(9): 1580-1584.
[2]谢等龙. 金丝桃素注射剂的制备及质量标准的建立[D]. 兰州: 甘肃农业大学, 2007. Xie DL. Hypericin preparation of injection and the establishment of quality standard [D]. Lanzhou: Gansu Agricultural Unversity, 2007.
[3]Sharma KV, Davids LM. Depigmentation in melanomas increases the efficacy of hypericin-mediated photodynamic-induced cell death [J]. Photodiagnosis Photodyn Ther, 2012, 9(2): 156-163.
[4]李岩,汤敏,安瑛,等.金丝桃素体外抗乙型肝炎病毒的作用[J]. 中华传染病杂志, 2012, 30(8): 459-462. Li Y, Tang M, An Y, et al. The effects of hypericin on inhibition of hepatitis B virus replication in vitro [J]. Chin J Infect Dis, 2012, 30(8): 459-462.
[5]Gagey D, Ravetti S, Castro EF, et al. Antiviral activity of 5′-O-carbonate-2′, 3′-dideoxy-3′-thiacytidine prodrugs against hepatitis B virus in HepG2 2.2. 15 cells [J]. Int J Antimicrob Agents, 2010, 36(6): 566-569.
[6]Bertoli A, Giovannini A, Ruffoni B, et al. Bioactive constituent production in St. John’s Wort in vitro hairy roots. Regenerated plant lines [J]. J Agric Food Chem, 2008, 56(13): 5078-5082.
[7]Pourkarim MR, Amini-Bavil-Olyaee S, Verbeeck J, et al. Molecular evolutionary analysis and mutational pattern of full-length genomes of hepatitis B virus isolated from Belgian patients with different clinical manifestations [J]. J Med Virol, 2010, 82(3): 379-389.
[8]Lu YP, Guo T, Wang BJ, et al. Replication of clinical hepatitis B virus isolate and its application for selecting antiviral agents for chronic hepatitis B patients [J]. World J Gastroenterol, 2008, 14(22): 3490-3496.
[9]Seitz G, Krause R, Fuchs J, et al. In vitro photodynamic therapy in pediatric epithelial liver tumors promoted by hypericin [J]. Oncol Rep, 2008, 20(5): 1277-1282.
[10]Xu WS, Zhao KK, Miao XH, et al. Effect of oxymatrine on the replication cycle of hepatitis B virus in vitro [J]. World J Gastroenterol, 2010, 16(16): 2028-2037.
[11]Yuen MF, Lai CL. Hepatitis B in 2014: HBV research moves forward [mdash] receptors and reactivation [J]. Nat Rev Gastroenterol Hepatol, 2015, 12(2): 70-72.
[12]Miskovsky P. Hypericin-a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological macromolecules [J]. Curr Drug Targets, 2002, 3(1): 55-84.
[13]Meruelo D, Degar S, Amari N, et al. Mode of action of hypericin as an antiretroviral agent and other relevant findings [M]//Chu CK, Cutler HG. Natural Products as Antiviral Agents. New York: Plenum Press, 1992: 91-119.
[14]Moraleda G, Wu TT, Jilbert AR, et al. Inhibition of duck hepatitis B virus replication by hypericin [J]. Antiviral Res, 1993, 20(3): 235-247.
[15]Meruelo D, Lavie G, Lavie D. Therapeutic agents with dramatic antiretroviral activity and little toxicity at effective doses: aromatic polycyclic diones hypericin and pseudohypericin [J]. Proc Natl Acad Sci U S A, 1988, 85(14): 5230-5234.
(责任编辑:王全楚)
Effect of hypericin on activity of hepatitis B virus promoter
LAN Tianyun1,2, ZHAO Xingwang1,2, FAN Hong1,2, CHEN Yongbin3, YANG Cuiping3, LI Yan1,2
1.Medical Faculty of Kunming University of Science and Technology, Kunming 650032; 2.Department of Gastroenterology, the First People’s Hospital of Yunnan Province; 3.Kunming Institute of Zoology, the Chinese Academy of Sciences, China
Objective To investigate the effect of hypericin on activity of hepatitis B virus promoter.Methods The constructed dual luciferase reporter gene system with viral promoter and plasmids containing 1.3 times HBV genome were transfected into 293T, L02 and HepG2 cells respectively. The cells were divided into different groups. Experimental groups were cultured and treated with concentration gradient of hypericin, negative control was treated with 1.0 μmol/L Lamivudine, and deionized water was as blank control group. Forty-eight hours after the administration, the cells were collected for double luciferase detection and pgRNA expression levels by quantitative real-time PCR assay.Results In the results of virus promoter activity test, hypericin group, Lamivudine group and blank control group results were consistent, promoter activity change was not obvious (P>0.05). Hypericin could significantly inhibited pgRNA level compared with ddH2O and Lamivudine in liver-derived cell lines L02 and HepG2 cells (P<0.05), but had no significant change in non-liver-derived cell lines 293T (P>0.05).Conclusion Hypericin may not be the impact of the virus through the promoter, but to exert antiviral effect through other pathway.
Hepatitis B virus; Pregenomic RNA; Hypericin; Promoter
国家自然科学基金青年科学基金(81300324)
蓝天云,研究方向:药理学。E-mail:lty404@hotmail.com
李岩,主治医师,研究方向:消化内科药理学。E-mail:hepatocellular@sina.com
10.3969/j.issn.1006-5709.2017.03.013
R512.6+2
A 文章编号:1006-5709(2017)03-0292-04
2016-07-13
