沉默S期激酶相关蛋白2对Eca109细胞增殖的影响
2017-06-05徐倩倩李彩丽孙泽群
徐倩倩,李彩丽,成 丹,孙泽群
湖北医药学院附属人民医院消化内科,湖北 十堰 442000
其他论著
沉默S期激酶相关蛋白2对Eca109细胞增殖的影响
徐倩倩,李彩丽,成 丹,孙泽群
湖北医药学院附属人民医院消化内科,湖北 十堰 442000
目的研究Ad-skp2-siRNA对Eca109细胞增殖的影响。方法采用荧光显微镜、流式细胞仪和Western bloting检测转染效率;采用CCK8法检测Ad-skp2-siRNA转染Eca109细胞后对奥沙利铂耐药的影响;采用细胞划痕实验和侵袭实验检测Ad-skp2-siRNA对Eca109细胞迁移能力的影响;采用Western blotting检测Ad-skp2-siRNA作用Eca109细胞后对相关蛋白表达的影响。结果Ad-skp2-siRNA能够抑制Eca109细胞的生长和迁移,呈时间-剂量依赖性,Ad-skp2-siRNA能够影响相关蛋白的表达,差异有统计学意义(P<0.05)。结论沉默Skp2有助于抑制细胞增殖。
S期激酶相关蛋白2;食管癌;增殖
S期激酶相关蛋白2(S-phase kinase-associated protein 2, Skp2)是细胞周期中的重要调节蛋白,参与泛素蛋白酶体途径,具有特异性识别底物和关键限速酶的作用,其在食管癌中表达且在耐化疗药的食管癌中高表达,Skp2参与细胞衰老相关信号转导的调控和转录调控,促进细胞增殖与致癌作用,并可以决定细胞对DNA反应后是凋亡还是自噬,故Skp2可能影响肿瘤耐药的多个环节[1-2],其在食管癌中高表达可能与食管癌的耐药有某种联系。本实验选择Skp2作为基因干预的靶点,采取RNA干扰技术(RNA interference,RNAi)基因沉默技术,特异性地阻断Skp2的表达[3],探讨Skp2下调后对Eca109细胞的增殖、耐药等方面的影响。
1 材料与方法
1.1 细胞来源与细胞培养人食管癌Eca109细胞(湖北省十堰市人民医院消化研究所提供)培养在含100 g/L胎牛血清(杭州四季青公司)的RPMI 1640培养基(美国Gibco),置于体积分数5%CO2、37 ℃恒温培养箱,每隔2~3 d用0.25%的胰蛋白酶消化传代1次,连续传3代后,取对数生长期的细胞。
1.2 主要试剂及抗体单抗小鼠抗人SKP2 IgG单抗(美国Zymed Laboratories公司);Bax、Bcl-2抗体购自IBCAM公司,MMP2及MMP9抗体购自Proteintech公司,α-tubulin抗体购自sigma公司。抗E-cadherin抗体购自Bioworld Technology公司。CCK8试剂盒购自上海七海生物公司,Martrigel胶购自BD公司,Transwell小室购自Corning公司(8 μm);流式细胞仪:Beckman Coulter(EPICS XL),凝胶成像系统:Bio-Rad,酶标仪:Tecan(Sunrise)。
1.3 Ad-skp2-siRNA重组腺病毒载体的构建及鉴定本实验所用腺病毒由湖北医药学院徐少勇教授馈赠[4],本文采用的 Skp2干扰序列及对照序列均为已被应用的序列[5],由上海生工生物工程技术服务有限公司合成的Skp2-siRNA序列。siSkp2 正义链:5′-CGCGTCGTTCTCTCGATTTAGCTTAGGCTTCAAGAGAGCCTAAGCTAAATCGAGAGAACTTTTTTGGAAA-3′;阴 性 对 照 (NC) 正 义 链:5′-CGCGTCAGCAGAAGTGGTATTTTCTCATTCAAGAGATGAGAAAATACCACTTCTGCTTTTTTGGAAA-3′。将载体pShuttle-H1用MluⅠ和HindⅢ双酶切, 将以上退火形成的双链寡核苷酸用T4DNA连接酶连接,转化感受态大肠埃希菌DH5α,培养后小提质粒,PacⅠ酶切鉴定阳性克隆,得到pShuttle-H1-Skp2-siRNA质粒。pShuttle-H1-NC质粒用同样方法获得。分别取质粒pShuttle-H1-Skp2-siRNA及pShuttle-H1-NC,用PmeⅠ线性化,经纯化回收后转化带骨架质粒pAdeasy-1的感受态大肠埃希菌BJ5183进行同源重组。37 ℃培养过夜,选取菌落,培养并提取质粒,用PacⅠ酶切鉴定阳性克隆,后用酚-氯仿法进行纯化。纯化的质粒用 Lipofectamine 2000转染HEK293细胞,包装病毒并扩增,后对重组腺病毒进行CsCl密度梯度离心纯化。
1.4 Ad-skp2-siRNA重组腺病毒转染效率的检测细胞接种于6孔板上,按感染复数(multiplicity of infection, MOI)100 加入腺病毒,在感染3 d后用胰酶(0.25%)消化转染的细胞,将细胞吹打成单个细胞,加入PBS,5 min,弃上清,再用PBS重新清洗2次,将细胞密度调整为1×106个/ml,上机检测,以未转染的细胞作为阴性对照。
1.5 CCK8法检测药物作用于Ad-skp2-siRNA转染的Eca109细胞的毒性将Eca109细胞用胰酶消化制成细胞悬液,分为正常对照组、实验组。使用细胞计数板计数,调整细胞浓度为7×104个/ml接种到96孔板上(100 μl/孔),将培养板置于培养箱中培养(37 ℃,体积分数5% CO2)24 h,待细胞贴壁后加入含奥沙利铂的培养基各100 μl,使得奥沙利铂的终浓度分别为(0 μg/ml、1.25 μg/ml、2.5 μg/ml、5 μg/ml、10 μg/ml、20 μg/ml、40 μg/ml),每组设2个复孔,待48 h后,向每孔加入10 μl CCK溶液,将培养板在培养箱内孵育1 h后,用酶标仪测定在450 nm处的吸光度值,然后计算抑制率:抑制率(%)=(正常对照组-实验组)/正常对照组。
1.6 细胞划痕实验检测Ad-skp2-siRNA对Eca109细胞增殖的影响细胞接种于24孔培养板中,分为正常对照组、腺病毒组,待长到完全融合时,用200 μl Tip头在每孔单层细胞上划痕,造成细胞伤口模型,后用PBS冲洗2次,继续培养。分别在0 h、6 h、12 h、24 h时用1%结晶紫染液染色,15 min后置于显微镜下观察伤口愈合程度并拍照1次。
1.7 侵袭实验按比例(1∶8)配置Matrgel胶50 μl并加入到Transwell小室内,干燥1 h;取实验组与正常对照组的Eca109细胞,胰酶消化,转入1.5 ml离心管,4 ℃ 15 000 r/min离心5 min,弃上清,细胞重悬于含100 g/L胎牛血清的RPMI 1640中,调整细胞浓度为5×104个/ml,各取200 μl加入上室,并在下室中加入含100 g/L胎牛血清的RPMI1640培养基1 500 μl;将24孔板置于体积分数5% CO2、37 ℃恒温培养箱中24 h,取出Transwell小室并用棉签擦掉上室内的Matrgel胶和上室内底部的细胞。行1%结晶紫固定并染色,置于显微镜下计数观察。
1.8 Western blotting检测耐药相关蛋白按MOI 100加入Ad-skp2-siRNA,72 h后收集细胞,冰PBS洗2次,加入含有蛋白酶抑制剂的细胞裂解液,于冰上裂解30 min,转入1.5 ml离心管,4 ℃ 1 000 r/min,离心5 min,取上清。蛋白上样量70 μg,10%的SDS-PAGE凝胶电泳分离蛋白,湿转120 min,电压70 V;5%脱脂奶粉室温封闭1 h,加抗Skp2 (1∶1 000)、抗Bcl-2 (1∶1 000)、抗Bax (1∶1 000)、抗MMP9 (1∶500)、抗MMP2 (1∶500)、抗E-cadherin (1∶1 000)、抗N-cadherin (1∶1 000),以a-tubulin为内参(1∶1 000),4 ℃孵育过夜,分别以羊抗兔二抗(1∶10 000)反应2 h,洗膜后ECL显色成像,Image J软件读出条带的灰度值,求出各目的条带与内参的灰度值比值,即相对蛋白含量,设control组的相对对照蛋白含量为1,计算各组与对照组的相对蛋白含量比值。
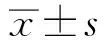
2 结果
2.1 转染效率实验组与正常对照组的细胞分别通过流式细胞仪和Western blotting检测转染效率。实验组转染率为95.4%,对照组转染率为2.05%(见图1)。
2.2 Ad-skp2-siRNA转染Eca109细胞后对药物敏感性的影响分别以1.25 μg/ml、2.5 μg/ml、5 μg/ml、10 μg/ml、20 μg/ml、40 μg/ml浓度的奥沙利铂作用于正常对照组与腺病毒组48 h后测得IC50为17.37 μg/ml,以奥沙利铂浓度为横坐标,OD值为纵坐标,绘制生长曲线,实验组与正常对照组相比,OD值差异有统计学意义(P<0.05,见图2)。
2.3 Ad-skp2-siRNA转染Eca109细胞后对其迁移能力的影响实验组与正常对照组在0 h、6 h、12 h、24 h的细胞侵袭结果显示(见图3),加入Ad-skp2-siRNA的实验组(7.0±1.3)与正常对照组(22.1±3.5)比较,相同时间内穿过24孔-小室微孔膜数减少,差异有统计学意义(P<0.05,见图4);与肿瘤细胞迁移有关的蛋白:MMP2显著增加[(98.1±4.6)%vs(125.8±2.7)%](P<0.05),MMP9显著减少[(99.3±1.2)%vs(38.1±2.5)%](P<0.05,见图5)。
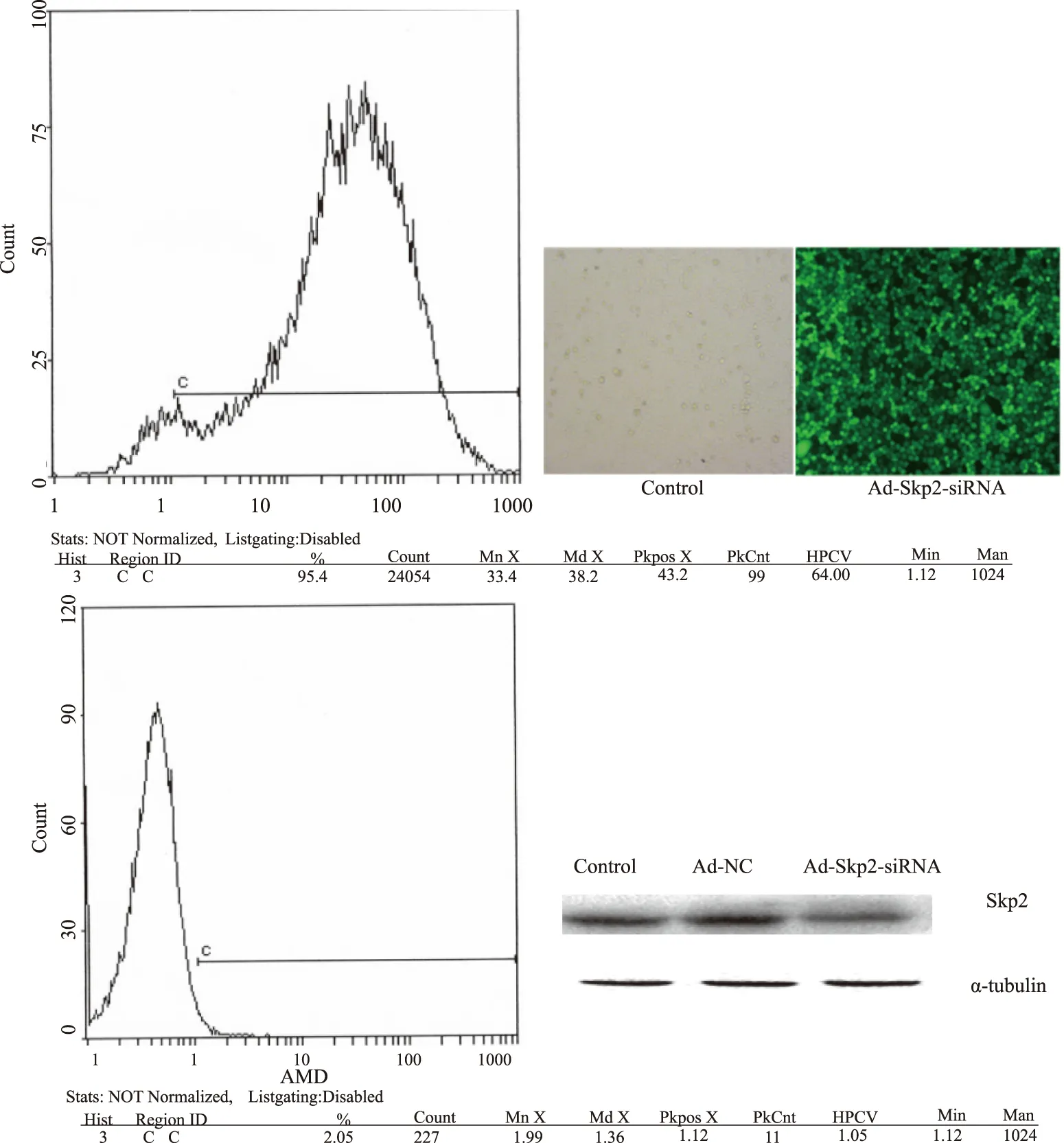
图1 流式测转染效率、免疫荧光及Western blotting检测沉默效果
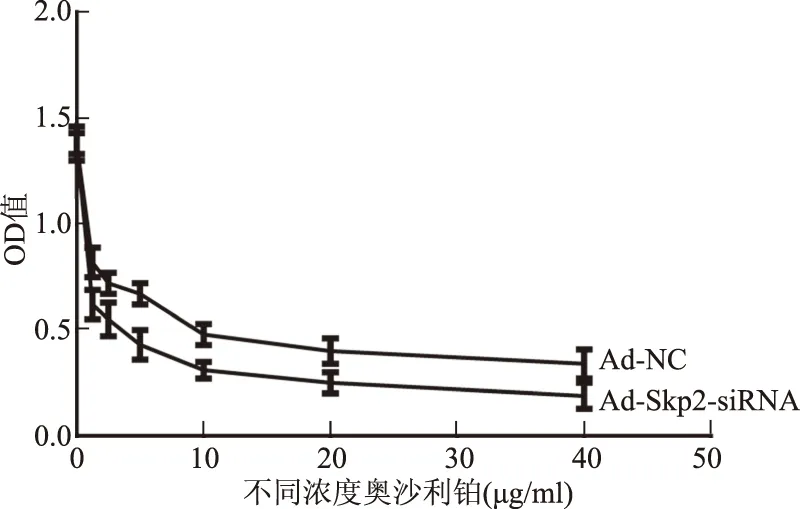
图2 食管癌Eca109细胞的增殖曲线
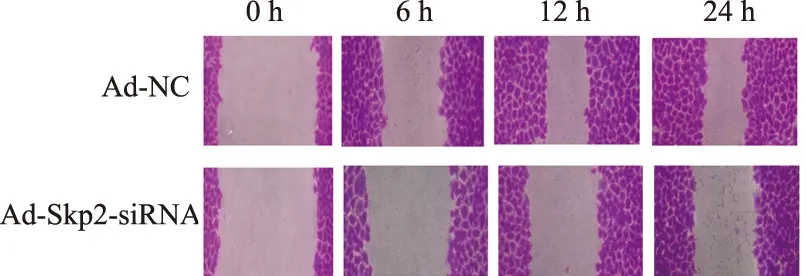
图3 不同时间点两组细胞迁移情况
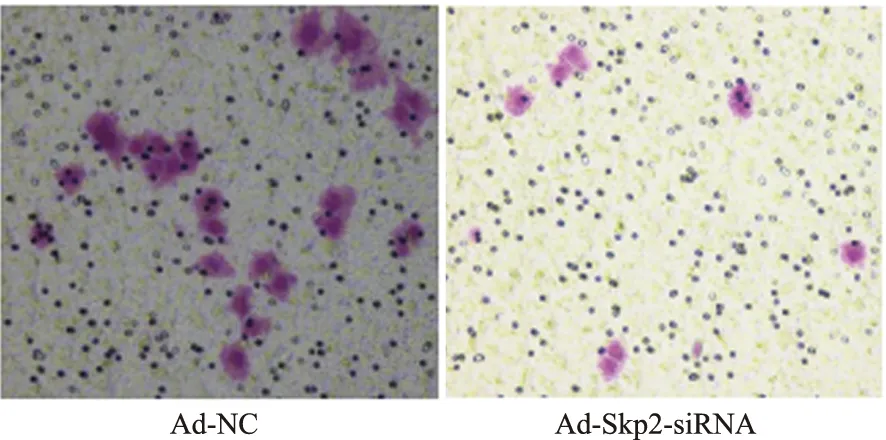
图4 Transwell 结果
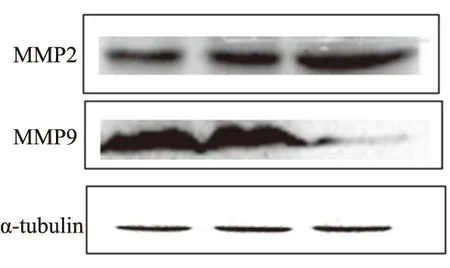
图5 Western blotting 检测相关蛋白水平
2.4 Western blotting检测有关增殖蛋白的表达Western blotting检测结果显示,加入腺病毒后,实验组与正常对照组比较:相关蛋白Bax显著增加[(38.2±4.7)%vs(98.1±3.1)%](P<0.05),Bcl-2显著减少[(122.1±3.2)%vs(75±2.2)%](P<0.05),E-cadherin显著增加[(40.2±3.8)%vs(110.1±3.7)%](P<0.05),N-cadherin显著减少[(93.2±3.3)%vs(65.0±1.7)%](P<0.05,见图6)。
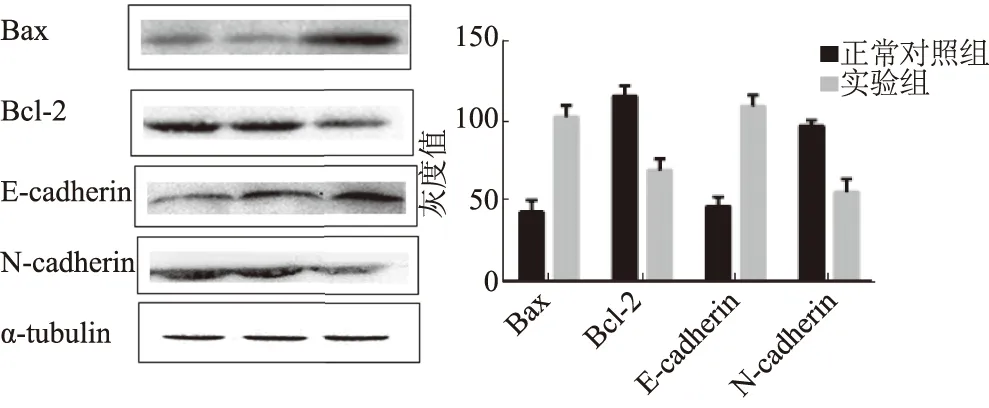
图6 实验组与正常对照组的相关蛋白表达
Fig 6 The expressions of apoptosis related proteins in experimental group and normal control group
3 讨论
食管癌是5年生存率<16%的高度恶性肿瘤,对于已转移的肿瘤,88%的患者选择外科手术治疗[6],所以,对于术后的化疗十分重要。奥沙利铂是目前食管癌化疗的一线药物,以铂类化疗药为基础的多药耐药是食管癌治疗中的主要问题之一[7-8]。由于耐药机制的复杂性,所选择的靶点基因也应涉及耐药机制的多环节,Skp2是F-box蛋白家族成员之一,具有癌蛋白的特性,是细胞周期中重要的调节因子,能特异性识别磷酸化底物并介导其泛素化降解, 其通过降解多种细胞周期调控因子,调节细胞周期S、G2期的运行。Skp2还参与细胞衰老相关信号转导调控和转录调控,研究证实磷酸化功能域缺失的Skp2突变蛋白可彻底失去其促进细胞增殖与致癌作用[9-11]。
本实验旨在研究Ad-skp2-siRNA与体外培养的Eca109细胞的关系,采用CCK8验证了Ad-skp2-siRNA能够降低Eca109细胞的耐药性,且随着浓度的增加,抑制效果愈加明显;采用划痕实验和侵袭实验直观地表示Ad-skp2-siRNA能够显著地抑制Eca109细胞的迁移,且与侵袭相关的蛋白MMP2的显著升高与MMP9的显著降低也从Western blotting方面验证了Ad-skp2-siRNA对Eca109细胞的迁移的抑制作用;文中与凋亡有关的Bcl-2的降低与Bax的升高证明了Ad-skp2-siRNA增加了Eca109细胞凋亡的能力,也证明了沉默Skp2能够促进食管癌细胞发生凋亡,抑制其增殖,介导细胞黏附的相关蛋白E-cadherin的增加与N-cadherin的降低也从细胞连接与迁移方面证明了Ad-skp2-siRNA对于Eca109细胞的抑制作用。
综上所述,Ad-skp2-siRNA能够增加Eca109细胞对药物的敏感性,抑制Eca109细胞的迁移及增值,但腺病毒是通过何种通路以及过程中所包含的一系列细胞活动还有待进一步深入研究,但这也为临床上抵抗肿瘤细胞的耐药及抑制肿瘤的转移找到了一个新的契机。
[1]Zhang H, Kabayashi R, Galakitionov K, et al. p19Skpl and p45Skp2 are essential elements of the cyclinA-CDK2 S phase kinase [J]. Cell,1995, 82(6): 915-925.
[2]Rebucci M, Michiels C. Molecular aspects of cancer cell resistance to chemotherapy [J]. Biochem Pharmacol, 2013, 85(9): 1219-1226.
[3]廉超, 谢玉波, 肖强. RNA干扰在胃癌多药耐药中的研究进展[J]. 世界华人消化杂志, 2013, 21(12): 1096-1101. Lian C, Xie YB, Xiao Q. Role of RNA interference in research of multidrug resistance in gastric cancer [J]. World Chinses Journal of Diegestology, 2013, 21(12): 1096-1101.
[4]魏刚, 孙泽群, 孔霞, 等. Skp2-siRNA重组腺病毒载体构建及鉴定[J]. 湖北医药学院学报, 2011, 30(2): 109-111, 115. Wei G, Sun ZQ, Kong X, et al. Construction and identification of recombinant adenovirus vector of SiRNA targeting skp2 [J]. J HBUM, 2011, 30(2): 109-111, 115.
[5]Fang L, Hu Q, Hua Z, et al. Growth inhibition of a tongue squamous cell carcinoma cell line (Tca8113) in vitro and in vivo via siRNA-mediated down-regulation of skp2 [J]. Int J Oral Maxillofac Surg, 2008, 37(9): 847-852.
[6]Yu L, Wu WK, Gu C, et al. Obatoclax impairs lysosomal function to block autophagy in cisplation-sensitive and -resistant esophageal cancer cells [J]. Oncotarget, 2016, 7(12): 14693-14707.
[7]徐桂芳, 张伟杰, 周志华, 等. 肿瘤干细胞与多药耐药[J]. 国际肿瘤学杂志, 2012, 39(12): 902-904. Xu GF, Zhang WJ, Zhou ZH, et al. Cancer stem cells and multidrug resistance [J]. J Int Oncol, 2012, 39(12): 902-904.
[8]司鑫鑫, 孙玉洁. DNA甲基化异常与肿瘤耐药[J]. 遗传, 2014, 36(5): 411-419. Si XX, Sun YJ. Aberrant DNA methylation and drug resistance of tumor cells [J]. Hereditas, 2014, 36(5): 411-419.
[9]Chan CH, Li CF, Yang WL, et al. The Skp2-SCF E3 ligase regulates Akt ubiquitination, glycolysis, herceptin sensitivity, and tumorigenesis [J]. Cell, 2012, 149(5): 1098-1111.
[10]魏刚, 王璠, 王斌, 等. Skp2基因沉默对大肠癌细胞SW480生物学特性的影响[J]. 湖北医药学院学报, 2013, 32(5): 363-366, 376, 457. Wei G, Wang F, Wang B, et al. Effects of Skp2 gene silence on biological characteristics of human colorectal cancer cells [J]. J HBUM, 2013, 32(5): 363-366, 376, 457.
[11]王斌, 宋军, 孙泽群, 等. Skp2-siRNA构建及其对食管癌细胞Eca-109 p27和Bcl-2蛋白表达的影响[J]. 湖北医药学院学报, 2011, 30(1): 11-15. Wang B, Song J, Sun ZQ, et al. Skp2 siRNA construction and its effects on p27, Bcl-2 expression of esophageal carcinoma cell Eca-109 [J]. J HBUM, 2011, 30(1): 11-15.
(责任编辑:马 军)
Effects of S-phase kinase-associated protein 2 gene silence on proliferation of esophageal cancer Eca109 cells
XU Qianqian, LI Caili, CHENG Dan, SUN Zequn
Department of Gastroenterology, Hubei University of Medicine, Shiyan People’s Hospital, Shiyan 442000, China
Objective To observe the effects of S-phase kinase-associated protein 2 (Skp2) gene silence on proliferation of esophagus cancer Eca109 cell.Methods Ad-skp2-siRNA was transfected into Eca109 cells. Flourescence microcope, flow cytometry and Western blotting were used to detect transfecting efficiency. The metastatic potential and apoptosis were examined by cell wound model, CCK8 assay, Boyden chamber invasion assay and Western blotting in vitro.Results Ad-skp2-siRNA inhibited the proliferation and migration of Eca109 cells, showed time-dose dependent. Ad-skp2-siRNA could influence the expressions of resistance proteins, the difference was significant (P<0.05).Conclusion Skp2 gene silence can contribute to inhibite the proliferation and migration of Eca109 cells.
S-phase kinase-associated protein 2; Esophageal cancer; Proliferation
徐倩倩,硕士,住院医师,研究方向:食管癌的基因易感性。E-mail: 455482761@qq.com
孙泽群,博士,主任医师,研究方向:食管癌的基因易感性。E-mail: wwwszq@163.com
10.3969/j.issn.1006-5709.2017.02.017
R735.1
A 文章编号:1006-5709(2017)02-0177-04
2016-04-23
