磁场对氨水吸收烟气中CO2的促进作用
2017-06-05张琦吴佳艺卢平吴涛邵静萍邓晓艳
张琦,吴佳艺,卢平,吴涛,邵静萍,邓晓艳
磁场对氨水吸收烟气中CO2的促进作用
张琦,吴佳艺,卢平,吴涛,邵静萍,邓晓艳
(南京师范大学能源与机械工程学院,江苏南京210042)
开发了一种新型磁场辅助氨法烟气脱碳技术。含碳烟气通入混有磁性颗粒的氨水溶液,在外加磁场的作用下发生脱碳反应。对该技术的运行特性开展了实验研究。结果表明,外加8 mT恒稳磁场,2 g·L-1纳米级Fe3O4颗粒,氨水的CO2脱除效率比不添加磁场和颗粒时最多可提高8.8%。外加磁场可以有效提高低浓度氨水的CO2脱除效率。在模拟烟气流量增加时,外加磁场能有效减缓CO2脱除效率下降的趋势。同时,外加磁场使得CO2脱除效率曲线向低温方向移动5℃,有助于提高低温条件下的CO2脱除效率。磁场可提高气液接触效率、降低相间传质阻力、增强氨水反应活性,从而提高氨水吸收CO2性能。
二氧化碳捕集;磁场;氨水;吸收;纳米颗粒
引 言
近年来,温室效应引起了全球各地极端气候的发生,为缓解温室效应,碳捕集与封存技术(CCS)逐渐成为研究热点。化学吸收法是最具有发展潜力的CCS技术之一[1]。考虑到燃煤烟气流量大、CO2浓度偏低(13%~15%)、含多种酸性气体(SO2、NO2)和痕量杂质等情况,以醇胺类溶液为吸收剂开展燃煤烟气碳捕集时,存在设备投资和运行费用高昂、吸收剂再生能耗大、吸收剂易降解和吸收液有腐蚀性等问题[2]。与醇胺类溶液相比,氨水具有CO2吸收能力强、再生能耗低、不易降级、腐蚀性低、可实现多污染物联合脱除和副产品可利用等突出优点[3-5],氨法脱碳技术逐渐受到研究者的重视。
针对氨法脱碳技术基础理论方面的研究包括:CO2-NH3-H2O系统的热力学特性、氨水吸收CO2的化学反应机理、氨水吸收和再生的动力学特性和氨法脱碳的系统能耗等[6-12]。自从Powerspan公司推出氨法多污染物(SO2、NO和CO2)联合脱除技术(ECO2post-combustion regenerative process),Alstom公司推出深冷氨法脱碳技术(chilled ammonia process,CAP)后,面向工业应用的氨法脱碳技术的研究取得重要进展。深冷氨法被视为最有市场前景的氨法脱碳技术,但相关示范工程的运行也显现出一些问题:吸收反应在0~20℃(甚至0~10℃)内进行,氨水CO2吸收速率降低;烟气和吸收剂的冷却都需要额外的能耗;在较低温度下产物易结晶,造成设备堵塞,影响系统运行的稳定性[13]。
近期氨法脱碳技术的研究集中于脱碳系统集成和优化、脱碳过程强化、氨逃逸抑制、固体沉淀物生成抑制、再生能耗降低和新工艺开发等方 面[14-17]。各种反应器,包括填料塔、喷淋塔、湿壁塔、超重床、三相循环流化床和气体吸收膜都被引入氨法脱碳技术[18-25]。多种添加剂,包括乙醇、哌嗪、氨基酸、氨基乙磺酸和聚乙二醇二甲醚等物质,都能提高氨水的CO2吸收速率或降低氨逃逸率,有时两者兼备[26-27]。由上述研究可见,从热力学角度,提高氨水吸收CO2和吸收氨气的能力、降低吸收过程的反应热;从动力学角度,增加反应概率、增强反应活性、降低传质阻力,是提高氨法脱碳效率和经济性的根本途径。
在气液两相体系中加入微细颗粒,可强化气液相间传质过程,从而提高气相吸收速率[28]。TiO2纳米颗粒可提高碳酸丙烯酯对CO2的物理吸收速 率[29]。SiO2、Al2O3和TiO2等纳米颗粒可提高醇胺类溶液对CO2的化学吸收速率,并且这3种颗粒对CO2解吸过程也存在促进作用[30]。Al2O3、Fe2O3、ZnFe2O4等纳米颗粒可使得氨水溶液对氨气的有效吸收率提高50%以上,且每种颗粒都存在最佳添加量[31]。
使用微细颗粒强化气液传质时,通常需要控制微细颗粒在溶液中的空间分布,从而真正达到强化气液传质的目的。当微细颗粒为磁性物质时,外加低强度的磁场,可形成一种特殊的反应器——磁稳床。磁稳床床层压降小、气泡少、相间返混少、相间传热传质效果好、可流化微细颗粒[32]。该类床体在化工、环保、生化、分离净化等领域都有应用实例。气液固三相磁稳床可降低加氢反应中非晶态合金催化剂耗量,提高反应效率,该技术已投入工业化生产[33]。液固磁稳床用于乙醇酵取、淀粉水解、蛋白质吸收、免疫球蛋白净化和抗生素制备等生化反应时,可达到良好的效果[34]。气固磁稳床用于烟气脱硫[35]和脱硝[36]等工艺时,在提高气固接触效率的同时,还能促进反应活性,污染物脱除效率能得到显著的提升。
将含碳烟气通入混有磁性颗粒的氨水溶液,在外加磁场的作用下发生脱碳反应,形成了新型的氨法脱碳技术——磁场辅助氨法烟气脱碳技术。本文研究了磁场条件下,氨水浓度、烟气流量、CO2浓度和反应温度等运行参数对氨水CO2脱除效率的影响规律,并对磁场强化机理进行了初步的探索,为新技术的开发奠定基础。
1 实验材料和方法
1.1 实验系统与实验装置
1.1.1 实验系统 磁场辅助鼓泡床氨水烟气脱碳实验系统如图1所示,由模拟烟气系统、加磁恒温鼓泡床、烟气净化与分析系统组成。模拟烟气由N2和CO2按一定比例配制后,经混气罐输送到鼓泡床反应器中,在外加磁场(extrenal magnetic field,EMF)的作用下发生脱碳反应,脱碳后的烟气依次经过水洗瓶、酸洗瓶、干燥管和CO2分析仪,净化后排空。实验系统中另设一条旁路,用以测试初始CO2浓度。
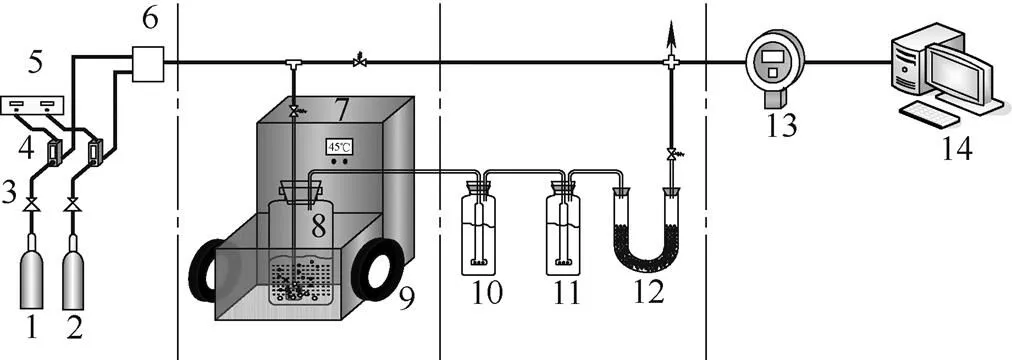
图1 磁场辅助鼓泡床氨水烟气脱碳实验系统
1—N2; 2—CO2;3—pressure reducing valve; 4—mass flow controller; 5—mass flow indicator; 6—mixed tank; 7—constant temperature bath; 8—bubbling reactor; 9—permanent magnets; 10—washing bottle; 11—pickling bottle; 12—CaCl2drying tube; 13—CO2online analyzer; 14—computer
1.1.2 磁场发生装置 外加磁场由永磁铁产生。本实验采用由上海亘昌磁材公司生产的两种规格的永磁铁,分别可产生100和120 mT的恒稳磁场。实验时,将永磁铁设置在鼓泡床外围,产生覆盖鼓泡床反应区域的垂直磁场。磁场布置方式如图2 所示。
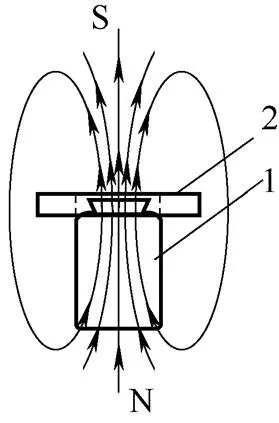
图2 磁场布置
1—bubbling reactor; 2—permanent magnet
1.2 实验物料
实验中使用的氨水由市售氨水和去离子水按一定比例配制。市售氨水质量分数25%~28%,AR,生产厂家为南京化学试剂有限公司。CO2和N2纯度大于99.999%,由南京天泽气体有限公司生产。实验中采用的磁性颗粒为Fe3O4颗粒,其平均粒径为30 nm,纯度大于98%,由杭州万景新材料有限公司生产。
1.3 分析测试仪器
CO2分析仪,FIX550-CO2-G-IR型,深圳市万安迪科技有限公司。X射线能谱仪,D/max2500/PC型,日本理学公司。
1.4 实验工况
实验中鼓泡反应器内氨水体积为500 ml,外加磁场强度为8 mT,颗粒添加量为2 g·L-1。其他实验工况条件见表1。
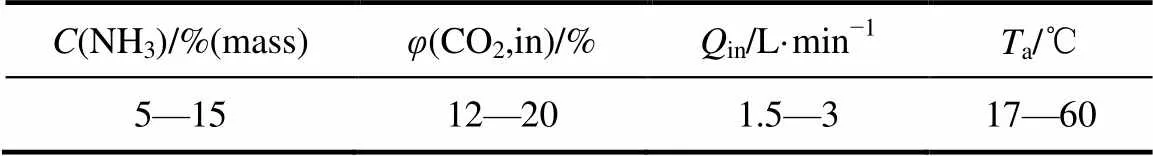
表1 实验工况
CO2脱除效率由式(1)计算
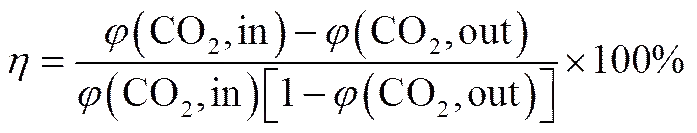
2 实验结果与讨论
2.1 磁场对氨水吸收CO2的强化作用
在反应温度20℃,模拟烟气流量2.0 L·min-1,氨水浓度5%,CO2浓度20%工况下,选取无磁场无颗粒、仅有磁场、仅有颗粒、颗粒和磁场协同作用条件4种情况开展实验研究,考察外加磁场和磁性颗粒的协同作用效果。实验结果如图3所示。
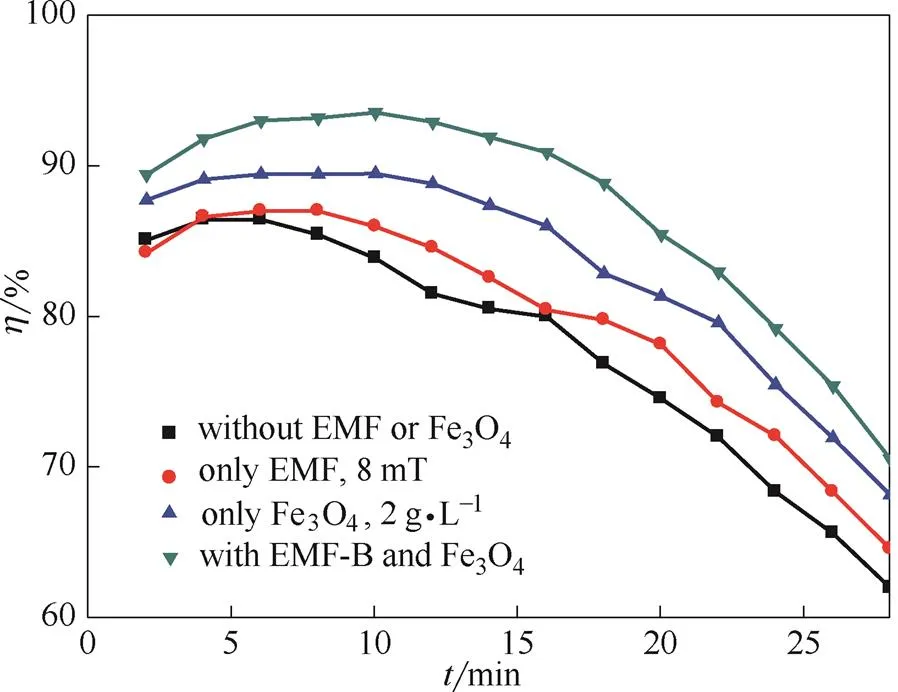
图3 外加磁场和磁性颗粒协同强化效果
图3记录了2.5~28 min内CO2脱除效率随时间变化规律。图3中的4条曲线均呈现先增长,然后持平,最后下降的趋势。但是对应的时间段长短不一。初始氨水明显过量,CO2脱除效率维持较高水平,随着时间增长,氨水的含碳量增加,CO2脱除效率呈现下降趋势。刚开始,CO2脱除效率在短时间内呈现上升趋势,源于反应器内流场的稳定和气液接触效果的改善。后续文中所取的CO2脱除效率均为相应工况下CO2脱除效率的最大值。
在同一时刻,外加磁场和磁性颗粒协同作用下CO2脱除效率最高,其次为仅有纳米Fe3O4颗粒的情况,再次为仅有磁场作用的情况,单纯氨水的CO2脱除效率最低。外加磁场和磁性颗粒协同作用下的CO2脱除效率最高可达到94.3%,而单纯氨水最高为85.5%,两者相差8.8%。
仅添加8 mT的外加磁场,CO2脱除效率会有小幅度提升。磁场可促进氨水对氨气的吸收[37-38],氨水中氨浓度上升,氨水和CO2的反应进行得更加充分,CO2的液相传质系数会提高,最终会导致CO2脱除效率的提高。实验系统中,在反应器后方设置了水洗瓶收集逃逸氨气。半连续实验结束后,水洗瓶中去离子水的pH,可以体现氨逃逸总量的大小。分别对有、无磁场条件下反应前、后水洗瓶内的去离子水pH进行了测量,结果见表2。

表2 水洗瓶中溶液pH的对比
由表2可知,反应前有、无磁场时,水洗瓶中的pH相当,而反应后有磁场时的pH明显小于无磁场的情况。即有磁场时水洗瓶中捕集到的氨气明显少于无磁场的情况。由此可见,有磁场时更多氨气参与了CO2吸收反应。
仅添加2.0 g·L-1的Fe3O4颗粒,CO2脱除效率也会有提升。这是由于在气液反应体系中添加纳米级颗粒后,颗粒在液相中运动会引起涡流,可达到破碎和挤压气泡的效果,同时颗粒搅拌了液体,使反应中气液界面的面积增加,促使气液充分接触和反应[39],从而提高了CO2脱除效率。同时,有颗粒存在时,反应物在气液两相的传质阻力都明显下降,也导致CO2脱除效率明显上升。因此,仅添加颗粒也可达到促进CO2吸收的效果。
外加磁场和磁性颗粒的协同作用,一方面体现在虽然外加磁场的场强较低,但使用磁性颗粒后,磁性颗粒被磁场磁化,可在反应器内产生较高强度的磁场。在较高强度磁场作用下,氨水吸收过程可得到进一步强化,CO2脱除效率也可得到明显提升。另一方面,磁稳床中,颗粒在磁场中的分布更加均匀,CO2和氨水的气液接触效率得到进一步提升,从而提高了CO2脱除效率。
2.2 磁场作用下运行参数对CO2脱除效率的影响
2.2.1 氨水浓度对CO2脱除效率的影响 图4给出了烟气流量2.0 L·min-1,CO2浓度20%,温度20℃时,有、无磁场两种条件下,CO2脱除效率随氨水浓度(5%~15%)的变化趋势。由图可知,在任意氨水浓度条件下,有磁场时的CO2脱除效率都明显高于无磁场时的情况;无磁场时,CO2脱除效率随氨水浓度的下降而明显下降;有磁场时,CO2脱除效率随氨水浓度的下降而小幅下降,低浓度氨水也能获得较高的CO2脱除效率。外加磁场可使5%氨水的CO2脱除效率达到95%左右,而无磁场时需要10%氨水才能获得这一效率。
氨水吸收CO2的反应是可逆反应,随着氨水浓度的下降,反应可能向逆反应方向移动,导致反应对CO2液相传质的促进作用减弱,进而导致CO2脱除效率下降。同时,氨水浓度较低时,氨液相传质动力小,传质速率也较低,也会导致CO2脱除效率的下降。
添加磁场后,氨水本身反应活性会增强,低浓度的氨水也会有较高的反应活性,化学反应对CO2吸收的促进作用不会明显减弱。同时,氨水液相传质阻力下降,也会抵消传质动力下降的不利影响,氨水液相传质速率不会出现明显下降。因此,有磁场时,低浓度氨水也能获得较高的CO2脱除效率。氨逃逸是制约氨法脱碳技术发展的瓶颈。高浓度氨水更易挥发。在低强度磁场的辅助作用下,应用低浓度氨水捕集烟气中的CO2,可兼顾效率和氨逃逸两方面的需求。
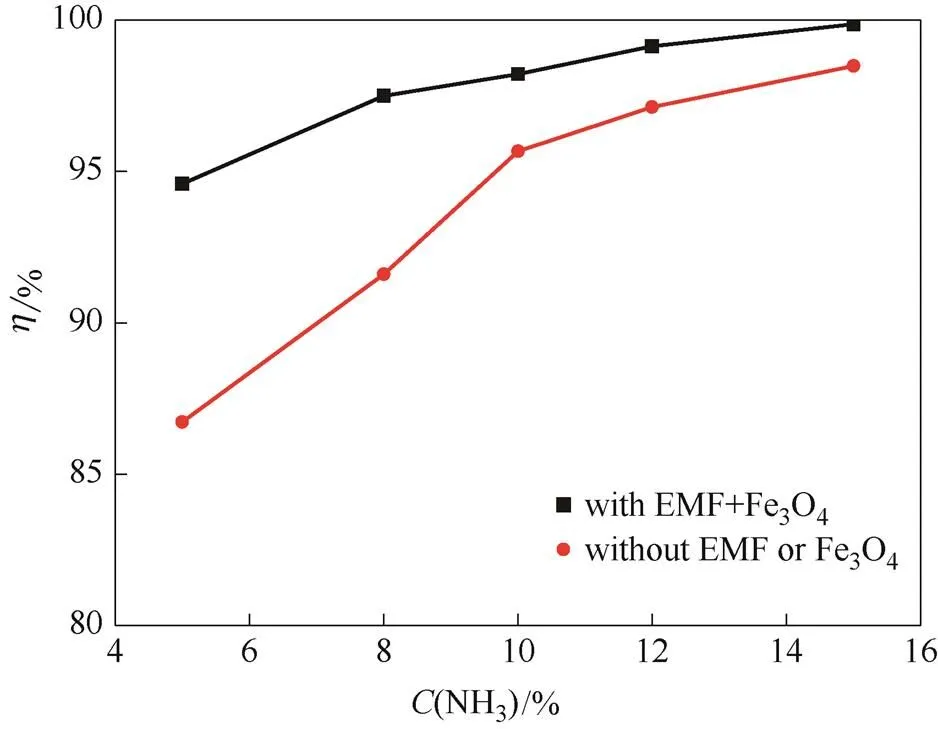
图4 氨水浓度对CO2脱除效率的影响
2.2.2 烟气流量对CO2脱除效率的影响 图5给出了氨水浓度8%,CO2浓度20%,温度20℃时,有、无磁场两种条件下,CO2脱除效率随烟气流量(1.5~3.5 L·min−1)的变化趋势。由图可知,在任意烟气流量条件下,有磁场时的CO2脱除效率都明显高于无磁场时的情况;无磁场时,CO2脱除效率随烟气流量的上升而明显下降;有磁场时,CO2脱除效率基本不随烟气流量的变化而变化。外加磁场能在烟气流量明显增加的情况下,维持很高的脱碳效率。
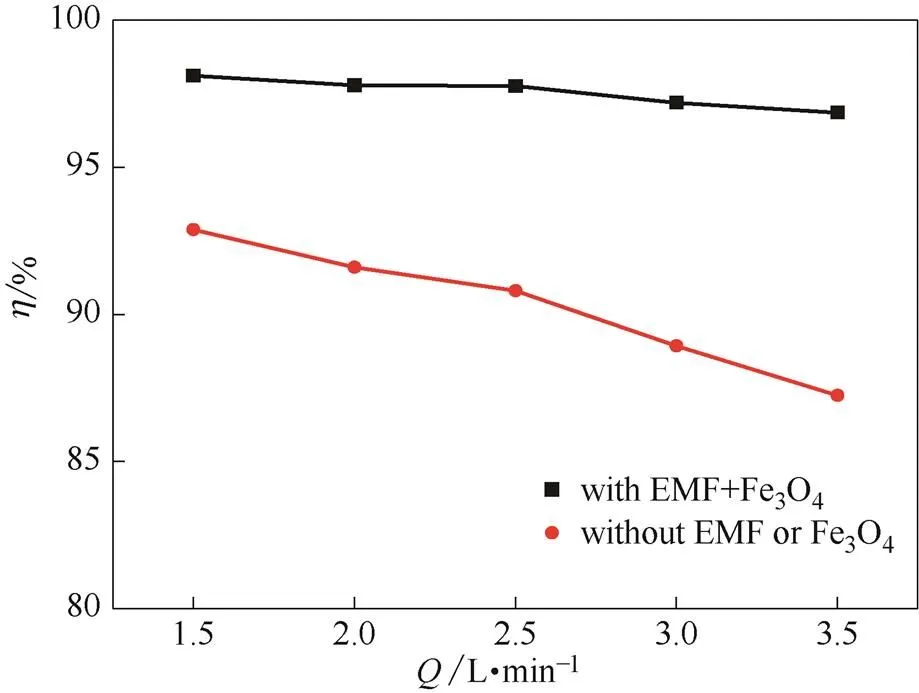
图5 烟气流量对CO2脱除效率的影响
随着烟气流量的增加,气流在氨水中的停留时间缩短,脱碳反应和传质过程不能充分进行,导致CO2脱除效率下降。而在磁场作用下,反应和传质都得到强化,停留时间的缩短,不会引起CO2吸收速率的降低。另外,烟气流速的加快还能使得颗粒的运动更加活跃,气液接触界面更大,传质阻力更小,CO2吸收速率和脱除效率都得到提高。因此,有磁场时,高流量烟气也可对应较高的CO2脱除 效率。
燃煤电厂烟气量会有波动的情况,在磁场的作用下,CO2脱除效率都能维持较高的水平,系统运行的稳定性增加。
2.2.3 CO2浓度对CO2脱除效率的影响 图6给出了氨水浓度8%,烟气流量2.0 L·min-1,温度20℃时,有、无磁场两种条件下,CO2脱除效率随CO2浓度(12%~20%)的变化趋势。由图可知,有磁场和无磁场时,随着CO2浓度上升,CO2脱除效率都略有下降,变化趋势基本一致。有磁场时的CO2脱除效率比无磁场时高5%左右。

图6 CO2浓度对CO2脱除效率的影响
随着CO2浓度的增加,一方面CO2气相分压增加,CO2气相传质得到强化;另一方面液相中的氨碳摩尔比相对减小,化学反应对CO2吸收的促进效果减弱,综合效果是CO2脱除效率略有下降。有磁场时,随着CO2浓度的增加,液相中的氨碳摩尔比同样会减小,CO2脱除效率也会略有下降。
2.2.4 反应温度对CO2脱除效率的影响 图7给出了氨水浓度8%,烟气流量2.0 L·min-1,CO2浓度20%时,有、无磁场两种条件下,CO2脱除效率随温度(20~60℃)的变化趋势。由图可知,有、无磁场两种条件下,随着温度的升高,CO2脱除效率都呈现先上升、后下降,最后又上升的趋势。相比无磁场时,有磁场时整个CO2脱除效率变化曲线向低温方向移动了5℃左右。在低于33℃,高于47℃温度区间,有磁场时的CO2脱除效率明显高于无磁场时的情况。在33~47℃温度区间,无磁场时的CO2脱除效率明显高于有磁场时的情况。
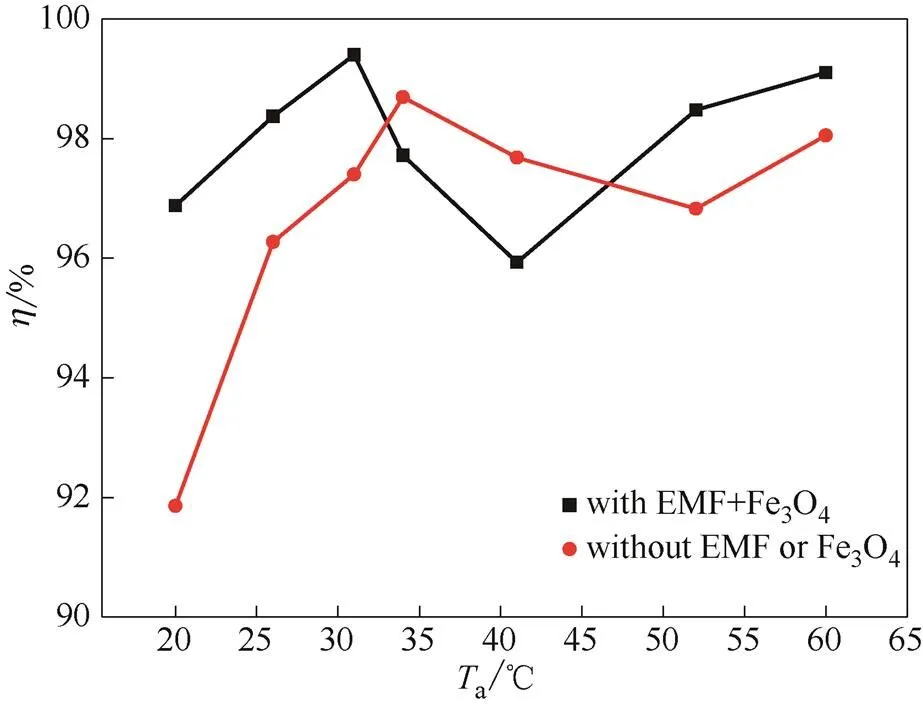
图7 反应温度对脱碳效率的影响
CO2与氨水在常温、常压条件下,主要生成NH2COONH4。
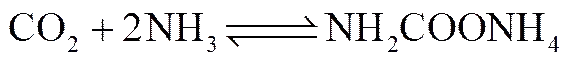
NH2COONH4很容易水解生成NH4HCO3
(3)
同时,NH3和H2O反应生成NH4OH
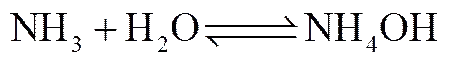
NH4HCO3与NH4OH反应生成(NH4)2CO3
(5)
(NH4)2CO3吸收CO2生成NH4HCO3

在中温段,有、无磁场两种条件下,温度的上升都会带来CO2脱除效率的下降。这是由于在这一温度区间,反应(5)逆向进行,即出现碳酸盐分解反 应[19,40],不利于CO2吸收。温度超过一定数值后,化学反应平衡又向正向移动,碳酸盐分解作用减小,溶液对CO2的吸收能力加强,促进了CO2脱除效率再次升高。
对比有、无磁场两种条件下的变化趋势可见,磁场对氨水与CO2的各个基元反应都存在促进作用。在低温和高温段,磁场可提高氨水吸收氨气的能力,同时降低反应物在气液两相的传质阻力,最终导致CO2脱除效率的上升。在中温段,磁场对盐酸盐的分解反应同样存在促进作用,从而导致CO2脱除效率的下降。
反应温度越高,氨水挥发性越高。添加磁场后,可在低温下获得较高的CO2脱除效率,氨逃逸现象可因为低温而获得有效的抑制。
2.3 反应前后铁磁颗粒成分对比
为研究Fe3O4颗粒是否与氨水或CO2发生化学反应,将反应结束后分离出的Fe3O4颗粒干燥,进行XRD分析,图8为脱碳反应前后Fe3O4颗粒的物相分析。
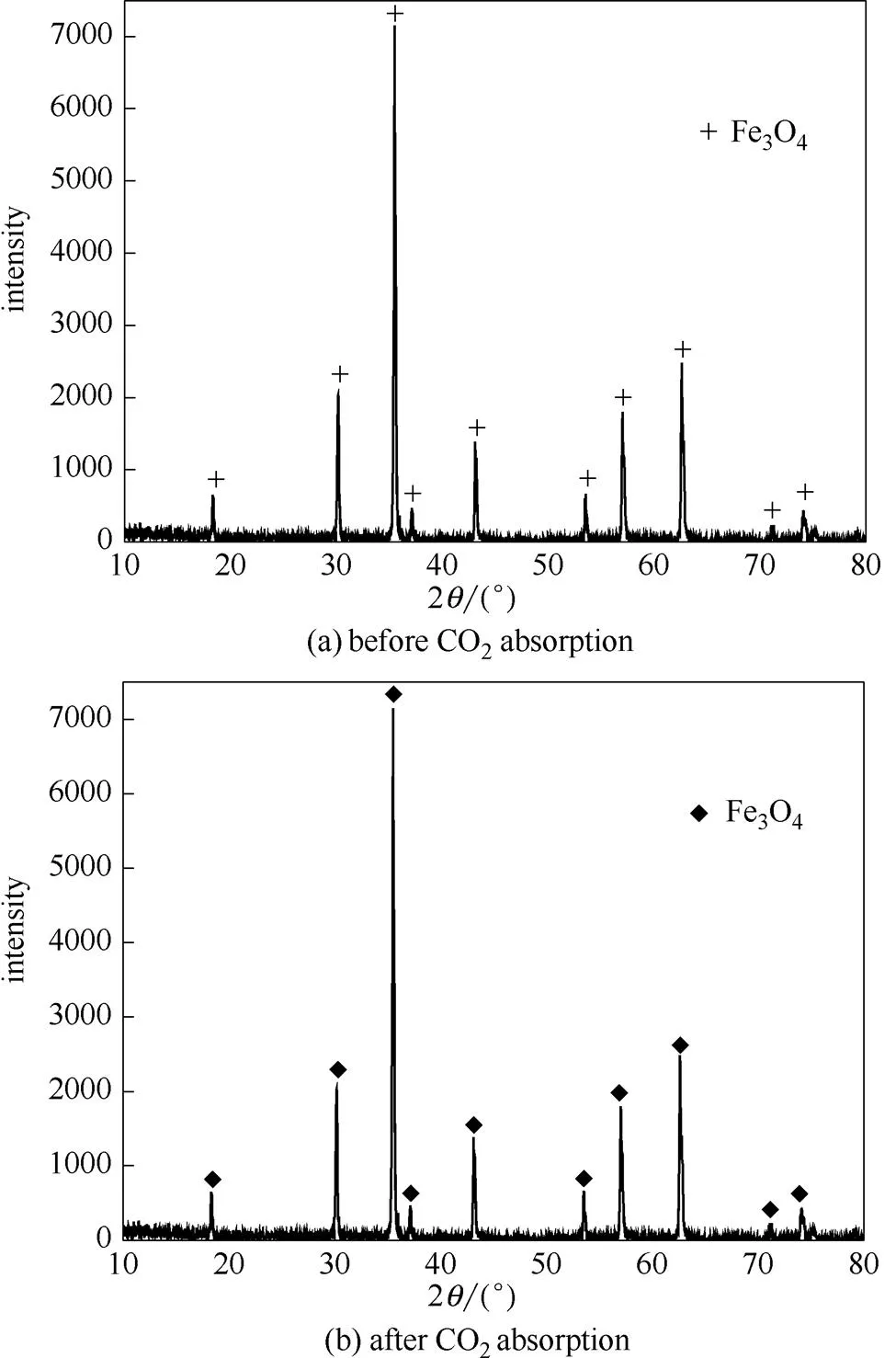
图8 反应前后Fe3O4的XRD谱图
通过标准Fe3O4粉末衍射卡峰形比对,图8(a)中标有+、图8(b)中标有◆的峰均为Fe3O4。(a)、(b)两组XRD衍射峰峰形尖锐,衍射强度高,在衍射角坐标方向上各峰一一对应,强度相当,各峰值对应角度几乎重合。因此可以判断,反应后Fe3O4颗粒未变性,Fe3O4颗粒并未与氨水或CO2发生化学反应。
3 结 论
(1)外加磁场和磁性颗粒可以促进反应过程中CO2的脱除,外加磁场和磁性颗粒协同作用时CO2脱除效率最高,其次为仅有颗粒的情况,再次为仅有磁场作用的情况。
(2)外加磁场能有效促进低浓度(5%~8%)氨水的CO2脱除效率。
(3)外加磁场能在烟气流量明显增加时(1.5~3.5 L·min−1),维持较高的CO2脱除效率。
(4)在12%~20%CO2浓度区间,外加磁场条件下CO2脱除效率随CO2浓度上升而略有下降,相比无外加磁场条件下CO2脱除效率高5%。
(5)外加磁场条件下CO2脱除效率随温度的升高出现波动,在正反应为主的温度区间,外加磁场可以提高CO2脱除效率,在逆反应为主的温度区间,外加磁场使得CO2脱除效率降低。外加磁场促使CO2脱除效率变化曲线出现向低温方向移动了5℃左右。
(6)铁磁颗粒不与氨水或CO2发生反应。磁场对氨水吸收CO2的促进机理主要在于:提高气液接触效率、降低相间传质阻力和增强氨水反应活性。
符 号 说 明

C(NH3)——氨水浓度,% Qin——进口模拟烟气量,L·min-1 Ta——反应温度,℃ η——脱碳效率,% φ(CO2,in)——进口CO2浓度,% φ(CO2,out)——出口CO2浓度,% 下角标 in——吸收前 out——吸收后
References
[1] 朱德臣. 燃煤烟气CO2化学吸收技术研究 [D]. 杭州: 浙江大学, 2011. ZHU D C. Chemical absorption of CO2from flue gas [D]. Hangzhou: Zhejiang University, 2011.
[2] 陈健, 罗伟亮, 李晗. 有机胺吸收二氧化碳的热力学和动力学研究进展 [J]. 化工学报, 2014, 65 (1): 12-21. CHEN J, LUO W L, LI H. Advances in thermodynamics and kinetics of organic amine to absorb carbon dioxide [J]. CIESC Journal, 2014, 65 (1): 12-21.
[3] SHAKERIAN F, KIM K H, SZULEJKO J E,. A comparative review between amines and ammonia as sorptive media for post-combustion CO2capture [J]. Applied Energy, 2015, 148:10-22.
[4] BAI H, YEH A C. Removal of CO2greenhouse gas by ammonia scrubbing [J]. Industrial & Engineering Chemistry Research, 1997, 36 (6): 2490-2493.
[5] YEH A C, BAI H. Comparison of ammonia and monoethanolamine solvents to reduce CO2greenhouse gas emissions [J]. Science of the Total Environment, 1999, 228 (2): 121-133.
[6] KIM Y J, YOU J K, HONG W H,. Characteristics of CO2absorption into aqueous ammonia [J]. Separation Science and Technology, 2008, 43 (4): 766-777.
[7] QIN F, WANG S J, HARTONO A,. Kinetics of CO2absorption in aqueous ammonia solution [J]. International Journal of Greenhouse Gas Control, 2010, 4 (5): 729-738.
[8] PARK S Y, YI K B, CHANG H K,. Selection of optimal operating conditions for a continuous CO2-capture process using an aqueous ammonia solution [J]. Energy & Fuels, 2010, 24 (6): 3704-3709.
[9] VERSTEEG P, RUBIN E S. A technical and economic assessment of ammonia-based post-combustion CO2capture at coal-fired power plants [J]. International Journal of Greenhouse Gas Control, 2011, 5 (6):1596-1605.
[10] ZHANG M K, GUO Y C. Rate based modeling of absorption and regeneration for CO2capture by aqueous ammonia solution [J]. Applied Energy, 2013, 111 (4): 142-152.
[11] DANIEL S, MATTEO G, MARCO M. Formation of solids in ammonia-based CO2capture processes-identification of criticalities through thermodynamic analysis of the CO2-NH3-H2O system [J]. Chemical Engineering Science, 2015, 133: 170-180.
[12] QUE H L, CHEN C C. Thermodynamic modeling of the NH3-CO2-H2O system with electrolyte NRTL model [J]. Industrial & Engineering Chemistry Research, 2011, 50 (19): 11406-11421.
[13] BAK C U, ASIF M, KIM W S. Experimental study on CO2capture by chilled ammonia process [J]. Chemical Engineering Journal, 2014, 265 (5): 1-8.
[14] YU J, WANG S. Development of a novel process for aqueous ammonia based CO2capture [J]. International Journal of Greenhouse Gas Control, 2015, 39: 129-138.
[15] 马双忱, 陈公达, 温佳琪, 等. 氨法脱碳过程中氨逃逸规律及其抑制 [J]. 化工学报, 2016, 67 (5): 2064-2069. MA S C, CHEN G D, WEN J Q,. Ammonia escape and its prevention in CO2absorption process using ammonia solution [J]. CIESC Journal, 2016, 67 (5): 2064-2069.
[16] 张宇, 高建民, 何明月, 等. 两种强化低碳化度氨水结晶的新型氨法脱碳工艺 [J]. 化工学报, 2015, 66 (6): 2123-1230. ZHANG Y, GAO J M, HE M Y,. Two kinds of new carbon capture technology by ammonia based on reinforced crystallization [J]. CIESC Journal, 2015, 66 (6): 2123-1230.
[17] 冷浩, 高建民, 张宇, 等. 强化结晶氨法脱碳实验研究 [J]. 化工学报, 2016, 67 (6): 2440-2448. LENG H, GAO J M, ZHANG Y,. Carbon capture by ammonia with reinforced crystallization [J]. CIESC Journal, 2016, 67 (6): 2440-2448.
[18] 彭远昌, 赵兵涛, 李蕾蕾, 等. 鼓泡式反应器高径比对氨法烟气脱碳性能的影响 [J]. 化工环保, 2013, 33 (3): 206-209. PENG Y C, ZHAO B T, LI L L,. Effect of bubble reactor height to diameter ratio of ammonia flue gas decarbonization performance [J]. Environmental Protection of Chemical Industry, 2013, 33 (3): 206-209.
[19] 马双忱, 孙云雪, 赵毅, 等. 氨水捕集模拟烟气中二氧化碳的实验与理论研究 [J]. 化学学报, 2011, 69 (12): 1469-1474. MA S C, SUN Y X, ZHAO Y,. Experimental and theoretical studies simulated flue gas ammonia trapping carbon dioxide [J]. Acta Chemical, 2011, 69 (12): 1469-1474.
[20] 刘芳. 再生氨法脱除燃煤电厂烟气中二氧化碳的实验研究 [D]. 北京: 清华大学, 2009.LIU F. Experimental study of regeneration ammonia removal of carbon dioxide in the flue gas of coal-fired power plant [D]. Beijing: Tsinghua University, 2009.
[21] RESNIK K P, PENNLINE H W. Study of an ammonia-based wet scrubbing process in a continuous flow system [J]. Fuel, 2013, 105 (1):184-191.
[22] MA S C, ZANG B, SONG H H,. Research on mass transfer of CO2absorption using ammonia solution in spray tower [J]. International Journal of Heat & Mass Transfer, 2013, 67 (12): 696-703.
[23] KONG D J, ZHANG Y F, LI N,. Experimental investigation on gas-liquid flow, heat and mass transfer characteristics in a dual-contact-flow absorption tower [J]. Chemical Engineering Research & Design, 2014, 92 (1): 13-24.
[24] ZHAO B T, SU Y X, TAO W W. Mass transfer performance of CO2capture in rotating packed bed: dimensionless modeling and intelligent prediction [J]. Applied Energy, 2014, 136: 132-142.
[25] LI J L, CHEN B H. Review of CO2absorption using chemical solvents in hollow fiber membrane contactors [J]. Separation & Purification Technology, 2005, 41 (2): 109-122.
[26] YANG N, YU H, XU D Y,. Amino acids/NH3mixtures for CO2capture: effect of neutralization methods on CO2mass transfer and NH3vapour loss [J]. Energy Procedia, 2014, 63: 773-780.
[27] LI L, CONWANE W, PUXTY G,. The effect of piperazine (PZ) on CO2absorption kinetics into aqueous ammonia solutions at 25.0℃ [J]. International Journal of Greenhouse Gas Control, 2015, 36: 135-143.
[28] ZHI H L, LEE K T, BHATIA S,. Post-combustion carbon dioxide capture: evolution towards utilization of nanomaterials [J]. Renewable & Sustainable Energy Reviews, 2012, 16 (5): 2599-2609.
[29] JUNG J Y, LEE J W, KANG Y T. CO2absorption characteristics of nanoparticle suspensions in methanol [J]. Journal of Mechanical Science and Technology, 2012, 26 (8): 2285-2290.
[30] JIANG J Z, ZHAO B, CAO M,. Chemical absorption kinetics in MEA solution with nano-particles [J]. Energy Procedia, 2013, 37: 518-524.
[31] YANG L, DU K, NIU X F,. Experimental study on enhancement of ammonia-water falling film absorption by adding nano-particles [J]. International Journal of Refrigeration, 2011, 34 (3): 640-647.
[32] ZENG P, ZHOU T, YANG J S. Behavior of mixtures of nano-particles in magnetically assisted fluidized bed [J]. Chemical Engineering and Processing, 2008, 47: 101-108.
[33] 宗保宁, 慕旭宏, 孟祥堃, 等. 镍基非晶态合金加氢催化剂与磁稳定床反应器的开发与工业应用 [J]. 化工进展, 2002, 21 (8): 536-539. ZONG B N, MU X H, MENG X K,. Amorphous skeletal nickel-based alloy catalyst and magnetically stabilized bed reactor [J]. Chemical Industry & Engineering Progress, 2002, 21 (8): 536-539.
[34] LIU Y A, KEITY H, COLBERG R. Fundamental and practical developments of magnetofluidized beds [J]. Powder Technology, 1991, 64 (1/2): 3-41.
[35] ZHANG Q, GUI K T, WANG X B. Effects of magnetic fields on improving mass transfer in flue gas desulfurization using a fluidized bed [J]. Heat and Mass Transfer, 2016, 52: 331-336.
[36] 姚桂焕, 陆芳, 王芳, 等. 铁基磁流化床SCR烟气脱硝的磁场效应 [J]. 工程热物理学报, 2009, 31: 439-442. YAO G H, LU F, WANG F,. Reaction mechanism of flue gas desulfurization magnetically fluidized bed strengthen iron-based magnetic field effect fluidized-bed selective catalytic reduction flue gas denitrification [J]. Journal of Engineering Thermophysics, 2009, 31: 439-442.
[37] 张春, 武卫东, 李增扬, 等. 磁场及纳米磁性流体强化氨水鼓泡吸收实验研究 [J]. 磁性材料及器件, 2014, 45 (3): 21-24.ZHANG C, WU W D, LI Z Y,. Experimental study of ammonia bubble absorption of magnetic field and magnetic nanoparticles hydroenhancement [J]. Journal of Magnetic Materials and Devices, 2014, 45 (3):21-24.
[38] 武卫东, 庞常伟, 盛伟, 等. 单体Ag纳米流体强化氨水鼓泡吸收特性 [J]. 化工学报, 2010, 61 (5): 1112-1117. WU W D, PANG C W, SHENG W. Enhancement effects of Ag nanoparticles on ammonia bubble absorption [J]. CIESC Journal, 2010, 61 (5): 1112-1117.
[39] 齐国杰. 氨水溶液联合脱除二氧化碳和二氧化硫的研究 [D]. 北京: 清华大学, 2013. QI G J. Ammonia-based capture of CO2and SO2from flue gas [D]. Beijing: Tsinghua University, 2013.
[40] 牛振祺, 郭印诚, 林文漪. MEA, NaOH与氨水喷雾捕集CO2性能 [J]. 清华大学学报(自然科学版), 2010, (7): 1130-1134. NIU Z Q, GUO Y C, LIN W Y. MEA, NaOH and ammonia spray CO2capture performance [J]. Journal of Tsinghua University (Science and Technology Edition), 2010, (7): 1130-1134.
CO2absorption by aqueous ammonia solution with use of external magnetic field
ZHANG Qi, WU Jiayi, LU Ping, WU Tao, SHAO Jingping, DENG Xiaoyan
(School of Energy and Mechanical Engineering, Nanjing Normal University, Nanjing 210042, Jiangsu, China)
A novel ammonia-based CO2capture process was proposed in the paper. The process uses magnetically gas-solid-liquid bed as the reactor in which the ferromagnetic particles suspend in aqueous ammonia solutions under the influence of external magnetic field (EMF). A continuous of CO2passed through the reactor was absorbed by aqueous ammonia. Experiments in a laboratory-scale apparatus were carried out to investigate the roles of EMF. The results showed that the highest CO2absorption efficiency with 8 mT EMF and 2 g·L-1nano-magnetic particles reached 94.3%, more than 8.8% compared to that without EMF and nanoparticles. CO2absorption efficiency with EMF and nanoparticles increased significantly under the conditions of low concentration aqueous ammonia (5%—8%), large flux of simulated flue gas (3.5 L·min-1) and low absorption temperature (22—36℃). The enhancement of CO2absorption under the influence of EMF and nanoparticles should be attributed to good gas-liquid contact, large mass transfer coefficient and high reactivity of aqueous ammonia.
CO2capture; magnetic field; aqueous ammonia solution; absorption; nanoparticles
10.11949/j.issn.0438-1157.20161596
X 701.7;X 511
A
0438—1157(2017)06—2555—08
卢平。
张琦(1978—),女,博士,副教授。
国家自然科学基金项目(51606105);江苏省自然科学基金项目(BK20130905)。
2016-11-10收到初稿,2017-02-26收到修改稿。
2016-11-10.
Prof. LU Ping, luping@njnu.edu.cn
supported by the National Natural Science Foundation of China (51606105) and the Natural Science Foundation of Jiangsu Province (BK20130905).
