邻苯二甲酸二甲酯(DMP)对黄瓜抗氧化代谢及果实品质的影响
2017-06-05张颖董俊伟王蕾范新会孙瑞雪张惠单德鑫
张颖,董俊伟,王蕾,范新会,孙瑞雪,张惠,单德鑫
(东北农业大学资源与环境学院,哈尔滨 150030)
邻苯二甲酸二甲酯(DMP)对黄瓜抗氧化代谢及果实品质的影响
张颖,董俊伟,王蕾,范新会,孙瑞雪,张惠,单德鑫
(东北农业大学资源与环境学院,哈尔滨 150030)
以黄瓜(Cucumissativus L.)为材料,通过分析邻苯二甲酸二甲酯(DMP)处理对黄瓜成株叶片中抗氧化酶活性、脯氨酸含量、丙二醛含量、果实品质的影响及DMP在黄瓜体内的积累情况,研究DMP对黄瓜的生态毒性效应。结果显示:30mg·L-1的DMP处理下叶片抗氧化酶活性增加,果实营养价值降低,但黄瓜植株生长及干物质积累变化不大;50mg·L-1处理下,叶片抗氧化酶在盛花期达到最大值,随着处理时间延长黄瓜叶片的抗氧化酶活性、干物质积累及营养价值均降低;而100和200mg·L-1处理下的黄瓜叶片,抗氧化酶活性始终低于对照处理组的水平,干物质积累随着DMP处理浓度增加呈下降趋势,且果实均在幼果期出现萎蔫致死现象;DMP在黄瓜植株内的积累量随其浓度升高而增加(茎>根>叶)。上述结果表明,DMP污染会影响黄瓜正常的生理生化指标,降低黄瓜果实的品质,会产生潜在的健康风险。
DMP;黄瓜;抗氧化酶;干物质量;果实品质
酞酸酯(PAEs)即邻苯二甲酸酯,PAEs主要包括DMP(邻苯二甲酸二甲酯)、DEP(邻苯二甲酸二乙酯)、DBP(邻苯二甲酸二丁酯)、DNOP(邻苯二甲酸二正辛酯)、DEHP(邻苯二甲酸二(2-乙基己基)酯)和BBP(邻苯二甲酸丁基苄酯)等[1],在化工生产中常被用作增塑剂和软化剂[2]。在众多的增塑剂中,PAEs的生产和消费量最大,占我国增塑剂产量的90%以上[3]。我国的生物、水体、大气等各种环境样品中广泛检出了PAEs[4],我国农业种植区土壤遭受到了不同程度的PAEs污染,含量水平一般在μg·kg-1至mg·kg-1数量级,污染程度不一[5]。我国是一个农业大国,设施农业在整个农业中占有很大比例,由于PAEs类化合物在农膜中的大量使用且PAEs类化合物与介质之间以非共价键结合,容易扩散到土壤中,被根吸收而进入植株,影响其生长以及果实的品质[6]。因此,研究对PAEs类化合物的吸收和积累是考察PAEs的环境行为和生态效应的重要环节。
邻苯二甲酸二甲酯(DMP)是PAEs中侧链最短的一种化合物,分子量最小,结构简单,毒性很强,相对水溶性高,易被吸收,通过食物链进入人体和动物体。研究表明PAEs具有内分泌干扰效应,通过破坏内源性激素及其受体干扰动物和人类的发育和生殖系统[7]。因此,DMP已经被美国环境保护局(USEPA)、中国及其他国家列为优先控制污染物[8]。蔺琰东等[9]的研究表明,DMP对马铃薯组培苗的正常生长有逆境胁迫作用,使得马铃薯组培苗株高下降、新叶数减少,还会影响其他正常的生理功能。吴志辉等[10]研究了DMP对海洋浮游的影响,结果表明毒性效应表现在该藻的叶绿素a含量降低,藻体的生理生化代谢。
在我国,由于农膜的大量使用,造成农产品中存在较高的DMP检出率,有研究发现78个食物样本中DMP的检出率达到82%,最大含量达到97μg·kg-1[11]。近年来许多关于PAEs氧化效应的研究主要集中于各种动物和细胞[12],关于PAEs对蔬菜作物生长阶段的生物效应报道较少,只有少数关于蔬菜作物在PAEs胁迫下的生理指标变化和超微结构的研究。黄瓜是一种重要的设施蔬菜,素有“瓜菜之王”的美誉[13]。本研究以DMP为污染物,以典型设施蔬菜黄瓜为研究对象,研究DMP胁迫对黄瓜始花期、盛花期、结果期、衰老期叶片抗氧化系统的变化,黄瓜果实品质及DMP在植株内的积累,初步探究黄瓜对DMP胁迫的应答,分析DMP对黄瓜的生态毒性效应,为降低土壤中DMP污染以及为提高蔬菜粮食生产的安全性提供相关参考。
1 材料与方法
1.1 供试材料
本实验使用的种子为天津市农科院技术有限公司的津研4号黄瓜种子(Cucumis sativus L.),用1%的高锰酸钾溶液消毒、洗净备用。DMP(C10H10O4)购自国药集团化学试剂有限公司,微黄色液体,纯度≥99.5%。
1.2 实验设计
黄瓜种子在蛭石中发芽并浇灌不含DMP的霍格兰营养液。待第三片真叶完全展开,黄瓜幼苗被移植到装满蛭石的陶瓷盆里[东北农业大学园艺站大棚,白天温度(27±1)℃,夜间温度(20±1)℃,空气湿度60%~70%]。用污染浓度分别为0、30、5、100、200mg· L-1的DMP溶液处理黄瓜幼苗[12]。每3~5 d浇灌一次霍格兰营养液,每处理3个重复。对始花期、盛花期、结果期、衰老期的叶片SOD、POD、CAT酶活性进行检测,同时对结果期果实产量、品质及DMP积累量,衰老期根、茎、叶中DMP积累量进行检测。
1.3 抗氧化酶活性测定
取0.5 g新鲜黄瓜叶片,用5 mL pH7.0的50 mmol·L-1磷酸缓冲液,0.2mmol·L-1乙二胺四乙酸,1 mmol·L-1抗坏血酸和2%(W/V)聚乙烯吡咯烷酮,提取粗酶液,测定CAT、POD、SOD活性[14]。
1.3.1 超氧歧化酶(SOD)活性的测定
采用氮蓝四唑法(NBT)测定SOD活性[15]。配制浓度为50mmol·L-1的PBS(pH7.8)缓冲液,内含浓度为0.1mol·L-1的EDTA溶液,13.37mmol·L-1的甲硫氨酸,20μmol·L-1的核黄素以及77.12μmol·L-1的NBT。以上溶液混合作为反介质,以缓冲液代替酶液作为对照。将加入物质混匀以后,放入光照培养箱中光照10min,在波长为560 nm处,测定吸光值,一个酶活性单位定义为引起NBT还原的50%抑制所需的酶量,酶活性为U·mg-1FW。
1.3.2 过氧化物酶(POD)活性的测定
POD活性的测定采用愈创木酚法[16]。将3mL反应液(内含愈创木酚、0.2mmol·L-1磷酸缓冲液、30% H2O2)和20μL酶提取液加入试管中进行反应,同时以等量的PBS代替酶液作为对照。在470 nm处测定OD值,每个1min记录1次,共计5min。定义以每分钟内A470改变0.01为1个酶活性单位(U),酶活性以U·mg-1FW表示。
1.3.3 过氧化氢酶(CAT)活性的测定
CAT活性采用紫外吸收法[17]。将粗酶提取液按照表1加入反应液,25℃预热后,逐管加入3mL 0.1 mol·L-1的H2O2,每加完一管立即计时,并迅速倒入比色杯中,测定240 nm处吸光值,每隔1min计数1次,共测4min,每组3个重复。一个酶活性单位定义为在1min内分解1μmolH2O2的酶的量,酶活性以U·mg-1FW表示。
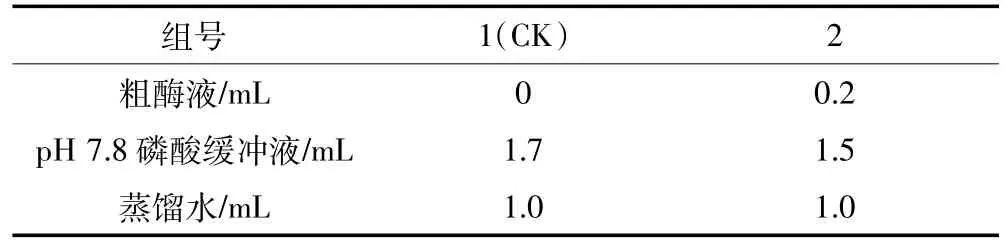
表1 CAT活性测定配制表Table 1 The determination ofCATactivity configuration
1.4 脯氨酸(Pro)含量的测定
Pro含量采用磺基水杨酸法测定[18]。称取不同浓度DMP处理下的黄瓜叶片各0.5 g,加到盛有5mL 3%磺基水杨酸的提取液中,100℃水浴10min。冷却后,取提取液2mL、冰醋酸2mL和2.5%酸性茚三酮试剂2 mL于试管中,沸水浴中显色30min。冷却后用甲苯萃取,在520 nm处测定吸光值,单位为μg·g-1FW。
1.5 丙二醛(MDA)含量的测定
叶片中MDA含量采用硫代巴比妥酸法[18]测定。冰浴研钵中加入不同DMP浓度处理下的黄瓜叶片各0.3 g,然后加入2mL预冷的0.05mol·L-1磷酸缓冲液进行研磨后,提取液置于3000 r·min-1离心机中离心15min,上清液用于MDA含量测定。分别于532、600、450 nm处测定OD值,单位为mmol·g-1FW。
1.6 果实品质的测定
随机称取同一处理条件下新鲜的单株黄瓜样品,果实有机酸含量的检测采用酸碱滴定法;可溶性糖含量的测定采用蒽酮法;采用考马斯亮蓝G-250法测定蛋白质含量;采用2,6-二氯靛酚滴定法测定维生素C(VC)含量。随机称取同一处理条件下烘干后的单株黄瓜样品,计算成株干重[19],每处理3个重复。
1.7 DMP残留量的测定
对不同浓度DMP(0、30、50、100、200mg·L-1)处理下的黄瓜衰老期根、茎、叶中DMP积累量及果实中DMP含量分别进行检测。随机称取同一处理条件下烘干后的单株黄瓜样品5 g,用正己烷和丙酮混合液提取12 h后,将提取液置于旋转蒸发仪上进行浓缩,抽取1mL置于棕色小瓶中,用GC-MS对DMP的含量进行测定[20],每处理3个重复。
1.8 数据处理
所有数据均使用SPSS 19.0软件进行处理,采用t检验进行Duncan多重比较,P<0.05(差异性显著),揭示不同浓度DMP对于不同时期黄瓜的生长影响,数据均为5次重复实验的平均值(mean)±标准偏差(SD)。图表使用Origin 8.0及Excel2010绘制。
2 结果与分析
2.1 DMP处理对黄瓜不同生育期叶片SOD活性的影响
结果显示,随着DMP处理浓度的增加,叶片中的SOD活性呈“先升后降”趋势,当处理浓度为50mg·L-1时,叶片中的SOD活性达到最高;当DMP处理浓度超过50mg·L-1时,SOD活性被显著抑制(P<0.05)。同时,随着黄瓜生育期的延长,叶片中SOD活性也呈“先升后降”趋势,在盛花期,叶片中的SOD活性达到最高(图1)。在盛花期和衰老期,不同浓度对黄瓜SOD活性的影响较大,并且在衰老期时,出现随浓度升高,SOD活性降低的趋势。在始花期和结果期,处理浓度不超过50mg·L-1时,SOD活性无显著差异(P<0.05)。
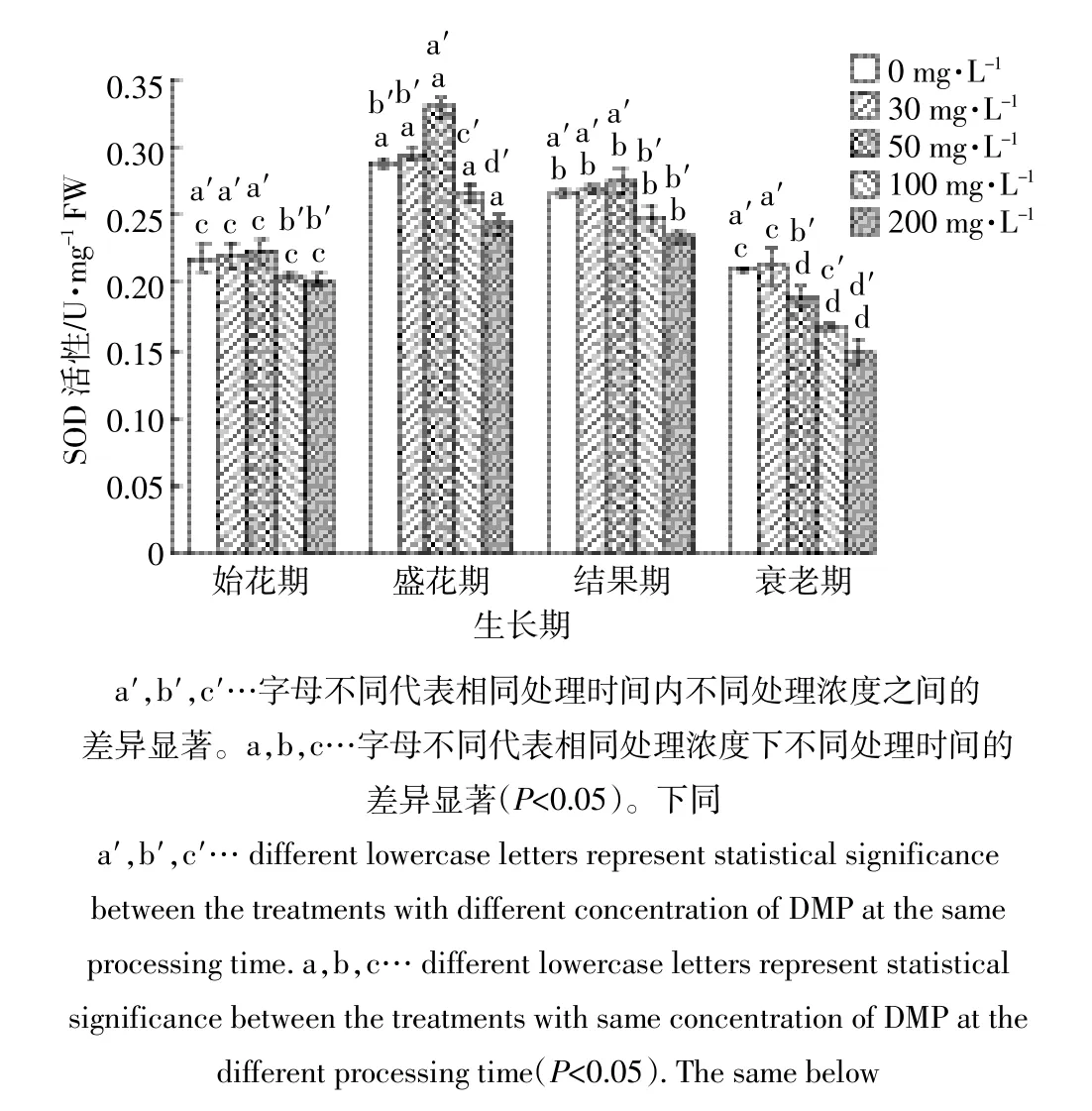
图1 DMP处理对不同生育期黄瓜叶片SOD活性的影响Figure 1 EffectofDMP treatmentson SOD activity ofcucumber leaves in differentgrowth stages
2.2 DMP处理对黄瓜不同生育期叶片POD活性的影响
随着处理时间延长,各浓度处理组POD活性均呈现先上升后下降的趋势(图2),在盛花期达到最大值。不同处理浓度对于POD活性的影响,亦为先随着浓度增加表现出促进,当浓度大于50mg·L-1,表现出抑制。在衰老期,浓度在30mg·L-1时,POD活性达到最大值,而在其他时期,在浓度为50mg·L-1时达到最大值。
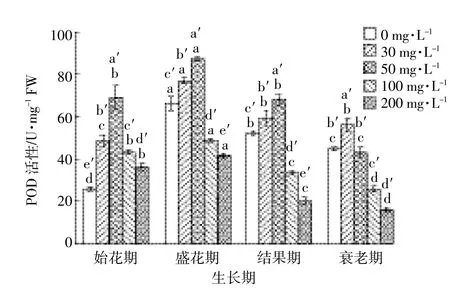
图2 DMP处理对不同生育期黄瓜叶片POD活性的影响Figure2 EffectofDMP treatmentson POD activity ofcucumber leaves in differentgrowth stages
2.3 DMP处理对黄瓜不同生育期叶片CAT活性的影响
随着DMP处理浓度的增加,CAT活性的差异并不显著(P<0.05),但仍呈先上升后下降的趋势,当浓度达到200mg·L-1,都表现出抑制。在结果期,随着浓度的增加,CAT活性呈先升再降,而后又上升再下降的趋势(图3)。随着生育期的延长,CAT活性呈先上升后下降的趋势,始花期和衰老期的CAT活性较小。
2.4 DMP处理对黄瓜不同生育期叶片脯氨酸含量的影响
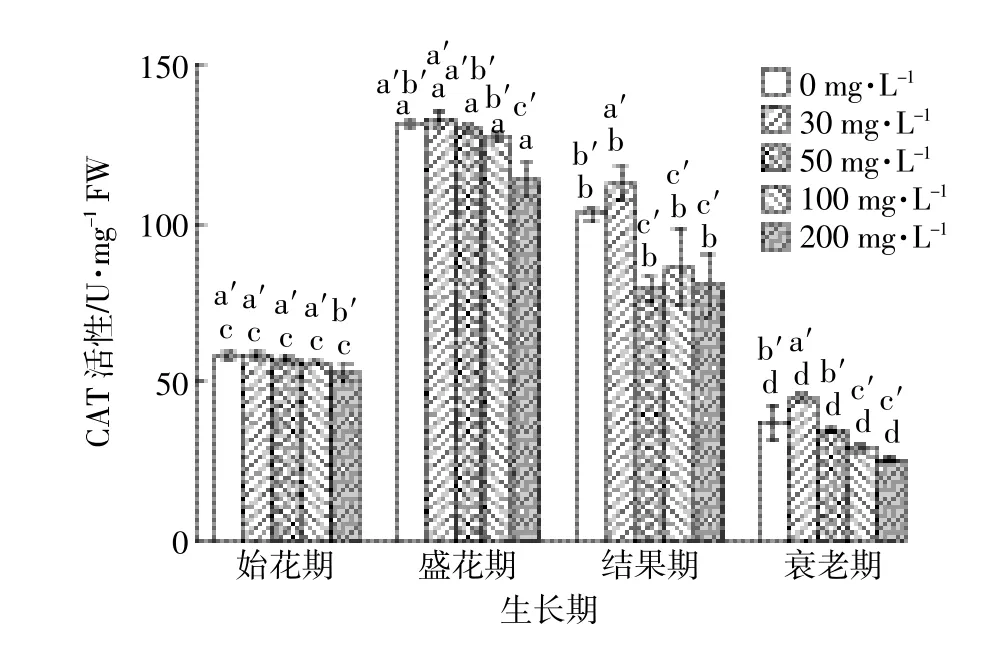
图3 DMP处理对不同生育期黄瓜叶片CAT活性的影响Figure 3 EffectofDMP treatmentson CATactivity ofcucumber leaves in differentgrowth stages
脯氨酸在植株渗透调节过程中起重要作用。随着浓度的增加,Pro含量都呈上升趋势。在衰老期,随着浓度的增加,DMP先促进Pro含量增长,后表现出抑制。随着时间的增加,黄瓜植株的Pro含量表现出增长的趋势,盛花期与结果期的差异不明显(图4)。
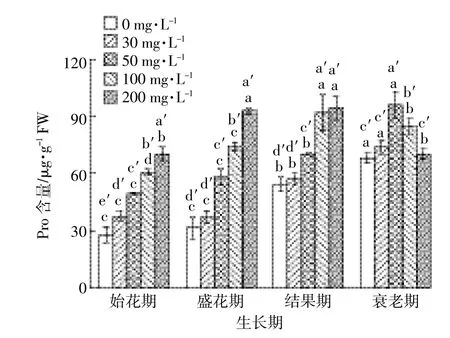
图4 DMP处理对不同生育期黄瓜叶片Pro含量的影响Figure 4 EffectofDMP treatmentson Pro contentsof cucumber leaves in differentgrowth stages
2.5 DMP处理对黄瓜不同生育期叶片MDA含量的影响
胁迫条件下体内MDA会大量积累。由图5可知,所有浓度DMP处理组,黄瓜叶片中MDA含量都随着DMP浓度的增加和时间的推移而积累增加。整个过程中,只有30mg·L-1DMP处理组与对照组均无显著性差异,而其他浓度DMP处理组叶片中MDA含量与对照组均表现出显著性差异,并且差异随时间的延续而增大。这说明,高于30mg·L-1DMP处理对黄瓜叶片产生严重的氧化损伤。
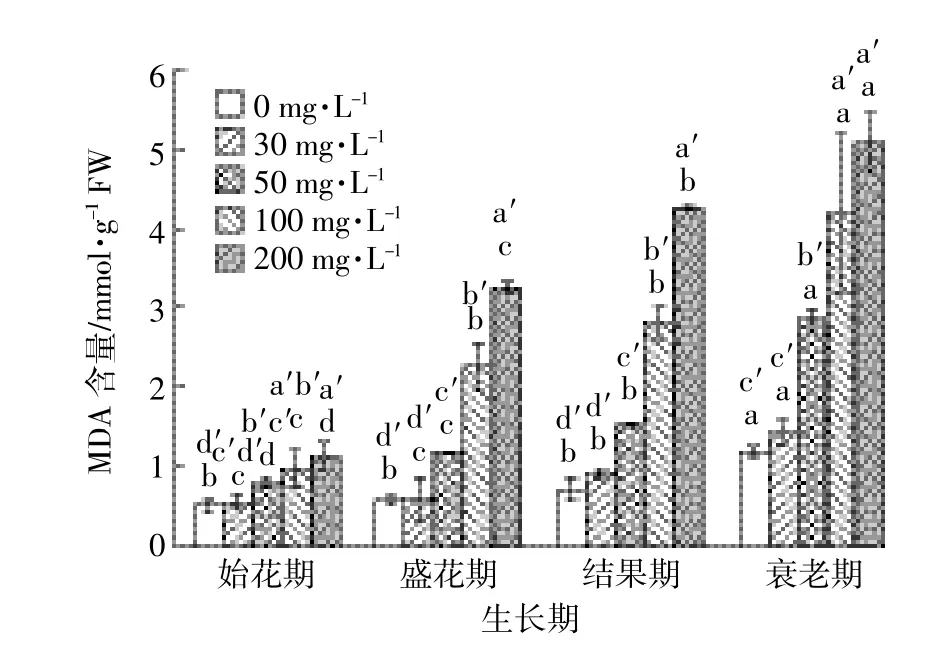
图5 DMP处理对不同生育期黄瓜叶片MDA含量的影响Figure5 EffectofDMP treatmentson MDA contentsofcucumber leaves in differentgrowth stages
2.6 黄瓜成株干物质量和DMP积累特性研究
与对照组相比,所有DMP处理组都显著影响了根部干重。30mg·L-1的处理对根部干物质量的积累起促进作用,而其他处理组对根部干物质的积累起抑制作用(表2);30mg·L-1的处理显著促进了黄瓜植株茎干物质量的积累,其他处理组显著抑制茎部干物质量的积累且低于对照的水平;30mg·L-1的处理对叶干重的影响显著高于对照,而浓度为50mg·L-1时差异不显著,当浓度高于50mg·L-1时叶部干物质量积累明显受到抑制,显著低于对照。DMP在对照组黄瓜成株植株根、茎、叶中均未被检测到(表3)。根部DMP在低浓度(30、50mg·L-1)处理组中的积累量与对照相比无显著差异,而在高浓度(100、200mg·L-1)处理组中均明显高于对照。DMP处理组黄瓜成株各茎和叶中DMP积累均显著高于对照,且随处理浓度的增大而增加。根、茎、叶中的DMP积累范围分别为ND~0.049 93mg·L-1、ND~0.068 6mg·L-1、ND~0.025 2mg· L-1,30mg·L-1处理,DMP积累分布表现为根>茎>叶,其余浓度分布均表现为茎>根>叶。这与长期DMP处理条件下DMP向上运输有关。总DMP积累量均随着处理浓度的增大而增大,且DMP积累主要集中在茎与根中,随着处理浓度的增大,黄瓜植株茎中DMP的积累总量愈加显著(图6)。
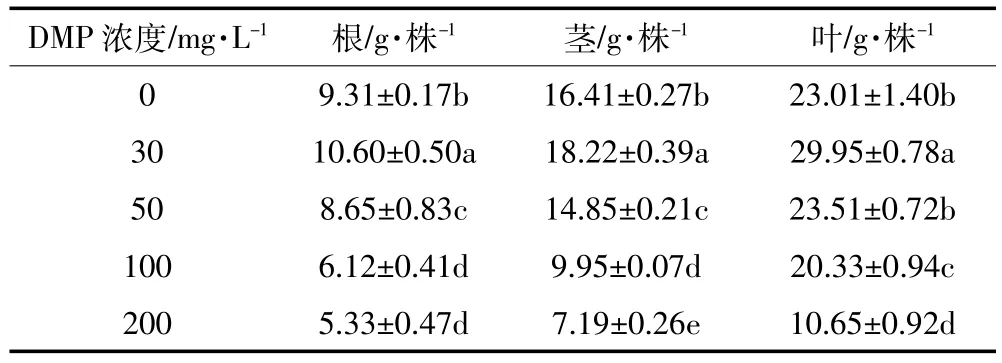
表2 DMP处理对黄瓜成株干重的影响Table 2 Effecton dryweightofcucumberadult-plant underDMP treatments
2.7 DMP对黄瓜结果和品质的影响
对照组和30、50mg·L-1DMP处理的黄瓜植株均开花结果,果实生长正常;100、200mg·L-1的DMP处理的黄瓜植株虽然也开花结果,但所结果实未能长到成熟收获就已凋落(图7)。
通过对黄瓜果实中糖酸比、VC以及蛋白质含量进行检测,判断果实品质。试验中,30、50mg·L-1DMP处理的黄瓜果实中各项指标均低于对照组(表4)。30 mg·L-1DMP处理的黄瓜果实内可溶性蛋白含量与对照组相比无明显差异,而50mg·L-1DMP处理显著低于对照组。DMP处理会对黄瓜果实品质产生影响,糖酸比降低,造成果实口感不佳,最终导致果实品质和营养价值下降。从表4可见,不同污染浓度的DMP处理与有机酸、可溶性糖、可溶性蛋白以及VC含量呈显著相关关系,表明DMP污染浓度升高时,黄瓜果实中有机酸、可溶性糖、可溶性蛋白以及VC含量会相应减少。
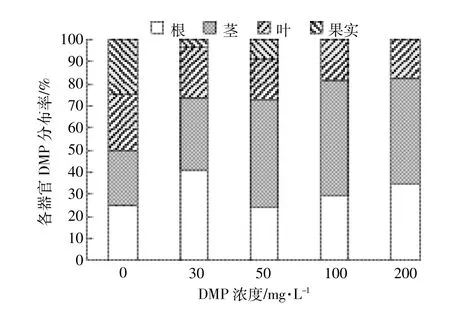
图6 DMP在黄瓜成株各器官总积累情况Figure 6 Totalaccumulation ofDMP in differentorgansof cucumberadult-plant

表3 DMP在黄瓜成株各器官积累情况Table 3 Accumulation ofDMP in differentorgansofcucumberadult-plant
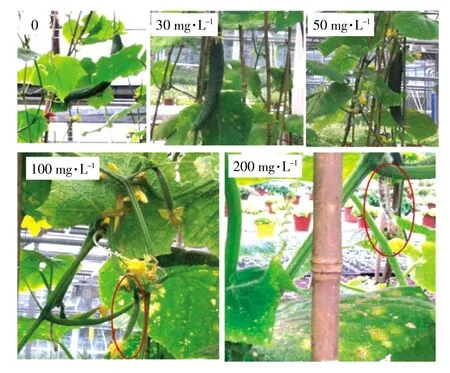
图7 结果期不同DMP处理的黄瓜果实生长情况Figure 7 Thegrowth ofcucumber fruitswith treatmentofdifferent DMPat fruitstage
3 讨论
CAT、POD、SOD在活性氧清除系统中起着重要作用,三者之间通过协同作用能够抵御大多数有害的且极具活性的氧的形成,从而预防膜质过氧化作用和最终产物MDA的积累[21]。所有处理组中,黄瓜叶片中的MDA含量都随着DMP浓度的增加和时间的推移而产生一定的积累,表明DMP的存在会导致超氧自由基的产生并促进膜脂过氧化反应。30mg·L-1DMP处理组中,SOD、POD、CAT的活性、脯氨酸含量、干物质量的积累都高于对照组,说明低浓度处理对黄瓜叶片抗氧化系统具有促进效应,且DMP对于SOD和POD酶活的促进效应都显著高于CAT,表明SOD和 POD在应对DMP的处理时,发挥了更强的防御作用。这与李勇等[22]关于在镉胁迫下抗氧化酶活变化的研究成果一致,在镉的胁迫下相较于CAT、SOD和POD提供了更强的防御机制。在低浓度DMP处理组(30、50mg·L-1)三种抗氧化酶(SOD、POD、CAT)的活性都呈现先升高后降低的趋势,在盛花期时抗氧化酶的酶活达到最高峰,与铅胁迫下SOD酶活[23]的变化趋势一致。在高浓度DMP处理组(100、200mg·L-1)三种抗氧化酶(SOD、POD、CAT)的活性都低于对照组。关于DMP处理下抗氧化酶系统酶活的变化表明:DMP能够在一定浓度范围内对黄瓜SOD、POD、CAT活性产生促进作用,超过这个范围将产生抑制作用。这与水杨酸对Cd胁迫玉米根系POD和SOD的影响的研究结果一致[12]。
过量的活性氧会对细胞造成氧化损伤,为最小化活性氧的损害效应,发挥了酶促和非酶促系统来调节细胞内活性氧的水平[24,25]。由脯氨酸等小分子物质组成的非酶促系统在细胞遭受逆境胁迫时,通过增加细胞质浓度,减小渗透压来保护膜结构,而由SOD、POD、CAT组成的酶促系统则主要是通过协同作用来清除活性氧,从而预防膜脂过氧化作用。MDA是膜脂过氧化反应的最终产物,体内MDA的生成反映了氧化胁迫导致的脂质过氧化作用,MDA含量的上升最终会导致生物膜的严重损伤。本研究高于50mg·L-1DMP处理组的抗氧化酶活性上升,脯氨酸含量显著上升,MDA含量显著上升,说明>50mg·L-1的DMP会对黄瓜的生理指标产生影响。
高浓度DMP处理组的黄瓜生长受到了抑制,并且干物质量积累也表现出明显的抑制作用。任旭琴等[26]的研究表明,当土壤中DBP和DIBP含量达到20 mg·kg-1以上时,对辣椒生长和干物质积累有显著抑制作用,说明DMP能够显著降低黄瓜的品质。DMP在植株内的积累也呈显著上升趋势,且主要集中积累在茎中。本试验结果显示,在不同的器官中,随着DMP处理浓度的增加,DMP的积累量也会随着增加。这个结果表明,DMP不仅可以通过根部的运输转移到各个器官中,而且还表现出明显的剂量-效应关系。
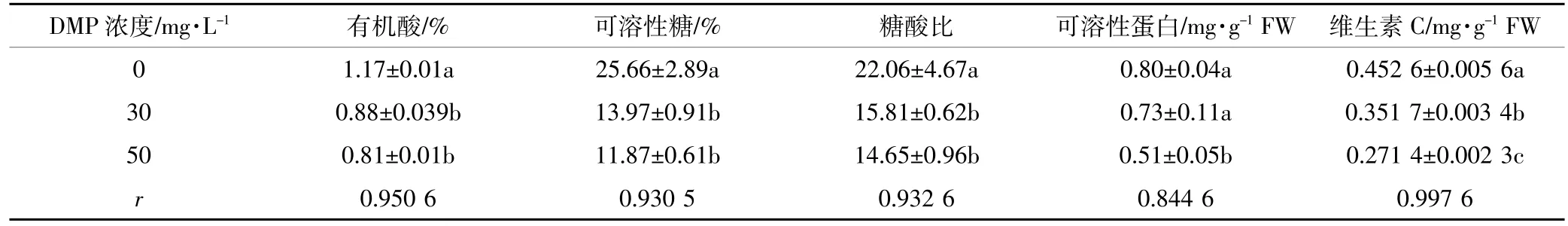
表4 DMP处理对黄瓜果实品质的影响Table 4 Effectson fruitquality ofcucumberunderDMP treatments
对于鲜果,可溶性糖和有机酸的含量及其二者的比例既是果实成熟度的重要评价依据,同时也是决定消费者口感的重要物质基础。另外,有机酸含量也直接影响果实的贮藏性能。一般情况下,有机酸含量高或者采后有机酸降解缓慢的果实贮藏性能较好[27]。试验中,DMP处理组的黄瓜果实的有机酸、可溶性糖、糖酸比均显著低于对照组,说明DMP的处理显著影响了黄瓜的口感和贮藏性能。皮尔森相关系数分析发现,果实中有机酸的含量正相关于SOD和POD的活性,也存在证据证实有机酸可以直接清除活性氧[28]。我们推测有机酸可能通过激活酶促系统来清除体细胞内的活性氧,进而响应各种逆境胁迫。贮藏果实中有机酸浓度与活性氧酶促清除系统中抗氧化酶活性的相关性也表明,有机酸可在缓减果实衰老方面发挥功能[29]。
逆境胁迫一般会导致氧化胁迫的发生,而VC是活性氧清除的重要组成部分,一般升高的VC可以降低果实细胞的氧化胁迫,促进果实的顺利发育[30],然而本研究得出了相反的结论,DMP处理降低了黄瓜果实中VC的含量。这主要是由于VC的结构在酸性环境下稳定,而试验中酸的降低导致VC发生了氧化分解。30mg·L-1DMP处理下的黄瓜果实蛋白质含量与对照组相比无显著差异,说明该浓度下DMP处理对黄瓜果实品质影响不大;而50mg·L-1DMP处理下的果实蛋白质的含量显著低于对照组,说明该浓度下黄瓜植株出现了萎蔫,衰老导致细胞合成蛋白质能力降低或加剧了蛋白质的分解和流失,从而导致蛋白质含量出现下降[31]。
4 结论
(1)30mg·L-1的DMP处理时叶片抗氧化酶活性增加,果实营养价值降低,但黄瓜植株生长及干物质积累变化不大。
(2)50、100、200mg·L-1的DMP处理时,均在不同程度上表现出抑制黄瓜生长的现象,同时降低了果实的口感和营养价值。
(3)不同浓度DMP处理组,黄瓜植株均从根部向上运输转移到茎和叶中,含量主要分布为茎>根>叶,并且表现出明显的剂量-效应关系。
[1]王立鑫,杨旭.邻苯二甲酸酯毒性及健康效应研究进展[J].环境与健康杂志,2010 27(3):276-281.
WANG Li-xin,YANGXu.Research progresson toxicity and health effectsofphthalates[J].Journal of Environmentand Health,2010 27(3):276-281.
[2]高军,于小彬,张裕,等.酞酸酯对土壤污染及其生态毒理效应研究进展[J].淮阴工学院学报,2013,22(3):43-47.
GAO Jun,YU Xiao-bin,ZHANG Yu,et al.The research progress of pollution and eco-toxicological effect of PAEs in agricultural soil[J]. JournalofHuaiyin Instituteof Technology,2013,22(3):43-47.
[3]林兴桃.邻苯二甲酸酯及其代谢物分析方法研究及暴露评价[D].北京工业大学,2012.
LIN Xing-tao.Study on the analyticalmethods of phthalates and their metabolitesand exposurevaluation[D].Beijing IndustryUniversity,2012.
[4]刘庆,杨红军,史衍玺,等.环境中邻苯二甲酸酯类PAEs污染物研究进展[J].中国生态农业学报,2012 20(8):968-975.
LIU Qing,YANG Hong-jun,SHIYan-xi,et al.Research progress of phthalate PAEs in the environment[J].Chinese Journalof Eco-Agriculture,2012,20(8):968-975.
[5]周震峰,张海光,王茜,等生物炭对邻苯二甲酸二甲酯在土壤中自然降解和吸附行为的影响[J].环境工程学报,2014,8(10):4474-4479.
ZHOU Zhen-feng,ZHANG Hai-guang,WANG Qian,et al.Effects of biocarbon on natural degradation and adsorption of dimethyl phthalate in soil[J].Chinese Journalof Environmental Engineering,2014,8(10):4474-4479.
[6]Zhang Y,Tao Y,Zhang H,etal.Effect of di-n-butyl phthalate on root physiology and rhizospheremicrobial community of cucumber seedlings [J].JournalofHazardousMaterials,2015,289:9-17.
[7]Zhang Y,Zhang H,Sun X,etal.Effectof dimethyl phthalate(DMP)on germination,antioxidant system,and chloroplast ultrastructure in Cucumissativus L.[J].EnvironmentalScienceand Pollution Research,2016, 23:1183-1192.
[8]Han D,Li J,Cao H,et al.Theoretical investigation on themechanisms and kineticsofOH-initiated photooxidationofdimethylphthalate(DMP)in atmosphere[J].Chemosphere,2014,95:50-57.
[9]蔺琰东,秦舒浩,王丽,等.外源邻苯二甲酸二甲酯和苯甲酸对马铃薯组培苗生长的化感效应[J].广东农业科学,2011(9):17-20.
LIN Yan-dong,QIN Shu-hao,WANG Li,et al.Allelopathic effects of exogenous dimethyl phthalate and benzoic acid on the growth of tissue cultureofpotato[J].Guangdong AgriculturalSciences,2011(9):17-20.
[10]吴志辉,聂湘平,杨宇峰.邻苯二甲酸二甲酯DMP对海洋微藻的生态毒理研究[J].生态科学,2006,25(2):168-170.
WU Zhi-hui,NIE Xiang-ping,YANG Yu-feng.Study on the ecological toxicity of dimethyl phthalate DMP tomarinemicroalgae[J].Chinese JournalofEcology,2006,25(2):168-170.
[11]Guo Y,Zhang ZF,Liu LY,etal.Occurrenceand profilesofphthalates in foodstuffs from China and their implications for human exposure[J].Journal of Agricultural and Food Chemistry,2012,60(27):6913-6919.
[12]Zhang Y,Tao Y,Sun GQ,etal.Effectsof di-n-butyl phthalateon the physiology and ultrastructure of cucumber seedling roots[J].Environmental Scienceand Pollution Research,2014,21:6662-6670.
[13]李增杰,廉华,郑天琪,等.不同叶面肥对黄瓜产量和品质的影响[J].黑龙江农业科学,2014,(6):44-46.
LIZeng-jie,LIAN Hua,ZHENG Tian-qi,etal.Effectsof different foliar fertilizerson the yield and quality of cucumber[J].Heilongjiang A-griculturalSciences,2014,(6):44-46.
[14]杜娜.黄瓜对邻苯二甲酸二丁酯(DBP)的毒性响应[D].哈尔滨市:东北农业大学,2014:11-13.
DUNa.Toxicity responseofcucumber todibutylphthalate[D].Haerbin:NortheastAgriculturalUniversity,2014:11-13.
[15]程建勋,王晓峰.生理学实验指导[M].广州:华南理工大学出版社, 2006.
CHENG Jian-xun,WANGXiao-feng.Experimentalguideline for plant physiology[M].Guangzhou:South China University Technology Press, 2006.
[16]郝建军,康宗利,于洋.生理学实验技术[M].北京:化学工业出版社,2006.
HAO Jian-jun,KANG Zong-li,YU Yang.Experimental technologies for plantphysiology[M].Beijing:Chemical Industry Press,2006.
[17]中国科学院上海生理研究所,上海市生理学会.现代生理学实验指南[M].北京:科学出版社,1999.
Shanghai Institutes for Biological Sciences,Chinese Academy of Sciences,The ShanghaiSociety for PlantPhysiology.Experimentalguideline formodern plantphysiology[M].Beijing:Science Press,1999.
[18]Proinoke XH.Theanalysismethodsofbiochemistry ofplants[M].Beijing:Science Press,1981:197-209.
[19]Wang L,Sun X,Chang Q,etal.Effectof di-n-butyl phthalate(DBP)on the fruitquality of cucumber and the health risk[J].Environmental Science&Pollution Research International,2016:1-7.
[20]Zhang Y,Wang PJ,Wang L,etal.The influence of facility agriculture production on phthalate esters distribution in black soils of Northeast China.[J].Scienceof the TotalEnvironment,2014,506:118-125.
[21]刘永辉.夏玉米不同生育期对水分胁迫的生理反应与适应[J].干旱区资源与环境,2013,27(2):172-175.
LIU Yong-hui.Physiological responses and adaptation of summer maize(Zeamays L.)towater stress during differentgrowth periods[J]. Journal of Arid Land Resources and Environment,2013,27(2):172-175.
[22]LiY,Zhang S,JiangW,etal.Cadmium accumulation,activitiesofantioxidantenzymes,andmalondialdehyde(MDA)content in Pistia stratiotes L.[J].Environmental Science and Pollution Research,2013,20 (2):1117-1123.
[23]Verma S,Dubey R S.Lead toxicity induces lipid peroxidation and alters theactivitiesofantioxidantenzymes in growing rice plants[J].Plant Science,2003,164(4):645-655.
[24]赵新月,何茂,石辉,等.外源水杨酸对镉胁迫下玉米幼苗的叶氮素代谢和根系抗氧化酶的影响[J].农业环境科学学报,2013,32 (10):1950-1958.
ZHAO Xin-yue,HEMao,SHIHui,et al.Role of exogenous salicylic acid in alleviatingnitrogenmetabolism in leavesand antioxidase in root by cadmium stress inmaize seedling[J].Journal of Agro-Environment Science,2013,32(10):1950-1958.
[25]Sharma P,Dubey R S.Involvement of oxidative stress and role of antioxidative defense system in growing rice seedling exposed to toxic concentrationsofaluminum[J].PlantCellReports,2007,26(11):2027-2038.
[26]任旭琴,高军,陈伯清,等.辣椒DBP/DIBP胁迫及其修复剂优化和机理研究[J].农业环境科学学报2015,34(6):1121-1126.
REN Xu-qin,GAO Jun,CHEN Bo-qing,et al.Pepper growth influenced by and formula optimization andmechanisms of remediation for DBP/DIBP[J].Journal of Agro-Environment Science,2015,34(6):1121-1126.
[27]程运江.园艺产品贮藏运销学[M].北京:中国农业出版社,2011:215-216.
CHENG Yun-jiang.Storage and transportation of horticultural products[M].Beijing:China Agriculture Press,2011:215-216.
[28]Varma SD,Devamanoharan PS,Morris SM.Prevention of cataractby nutritionalandmetabolic antioxidants[J].CriticalReviews in Food Scienceand Nutrition,1995,35(1/2):111-129.
[29]孙晓华.柚果实采后贮藏期间有机酸代谢的研究[D].武昌:华中农业大学,2012:73-75.
SUN Xiao-hua.Organic acid metabolism in pumelo fruit during postharveststoragephase[D].Wuchang:Huazhong AgriculturalUniversity,2012:73-75.
[30]张振兴,孙锦,郭世荣.钙对盐胁迫下西瓜光合特性和果实品质的影响[J].园艺学报,2011,38(10):1929-1938.
ZHANG Zhen-xing,SUN Jin,GUO Shi-rong.Effects of supplemental calcium on thephotosynthetic characteristicsand fruitquality ofwatermelon under salt stress[J].Acta Horticulturae Sinica,2011,38(10):1929-1938.
[31]郭春芳,孙云,张云,等.茶树叶片抗氧化系统对土壤水分胁迫的响应[J].福建农林大学学报(自然科学版),2008,37(6):580-586.
GUO Chun-fang,SUN Yun,ZHANG Yun,et al.Effects of soilwater stresson the antioxidantsystem in leavesof tea plants(Camellia sinensis)[J].Journal of Fujian Agriculture and Forestry University(Natural Science Edition),2008,37(6):580-586.
Toxic effectsof dimethylphthalateon cucumber at the grow th stage
ZHANGYing,DONG Jun-wei,WANG Lei,FANXin-hui,SUNRui-xue,ZHANGHui,SHANDe-xin
(College ofResource and Environment,NortheastAgriculturalUniversity,Harbin 150030,China)
The leaves of cucumber(Cucumis sativus L.)were used to study the effects of dimethyl phthalate(DMP)on antioxidantenzyme activities and proline(Pro)andmalondialdehyde(MDA)content.Furthermore,the fruitquality and the accumulation of DMPwere studied to investigate the ecological toxic effects of DMP on cucumber.The results showed that the activities of antioxidant enzymes in the leaves treated with 30mg·L-1DMPwere increased,with a decrease in the nutritionalvalue of the fruit.However,thishad a very little impacton the accumulation of dry matter and plant growth.Under the treatment of 50 mg·L-1DMP,the antioxidant enzyme activities of the leaves achieved their peak value at full-blooming stage.The antioxidantenzyme activities,the accumulation of drymatter,and the fruitnutritional value all declined with increasing treatment time.However,under the treatments of100mg·L-1and 200mg·L-1DMP,the antioxidant enzyme activitieswere remarkably suppressed(P<0.05)as compared to those of the control group during the entire growth period.Moreover, with increasing concentration ofDMP,a decline in the accumulation of drymatterwas presented,with the appearance ofa fatalwilting phenomenon during the young fruit period.The accumulation of DMP in the cucumber increased with increasing concentrations(stem>root>leaf).These results showed thatDMP pollution could affect the normalphysiologicaland biochemical indicesof cucumber,reduce the quality of cucumber fruit,and hence pose potentialhealth risks.
DMP;Cucumissativus L.;antioxidantenzyme;drymatter;fruitquality
X171.5
A
1672-2043(2017)05-0847-08
10.11654/jaes.2016-1620
2016-12-16
张颖(1972—),女,吉林珲春人,博士,教授,从事土壤保护与修复。E-mail:zhangyinghr@hotmail.com
国家自然科学基金项目(31470550)
Project supported:The NationalNaturalScience Foundation ofChina(31470550)
张颖,董俊伟,王蕾,等.邻苯二甲酸二甲酯(DMP)对黄瓜抗氧化代谢及果实品质的影响[J].农业环境科学学报,2017,36(5):847-854.
ZHANGYing,DONG Jun-wei,WANG Lei,etal.Toxic effectsofdimethylphthalateon cucumberat thegrowth stage[J].Journalof Agro-EnvironmentScience, 2017,36(5):847-854.
