左乙拉西坦注射液与3种注射液的配伍稳定性考察
2017-06-05黄凤玲宋艳霞李直马晓黎杨明波李波抗生素研究与再评价四川省重点实验室成都大学四川抗菌素工业研究所成都610052
黄凤玲,宋艳霞,李直,马晓黎,杨明波,李波(抗生素研究与再评价四川省重点实验室/成都大学四川抗菌素工业研究所,成都610052)
左乙拉西坦注射液与3种注射液的配伍稳定性考察
黄凤玲*,宋艳霞,李直,马晓黎,杨明波,李波#(抗生素研究与再评价四川省重点实验室/成都大学四川抗菌素工业研究所,成都610052)
目的:考察左乙拉西坦(Lev)注射液与3种注射液的配伍稳定性。方法:取Lev注射液各1 000 mg分别与0.9%氯化钠注射液100 mL、5%葡萄糖注射液100 mL和乳酸钠林格注射液100 mL配伍,在25℃未避光条件下,分别于配制后24 h不同时间点观察各配伍液的颜色和澄清度,测定其pH值和不溶性微粒数,并采用高效液相色谱法测定各配伍液中相关杂质(杂质A、B、C、D和2-羟基吡啶)和Lev的含量。结果:在上述条件下,各配伍液在24 h内均为无色澄清液体,pH值无明显变化(RSD<1%,n=7),不溶性微粒数均未超出2015年版《中国药典》规定的范围;未检出杂质B和杂质C,其余杂质的含量均符合国外各药典的限度要求;Lev的相对百分含量无明显变化(RSD<1%,n=7)。结论:Lev注射液与0.9%氯化钠注射液、5%葡萄糖注射液和乳酸钠林格注射液配伍后,在25℃未避光条件下24 h内保持稳定。
左乙拉西坦注射液;氯化钠注射液;葡萄糖注射液;乳酸钠林格注射液;配伍;稳定性;高效液相色谱法
左乙拉西坦(Levetiracetam,Lev)为吡咯烷酮衍生物,于2000年4月获FDA批准上市,主要用于治疗局限性和继发性全身性癫痫,具有较强的抗癫痫作用,可有效地控制癫痫发作[1-4]。目前,Lev注射液的原研制剂(商品名:Keppra)尚未获准进入我国市场,国产Lev注射液也正在进行生产报批。鉴于此,本研究参考美国药典(USP)的方法[5],对国产Lev注射液与3种常用注射液[0.9%氯化钠注射液(0.9%NS)、5%葡萄糖注射液(5% GS)和乳酸钠林格注射液]的配伍稳定性进行考察,以期为其质量管理和临床应用提供参考。
1 材料
1.1 仪器
LC-2010 CHT型液相色谱系统、LC-20AD型液相色谱系统(日本岛津公司);FE20型pH计(上海梅特勒-托利多仪器有限公司);YB-Ⅱ型澄明度检测仪(天津大学精密仪器厂);GWJ-4型智能微粒检测仪(天津天大天发科技有限公司)。
1.2 药品与试剂
Lev注射液[成都天台山制药有限公司,批号:130402(Ⅱ),规格:5 mL∶500 mg];0.9%NS(四川科伦药业股份有限公司,批准文号:国药准字H51021158,规格:500 mL∶4.5 g);5%GS(批准文号:国药准字H51022443,规格:500 mL∶25 g)和乳酸钠林格注射液(批准文号:国药准字H20043897,规格:500 mL)均购自四川美大康佳乐药业有限公司。
Lev对照品(美国药典委员会,批号:1359404,纯度:99.8%);Lev工作对照品(用Lev对照品自标化,海南万特制药有限公司,批号:S130402,纯度:100.6%);2-羟基吡啶对照品(上海阿拉丁生化科技股份有限公司,批号:1040918,纯度:97%);(S)-2-(2-吡咯烷酮-1)丁酸对照品(欧洲药品质量管理局,以下简称杂质A,批号:Y0001254,纯度:100%);(2Z)-2-(2-吡咯烷酮-1)丁酰胺对照品(欧洲药品质量管理局,以下简称杂质B,批号:Y0001255,纯度:100%);(S)-N-(1-氨-1-丁酮-2)-4-氯丁酰胺对照品(美国药典委员会,以下简称杂质C,批号:1359426,纯度:100%);(S)-2-氨基丁酰胺对照品(美国药典委员会,以下简称杂质D,批号:1359437,纯度:100%);杂质D工作对照品[(S)-2-氨基丁酰胺盐酸盐(用杂质D自标化),海南万特制药有限公司,批号:ABAH-1211170,纯度:100%];辅料[氯化钠(江苏省勤奋药业有限公司,批号:20120827,纯度:99.9%);氢氧化钠(湖南尔康制药股份有限公司,批号:20111105,纯度:99.7%);冰乙酸(广东省台山市新宁制药有限公司,批号:20130203,纯度:99.8%)]。乙腈为色谱纯,水为纯净水。
2 方法与结果[5]
2.1 色谱条件
2.1.1 色谱条件一色谱柱:Agilent Zorbax SB-C18(250 mm×4.6 mm,5µm);流动相(简称流动相一):癸烷磺酸钠溶液(取癸烷磺酸钠1.22 g,用水适量溶解,加磷酸1.3 mL,用水稀释至1 000 mL,用20%氢氧化钾溶液调节pH值至3.0)-乙腈(82∶18,V/V);检测波长:200 nm;流速:1.0 mL/min;柱温:30℃;进样量:50µL。
2.1.2 色谱条件二色谱柱:Welchrom C18(150 mm× 4.6 mm,5µm);流动相:乙腈-2.7 g/L磷酸二氢钾水溶液(用2%氢氧化钾调节pH值至5.5)(1∶19,V/V)混合溶液(A)-乙腈(B),梯度洗脱(0~3 min,100%A;>3~20 min,100%A→71%A;>20~25 min,71%A→100% A;>25~30 min,100%A);检测波长:205 nm;流速:0.9 mL/min;柱温:35℃;进样量:10µL。
2.2 溶液的制备
2.2.1 配伍液模拟国外临床常用剂量,在25℃未避光条件下,取Lev注射液6支,各取2支(1 000 mg)加至0.9%NS 100 mL、5%GS 100 mL和乳酸钠林格注射液100 mL中,得Lev质量浓度均为9 090µg/mL的配伍液。
2.2.2 对照品贮备液(1)杂质D对照品贮备液:精密称取杂质D工作对照品10.0 mg,置20 mL量瓶中,用流动相一溶解并定容,再用流动相一稀释成质量浓度为50µg/mL的溶液。(2)2-羟基吡啶对照品贮备液:精密称取2-羟基吡啶对照品10.0 mg,置50 mL量瓶中,用色谱条件二中的流动相A相(以下简称“流动相二”)溶解并稀释成质量浓度为200µg/mL的溶液。(3)杂质A对照品贮备液:精密称取杂质A对照品15.0 mg,置50 mL量瓶中,用流动相二溶解并稀释成质量浓度为300µg/mL的溶液。(4)杂质B对照品贮备液:精密称取杂质B对照品10.0 mg,置100 mL量瓶中,用流动相二溶解并稀释成质量浓度为100µg/mL的溶液。(5)杂质C对照品贮备液:精密称取杂质C对照品10.0 mg,置100 mL量瓶中,用流动相二溶解并稀释成质量浓度为100µg/mL的溶液。(6)Lev对照品贮备液:精密称取Lev工作对照品25.0 mg,置25 mL容量瓶中,加流动相二溶解并稀释成质量浓度为1 000µg/mL的溶液。
2.2.3 供试品溶液(1)杂质D供试品溶液:精密量取Lev注射液适量,用流动相一稀释成Lev质量浓度为2 000 µg/mL的溶液。(2)有关物质供试品溶液:精密量取Lev注射液适量,用流动相二稀释成Lev质量浓度为5 000 µg/mL的溶液。(3)Lev供试品溶液:精密量取Lev注射液适量,用流动相二稀释成Lev质量浓度为100µg/mL的溶液。
2.2.4 对照品溶液(1)杂质D对照品溶液:精密量取杂质D对照品贮备液适量,用流动相一稀释配制成杂质D质量浓度为2µg/mL的溶液。(2)有关物质对照品溶液:精密量取Lev对照品贮备液适量,用流动相二稀释成Lev质量浓度为5µg/mL的溶液。(3)Lev对照品溶液:精密量取Lev对照品贮备液适量,用流动相二稀释成Lev质量浓度为100µg/mL的溶液。
2.2.5 空白溶液除不加Lev外,其他辅料正常加入,并按“2.2.1”项下方法配制,即得空白对照。精密量取上述空白对照适量,按“2.2.3”项下杂质D供试品溶液稀释方法配制空白溶液A;精密量取上述空白对照适量,按“2.2.3”项下有关物质供试品溶液稀释方法配制空白溶液B。
2.2.6 混合溶液(1)混合溶液A:精密量取2-羟基吡啶、杂质A、杂质B、杂质C和Lev对照品贮备液各适量,用流动相二配制成杂质限度浓度(2-羟基吡啶1.25µg/mL、杂质A 15µg/mL、杂质B 2.5µg/mL、杂质C 2.5µg/mL)和Lev 100µg/mL的溶液。(2)混合溶液B:精密量取2-羟基吡啶、杂质A、杂质B、杂质C对照品贮备液各适量,用流动相二配制成各杂质限度浓度(同混合溶液A)的溶液。
2.3 测定方法
2.3.1 杂质D测定按“2.1.1”项下色谱条件一,分别精密量取“2.2”项下杂质D供试品溶液和杂质D对照品溶液各50µL,进样分析,记录色谱图。按外标法以峰面积计算供试品溶液中杂质D的含量(%)。
2.3.2 有关物质检查按“2.1.2”项下色谱条件二,分别精密量取“2.2”项下有关物质供试品溶液和有关物质对照品溶液各10 μL,进样分析,记录色谱图。按加校正因子的主成分对照法计算2-羟基吡啶、杂质A、杂质B和杂质C的含量(%)(以Lev对照品线性回归方程斜率与各杂质对照品线性回归方程斜率的比值来计算各杂质的校正因子,校正因子分别为1.10、0.77、0.27、1.85)。
2.3.3 Lev含量测定按“2.1.2”项下色谱条件二,精密量取“2.2”项下Lev供试品溶液和Lev对照品溶液各10 μL,进样分析,记录色谱图。按外标法以峰面积计算Lev的含量(%)。
2.4 方法学考察
2.4.1 专属性考察在“2.1”项色谱条件下,各待测物峰形良好,杂质D、有关物质(2-羟基吡啶、杂质A、杂质B、杂质C)和Lev的保留时间分别为9.733、3.972、5.831、7.939、14.779和11.590 min,详见图1、图2。

图1 HPLC色谱图(色谱条件一)Fig 1 HPLC chromatograms(chromatogram condition one)

图2 HPLC色谱图(色谱条件二)Fig 2 HPLC chromatograms(chromatogram condition two)
2.4.2 标准曲线的绘制与定量下限的考察(1)杂质D:精密量取“2.2.2”项下杂质D对照品贮备液适量,用流动相一稀释成质量浓度分别为0.15、0.38、0.76、1.52、3.79、15.18µg/mL的杂质D系列溶液。(2)有关物质:精密量取“2.2.2”项下2-羟基吡啶对照品贮备液适量,用流动相二稀释成质量浓度分别为0.06、1.00、5.00、10.00、50.00、100.00µg/mL的2-羟基吡啶系列溶液;精密量取“2.2.2”项下杂质A、杂质B、杂质C对照品贮备液各适量,用流动相二稀释成质量浓度分别为0.08、1.50、3.00、15.00、60.00、150.00µg/mL的杂质A系列溶液,质量浓度分别为0.04、0.40、4.00、10.00、25.00、50.00µg/mL的杂质B系列溶液,质量浓度分别为0.60、1.20、10.00、12.00、25.00、50.00µg/mL的杂质C系列溶液。(3)Lev:精密量取“2.2.2”项下Lev对照品贮备液适量,用流动相二稀释成质量浓度分别为0.05、0.25、0.50、5.00、50.00、500.00 µg/mL的Lev系列溶液。取上述系列溶液各适量,分别按“2.1.1”和“2.1.2”项下色谱条件进样分析,记录峰面积。以待测物质量浓度(c)为横坐标、相应色谱峰峰面积(A)为纵坐标,进行线性回归。将各对照品溶液逐级稀释,以确定检测限(信噪比为3.0)。结果显示,杂质D、2-羟基比啶、杂质A、杂质B、杂质C和Lev的质量浓度分别在0.15~15.18、0.06~100.00、0.08~150.00、0.04~50.00、0.60~50.00、0.05~500.00µg/mL范围内线性关系良好(r>0.999 0),定量下限分别为0.15、0.06、0.08、0.04、0.60、0.05µg/mL,检测限分别为0.03、0.01、0.04、0.01、0.30、0.03µg/mL,详见表1。
2.4.3 重复性试验(1)杂质D:按“2.2.4”项下杂质D对照品溶液的配制方法,重复配制6份;按“2.1.1”项下色谱条件进样分析,记录峰面积。结果显示,杂质D的平均峰面积为41 105(RSD=1.80%,n=6),表明该方法重复性良好。(2)有关物质:按“2.2.6”项下混合溶液B的配制方法,重复配制6份;按“2.1.2”项下色谱条件进样分析,记录峰面积。结果显示,2-羟基吡啶、杂质A、杂质B和杂质C的平均峰面积分别为21 565、452 408、204 813和6 389(RSD分别为0.95%、2.61%、3.55%和0.92%,n=6),表明该方法重复性良好。(3)Lev:按“2.2.4”项下Lev对照品溶液的配制方法,重复配制6份。按“2.1.2”项下色谱条件进样分析,记录峰面积。结果显示,Lev的平均峰面积为2 454 867(RSD=0.80%,n=6),表明该方法重复性良好。

表1 各待测物的回归方程、定量下限和检测限Tab 1 Regression equations,limit of quantitation and limit of detection
2.4.4 回收率试验(1)杂质D:精密量取“2.2.2”项下杂质D对照品贮备液各适量,加至Lev注射液中,用流动相一分别稀释成含Lev 2 000µg/mL和杂质D 1.6、2.0、2.4µg/mL的混合溶液各3份,按“2.1.1”项下色谱条件进样分析,记录色谱图。结果显示,杂质D的回收率为97.89~101.74%(RSD=1.50%,n=9)。(2)有关物质:精密量取“2.2.2”项下2-羟基吡啶对照品贮备液各适量,加入至Lev注射液中,用流动相二分别稀释成含Lev 5 000 µg/mL和2-羟基吡啶1.00、1.25、1.50µg/mL的混合溶液各3份;精密量取“2.2.2”项下杂质A、杂质B和杂质C对照品贮备液各适量,同法配制成含Lev 5 000µg/mL和杂质A 12、15、18µg/mL,含Lev 5 000µg/mL和杂质B 2.0、2.5、3.0µg/mL,含Lev 5 000µg/mL和杂质C 2.0、2.5、3.0µg/mL的混合溶液各3份。按“2.1.2”项下色谱条件进样分析,记录色谱图。结果显示,2-羟基吡啶、杂质A、杂质B、杂质C的回收率分别为99.77~101.48%、99.35~101.62%、98.49~99.58%、95.93~104.33%(RSD分别为0.68%、0.76%、0.32%和3.07%,n=9)。(3)Lev:精密称取Lev工作对照品适量,用流动相二稀释,配制成质量浓度为80、100、120 μg/mL的溶液各3份,按“2.1.2”项下色谱条件进样分析,记录色谱图。结果显示,Lev的回收率为99.40~100.70%(RSD=0.46%,n=9)。
2.4.5 稳定性试验(1)杂质D:配制杂质D低、高质量浓度(杂质D 2 μg/mL,Lev 2 000 μg/mL)的溶液,考察其在室温条件下的稳定性。结果显示,各样品在室温下放置1 h稳定(RSD<5%,n=6)。(2)有关物质:配制有关物质低、高质量浓度(2-羟基吡啶1.25µg/mL、杂质A 15µg/mL、杂质B 2.5µg/mL、杂质C 2.5µg/mL,Lev 5 000 μg/mL)的溶液,考察其在室温条件下的稳定性。结果显示,各样品在室温下放置17 d稳定(RSD<5%,n= 6)。(3)配制Lev高质量浓度(Lev 100 μg/mL)的溶液,考察其在室温条件下的稳定性。结果显示,样品在室温下放置50 h稳定(RSD<1%,n=6)。
2.5 配伍稳定性试验
2.5.1 颜色、澄清度和pH值的变化取“2.2.1”项下配伍液各适量,在25℃未避光条件下,分别于配制后0、1、2、4、6、8、24 h时参照2015年版《中国药典》(四部)通则中“溶液颜色检查法”、“澄清度检查法”和“pH值测定法”对其颜色、澄清度和pH值进行检查[6]。结果显示,配制后24 h内,各配伍液均为无色澄清液体,pH值无明显变化(RSD<1%,n=7),详见表2。

表2 各配伍液pH值的测定结果Tab 2 Determination results of pH values of mixtures
2.5.2 不溶性微粒检查取“2.2.1”项下配伍液各适量,在25℃未避光条件下,分别于配制后0、1、4、24 h时参照2015年版《中国药典》(四部)通则中“不溶性微粒检查法”(光阻法)检查其不溶性微粒数是否符合药典相关规定[每1 mL中含10µm及10µm以上(≥10 μm)的微粒数不得超过25粒,含25µm及25µm以上(≥25 μm)的微粒数不得超过3粒][6]。结果显示,配制后24 h内,各配伍液中的微粒数均符合药典规定,详见表3。
表3 各配伍液中不溶性微粒数的检查结果(±s,n=3,粒/mL)Tab 3 Determination results of insoluble particles of mixtures(±s,n=3,grain/mL)

表3 各配伍液中不溶性微粒数的检查结果(±s,n=3,粒/mL)Tab 3 Determination results of insoluble particles of mixtures(±s,n=3,grain/mL)
溶剂粒径,µm 不溶性微粒0.9%NS 5%GS乳酸钠林格注射液≥10≥25≥10≥25≥10≥25 0 h 8.7±0.7 0.0±0.0 12.5±0.5 0.0±0.0 9.3±1.0 0.0±0.0 1 h 3.7±0.8 0.0±0.0 6.1±0.8 0.2±0.2 3.0±0.2 0.0±0.0 4 h 1.7±0.8 0.1±0.1 2.1±0.8 0.1±0.1 3.9±1.0 0.1±0.1 24 h 1.3±0.5 0.0±0.0 1.9±0.4 0.0±0.0 2.7±0.6 0.0±0.0
2.5.3 杂质D含量的变化取“2.2.1”项下配伍液各适量,在25℃未避光条件下,用流动一稀释成含Lev 2 000 µg/mL的供试品溶液,分别于配制后0、1、2、4、6、8、24 h时按“2.1.1”项下色谱条件进样分析,按“2.3.1”项下方法测定,计算杂质D的含量。结果显示,配制后24 h内,各配伍液中杂质D的含量无明显变化,符合USP的限度要求(杂质D限度为0.1%)[5],详见表4。
2.5.4 有关物质的含量变化取“2.2.1”项下配伍液各适量,在25℃未避光条件下,用流动二稀释成含Lev 5 000 µg/mL的供试品溶液。分别于配制后0、1、2、4、6、8、24 h时按“2.1.2”项下色谱条件进样分析,按“2.3.2”项下方法测定,计算有关物质的含量。结果显示,配伍后24 h内,各配伍液均未检出杂质B和杂质C,2-羟基吡啶和杂质A的含量符合国外各药典的限度要求(2-羟基吡啶的限度为0.025%,杂质A的限度为0.3%)[5,7-8],详见表5。

表4 各配伍液中杂质D含量的测定结果(%%)Tab 4 Determination results of the content of impurity D in mixtures(%%)

表5 各配伍液中有关物质含量的测定结果(%%)Tab 5 Determination results of the content of related substance in mixtures(%%)
2.5.5 Lev相对百分含量的变化取“2.2.1”项下配伍液各适量,在25℃未避光条件下,用流动二稀释成含Lev 100µg/mL的供试品溶液。分别于配制后0、1、2、4、6、8、24 h时按“2.1.2”项下色谱条件进样分析,按“2.3.3”项下方法测定,计算Lev的含量。以配制0 h时Lev的含量为100%,换算出其他时间点的相对百分含量。结果显示,配制后24 h内,各配伍液中Lev的相对百分含量无明显变化(RSD<1%,n=7),详见表6。
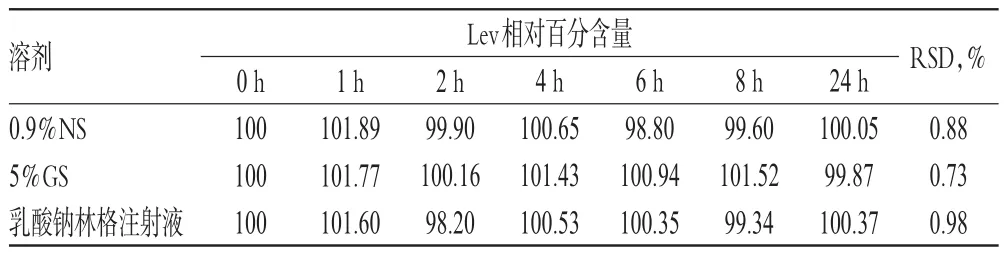
表6 各配伍液中Lev相对百分含量的测定结果(%%)Tab 6 Determination results of relative percentage contents of Lev in mixtures(%%)
3 讨论
配制已知杂质2-羟基吡啶、杂质A、杂质B、杂质C、杂质D对照品混合溶液,分别在以1.96 g/L硫酸水溶液-乙腈(7∶93,V/V)和(4∶96,V/V)[《欧洲药典》(EP)和《英国药典》(BP)]为流动相的正相色谱法[7-8]、以磷酸盐溶液(取磷酸二氢钠1.56 g和庚烷磺酸钠1.01 g,加水1 000 mL,用氢氧化钠试液调pH值至7.0)-乙腈(90∶10,V/V)为流动相的离子对色谱法(USP)[5]和参考USP方法并优化的反相色谱法(“2.1.2”项下色谱条件二)等多种流动相体系下进样分析,结果显示,本研究优化的色谱条件二对已知杂质和Lev的分离效果更好。因此,本研究选择色谱条件二进行有关物质的检查和Lev的含量测定。而杂质D由于极性较大,在色谱条件二下保留时间短,与溶剂峰难以完全分离,故本研究建立了色谱条件一,使其分配系数增大,保留时间延长,有利于待测物的分离和定量,因此单独采用色谱条件一测定杂质D。
各国药典对杂质和有关物质的含量作出了限度要求。其中,2-羟基吡啶、杂质A在USP、EP和BP中限度分别为0.025%和0.3%,杂质B在EP和BP中限度均为0.05%,杂质C和杂质D在USP中限度分别为0.05%和0.1%[5,7-8]。本课题组前期进行的强制降解试验和稳定性试验表明,Lev注射液中杂质A和杂质B为降解产生,杂质C和杂质D分别为合成Lev的中间体和起始原料,2-羟基吡啶为原料中引入的杂质。因此,为全面了解Lev注射液与0.9%NS、5%GS和乳酸钠林格注射液配伍液中的杂质含量情况,本研究对杂质D、2-羟基吡啶、杂质A、杂质B和杂质C的含量进行了考察。
本试验的目的是考察Lev注射液与3种注射液配伍的稳定性,为其质量管理和临床应用提供依据。因此,配伍液均按临床常用剂量、在25℃未避光条件下配制。在实际操作过程中,由于Lev注射液会因注射器的抽吸动作而产生较多的气泡,影响不溶性微粒的准确测定。因此,本研究将配制后静置20 min时的测定结果作为配制后0 h时的结果,以消除抽吸所致气泡的干扰。
本试验参考了配伍稳定性的相关研究[9-11],将稳定性考察时间延长至24 h。结果显示,Lev注射液与0.9% NS、5%GS和乳酸钠林格注射液配伍后24 h内,各配伍液无色澄清,不溶性微粒数均符合2015年版《中国药典》的规定,pH值无明显变化。3种配伍液中杂质D和杂质A的含量远低于各国药典的限度要求。虽然,Lev注射液与乳酸钠林格注射液配伍24 h后2-羟基吡啶的含量从无增加至0.001 8%,但仍远低于各国药典中0.025%的限度要求,故认为是安全、合格的。Lev相对百分含量的RSD值均符合2015年版《中国药典》(四部)通则中“待测成分含量为100%,测定结果的RSD值应低于1%”的规定[6],提示各配液中Lev的含量均无明显变化。
综上所述,在25℃未避光条件下,Lev注射液与0.9%NS、5%GS和乳酸钠林格注射液配伍后24 h内,稳定性良好。但由于近年来随着糖代谢异常患者的不断增加,木糖醇注射液、果糖注射液在临床上也被广泛应用[12-14],而本试验仅参照原研Lev注射液的药品说明书,对其与0.9%NS、5%GS和乳酸钠林格注射液的配伍稳定性进行考察,故该制剂与其他溶剂(如木糖醇注射液、果糖注射液等)的配伍稳定性还有待进一步研究。
[1]Ben-Menachem E,Gilland E.Efficacy and tolerability of levetiracetam during 1-year follow-up in patients with refractory epilepsy[J].Seizure,2003,12(3):131-135.
[2]宋艳玲,孙欢,李柏娜.西坦类药物研究进展[J].中国药业,2015,24(1):4-7.
[3]刘俊杰.左乙拉西坦临床应用研究进展[J].首都医药,2011(12):12-13.
[4]应义,崔虓,张慧.抗癫痛药物研究现状及新进展[J].中国药业,2012,21(20):110-112.
[5]美国药典委员会.美国药典/国家处方集[S].USP36-NF31.华盛顿:美国药典委员会,2013:4084-4086.
[6]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:77-78、111-115、378.
[7]欧洲药典委员会.欧洲药典[S].8.0版.斯特拉斯堡:欧洲药品质量管理局,2013:2604-2606.
[8]英国药典委员会.英国药典[S].2014年版.伦敦:英国药典委员会,2014:2313-2316.
[9]林小明.丹参注射剂的配伍稳定性研究[J].中国药物评价,2016,33(1):20-23.
[10]杨小玲,程帆,刘艳红,等.喜炎平注射液与15种药物配伍稳定性考察[J].中国新药杂志,2013,22(20):2374-2378.
[11]黄艳,何海霞,周远大,等.注射用奥美拉唑钠与4种常用溶剂的配伍稳定性考察[J].中国药房,2015,26(14):1948-1949.
[12]吕芳,叶正良,兰淑玲,等.注射用益气复脉(冻干)与木糖醇注射液的配伍稳定性研究[J].时珍国医国药,2013,24(5):1124-1126.
[13]林淑瑜,杨昌云,潘丹婷,等.7种糖尿病常用药与木糖醇注射液的配伍稳定性研究[J].药学服务与研究,2016,16(3):234-237.
[14]史长城,朱慧,李亚芳,等.临床常用药物与果糖注射液配伍稳定性的文献分析[J].中国药房,2015,26(5):718-720.
(编辑:张元媛)
Compatible Stability of Levetiracetam Injection with Three Injections
HUANG Fengling,SONG Yanxia,LI Zhi,MA Xiaoli,YANG Mingbo,LI Bo(Sichuan Provincial Key Laboratory of Antibiotics Research and Re-evaluation/Sichuan Industrial Institute of Antibiotics,Chengdu University,Chengdu 610052,China)
OBJECTIVE:To investigate the compatible stability of Levetiracetam(Lev)injection with 3 injections.METHODS:Each Lev injection 1 000 mg mixed with 0.9%Sodium chloride injection 100 mL,5%Glucose injection 100 mL or Sodium lactate Ringer’s injection 100 mL respectively.Under the light condition,at 25℃,the color and clarification degree of mixtures were observed at different time points within 24 h after mixing;pH value and the number of insoluble particles were determined.The contents of related impurities(impurity A,B,C,D,2-hydroxypyridine)and Lev in mixtures were determined by HPLC.RESULTS:Under above condition,all mixtures were colorless clear liquid within 24 h;pH value had no significant change(RSD<1%,n=7);the number of insoluble particles was no more than the range stated in Chinese Pharmacopeia(2015 edition).Impurity B and C were not detected;the contents of other impurities were in line with the requirements of foreign pharmacopeia.No marked change was noted for relative content of Lev(RSD<1%,n=7).CONCLUSIONS:After mixing with 0.9%Sodium chloride injection,5%Glucose injection or Sodium lactate Ringer’s injection,Lev injection keep stable at 25℃within 24 h under the light condition.
Levetiracetam injection;Sodium chloride injection;Glucose injection;Sodium lactate Ringer’s injection;Compatiblity;Stability;HPLC
R969.2;R971
A文章编号1001-0408(2017)14-1911-06
2016-05-30
2017-02-23)
*硕士研究生。研究方向:药品质量控制。电话:028-84216020。E-mail:260396601@qq.com
#通信作者:研究员,硕士生导师。研究方向:药品质量控制。电话:028-84216020。E-mail:ckcdlibo@163.com
DOI10.6039/j.issn.1001-0408.2017.14.11
