荷钆硬脂酰壳寡糖的制备及其在胰腺癌成像中的应用
2017-06-05张炜华郑双双姚秀忠翁伟宇
张炜华,郑双双,姚秀忠,杜 斌,翁伟宇*
(1.华东理工大学药学院,上海 200237;2.复旦大学附属中山医院放射科,上海 200032)
实验研究
荷钆硬脂酰壳寡糖的制备及其在胰腺癌成像中的应用
张炜华1,郑双双1,姚秀忠2,杜 斌1,翁伟宇1*
(1.华东理工大学药学院,上海 200237;2.复旦大学附属中山医院放射科,上海 200032)
目的 制备荷钆硬脂酰壳寡糖(COSSA-DTPA-Gd),评价其胶束性质、细胞毒性、体外弛豫率和在胰腺肿瘤中的MR成像效果。方法 利用酰化反应合成硬脂酰壳寡糖,再枝接螯合剂DTPA并与Gd3+螯合得到最终产物。采用电镜和激光粒度仪等测定产物胶束性质;噻唑蓝法测定产物细胞毒性;在MR上测定体外弛豫率,评估其在原位胰腺肿瘤成像强化中的效果。结果 合成的COSSA-DTPA-Gd在水中可自发形成胶束,临界胶束浓度为(5.12±0.43)μg/ml,外观近似球形,粒径(58.3±5.7)nm,带正电荷,含钆量为330.31 μmol/g。产物的细胞毒性与市售对比剂马根维显相似(P>0.05),24 h内细胞存活率>85%。COSSA-DTPA-Gd的体外纵向弛豫率为8.23 mM-1·s-1,静注后对胰腺肿瘤的成像效果优于马根维显,肿瘤周边首先强化,肿瘤内部渐进性强化。结论 COSSA-DTPA-Gd胶束对比剂对胰腺肿瘤具有良好的成像效果。
钆;壳寡糖;胶束;磁共振成像;胰腺肿瘤
胰腺癌是一种恶性程度高、预后差的消化系统恶性肿瘤,术后5年生存率仅5%左右[1]。缺乏早期诊断手段是胰腺癌高死亡率的主要原因[1-2]。目前CT是胰腺癌诊断和分期的常规影像学方法[3]。与之相比,MRI具有更高的软组织对比度,在小胰腺癌、等密度胰腺癌等的诊断方面更具优势[3]。MRI常需使用对比剂来增强成像对比度,而目前尚无针对胰腺癌的特异性对比剂。为提高MRI诊断胰腺癌的敏感度和准确率,有学者[4-10]尝试采用纳米对比剂对动物胰腺癌进行检查,取得了初步效果。本研究旨在制备一种荷钆硬脂酰壳寡糖(gadolinium-loaded stearic acid grafted chitooligosaccharide,COSSA-DTPA-Gd)纳米胶束作为MRI对比剂,评价其体外弛豫率和体内原位胰腺肿瘤的成像效果,以期为胰腺癌的MR检查提供一种可行的优良对比剂。
1 材料与方法
1.1 实验动物 雌性无胸腺裸鼠8只,体质量18~20 g;雌性SD大鼠2只,体质量160~200 g,均由复旦大学实验动物科学部提供[实验动物使用许可证号SYXK(沪)2014-0029]。本研究方案经复旦大学附属中山医院伦理学委员会批准。所有动物进行实验前均在动物房适应1周。
1.2 仪器与材料 壳寡糖(COS,平均分子量5 kDa,脱乙酰度≥95%,青岛云宙生物科技有限公司)、硬脂酸(SA,上海凌峰化学试剂有限公司)、二乙烯三胺五乙酸(DTPA)和无水三氯化钆(GdCl3,国药集团化学试剂有限公司)、1-(3-二甲氨基丙基)-3乙基碳二亚胺盐酸盐(EDC·HCl,上海源聚生物科技有限公司)、N-琥珀酰亚胺(NHS)和芘(梯希爱上海化成工业发展有限公司)、马根维显(Bayer Schering Pharma AG)、噻唑蓝(MTT,Sigma-Aldrich公司);GIBCO RPMI 1640培养液(Invitrogen公司);人胰腺癌细胞株MIA PaCa-2(复旦大学附属肿瘤医院)。UV-5100B型紫外/可见分光光度计(上海元析仪器有限公司);Cary Eclipse荧光分光光度计和Varian 710全谱直读电感耦合等离子体发射光谱仪(美国安捷伦科技公司);JY92-2型超声波细胞粉碎机(宁波新芝科器研究所);Zetasizer Nano ZS激光粒度仪(英国马尔文仪器有限公司);JEM-1400透射电子显微镜(日本电子株式会社);Siemens Verio 3.0T MR扫描仪;HERAcell 150i CO2培养箱和Multiskan MK3全自动酶标仪[赛默飞世尔科技(中国)有限公司];XD-202倒置光学显微镜(南京江南永新光学有限公司)。
1.3 方法
1.3.1 COSSA-DTPA-Gd的合成 取COS 2 g(约含氨基葡萄糖单体12.4 mmol),加二甲基亚砜(DMSO)30 ml溶解备用。另取SA 0.6 g、EDC·HCl 0.8 g,加无水乙醇10 ml,加热至70℃使之溶解,并活化40 min。将活化后的溶液加入COS/DMSO溶液中,于45℃持续搅拌12 h。取反应液离心,4 000转/分,10 min,上清液加三倍量乙腈沉淀,抽滤,滤饼用热无水乙醇洗涤3次,于45℃减压干燥,获得硬脂酰壳寡糖(COSSA)。
取COSSA 1.5 g,加水30 ml溶解备用。取DTPA 0.95 g,加水90 ml,加热至70℃,待溶解后加入EDC·HCl 0.92 g,NHS 0.56 g,于70℃活化40 min。将DTPA活化酯溶液缓慢加入到COSSA溶液中,室温下持续搅拌12 h。将反应液装入透析袋(截留分子量3 500),用水透析3天。取透析袋中溶液,加乙腈沉淀,抽滤。取滤饼,45℃减压干燥,获得产物COSSA-DTPA。
取COSSA-DTPA 1 g,加水20 ml溶解,用NaOH溶液(0.2 mol/L)调节pH值至6.5±0.05。取GdCl3280 mg,加水4 ml溶解。将GdCl3溶液缓慢滴入COSSA-DTPA溶液,并在室温下搅拌2 h,期间应使溶液pH值始终维持在6.50±0.05。将溶液装入透析袋(截留分子量3 500),用水透析3天,取透析袋中溶液,冷冻干燥,即得最终产物COSSA-DTPA-Gd。用等离子体发射光谱仪测定产物中Gd的含量。
1.3.2 临界胶束浓度(CMC)的测定 采用荧光分光光度法,以芘为分子探针,测定COSSA-DTPA-Gd在水中的CMC[11]。称取芘,以甲醇溶解,配制浓度为6×10-5mol/L的溶液。取产物加水溶解并稀释至适当浓度作为供试液。精密量取芘溶液100 μl置10 ml离心管中,氮气吹干后加入各浓度的供试液10 ml,超声(400 W)20 s。以激发波长334 nm,扫描发射波长350~450 nm,测定芘在各溶液中的发射荧光强度。以芘的第一特征峰I1(λ=373 nm)与第三特征峰I3(λ=384 nm)的比值(I1/I3)对供试液浓度的对数作图,图中曲线转折点对应的浓度即为CMC。
1.3.3 对比剂胶束的粒径、电荷与外观 取COSSA-DTPA-Gd适量,加水溶解并适当稀释,超声(400 W)20 s,激光粒度仪测定胶束的粒径、多分散指数和Zeta电位。将COSSA-DTPA-Gd胶束溶液滴于有碳膜的铜网,采用2%的磷钨酸对聚合物胶束进行负染,于红外线灯下干燥,透射电子显微镜观察外观形态。
1.3.4 对比剂的体外细胞毒性检测 取COSSA-DTPA-Gd和马根维显,用pH 7.4的无菌磷酸盐缓冲液溶解、稀释至所需浓度,作为供试液。肝脏原位灌注消化法分离SD大鼠肝细胞,培养于RPMI 1640培养液。取肝细胞(细胞浓度为2×105cell/ml)接种于96孔培养板中,每孔接种体积为100 μl,培养至贴壁。每孔加入系列浓度的供试品溶液100 μl,用空白磷酸盐缓冲液作为阴性对照组。在温度37℃、5% CO2的培养箱内培养24 h。将培养液吸出,每孔中加入0.5% MTT溶液100 μl,培养4 h。按MTT试剂盒说明书方法测定细胞成活率。
1.3.5 对比剂的体外弛豫率检测 取COSSA-DTPA-Gd和马根维显,用水配制成Gd3+浓度为0.036 7~0.5 mmol/L的系列溶液,采用Siemens Verio 3.0T MR仪及机器自带头颅容积线圈,测定各溶液的体外纵向弛豫时间。仪器参数设置为:3D VIBE序列(volume interpolated body examination),TE 1.73 ms,TR 5.32 ms,FOV 100 mm,第1和第2翻转角分别为2°和14°,层厚1.5 mm,体素大小0.5 mm×0.4 mm×1.5 mm。采用Syngo MR B17软件进行成像信号分析。以超纯水为对照,计算体外弛豫率[11]:1/(T1)obs=1/(T1)d+r1×[C],其中(T1)obs为样品弛豫时间,(T1)d为溶剂水的弛豫时间,[C]为样品中Gd3+的浓度,r1为对比剂的弛豫率(单位:mM-1·s-1)。
1.3.6 荷瘤动物的MR成像 无胸腺裸鼠左腹切口2~3 cm,暴露胰腺,采用注射法将事先培养好的MIA PaCa-2细胞以2×106cells/0.1 ml浓度接种于胰腺,建立胰脏原位荷瘤裸鼠模型。模型建立约21天,在体外可以触摸到肿块后用于MR检查。
荷瘤裸鼠腹腔注射浓度为20%的氨基甲酸乙脂溶液8 ml/kg体质量进行麻醉。取COSSA-DTPA-Gd以生理盐水配制Gd3+浓度为12.5 mmol/L的溶液,经超声(400 W,20 s)形成自组装纳米胶束。马根维显稀释至相同浓度作为对照。将两种对比剂按Gd3+剂量0.1 mmol/kg体质量[12]经荷瘤裸鼠尾静脉注射。采用4通道动物线圈,在5 min、30 min、1 h、2 h分别进行增强T1WI,由具有10年以上MRI阅片经验的医师评估肿瘤对比剂强化分布情况。仪器参数设置为:SE序列T1WI,TR 400 ms,TE 12 ms,FOV 100 mm,层厚1.2 mm,体素大小0.3 mm×0.3 mm×1.2 mm。
1.4 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
合成的COSSA-DTPA-Gd中钆的含量为330.31 μmol/g。该产物具有两亲性结构,在水性介质中可自发形成以SA为疏水内核的胶束,其可能的结构见图1A,电镜照片见图1B,粒径分布见图1C。胶束外观近似球形,临界胶束浓度(5.12±0.43)μg/ml,粒径(58.3±5.7)nm,多分散指数为0.22±0.08,Zeta电位(12.1±1.9)mV。
COSSA-DTPA-Gd与马根维显的细胞毒性实验结果见图2。当Gd3+浓度相同时,两者的细胞存活率差异无统计学意义(P>0.05),24 h内各Gd3+浓度的存活率均>85%。
对比剂的体外T1WI伪彩图见图3A。随Gd3+浓度增加,T1逐渐变小;当Gd3+浓度相同时,COSSA-DTPA-Gd的弛豫时间较马根维显短。以Gd3+浓度(mmol/L)对弛豫时间的倒数(1/T1)作图(图3B),算得马根维显弛豫率为4.37 mM-1·s-1, COSSA-DTPA-Gd的弛豫率为8.23 mM-1·s-1。
荷瘤裸鼠T1WI图像见图4。结果显示,在未注射对比剂时,原位胰腺癌在T1WI显示低信号。静注马根维显5 min后可见肿瘤不均匀强化,随时间推移,马根维显迅速从体内消除,2 h时的信号强度下降。静脉注射COSSA-DTPA-Gd后可迅速显示胰腺肿瘤组织的边界;随时间推移,肿瘤内部结构亦逐渐清晰,但信号强度弱于边界;2 h时可观察到对比剂已排泄至膀胱处,但肿瘤处的MR成像依旧清晰。

图1 胶束基本性状

图2 对比剂的细胞毒性(n=5)
3 讨论
胰腺癌属乏血供肿瘤,不成熟肿瘤新生血管和肿瘤间质所组成的微环境构成了诊疗药物输送的屏障,对比剂不易渗入,故MR检查时常无法获得清晰图像。本实验选用的对照马根维显是应用最广泛的MRI对比剂,属于非特异性细胞外间隙对比剂。给药后可见裸鼠整体的MR信号增强,但并不能显示清晰的肿瘤图像。此外,还常用Mn-DPDP增强正常胰腺信号,以区分正常胰腺组织与肿瘤组织。可见目前临床常用的MR对比剂并不能显著增强胰腺癌的信号水平。
为提高MR对胰腺癌的成像效果,研究者尝试采用纳米对比剂。纳米对比剂不仅可提高弛豫率,延长成像时间,而且可利用实体瘤的高通透性和滞留效应实现对肿瘤的靶向富集,还可做表面修饰,进一步提高对肿瘤细胞的识别力。目前用于体内胰腺癌MR检查的纳米对比剂载体有:脂质体[4]、胶束[5]、树枝状聚合物[6]、纳米氧化铁[7-9]、量子点[10]。
本研究所采用的载体材料COS是由壳聚糖降解生成的一类低聚糖,既保留了壳聚糖生物相容性好的优点,又具有良好的水溶性,且溶液黏度低。基于COS的含钆对比剂研究始于2013年[13-15],尚未涉及肿瘤的MR检查。本研究发现以两亲性COS衍生物——COSSA为载体的含钆对比剂对胰腺肿瘤有良好的成像效果,注射给药后肿瘤边缘首先被清晰显现,且随时间推移,内部结构亦可被对比剂逐渐充填。究其原因,有以下4点:①COSSA-DTPA-Gd具有两亲结构,在体液中可自组装成纳米胶束且临界胶束浓度低(约5 μg/ml),有利于机体内胶束的稳定;②该胶束对比剂粒径仅60 nm左右,适合于利用EPR效应溢出并富集于肿瘤周围;③该胶束对比剂具有正电荷,有利于溢出的对比剂通过电性吸附于带负电荷的肿瘤细胞,并逐步向肿瘤内部渗透;④该胶束对比剂有较高的弛豫率(约为马根维显的2倍),有利于提高组织对比度。
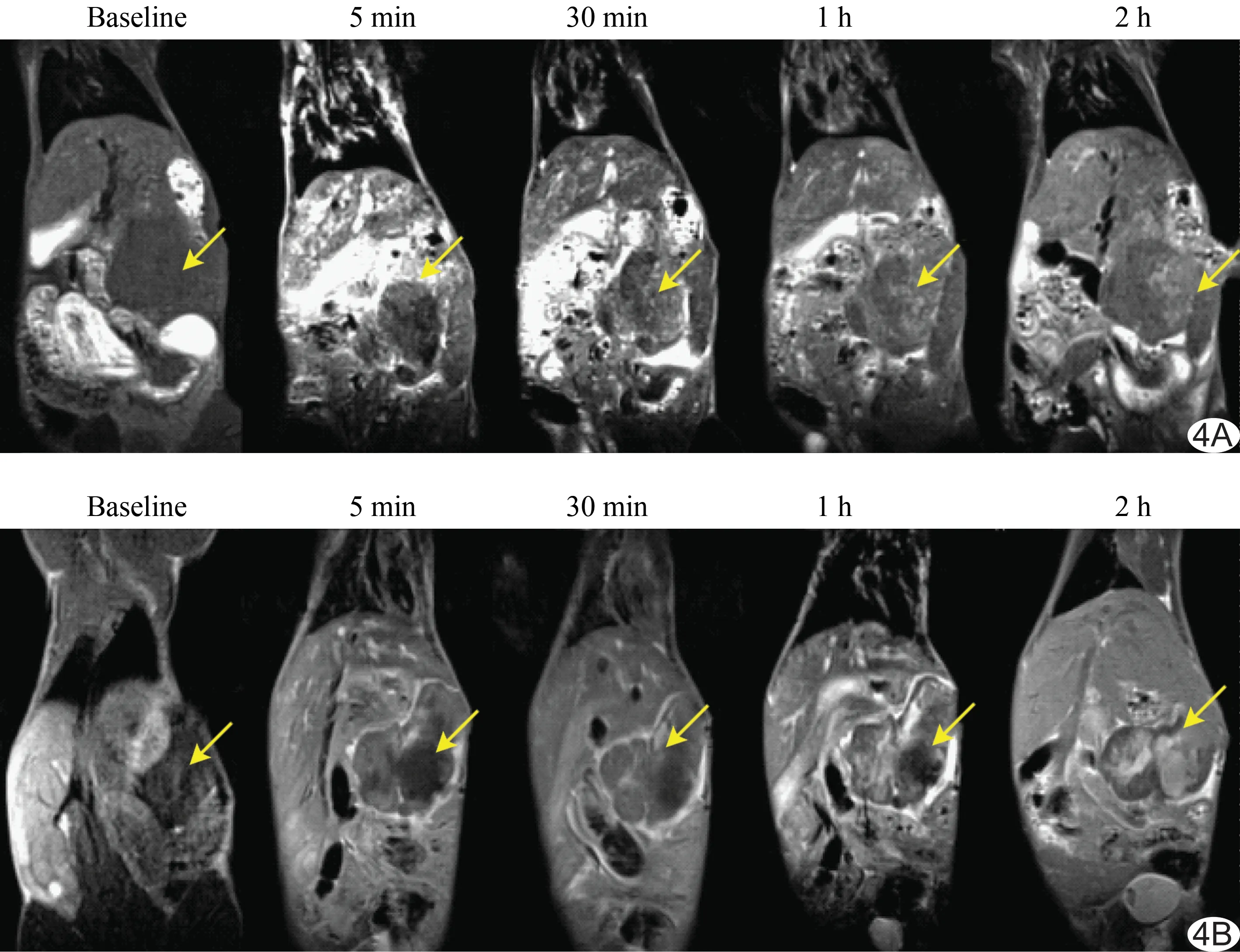
图4 不同时间原位胰腺癌(箭)的MR成像图
[1] 王理伟,陈栋晖,李琦,等.胰腺癌综合诊治中国专家共识(2014年版).临床肿瘤学杂志,2014,19(4):358-370.
[2] Stathis A, Moore MJ. Advanced pancreatic carcinoma: Current treatment and future challenges. Nat Rev Clin Oncol, 2010,7(3):163-172.
[3] Raman SP, Horton KM, Fishman EK. Multimodality imaging of pancreatic cancer-computed tomography, magnetic resonance imaging, and positron emission tomography. Cancer J, 2012,18(6):511-522.
[4] Pirollo KF, Dagata J, Wang P, et al. A tumor-targeted nanodelivery system to improve early MRI detection of cancer. Mol Imaging, 2006,5(1):41-52.
[5] Kaida S, Cabral H, Kumagai M, et al. Visible drug delivery by supramolecular nanocarriers directing to single-platformed diagnosis and therapy of pancreatic tumor model. Cancer Res, 2010,70(18):7031-7041.
[6] Wang Q, Li J, An S, et al. Magnetic resonance-guided regional gene delivery strategy using a tumor stroma-permeable nanocarrier for pancreatic cancer. Int J Nanomedicine, 2015,10(1):4479-4490.
[7] Shen JH, Li YF, Zhu YH, et al. Multifunctional gadolinium-labeled silica-coated Fe3O4and CuInS2nanoparticles as a platform for in vivo tri-modality magnetic resonance and fluorescence imaging. J Mater Chem B, 2015,3:2873-2882.
[8] Zhou H, Qian W, Uckun FM, et al. IGF1 receptor targeted theranostic nanoparticles for targeted and Image-Guided therapy of pancreatic cancer. ACS Nano, 2015,9(8):7976-7991.
[9] Rosenberger I, Strauss A, Dobiasch S, et al. Targeted diagnostic magnetic nanoparticles for medical imaging of pancreatic cancer. J Control Release, 2015,214:76-84.
[10] 曹凯,戎庭军,魏慧敏,等.基于NaGdF4:Yb,Er纳米颗粒的磁共振/上转换发光双模态探针的构建及胰腺癌体内成像研究.影像诊断与介入放射学,2016,25(2):91-97.
[11] Molina-Bolívar JA, Hierrezuelo JM, Carnero Ruiz C. Self-Selfassembly, hydration, and structures in N-decanoyl-Nmethylglucamide aqueous solutions: Effect of salt addition and temperature. J Colloid Interface Sci, 2007,313(2):656-664.
[12] Shalviri A, Foltz WD, Cai P, et al. Multifunctional terpolymeric MRI contrast agent with superior signal enhancement in blood and tumor. J Control Release, 2013,167(1):11-20.
[13] Huang Y, Cao B, Yang X, et al. Gd complexes of diethylenetriaminepentaacetic acid conjugates of low-molecular-weight chitosan oligosaccharide as a new liver-specific MRI contrast agent. Magn Reson Imaging, 2013,31(4):604-609.
[14] Termsarasab U, Cho HJ, Moon HT, et al. Self-assembled magnetic resonance imaging nanoprobes based on arachidyl chitosan for cancer diagnosis. Colloids Surf B Biointerfaces, 2013,109:280-286.
[15] Huang Y, Cao J, Zhang Q, et al. Chitosan oligosaccharide based Gd-DTPA complex as a potential bimodal magnetic resonance imaging contrast agent. Magn Reson Imaging, 2016,34(1):1-7.
Preparation of gadolinium-loaded stearic acid grafted chitooligosaccharide and application in pancreatic tumor imaging
ZHANGWeihua1,ZHENGShuangshuang1,YAOXiuzhong2,DUBin1,WENGWeiyu1*
(1.SchoolofPharmacy,EastChinaUniversityofScienceandTechnology,Shanghai200237,China; 2.DepartmentofRadiology,ZhongshanHospitalAffiliatedtoFudanUniversity,Shanghai200032,China)
Objective To prepare gadolinium-loaded stearic acid grafted chitooligosaccharide (COSSA-DTPA-Gd) and evaluate its micelle properties, cytotoxicity, relaxation rate in vitro, and pancreatic tumor in vivo imaging. Methods Stearic acid grafted chitooligosaccharide (COSSA) was synthesized by acetylation reaction between stearic acid and chitooligosaccharide. Diethylenetriaminepentaacetic dianhydride (DTPA) was conjugated to the residual amino groups of COSSA, then Gd3+was chelated to obtain the final product. The micelle properties were measured using an electron microscopy and a laser particle sizer. The MTT assay was adopted to determine cytotoxicity. The in vitro relaxation rate and in vivo imaging of pancreatic tumor were evaluated using an MR scanner. Results COSSA-DTPA-Gd could self-assemble into stable micelles in aqueous solutions with a critical micelle concentration of (5.12±0.43)μg/ml. The micelles had positive charge and exhibited roughly spherical shape with a mean diameter of (58.3±5.7)nm. The content of Gd3+in COSSA-DTPA-Gd was 330.31 μmol/g. The nanoprobe and Magnevist, the commercial formulation, showed similar cytotoxicity (P>0.05). The cell survival rate within 24 h were higher than 85%. The in vitro relaxation rate of COSSA-DTPA-Gd was 8.23 mM-1·s-1. After intravenous injection, COSSA-DTPA-Gd showed a better positive contrast-enhancing effect for pancreatic tumor than Magnevist. The MR images at the tumor periphery was rapidly enhanced, while a slow increase in image quality was observed in tumor core. Conclusion The prepared COSSA-DTPA-Gd can be used for efficient MR imaging of pancreatic tumor.
Gadolinium; Chitooligosaccharide; Micelles; Magnetic resonance imaging; Pancreatic neoplasms
上海市自然科学基金(16ZR1405900)。
张炜华(1987—),女,河北张家口人,在读硕士。研究方向:纳米磁共振对比剂。E-mail: 285149731@qq.com
翁伟宇,华东理工大学药学院,200237。E-mail: wyweng@ecust.edu.cn
2016-09-30
2017-01-05
10.13929/j.1003-3289.201609159
R332; R445.2
A
1003-3289(2017)04-0499-05
