表面等离子体共振免疫传感器用于快速检测微囊藻毒素的研究
2017-06-01钟金钢李仕萍
李 莹,钟金钢,马 骁,李仕萍,齐 攀
(1.光电信息与传感技术广东普通高校重点实验室,暨南大学,广东广州 510632;2.暨南大学预科部,广东广州 510610;3.暨南大学光电工程系,广东广州 510632;4. 广东交通职业技术学院电子工程系,广东广州 510650)
表面等离子体共振免疫传感器用于快速检测微囊藻毒素的研究
李 莹1,2,钟金钢1,3,马 骁1,3,李仕萍1,3,齐 攀4,*
(1.光电信息与传感技术广东普通高校重点实验室,暨南大学,广东广州 510632;2.暨南大学预科部,广东广州 510610;3.暨南大学光电工程系,广东广州 510632;4. 广东交通职业技术学院电子工程系,广东广州 510650)
针对现有微囊藻毒素(MC-LR)检测方法操作复杂、因标记而污染环境、仪器贵重,不利于现场快速检测等问题,将自行研制的表面等离子体共振(SPR)生物芯片检测仪应用于微囊藻毒素的检测,提出抑制型SPR生物芯片快速检测痕量微囊藻毒素的方法。采用该方法分别对浓度为3.5、2.5、1.5、1、0 μg/L的MC-LR样品进行了检测。结果表明:该方法检测限小于1 μg/L,可满足世界卫生组织(WHO)对于饮用水和我国地表水环境质量标准中MC-LR最低含量检测的需求。该方法完成一个样品检测耗时约8 min,相比于高效液相色谱法(HPLC)和酶联免疫吸附法(ELISA)等传统检测方法,快速定量是其最大的优势,可用于食品质量监控和现场实时检测。
表面等离子体共振,生物芯片,无标记快速检测,微囊藻毒素
随着社会工业化的发展,水体富营养化日益严重,蓝藻水华现象频频发生,产生的藻毒素严重威胁人类和动物的健康。蓝藻的次生代谢产物微囊藻毒素(Microcystin,MC)出现频率最高、产生量大且危害最严重[1]。MC能引起神经系统异常症状,如头晕、耳鸣、眩晕、头痛、呕吐、恶心、轻度耳聋、视力障碍和失明等,造成肝脏等多个器官的损伤[2-4]。在我国长江、黄河、松花江等主要河流以及滇池、上海淀山湖等淡水湖泊中都相继发生过蓝藻水华污染现象[5]。微囊藻毒素是一类具有生物活性的单环七肽,分子量900~1200 u,是一种肝毒素,是肝癌的强烈促癌剂[6]。至今已发现80多种异构体,在淡水环境中存在较多、毒性较强的是微囊藻毒LR[6],具有水溶性和耐热性,不挥发,抗pH变化,在水中的自然降解过程十分缓慢。目前,世界卫生组织(WHO)推荐的饮用水标准和我国地表水环境质量标准中规定MC-LR的标准限量值≤1 μg/L[7]。
MC-LR的检测常用方法有高效液相色谱法(High Performance Liquid Chromatography,HPLC)、酶联免疫吸附法(Enzyme Linked Immunosorbent Assay,ELISA)、液相色谱-质谱/质谱法(Liquid Chromatography-Mass Spectrometry/Mass Spectrometry,LC-MS/MS)等,这些方法的缺点是样品处理时间长,检测过程烦琐、难于操作,使用放射性元素或标记物而污染环境,仪器价格昂贵且检测成本高,在实际应用中受到限制[5,8-9]。基于表面等离子体共振(Surface Plasmon Resonance,SPR)的生物芯片是一种生物传感器,不需要标记就可对分子间的相互作用进行实时监测,已被广泛用于药物分析、食品分析、环境监测等许多领域[10-14]。
本研究采用自行开发的便携式表面等离子体共振(SPR)生物芯片检测仪,利用免疫反应的特异性,采用竞争型免疫方法检测微囊藻毒素(MC-LR),分析动力学反应过程,建立标准曲线。
1 材料与方法
1.1 材料与仪器
便携式SPR生物芯片检测仪为自行研制,如图1[15]所示,检测仪包括光路系统、流路系统、电路(信号探测与控制)系统、软件(数据分析)系统和传感芯片等部分。光路系统基于目前已应用成熟的Kretschman结构,采用共振角光信号的探测方式。用电学方法控制入射光角度的改变,检测不同入射角时反射光强的变化,方法简便易行,系统测量精度可达0.002°。用Labview软件编写控制程序,界面友好。
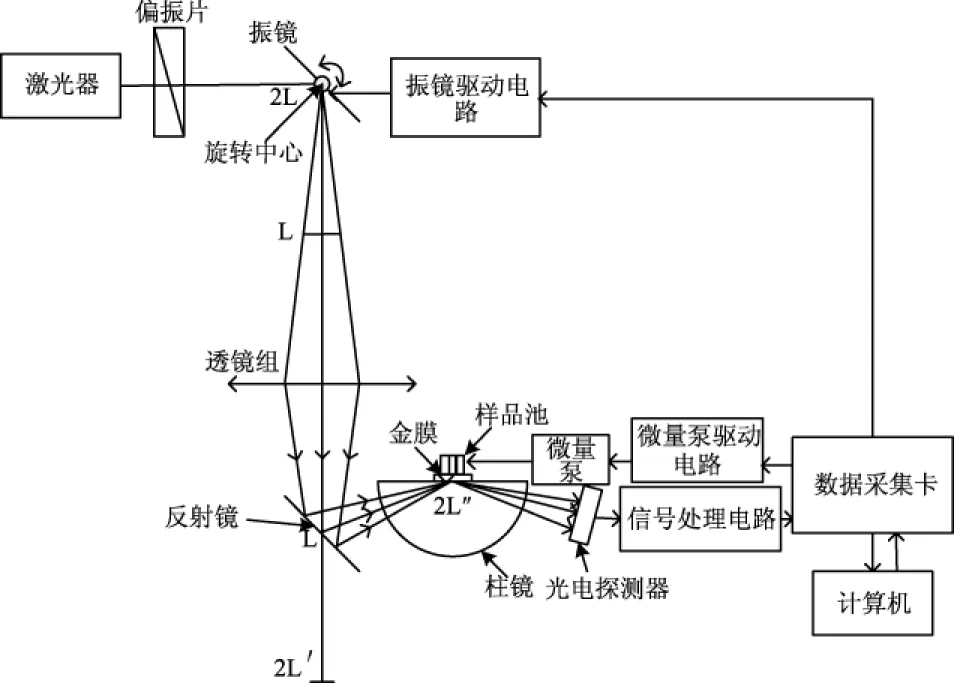
图1 表面等离子体共振生物芯片检测仪示意图Fig.1 System schematic of SPR biochip detector sensor
MC-LR(Microcystin-LR)标准品 TAS(Taiwan Algal Science Inc.),分子量995.2,纯度≥95%;MC-LR单克隆抗体(1 mg/mL)、MC-LR和BSA的耦联抗原MC-LR-BSA(1 mg/mL) 伊普瑞斯科技有限公司(北京);巯基十一酸[HS(CH2)10COOH]、巯基己酸[HS(CH2)6OH]、乙醇胺(Eth)、十二烷基硫酸钠(SDS)、N-羟基琥珀酰亚胺(N-Hydroxysuccinimide,NHS)、碳二亚胺[N-ethyl-N′-(dimethylaminopropyl)carbodiimide,EDC] 美国Sigma公司;其它试剂 北京化学试剂公司。免疫反应的缓冲液是PBS缓冲液(2 mmol/L NaH2PO4,2 mmol/L Na2HPO4,150 mmol/L NaCl,pH7.4),MC-LR标准品、MC-LR抗原、MC-LR单克隆抗体用PBS缓冲液稀释成相应浓度的溶液。
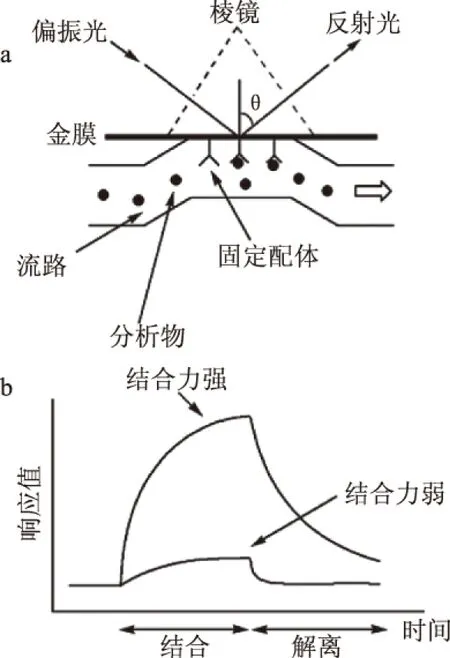
图2 表面等离子体共振传感器检测过程示意图Fig.2 Application example of Kretschmann SPR detector注:(a)SPR传感芯片工作示意图;(b)免疫反应结果简图。
1.2 检测原理
利用SPR进行生物(免疫反应)实验时,一般还要在传感芯片表面固定一种反应物,使其形成分子敏感膜;然后含待测物的样品通过流路系统进入传感芯片,传感芯片上分子间相互作用的情况可由SPR信号(共振波长或者共振角)的改变反映出来,并通过计算机软件将整个反应过程显示和记录下来[16-17]。图2[16]为Kretschmann型SPR检测仪器的传感芯片的工作示意图和免疫反应实验结果简图。图2a中,金膜上用共价交联法固定了配体,当含有匹配的受体的样品流经芯片表面时,亲和反应将分析物(受体)捕获在膜表面,引起折射率的增加,反射光的共振状态也会相应改变;图2b为典型的免疫反应响应曲线,通过注入含有待检测物质和不含有待检测物质的缓冲液,可实时监测被分析物结合与解离的过程。如图2b所示,随着反应时间(横坐标)的改变,待测样品折射率产生变化,从而引起新的共振波长或者共振角度(纵坐标)。因此,可根据表面等离子体共振时入射光波长或者角度与金属薄膜表面液体折射率的关系来探测生物分子间的相互作用。
1.3 生物芯片的制备
本实验所用生物芯片的基底为直径20 mm厚度1 mm的圆形玻璃片,上面沉积50 nm的金,然后通过自组装单层分子膜(Self-Assembled Monolayer,SAM)技术对金膜进行修饰,固定生物探针。香柏油的折射率与玻璃相近,由香柏油作为耦合剂,将镀有金膜的传感芯片安放到仪器上。安装流通系统,通入PBS缓冲液,基线稳定几分钟后进行生物芯片的自组装,通入0.1 mmol/L的HS(CH2)10COOH(巯基十一酸)和0.9 mmol/L的HS(CH2)6OH(巯基己酸)的乙醇溶液,对金膜表面进行化学修饰2 h。修饰液中的巯基与金键合,形成羧基。通入PBS缓冲液清洗,形成整个反应的基线。基线稳定后加入0.1 mol/L的NHS和0.1 mol/L的EDC混合液(1∶1,v/v),活化芯片表面15 min,将芯片表面的羧基活化成活泼酯。然后用PBS冲洗2 min,芯片修饰完毕。然后进行生物探针的固定,在修饰和活化后的生物芯片表面固定稀释了30倍的微囊藻毒素衍生物(MC-LR-BSA)作为生物探针,此时SPR响应值逐渐升高,30 min后通入PBS冲洗2 min,响应值高于探针固定前,说明探针固定效果较好。加入1 mol/L的乙醇胺(pH8.5)封闭灭活剩余的酯键,2~4 min,PBS冲洗后,生物芯片制备完成,可用于下一步的免疫检测。
2 结果与分析
2.1 抗体工作浓度的确定
微囊藻毒素MC-LR的分子量是995.2,如果生物芯片表面固定抗体,MC-LR能与抗体结合,但对芯片表面附近的折射率影响较小,SPR共振峰的变化小,导致检测限偏高,因此MC-LR分子不适于直接法检测。为了对MC-LR痕量物质检测,提出抑制型SPR生物芯片检测方法。将MC-LR-BSA固定在生物芯片表面,作为生物探针,不同浓度的微囊藻毒素分子与过量抗体混合,各组样品中抗体为固定的工作浓度,静置5 min后,通入生物芯片表面,检测SPR效应,分析动力学过程。每个样品测试完毕,通入PBS缓冲液和1%的SDS溶液,进行洗脱和再生,使SPR响应值回到基线。SPR生物芯片抑制免疫法检测微囊藻毒素的过程示意如图3所示。
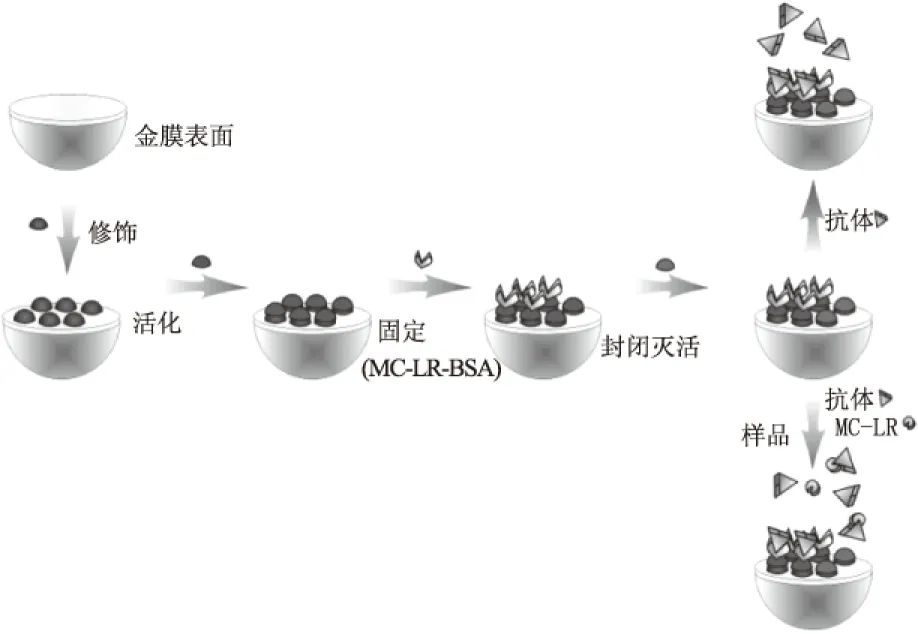
图3 MC-LR表面等离子体共振免疫检测示意图Fig.3 Scheme of MC-LR immune detection by surface plasmon resonance
为了确定抗体工作浓度,在生物芯片表面固定MC-LR-BSA,MC-LR单克隆抗体用PBS稀释1、2、3、10 mg/L,分别作为检测样品,比较各组样品的SPR响应值,作为选择工作抗体浓度的依据。抗体浓度的选择主要考虑两点[6]:一是适当的结合值。结合值高,抗体浓度高,抑制浓度随之增大,检测限也将提高;结合值低,抗体浓度低,竞争抑制曲线工作范围变小[18]。二是抗体的消耗量。由于抗体的制备成本较高,抗体消耗量大,会导致检测成本增加。由图4可见,在同样的进样量和进样速度等实验条件下,10 mg/L单克隆抗体的结合值最大,1 mg/L单克隆抗体的结合值最小。结合值大,抑制浓度随之增大,抗体消耗量也大,会增加检测成本;结合值小,检测范围相应减小。因此,综合考虑检测成本和检测范围,最后选择3 mg/L为抗体工作浓度,检测范围是1~4 μg/L。
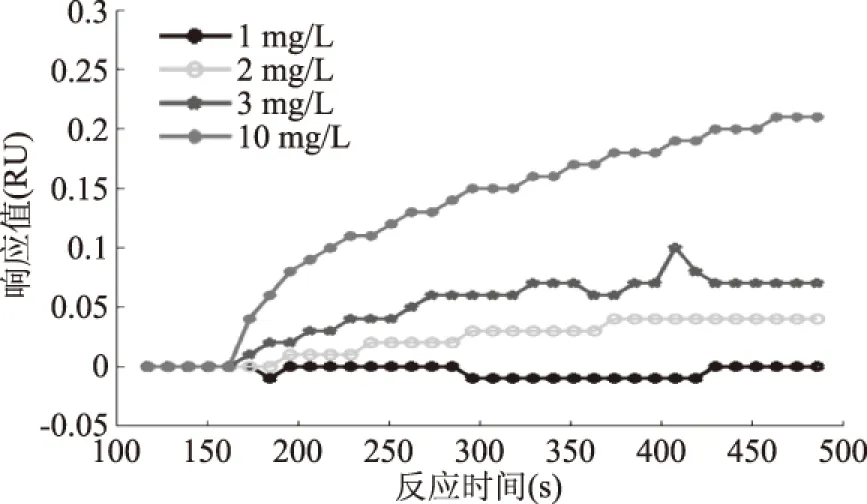
图4 抗体与生物探针免疫反应的动力学曲线Fig.4 Immune response kinetic curves of antibody and biological probes
用PBS缓冲液稀释MC-LR抗体,与微囊藻毒素分子样品混合,静置5 min,让两者充分反应。混合物通入生物芯片表面,记录SPR响应值的动态变化。上述混合物中的微囊藻毒素分子和生物芯片表面的探针MC-LR-BSA都可以与混合物中的抗体结合,即微囊藻毒素分子抑制探针MC-LR-BSA(和探针竞争关系)与微囊藻毒素抗体的结合。
2.2 芯片稳定性测试
为了测试芯片的稳定性,以10 mg/L的MC-LR单克隆抗体作为检测样品,与芯片表面探针MC-LR-BSA发生免疫反应,以1%的SDS为再生液,重复20次,测试芯片的稳定性,其中第1次、第10次和第20次测试的免疫反应曲线如图5所示。求得20次测量的平均结合值(SPR响应)为0.2055 RU,标准偏差为0.058,相对标准偏差为2.7%,可见芯片结合以及再生均稳定。
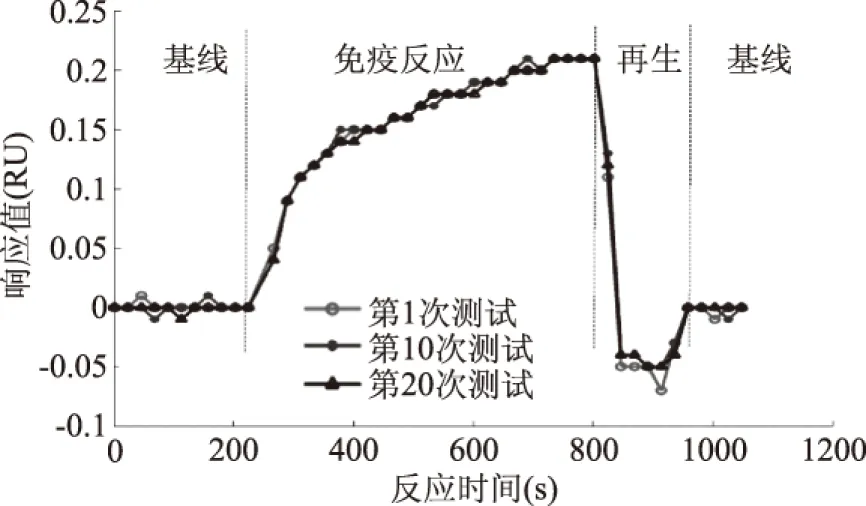
图5 生物芯片重复性测试曲线Fig.5 Repeatability test curve of biological chip
2.3 抑制法检测微囊藻毒素的标准曲线和检测限
用PBS缓冲液稀释MC-LR抗体,与一组微囊藻毒素分子样品混合,静置5 min,让两者充分反应。在混合物中抗体的终浓度为3 mg/L,微囊藻毒素分子的终浓度分别为0、1、1.5、2.5、3.5 μg/L。混合物通入生物芯片表面,记录SPR响应值的动态变化。抗体的分子量较大,抗体与芯片表面的探针结合后,抗原-抗体结合物引起SPR响应值变化大,则样品中微囊藻毒素分子的浓度与SPR响应值的变化成反比。如果样品中微囊藻毒素浓度小,则更多的微囊藻毒素抗体与生物芯片表面探针结合,SPR响应值即共振角的变化大。免疫反应约8 min后,结束检测,通入PBS溶液和1%的SDS溶液,进行洗脱和再生,使抗原-抗体结合物分解,然后PBS缓冲液清洗2 min,SPR响应值可回到免疫反应前的基线,可用于下组样品的检测。
图6是该组样品通入芯片表面,抑制法检测微囊藻毒素分子时的动力学曲线,当样品中微囊藻毒素浓度大时,可与芯片表面探针结合的微囊藻毒素抗体的数量少,免疫反应速度慢,SPR响应值低,微囊藻毒素分子浓度与SPR响应值成反比。

图6 抑制法检测MC-LR的动力学曲线Fig.6 Kinetic curve of detection of MC-LR by inhibition assay
图7是抑制法检测微囊藻毒素分子的标准曲线,用免疫反应6 min时的响应值作为纵坐标,微囊藻毒素浓度作为横坐标,曲线近似呈倒“S”型,检出限小于1 μg/L,可满足WHO对于饮用水和我国地表水环境质量标准中MC-LR的标准限量值≤1 μg/L的检测需求。由未知浓度的待测样品SPR响应值,查询标准曲线,可得出样品中微囊藻毒素的浓度。由图6可见,一个样品的检测耗时约8 min,相比于HPLC和ELISA等传统检测方法[19],其快速定量是最大的优势,该装置和方法可用于食品质量监控和现场实时检测。
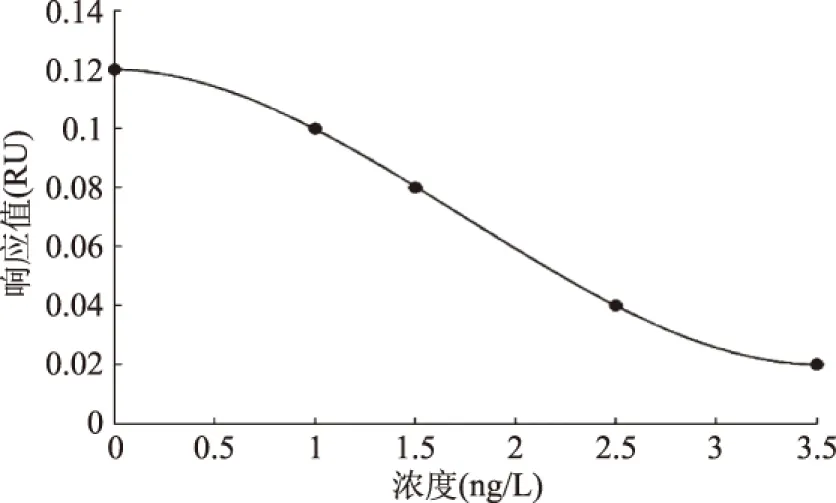
图7 抑制法检测MC-LR的标准曲线Fig.7 Standard curve of MC-LR detection by inhibition assay
3 结论
提出抑制型SPR生物芯片快速检测痕量微囊藻毒素的方法。实验结果表明所建立的研究方法检测限小于1 μg/L,可满足WHO对于饮用水和我国地表水环境质量标准中MC-LR最低含量检测的需求,本研究采用的抗体工作浓度是3 mg/L,如果降低抗体工作浓度,还可以降低微囊藻毒素分子样品的检出限。与常用的ELISA等方法相比,SPR生物芯片检测方法具有设备便携、样品前处理简单、免标记、特异性强、操作简便、对环境无污染、成本低、可快速给出定量结果等优点,可进行现场大量样品的实时连续检测和快速筛选,适用于超市、集市、工厂等需要实时检测的场所,进行质量监控。
[1]Carmichael W W. The Cyanotoxins[J]. Advances in Botanical Research,1997,27:211-256.
[2]徐潇颖,刘柱,梁晶晶,等. 全自动固相萃取-高效液相色谱法同时测定饮用水中3种微囊藻毒素[J]. 食品工业科技,2016,37(18):60-62.
[3]Arzate-Cárdenas M A,Olvera-Ramírez R,Martínez-Jerónimo F. Microcystis,toxigenic strains in urban lakes:a case of study in Mexico City[J]. Ecotoxicology,2010,19(19):1157-1165.
[4]Peng F,Xue H H,Chen W C,et al. Investigation on simultaneous determination of deltamethrin,carbaryl,microcystin-LR and benzo[a]pyrene by online SPE-HPLC method[J]. Advanced Materials Research,2014,1073-1076:575-578.
[5]梁丽丽,弓爱君,李红梅,等. 高效液相色谱法检测水体中微囊藻毒素[J]. 分析化学,2010,38(5):740-742.
[6]周宏敏,欧惠超,任鹏,等. 利用SPR技术测定湖水中微囊藻毒素[J]. 中国环境科学,2012,32(7):1284-1287.
[7]Yamamura S,Bartram J,Csanady M,et al. Drinking water Guidelines and standards[C]. World Health Organization,Geneva,Switzerland,2004.
[8]Yu T,Xie P,Dai M,et al. Determinations of MC-LR and[Dha7]MC-LR concentrations and physicochemical properties by liquid chromatography-tandem mass spectrometry[J]. Bulletin of Environmental Contamination & Toxicology,2009,83(5):757-760.
[9]Nagata S. Development and application of highly sensitive anti-immune complex ELISAs for microcystins in tap water[J]. Food & Agricultural Immunology,2010,12(3):231-241.
[10]Li S P,Zhong J G. Simultaneous amplitude-contrast and phase-contrast surface plasmon resonance imaging by use of digital holography[J]. Biomedical Optics Express,2012,3(12):3190-3202.
[11]Espiritu R A,Matsumori N,Murata M,et al. Interaction between the marine sponge cyclic peptide theonellamide a and sterols in lipid bilayers as viewed by surface plasmon resonance and solid-state 2H nuclear magnetic resonance[J]. Biochemistry,2013,52(14):2410-2418.
[12]Homola J,Lu H B,Yee S S. Dual-channel surface plasmon resonance sensor with spectral discrimination of sensing channels using dielectric overlayer[J]. Electronics Letters,1999,35(13):1105-1106.
[13]Nelson B P,Grimsrud T E,Liles M R,et al. Surface plasmon resonance imaging measurements of DNA and RNA hybridization adsorption onto DNA microarrays[J]. Analytical Chemistry,2001,73(1):1-7.
[14]Yuk J S,Kim H S,Jung J W,et al. Analysis of protein interactions on protein arrays by a novel spectral surface plasmon resonance imaging[J]. Biosensors and Bioelectronics,2006,21(8):1521-1528.
[15]齐攀,钟金钢,李莹,等. 用于食品安全检测的便携式表面等离子体共振生物传感器[J]. 光电工程,2014(3):22-27.
[16]Schasfoort R B M,Tudos A J. Handbook of surface plasmon resonance[M]. Royal Society of Chemistry,2008.
[17]Karlsson R. SPR for molecular interaction analysis:a review of emerging application areas[J]. Journal of Molecular Recognition,2004,17(3):151-161.
[18]王晓萍,詹舒越,罗昭锋,等. 地表水微囊藻毒素的表面等离波子共振免疫检测方法研究[J]. 光学学报,2012,32(2):0212005-1-0212005-6.
[19]郭伟,黑亮,杨燕婷,等.固相萃取-高效液相色谱法优化测定饮用水中的微囊藻毒素[J]. 广东农业科学,2014,1:146-148.
Research of the surface plasmon resonance immunosensor for rapid detection of microcystin
LI Ying1,2,ZHONG Jin-gang1,3,MA Xiao1,3,LI Shi-ping1,3,QI Pan4,*
(1.Laboratory of Optoelectronic Information and Sensing Technologies of Guangdong Higher Education Institutes,Jinan University,Guangzhou 510632,China;2.Pre-university,Jinan University,Guangzhou 510610,China;3.Department of Optoelectronic Engineering,Jinan University,Guangzhou 510632,China;4.Department of Electronics Engineering,Guangdong Communication Polytechnic,Guangzhou 510650,China)
As the existing pesticide detection methods were complicated,would pollute the environment by marking,with precious instrument,and not conducive to on-site rapid detection,the self-developed surface plasmon resonance biological chip detector was used in the detection of microcystin(MC-LR),a method for rapid detection of microcystin by inhibiting type SPR biological chip was proposed. The competitive inhibition immunoassay was preceded in MC-LR with concentrations of 3.5,2.5,1.5,1,0 μg/L. The experimental results showed that the detection limit could be 1 μg/L which could meet the needs of the World Health Organization(WHO)for detecting the minimum content of MC-LR in drinking water and surface water environmental quality standards in China. The detection of 1 sample would take about 8 min by this method,compared with the traditional methods such as high performance liquid chromatography(HPLC)and enzyme linked immunosorbent assay(ELISA),the rapid and quantitative was the biggest advantage of this method. The established device and method could be used for food quality monitoring and on-site real-time detection.
surface plasmon resonance;biochip;label free rapid detection;microcystin
2016-08-26
李莹(1976-),女,博士,教授,主要从事生物医学信息技术研究,E-mail:916407691@qq.com。
*通讯作者:齐攀(1982-),男,博士,副教授,主要从事光电检测技术方面的研究,E-mail:82381299@qq.com。
国家自然科学基金项目(61605063和41206081);广东省自然科学基金项目(2014A030310483和2015A030310458);广东省高等职业院校珠江学者岗位计划资助项目(2016年度)。
TS207.3
A
1002-0306(2017)05-0304-5
10.13386/j.issn1002-0306.2017.05.049
