半纤维素降解菌J-25的筛选、鉴定及产酶特性研究
2017-06-01姜立春王成红林寿露赵丽萍阮期平
姜立春,王成红,刘 羽,林寿露,赵丽萍,阮期平
(绵阳师范学院分子生物学与生物制药重点实验室,四川绵阳 621000)
半纤维素降解菌J-25的筛选、鉴定及产酶特性研究
姜立春,王成红,刘 羽,林寿露,赵丽萍,阮期平*
(绵阳师范学院分子生物学与生物制药重点实验室,四川绵阳 621000)
以腐烂的木材为菌源,经过初筛、复筛,采用半纤维素水解圈法和胞外酶测定法进行菌株筛选获得一株半纤维素高效降解菌株J-25。通过对菌株J-25的16S rDNA进行测序分析,鉴定为纤维单胞菌属命名为Cellulomonassp. J-25。对菌株J-25进行产酶条件和酶学性质研究,结果表明:菌株J-25发酵产酶的优化条件为:培养时间为60 h、温度30 ℃、初始pH为7.0、麸皮浓度为20 g/L、酵母粉浓度为10 g/L、装液量为50 mL(250 mL三角瓶),半纤维素酶活性可达到62.8 U/mL。最适酶反应条件为:pH为6.5、温度为40 ℃、底物浓度为15 g/mL、反应时间为30 min。这些将为半纤维素的生物降解提供实验依据。
半纤维素,降解菌,产酶条件,酶学性质,16S rDNA
半纤维素是植物性材料的有效组成成份之一,约占15%~30%,是陆生植物细胞壁的一种主要组分,较集中于初级与次级细胞壁中。半纤维素是由己糖与戊糖构成的异质多糖[1],探讨半纤维素生物转化具有重要的实践价值,如在生物制浆,将其转化为单糖和酒精,处理造纸厂废水的环境污染等方面具有广泛的应用前景[2]。半纤维素酶是分解半纤维素的一类酶的总称,主要由内切酶、外切酶和糖苷水解酶组成[3]。微生物产生的半纤维素酶将半纤维素降解产生术糖和其它少量单糖[4]。有利于废弃农作物还田,改善植物的营养状况,还能够使农作物抵抗某些病原微生物的致病作用,减轻病虫害,增加产量[5]。全桂静等[5]使用半纤维素作为唯一碳源,通过平板水解圈与摇瓶发酵相结合方法,筛选分离纯化到1株半纤维素酶高产菌株Hc-3,鉴定该菌株属于曲霉属(Aspergillus)。张庆芳等[6]以木聚糖作为唯一碳源,分离获得1株降解半纤维素中木聚糖的高效菌株,经形态学和分子生物学鉴定为曲霉属(Aspergillus)。张宁宁等[7]以半纤维素为唯一碳源,从温泉中分离到1株降解半纤维素酶的嗜热菌DT-1,经16S rDNA序列比较分析,初步鉴定该菌株属于Geobacillusthermocatenulatus。
本研究以腐朽木材为菌源,筛选获得的一株半纤维素降解菌进行了菌株鉴定和发酵条件优化,并对酶学性质进行了分析,以期提高半纤维素酶的活性,为纤维的生物降解提供实验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 样本采集 使用无菌取样铲采集腐烂木材或长期存放木材下面的土壤作为筛选菌源,用无菌袋包装带回实验室,于4 ℃冰箱中保存,备用。
1.1.2 主要仪器和试剂 PCR仪器(Thermol Research Inc);Gel-Doc XR分子凝胶成像系统(BIO-RAD);高速冷冻离心机(Eppendorf);净化工作台(SB-JC-1A);紫外分光光度计(Uitrospec 3300pro);恒温培养摇床(HZ-9211K);微量可调移液器(Eppendorf)等。
pMD18-T试剂盒、X-gal和IPTG、DNA胶回收试剂盒和氨苄青霉素购自上海生物工程技术服务有限公司,引物的合成和DNA测序由上海生物工程技术有限公司完成,DNS试剂、木聚糖溶液。
1.1.3 培养基及配方 初筛培养基(100 mL):木聚糖0.5 g,酵母粉0.1 g,KH2PO40.1 g,NH4NO30.1 g,MgSO4·7H2O 0.1 g,NaCl 0.5 g,琼脂1.5 g。
透明圈测定培养基(100 mL)[8]:K2HPO42.0 g,NH4NO32.0 g,MgSO4·7H2O 0.2 g,酵母膏5.0 g,半纤维素20.0 g,pH7.2。
发酵产酶培养基(100 mL):木聚糖0.5 g,KH2PO40.1 g,NH4NO40.4 g,MgSO4·7H2O 0.1 g,NaCl 0.5 g。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5g,琼脂2.2%,水1000 mL,pH7.4~7.6,固体平板加2.0%琼脂。上述培养基均在121 ℃灭菌 20 min。
1.2 实验方法
1.2.1 菌株筛选 将样品制成菌悬液。将菌悬液稀释后均匀涂布于筛选平板上,27 ℃恒温培养3 d,将纯化后的单菌落点种于透明圈培养基上,27 ℃恒温培养,测量水解圈的直径D(mm)及菌落的直径d(mm),并计算D/d值,进行初筛。复筛测定发酵液酶活力。
1.2.2 菌种鉴定
1.2.2.1 形态观察 将细菌在牛肉膏蛋白胨培养基平板上培养32 ℃培养30 h后进行菌落形态观察,放于4 ℃冰箱中保存。选择单一菌落进行革兰氏染色,镜检观察其显微结构。
1.2.2.2 生理生化 菌株J-25生理生化实验参照文献[9]中的方法。依据《常见细菌系统鉴定手册》,对筛选获得的菌株J-25进行初步鉴定。
1.2.2.3 DNA提取与扩增16S rDNA基因 细菌基因组DNA提取:提取基因组DNA参考Kim等[10]方法,对其方法略有修改。0.9%琼脂糖电泳检测。
采用细菌通用引物P27f:5′-AGAGTTT GATCCTGGCTCAG-3′,P1492r:5′-GGTTACCTTG TTACGACTT-3′对菌株进行16S rDNA基因片段扩增。PCR反应体系:37.5 μL ddH2O、5.0 μL 10×PCR buffer、4 μL dNTPs(各2.5 mmol/L)、1.0 μL P27f引物(20 pmol/μL)、1.0 μL P1492r引物(20 pmol/μL)、2 μL模板、0.5 μL TaqDNA聚合酶,反应总体积为50 μL。扩增热循环体系:94 ℃预变性4 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸50 s;经35个循环后,72 ℃延伸18 min。PCR扩增产物经电泳检测后,其产物回收纯化与pMD-19T载体连接,转入感受态细胞JM109,筛选阳性重组子邮寄上海英俊生物科技有限公司测序。
1.2.2.4 16S rRNA序列分析与系统进化树构建 将菌株的16S rDNA序列在NCBI数据库中进行Blast序列比对与相似性分析,下载与该序列相似性较高的核酸序列用于系统进化树分析。将在数据库中下载的相关菌株16S rRNA序列,采用Clustal X软件包[11]进行多序列比对分析,用Mega 6.0软件程序中的Neighbor-Joining法进行聚类分析和构建系统进化树[12]。
1.2.3 半纤维素酶活性测定 粗酶液1.0 mL,加1.5 mL pH=4.8的1%木聚糖溶液(对照用1.0 mL稀释酶液加3.0 mL pH=4.8的醋酸缓冲液,不加木聚糖溶液),50 ℃水溶60 min,取出后,再吸取4.0 mL DNS试剂摇匀,立即沸水浴反应10 min,冷却后,补加水定容到25 mL,于550 nm下测OD值。一个半纤维素酶单位定义为:1.0 mL酶液于50 ℃ pH=4.8条件下,每分钟分解1.0%木聚糖溶液产生一微克还原糖(以木糖)的酶量定义为一个半纤维素酶活力单位。酶活力计算公式:U=(A×N×1000)/60,式中:A=OD550 nm下的吸收值相对应的木糖浓度;N=酶的稀释倍数。
1.2.4 产酶条件优化 在发酵培养基的基础上通过改变单一因素,并保持其他发酵条件不变,以下实验每个条件制作三个平行。培养时间:将菌株J-25接入产酶培养基中(接种量为1%)。置于32 ℃ 160 r/min摇床上进行培养,观察并记录其生长状况,每12 h测定记录一次,共5 d;碳源(浓度10 g/L)分别为麸皮、玉米粉、半纤维素、可溶性淀粉、麦芽糖、蔗糖、葡萄糖,在碳源确定的基础上,实验在5、10、15、20、25和30 g/L条件下分析碳源浓度;而氮源(浓度5 g/L)为蛋白胨、豆粕、酵母膏、硫酸铵、硝酸铵,在氮源确定的基础上,实验在1、5、10、15和20 g/L条件下分析氮源浓度;实验考察不同初始pH(5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10),不同装液量(10、30、50、80、100、120 mL/250 mL三角瓶),不同培养温度(20、24、27、30、33、37、40 ℃)等条件对该菌株产酶的影响[13-14]。
1.2.5 酶学性质初步研究
1.2.5.1 pH对酶活力的影响 pH分别为3.0、4.0、5.0、6.0、7.0的1.0%木聚糖溶液1.5 mL分别加入粗酶液0.5 mL,摇匀,50 ℃水浴60 min,取出后,用DNS法测定酶活力。
1.2.5.2 温度对酶活力的影响 调节最适pH,使酶反应体系在10、20、30、40、50、60 ℃下保温60 min,取出后,用DNS法测定不同温度下的酶活力。
1.2.5.3 底物浓度对酶活力的影响 浓度为1、5、10、15、20 g/L的木聚糖溶液1.5 mL,分别加入粗酶液0.5 mL,摇匀,50 ℃水浴60 min,取出后,用DNS法测定酶活力。
1.2.5.4 反应时间对酶活力的影响 调节最适pH,使酶反应体系在50 ℃水浴锅中分别保温10、20、30、40、50、60 min,取出后,用DNS法测定酶活力。
1.3 数据统计分析
测定结果利用Microsoft Excel软件制图以及进行统计学分析,实验每个条件制作3个平行。
2 结果与分析
2.1 半纤维素降解菌的筛选
经过平板分离,挑取能产生透明圈的菌株共6株。在液体培养基中发酵后测定酶活性,选出木聚糖酶活性较高的菌株3株,挑取酶活最高的菌株J-25进行产酶条件分析和酶学性质研究。菌株J-25在牛肉膏蛋白胨培养基上培养36 h后,菌落圆形,边缘整齐,乳白色,凸起圆球状,革兰氏染色阳性,菌体形态为短杆状,呈单个或成对排列。
2.2 菌株J-25生理生化鉴定
菌株J-25的V-P反应呈阴性,甲基红实验呈阳性,吲哚实验呈弱阳性,糖发酵实验中的葡萄糖、乳糖和蔗糖发酵实验均呈阳性,即菌能分解三种糖产酸但不产气,接触酶阳性。
2.3 菌株J-25系统发育树构建
将克隆得到的半纤维素降解菌株J-25的16S rDNA序列片段经过测序后,序列输入NCBI数据库中与已知的核酸序列进行Blast比对和相似性分析。结果表明,菌株J-25的16S rDNA序列与NCBI基因库中纤维单胞菌属(Cellulomonas)的16S rDNA同源性最为接近,且一致性均大于97%,表明该菌属于Cellulomonas。通过CLustal X软件的多序列比较和MEGA 6.0软件的分析得到以16S rDNA序列为基础构建的系统发育树,见图1。由系统发育树表明,在以上15个菌株中,菌株J-25与Cellulomonassp. RP-3(EU303279)菌株同源性达99%以上,因此,命名为Cellulomonassp. J-25。

图1 菌J-25与相近序列比较的系统发育进化树Fig.1 The phylogenetic tree of J-25 and related sequences
2.4 菌株J-25产酶条件优化
2.4.1 培养时间对半纤维素酶产生的影响 通过将菌株J-25培养时间优化后,测定半纤维素降解酶活,其结果和数据分析见图2。结果表明,J-25的酶活力在0~60 h逐渐增大,在60 h时达到最大为38.5 U/mL,其后酶活力随着时间的增大而呈下降趋势。所以确定最适发酵培养时间为60 h。
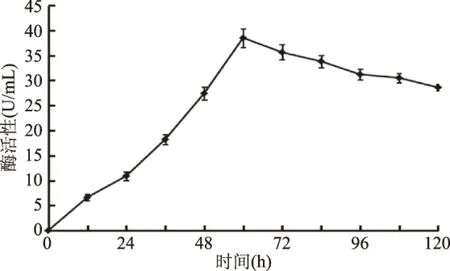
图2 培养时间对发酵产酶的影响Fig.2 Effect of culture time on enzyme production
2.4.2 碳源及浓度对半纤维素酶产生的影响 以不同碳源为横坐标,测得的酶活力为纵坐标,其结果见图3。结果表明,碳源麦麸诱导产木聚糖酶的效果最好,达到40.6 U/mL;半纤维素次之,为38.1 U/mL;而其它单糖和多糖诱导效果较差。因此,选择麦麸作为最适碳源。

图3 碳源对产酶的影响Fig.3 Effects of different carbon sources on production of enzymes
碳源则是由于原核生物必须根据环境条件的改变合成各种不同的蛋白质,使得代谢过程适应环境的变化,才能维持自己的生存和繁衍[15]。以不同浓度的麸皮为碳源发酵培养,其结果见图4。麸皮浓度在5~20 g/L时,随着浓度的增加,产酶活力逐渐增大,当浓度在20 g/L时,酶活力最高达到42.8 U/mL;在浓度高于20 g/L后,酶活力呈下降趋势,当麸皮浓度达到一定浓度后,培养液混浊度升高,溶氧度降低所致。因此,最适麸皮浓度为20 g/L。
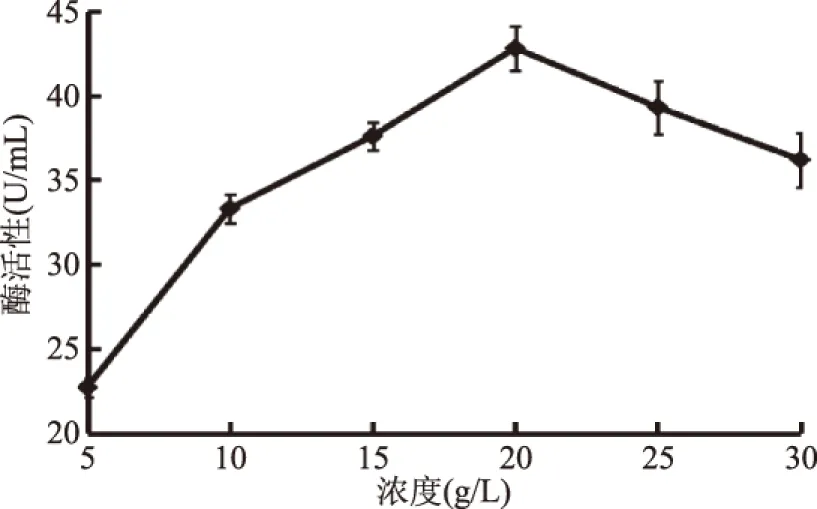
图4 麸皮浓度对产酶的影响Fig.4 Effects of bran concentration on production of enzymes
2.4.3 氮源及浓度对半纤维素酶产生的影响 以不同氮源为横坐标,氮源的质量浓度为5 g/L;碳源选择麦麸(15 g/L),对菌株J-25进行发酵培养,其结果见图5。结果表明,不同氮源对菌株J-25产酶活力有一定的影响,其中酵母粉对产酶活力影响最大,酶活力达到41.8 U/mL,硫酸铵次之,为40.2 U/mL;而硝酸铵效果最差,为28.3 U/mL。因此,选择酵母粉作为最适碳源。以不同浓度的酵母粉为氮源发酵培养,其结果见图6。酵母粉浓度在1.0~10 g/L时,随着浓度的增加,产酶活力逐渐增大,当浓度在10 g/L时,酶活力最高达到43.6 U/mL;在浓度高于10 g/L后,酶活力呈略微下降趋势,可能是当酵母粉浓度达到一定程度后,抑制了培养液的溶解氧的效率,导致产酶量降低。因此,最适酵母粉浓度为10 g/L。
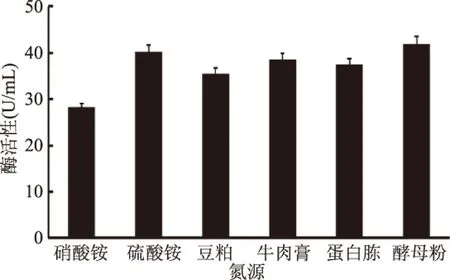
图5 氮源对产酶的影响Fig.5 Effects of different nitrogen sources on production of enzymes
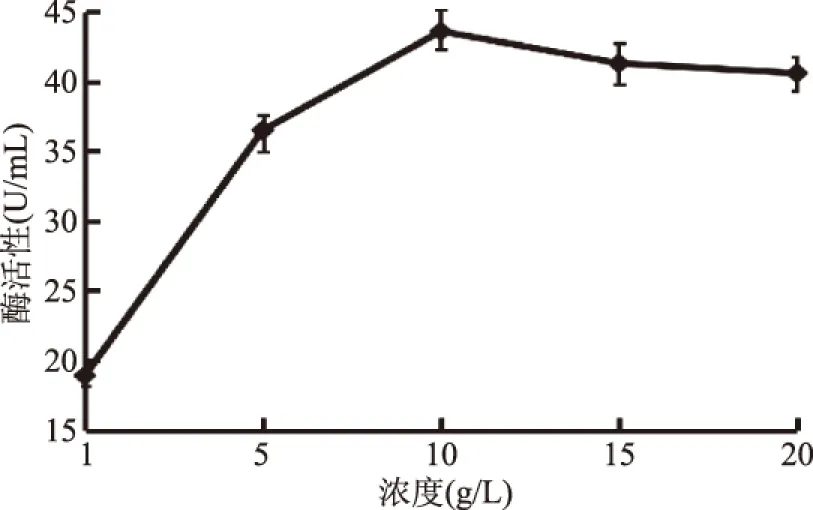
图6 酵母粉浓度对产酶的影响Fig.6 Effects of yeast powder concentration on production of enzymes
2.4.4 初始pH对半纤维素酶产生的影响 培养基初始pH变化将会使微生物细胞原生质体膜上电荷随之发生改变,从而影响微生物对培养基中营养物质的吸收及代谢产物的分泌,即影响了半纤维素酶的活性。如图7所示,当初始pH在5.0~7.0时,酶活力随着pH的升高而增大;在pH为7.0时,酶活力达到最大为45.8 U/mL;当pH高于7后,酶活力则随pH的升高而减弱,表明偏酸或偏碱的环境均不适合产酶,故最适产酶pH为7.0。
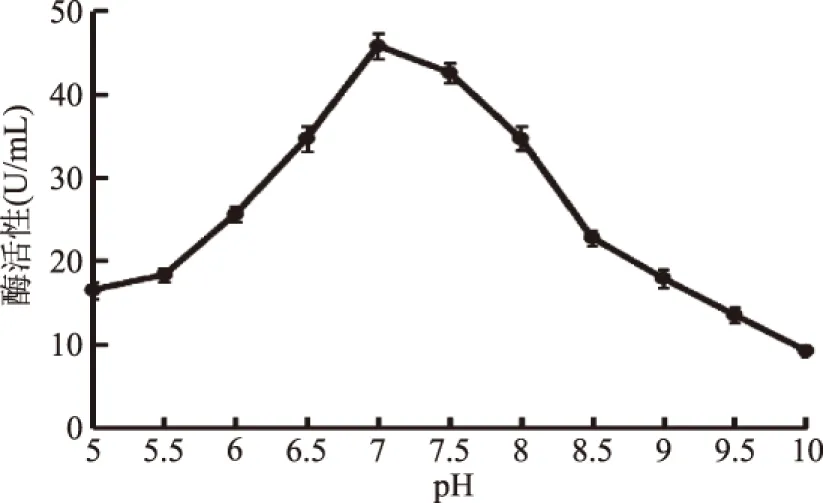
图7 初始pH对产酶的影响Fig.7 Effects of initial pH on production of enzymes
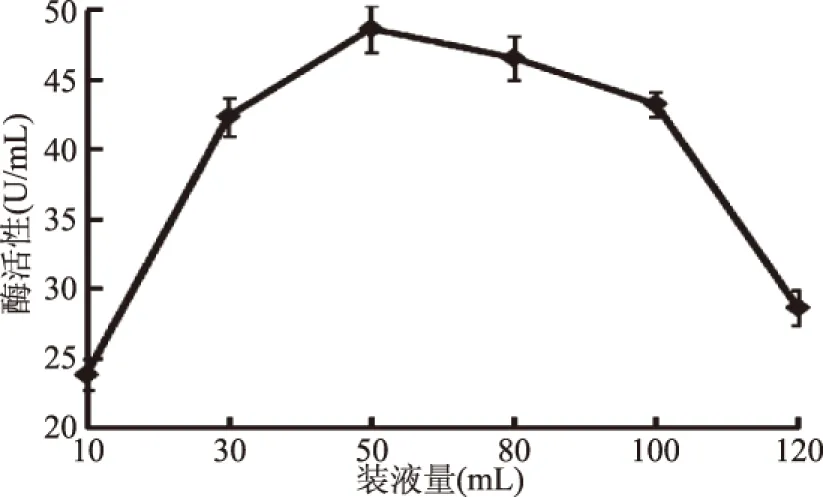
图8 装液量对产酶的影响Fig.8 Effects of loaded liquid on production of enzymes
2.4.5 培养基装液量对半纤维素酶产生的影响 当摇瓶中装液量较少时,通气好,则菌体旺盛生长,但是过少的培养基不能满足其生长产酶,因此酶活力较低;当装液量过高时,影响通气状况从而影响菌的生长,导致产酶量发生变化。结果如图8可知,当装液量为10~50 mL时,随着装液量的增多,酶的活性逐渐增高,装液量为50 mL时,产酶活力最高为48.6 U/mL;而装液量高于50 mL后,产酶活性呈下降趋势。故最装液量为50 mL。
2.4.6 发酵温度对半纤维素酶产生的影响 从酶反应动力学来看,发酵温度升高,酶反应速率增大,生长代谢速度加快,但酶本身容易因过热而失去活性,表现在菌体容易衰老,发酵周期缩短,影响最终产物。在发酵过程中,温度对菌体的生长和酶的产生的影响是不同的[16]。如图9所示,当温度在20~30 ℃时,随着发酵温度升高,产酶活性也逐渐增大;当温度达到32 ℃时,半纤维素酶活力达到最高为62.8 U/mL;温度继续升高反而使产酶活性快速减小。所以,最佳产酶温度为30 ℃。
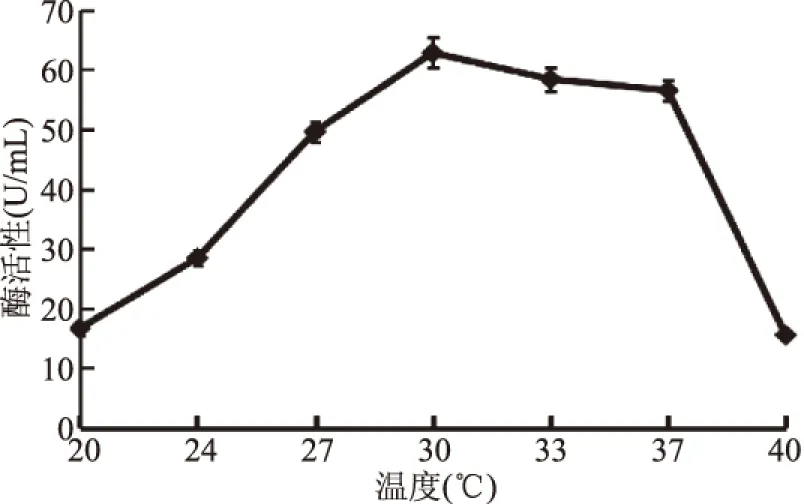
图9 发酵培养温度对产酶的影响Fig.9 Effects of fermentation temperature on production of enzymes
2.5 酶学特性研究
2.5.1 pH对酶反应的影响 pH变化会改变酶分子的空间构象,pH过大或过小将会导致酶丧失活性,进而使酶解率随之降低。酶促反应在不同pH下,酶分子与底物分子中基团的解离状态发生改变[17],从而影响酶分子的构象以及酶与底物的结合和催化效率。如图10所示,当pH在5.5~6.5时,随着pH增大酶活性增高,pH为6.5产酶活力达到最大为66.8 U/mL;之后随着pH升高,产酶活力反而下降,可能pH升高抑制了酶的活性。因此,酶促反应最适pH为6.5。
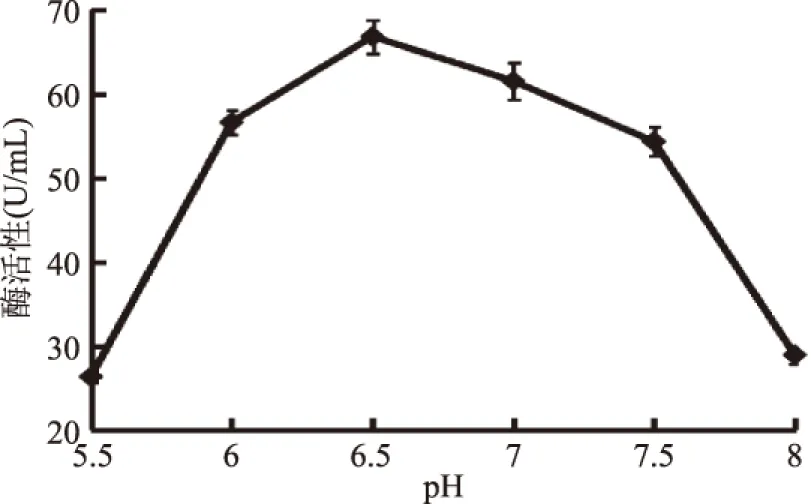
图10 pH对酶反应的影响Fig.10 Effects of pH on reaction of enzymes
2.5.2 温度对酶反应的影响 温度对酶的活性产生一定的影响,如图11所示,当温度过低时会抑制酶的活性,使得酶活力较低,随着温度升高,酶活力逐渐升高;当温度升到温度40 ℃时,酶的活性最大为63.8 U/mL。过高时,致使酶的空间结构破坏,酶活力反而下降。因此,酶促反应最适温度为40 ℃。
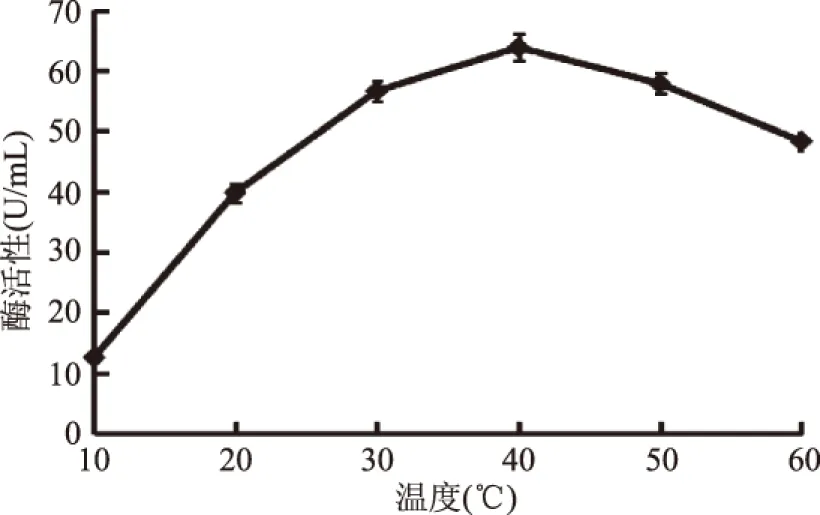
图11 发酵温度对酶反应的影响Fig.11 Effects of temperature on reaction of enzymes
2.5.3 底物浓度对酶反应的影响 如图12所示,底物浓度对酶反应的影响也很明显,酶的活性先随底物浓度的增加而增加,当到达15 g/L时达到最大为64.5 U/mL。在底物浓度较低的条件下,酶催化反应速度与底物浓度成正比,酶促反应速度将随底物浓度的增加而变快,当酶量饱和时,酶活力则不再上升,当底物浓度过高时,反而酶的活性降低,因为产物对酶促反应有了抑制作用。由此可知,最适底物浓度为15 g/L。
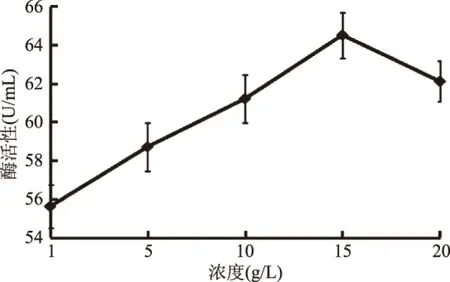
图12 底物浓度对酶反应的影响Fig.12 Effects of substrate concentration on reaction of enzymes
2.5.4 反应时间对酶反应的影响 随着酶促反应的时间延长,酶的活性增大,但反应达到一定时间后,随着时间的延长已不能有效地增加酶促反应活力。由于随着时间的延长,酶分子已充分与底物接触,结合后酶分子的有效浓度下降,且反应产物对酶促反应有一定的抑制作用,导致酶促反应变化并不明显。由图13所示,当30 min时,酶的活力最高为67.9 U/mL;而在随着反应时间的延长,酶活力变化几乎不大。因此,酶促反应最适时间为30 min。
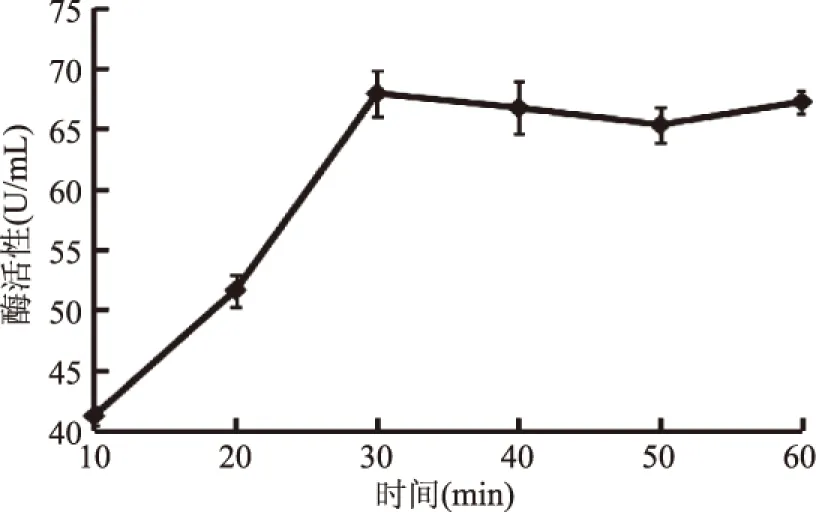
图13 时间对酶反应的影响Fig.13 Effects of time on reaction of enzymes
3 结论
筛选到一株半纤维素高效降解菌J-25,该菌株V-P反应呈阴性,甲基红实验呈阳性,吲哚实验呈弱阳性,能分解葡萄糖、乳糖和蔗糖产酸但不产气,鉴定为纤维单胞菌,命名为Cellulomonassp. J-25。半纤维素降解菌J-25的最佳产酶条件为:培养时间为60 h、温度为30 ℃、麸皮浓度为20 g/L、酵母粉浓度为10 g/L、初始pH为7.0、装液量为50 mL,在此培养条件下,酶的活性可达到62.8 U/mL。菌株J-25所产半纤维素酶的最适反应条件为:pH为6.5,温度为40 ℃,底物浓度为15 g/L,反应时间为30 min。
国内对半纤维素降解菌定量分析报道还较少,一些研究学者只做了定性分析[18-19];张宁宁等[20]以温泉水样作为研究材料,分离嗜热菌株DT-1的半纤维素酶活仅达到200 U/L;刘多涛等[21]以石油井附近的石油污染区域土样,获得菌株DT83半纤维素酶活可达70 U/mL以上;徐有权等[22]以田间富含腐烂稻秆的泥土为样本,筛选获得短小芽胞杆菌,产半纤维素酶活可达85.12 U/mL;而本实验获得的纤维单胞菌J-25,培养60 h后,其酶活性能够达到62.8 U/mL,具有较高的降解半纤维活性。由于Cellulomonassp. J-25对半纤维的降解与菌株分泌的降解酶有关,因此,其降解途径和机制还有待于进一步深入研究。本研究结果丰富了半纤维的生物降解资源库,为进一步研究半纤维的生物降解提供了实验依据。
[1]吴东儒. 糖类的生物化学[M]. 北京:高等教育出版社,1987. 362-364
[2]Wong KK,Tan LU,Saddler JN. Multiplicity of beta-1,4-xylanase in microorganisms:functions and applications.[J]. Microbiological Reviews,1988,52(3):305-17.
[3]Shallom D,Shoham Y. Microbial hemicellulases[J]. Current Opinion in Microbiology,2003,6(3):219-228.
[4]孙迅王,宜磊,邓振旭,等. 四株降解半纤维素细菌的分离和鉴定[J]. 菏泽师专学报,1997. 17-20.
[5]全桂静,赵航. 半纤维素酶高产菌株的筛选及产酶条件的研究[J]. 沈阳化工大学学报,2010,24(1):20-23.
[6]张庆芳,马菁玲,孔秀琴,等. 半纤维素酶高产菌株的筛选、鉴定及产酶条件的研究[J]. 中国沼气,2015,33(5):11-15.
[7]张宁宁,林白雪,何柳,等. 降解半纤维素嗜热菌的筛选及其酶学性质[J]. 福建农林大学学报:自然科学版,2010,39(5):28-29.
[8]王宜磊,邓振旭. 透明圈法快速筛选半纤维素分解菌[J]. 生物技术,2000,10(1):37-39.
[9]陈坚,刘和,李秀芬,等. 环境微生物实验技术[M]. 北京:化学工业出版社,2008.
[10]Kim S,Yoon J,Kim H,et al. A phylogenetic analysis of the genus Saccharomonospora conducted with 16S rRNA gene sequences[J]. International journal of Systematic Bacteriology,1995,45(2):351-356.
[11]Thompson JD,Gibson TJ,Plewniak F,et al. The Clustal X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research,1997,25(24):4876-4882.
[12]Tamura K,Stecher G,Peterson D,et al. MEGA6:Molecular Evolutionary Genetics Analysis Version 6.0[J]. Molecular Biology & Evolution,2013,30(4):2725-2729.
[13]陈惠忠,高培基,王祖农. 产木聚糖酶菌株的选育及其液体发酵条件[J]. 微生物学报,1990,30(5):351-357.
[14]汪世华,杨燕凌,胡开辉. 植酸酶液体发酵条件研究[J]. 福建农林大学学报:自然科学版,2006,35(1):82-86
[15]吴根福. 发酵工程实验指导[M]. 北京:高等教育出版社,2006:37-39
[16]余龙江. 发酵工程原理与技术应用[M]. 北京:化学工业出版社,2010:118-130.
[17]郭勇. 酶工程[M]. 第3版. 北京:科学出版社,2009:5-9.
[18]孙迅,王宜磊,邓振旭,等. 四株降解半纤维素细菌的分离和鉴定[J]. 菏泽师专学报,1997,19(2):17-20.
[19]王宜磊,孙迅,邓振旭. 五株降解半纤维素细菌的分离鉴定与酶活测定[J]. 山东师大学报:自然科学版,1997,12(4):474-476.
[20]张宁宁,林白雪,何柳,等. 降解半纤维素嗜热菌的筛选及其酶学性质[J]. 福建农林大学学报:自然科学版,2010,39(5):528-533.
[21]刘多涛,杨谦,王艳君,等. 张耐酒精半纤维素降解菌的筛选、鉴定及产酶分析[J]. 太阳能学报,2010,31(1):107-112.
[22]徐有权,顾文杰,张发宝,等. 酸性半纤维素降解细菌的筛选与鉴定[J]. 微生物学杂志,2012,32(2):36-40.
Screening,identification and enzymatic analysis of hemicellulose-degrading strain J-25
IANG Li-chun,WANG Cheng-hong,LIU Yu,LIN Shou-lu,ZHAO Li-ping,RUAN Qi-ping*
(Key Laboratory for Molecular Biology and Biopharmaceutics,Mianyang Normal University,Mianyang 621000,China)
A hemicellulose degrading bacteria was isolated with rotting wood as a source. Hydrolysis spot diameter measurement of hemicellulose plate and extracellular enzyme activity was used. The strain J-25 was identified asCellulomonasby 16S rDNA sequencing analysis,namedCellulomonassp. J-25. And characteristics of enzyme production and enzymatic properties were studied. The results indicated that fermentation conditions for enzyme production of strain J-25 was:temperature 30 ℃,the initial pH of 7.0,bran concentration of 20 g/L,yeast powder concentration of 10 g/L,liquid volume of 50 mL(250 mL flask),hemicellulose activity may reach 62.8 U/mL. The optimum enzyme reaction conditions were as follows:pH6.5,temperature of 40 ℃,substrate concentration of 15 g/mL,the reaction time of 30 min. These will provide experimental evidence for hemicellulose biodegradation.
hemicellulose;degrading-bacteria;fermentation conditions;enzymatic properties;16S rDNA
2016-09-28
姜立春(1977-),男,博士,副教授,从事应用微生物学与分子生物学方面研究,E-mail:jiang_lichun @126.com。
*通讯作者:阮期平(1961-),男,博士,教授,从事微生物学与生化药学方面研究,E-mail: qpruan20141230@163.com。
四川省科技厅项目(2016JY0038);四川省大学生创新创业训练项目(201510639010,201510639066)。
TS201.3
A
1002-0306(2017)05-0145-06
10.13386/j.issn1002-0306.2017.05.019
