马齿苋不同器官多糖提取物的抗氧化性研究
2017-06-01张晓艳
张晓艳,王 波,黄 攀,严 帆
(安徽师范大学 环境科学与工程学院,安徽芜湖 241002)
马齿苋不同器官多糖提取物的抗氧化性研究
张晓艳,王 波*,黄 攀,严 帆
(安徽师范大学 环境科学与工程学院,安徽芜湖 241002)
利用超声法提取马齿苋根、茎、叶和花中的多糖,研究马齿苋不同器官多糖含量及其抗氧化性。结果表明:马齿苋茎的多糖得率最高,达到7.65%;叶的多糖提取物浓度分别为9 mg/mL和10 mg/mL时对羟基自由基和超氧阴离子自由基的清除能力最强,清除率分别达到91.42%和78.02%;根的多糖提取物浓度为10 mg/mL时,对DPPH自由基清除能力最强,清除率达到99.41%;多糖提取物还原能力较强的部位是根,在多糖浓度为5 mg/mL时还原能力达到最大值0.80。在不同的自由基体系中,马齿苋不同部位多糖提取物对三种自由基具有较好的清除效果及较强的还原能力,且其抗氧化效果与多糖提取物的质量浓度呈明显的量效关系。
马齿苋,不同器官,多糖,自由基,抗氧化性
马齿苋(PortulaceoleraceaL.)是一年生肉质草本植物,原产于温带及热带地区,在我国除高寒地区外,南北方均有分布[1-3]。马齿苋含有多糖、黄酮、多酚、生物碱等生物活性物质,能清除体内的自由基,对人体有延年益寿的功效,故又称为“长寿菜”和“长命菜”[4-5]。
多糖是由单糖通过糖苷键连接而成的多聚物,广泛存在于植物、动物、细菌、真菌和海藻中,是一类重要的活性物质[6-7]。20世纪40年代,人类发现真菌多糖具有抗癌作用,之后研究表明多糖还具有免疫调节、抗炎症、抗病毒、抗疲劳、抗感染、抗辐射、抗衰老、降血脂、降血糖等多种生物功能,并具有毒副作用低和不易造成残留等优点,有“生物反应调节剂”之称[8-10]。因此,对于多糖的研究成为当前的热门研究领域,研究重点逐渐从药品向食品、从治疗向保健方向发展[8]。
目前,对于马齿苋多糖的研究主要集中在其医疗保健功能[11-14]、提取工艺[15-17]和抗氧化性[18-21]等方面。但以往的研究多是针对整株植株进行,较少有研究马齿苋植株不同器官多糖的含量及抗氧化性。研究表明马齿苋的茎和根的抗自由基作用强于叶[22]。为了探明马齿苋不同器官多糖的含量及其抗氧化性,本研究通过对马齿苋根、茎、叶和花中多糖物质的提取,采用对羟基自由基清除能力、超氧阴离子自由基清除能力、还原力和DPPH(1,1-二苯基-2-三硝基苯肼)自由基清除能力四种方法测定其抗氧化性大小,以期为马齿苋的食用及生产上利用其抗氧化性物质提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
马齿苋 2015年10月采于安徽省安庆市潜山县。新鲜的马齿苋样品先用自来水冲洗,然后用蒸馏水冲洗干净,最后用滤纸迅速吸干表面附着水分,对马齿苋进行根、茎、叶和花的分离,把分离后的马齿苋样品置于烘箱中,于90 ℃条件下杀青30 min,60 ℃条件下烘干。烘干后的马齿苋样品用粉碎机粉碎,存于自封袋中编号备用;葡糖糖标准品、苯酚、三羟基氨基甲烷、邻苯三酚、DPPH等试剂均为分析纯试剂。
紫外可见分光光度计 上海佑科仪器仪表有限公司;旋转蒸发仪RE-52AA 上海亚荣生化仪器厂;KH3200E型超声波清洗器 昆山禾创超声仪器有限公司;索氏提取器 上海欧蒙实业有限公司;DHG-9053A型电热恒温鼓风干燥箱 上海市三发科学仪器有限公司;HH-S恒温水浴锅 国胜实验仪器厂;SHZ-D(Ш)循环水式真空泵 上海凌科实业发展有限公司。
1.2 实验方法
1.2.1 马齿苋多糖的提取 称取5.0000 g已过40目筛的马齿苋样品,石油醚回流脱脂6 h,抽滤样品至干燥,转移干燥的样品于烧杯中,加入200 mL的蒸馏水(料液比1∶40 g∶mL),在70 ℃条件下,超声提取40 min,过滤提取液,于55 ℃条件下旋转蒸发浓缩,无水乙醇过夜醇析,抽滤,沉淀依次用无水乙醇、乙醚、丙酮进行洗涤,干燥沉淀,即可得到马齿苋多糖[23]。
1.2.2 马齿苋多糖含量的测定 标准曲线:准确称取于105 ℃条件下干燥至恒重的葡萄糖标准品20 mg,加蒸馏水溶解,转移至500 mL容量瓶中并稀释至刻度,得到浓度为40 μg/mL的葡萄糖标准溶液。准确吸取标准溶液0、0.2、0.4、0.6、0.8、1.0 mL,以蒸馏水补至1.0 mL,再加入5%的苯酚0.6 mL及98%的浓硫酸3.6 mL,摇匀,沸水浴加热30 min,冷却至室温。于波长490 nm处测定吸光度,以多糖含量(C)与吸光度(A)进行直线回归,得标准曲线回归方程[24]。
马齿苋多糖提取物含量的测定:准确称取马齿苋多糖10 mg于100 mL容量瓶中,移取1 mL滤液,同上操作加苯酚和浓硫酸进行显色反应,于490 nm 处测定吸光度。根据测得的吸光度和标准曲线回归方程计算马齿苋多糖的含量。
1.2.3 马齿苋多糖的抗氧化性 在反应体系中加入10 mmol/L FeSO4和10 mmol/L的水杨酸-乙醇溶液各1 mL,然后分别加入1 mL不同浓度的马齿苋多糖提取液(提取物浓度分别为:1、2、3、4、5、6、7、8、9、10 mg/mL),最后加入1 mL 8.8 mmol/L H2O2启动反应,37 ℃条件下保温0.5 h,以蒸馏水为参比液,在510 nm测定吸光度[25]。空白对照液中加入1 mL蒸馏水替换样品液,水解液中加入1 mL蒸馏水替换H2O2。根据公式计算清除率:
式中:Ao-空白对照液的吸光度;Ax-加入样品溶液后的吸光度;Axo-水解液的本底吸光度。
超氧阴离子清除能力的测定:采用邻苯三酚自氧化法。取不同浓度的马齿苋多糖提取液1mL(提取物浓度同上),加入pH8.2 50mmol/LTris-HCl缓冲液4.5mL,蒸馏水3.2mL,混均,27 ℃保温10min,取出后立即加入25 ℃预热过的用10mmol/LHCl溶液配制的3mmol/L邻苯三酚溶液0.3mL,以蒸馏水为参比液,在320nm下每隔30s测定吸光度,计算线性范围内每分钟吸光度的增加值[25-26]。空白对照液中加入1mL蒸馏水替换样品液。根据公式计算清除率:
式中:ΔAe-空白对照组每分钟吸光度的增加值;ΔAs-样品组每分钟吸光度的增加值。
DPPH自由基清除能力的测定:精确称取DPPH 19.7 mg,以95%乙醇定容至250 mL,制成浓度为0.2 mmol/L的DPPH溶液。取2 mL已配制的DPPH溶液,分别加入1 mL不同浓度的马齿苋多糖提取液(提取物浓度同上),以95%乙醇补足到4 mL,混匀,放置30 min后,以蒸馏水为参比液,在波长517 nm处测定吸光度[25]。空白对照液中加入1 mL 95%乙醇替换样品液,水解液中加入2 mL 95%乙醇替换DPPH溶液。根据公式计算清除率:
式中:Ac-空白对照液的吸光度;Ai-加入样品溶液后的吸光度;Aio-水解液的本底吸光度还原力的测定:取不同浓度的马齿苋多糖提取液1mL置于试管中(提取物浓度分别为:0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0mg/mL),依次加入2.5mL0.2mol/L磷酸缓冲液(pH6.6)和2.5mL质量分数为1%的K3Fe(CN)6混匀,于55 ℃恒温水浴20min后,迅速冷却,加入2.5mL质量分数为10%的三氯乙酸混合后,以3000r/min离心10min,取上清液2.5mL,依次加入2mL蒸馏水和0.5mL质量分数为1%的FeCl3溶液,充分混合,静置10min后,以蒸馏水为参比液,于波长700nm处测定吸光度,吸光度越大,表示还原能力越强[26-27]。空白对照液中加入1mL蒸馏水替换样品液。根据公式计算还原力:
还原力=样品吸光度-空白对照组吸光度
1.2.4 马齿苋多糖得率 为提取出的多糖质量占马齿苋原料质量的百分比。
1.2.5 统计分析 实验设3次重复,采用SPSS17.0forWindows软件进行数据分析,采用origin86软件作图。
2 结果与分析
2.1 马齿苋各器官鲜重百分比及含水率
新鲜马齿苋样品采样清洗后,逐一分离马齿苋全株的根、茎、叶、花并称重以计算获得马齿苋根、茎、叶、花占全株的鲜重百分比;采用直接干燥法测定马齿苋根、茎、叶、花的含水率。由表1可知,马齿苋根、茎、叶和花占全株的鲜重百分比及含水率明显不同。马齿苋叶、茎、花和根的含水率依次减少,叶和茎的含水率相当,分别为91.50%和91.30%,前人研究也表明马齿苋茎和叶含水率大约90%或者更高[28-30]。马齿苋茎、叶、花、根占全株的鲜重百分比依次减小,其中根的质量极少,仅占全株总重量的5.20%。这表明马齿苋主要由含水率相对较高的茎和叶组成,根和花含水率虽相对较低,但是其占全株的鲜重百分比明显低于马齿苋茎和叶。

表1 马齿苋根、茎、叶、花占全株的鲜重百分比及含水率
注:经邓肯氏多重极差测验,同列不同英文字母表示处理间在0.05水平上差异显著。
2.2 马齿苋不同器官多糖含量
由表2可知,马齿苋不同器官多糖提取物质量大小表现为:茎>花>叶>根;马齿苋茎的多糖得率最大、根的最小,分别为7.65%和5.39%。马齿苋茎的多糖含量最大,达到34.87%;根多糖含量最少,仅为22.30 %;叶和花的多糖含量相当,分别为24.82%和24.00%。结合表1马齿苋不同器官占全株鲜重的百分比及其含水率综合分析可知,马齿苋全株中的多糖含量主要来源于茎,其次是叶和花、根最少。

表2 马齿苋不同器官的多糖提取物的含量
2.3 马齿苋抗氧化性
2.3.1 不同器官多糖提取物对羟基自由基清除能力的差异 由图1可知,在实验的质量浓度范围内,马齿苋根、茎、叶和花的多糖提取物对羟基自由基的清除率总体上呈现出先增大后减小的趋势,在多糖提取物的质量浓度为9 mg/mL时,根、茎、叶和花的多糖提取物对羟基自由基的清除率达到最大值,分别为80.51%、82.20%、91.42%和85.03%,表现出较强的清除能力。由多糖质量浓度和清除率的量效关系测算得出,马齿苋根、茎、叶和花多糖提取物对羟基自由基的IC50分别为4.00、5.02、2.78、3.77 mg/mL,由此得出马齿苋不同器官的多糖提取物对羟基自由基的清除率表现为:叶>花>根>茎。综上分析得出马齿苋叶的多糖提取物对羟基自由基的清除能力最强。

图1 马齿苋不同器官多糖提取物对羟基自由基的清除率Fig.1 Clearance rates of hydroxyl free radical by polysaccharide extracts of different organsof Portulace oleracea L.
2.3.2 不同器官多糖提取物对超氧阴离子清除能力的差异 由图2可知,在实验的质量浓度范围内,马齿苋根、茎、叶和花的多糖提取物对超氧阴离子的清除率总体上随多糖提取物质量浓度的增加呈上升的趋势,在多糖质量浓度为10 mg/mL时,多糖提取物对超氧阴离子的清除率达到了最大值,分别为30.91%、62.23%、78.02%和44.06%。由多糖质量浓度和清除率的量效关系测算得出,马齿苋根、茎、叶和花多糖提取物对超氧阴离子的IC50分别为18.77、7.18、3.92和11.16 mg/mL,由此得出马齿苋不同器官的多糖提取物对超氧阴离子的清除率表现为:叶>茎>花>根。综上分析得出马齿苋叶的多糖提取物对超氧阴离子自由基的清除能力最强。
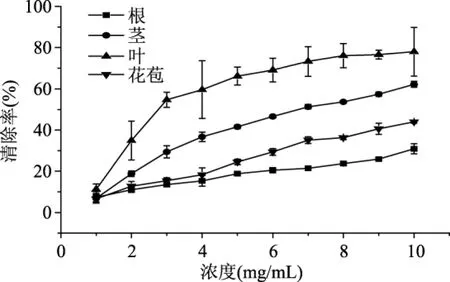
图2 马齿苋不同器官多糖提取物 对超氧阴离子自由基的清除率Fig.2 Clearance rates of superoxide negative ion free radical by polysaccharide extracts of different organsof Portulace oleracea L.
2.3.3 不同器官多糖提取物对DPPH自由基清除能力的差异 由图3可知,在实验的质量浓度范围内,马齿苋根、茎、叶和花的多糖提取物对DPPH自由基的清除率总体上随多糖提取物质量浓度增加而增大,在多糖质量浓度为10 mg/mL(叶为9 mg/mL)时,多糖提取物对DPPH自由基的清除率达到了最大值,分别为99.41%、65.53%、93.64%和65.05%。由多糖质量浓度和清除率的量效关系测算得出,马齿苋根、茎、叶和花多糖提取物对DPPH自由基的IC50分别为4.47、7.19、4.21、7.34 mg/mL,由此得出马齿苋不同器官的多糖提取物对DPPH自由基的清除率表现为:叶>根>茎>花。综上分析得出马齿苋叶和根的多糖提取物对DPPH自由基的清除能力较强。

图3 马齿苋不同器官多糖提取物对DPPH自由基的清除率Fig.3 Clearance rate of DPPH free radical activities of polysaccharide extracts of different organsof Portulace oleracea L.
2.3.4 不同器官多糖提取物还原力的差异 由图4可知,在实验的质量浓度范围内,马齿苋根、茎、叶和花的多糖提取物的还原能力总体上随多糖提取物的质量浓度的增加而增大,还原能力表现为:根>茎>叶>花,其中根的多糖提取物的还原能力显著大于其他三个部位。在多糖提取物质量浓度为5 mg/mL时,马齿苋根、茎、叶和花的多糖提取物的还原能力达到最大值,分别为0.80、0.48、0.37和0.18。综上分析得出马齿苋根的多糖提取物的还原能力较强。

图4 马齿苋不同器官多糖提取物的还原能力Fig.4 Reducing ability of polysaccharide extracts of different organsof Portulace oleracea L.
3 结论
马齿苋不同器官多糖提取物对羟基自由基、超氧阴离子自由基和DPPH自由基均具有一定的清除能力,也具有还原能力。
马齿苋不同器官多糖提取物对羟基自由基的清除能力表现为:叶>花>茎>根。结合马齿苋各部位占全株鲜重百分比及含水率综合分析可知,马齿苋鲜样全株中多糖提取物对羟基自由基的清除能力主要来源于茎和叶。
马齿苋不同器官多糖提取物对超氧阴离子自由基的清除能力表现为:叶>茎>花>根。结合马齿苋各部位占全株鲜重百分比及含水率综合分析可知,马齿苋鲜样全株中多糖提取物对超氧阴离子自由基的清除能力主要来源于叶和茎。
马齿苋不同器官多糖提取物对DPPH自由基的清除能力表现为:叶>根>茎>花。结合马齿苋全株各部位占全株鲜重百分比及含水率综合分析可知,马齿苋鲜样全株中多糖提取物对DPPH自由基的清除能力主要来源于叶。
马齿苋不同器官多糖提取物的还原能力表现为:根>茎>叶>花。结合马齿苋各部位占全株鲜重百分比及含水率综合分析可知,马齿苋鲜样全株中多糖提取物的还原能力主要来源于茎。
[1]夏道宗,陈佳,邹庄丹. 马齿苋、车前草复合保健饮料的研制及其抗氧化作用研究[J]. 食品科学,2009,30(4):118-122.
[2]周浩. 马齿苋营养成分及硝酸盐含量的测定[J]. 安徽农业科学,2009,37(32):15665-15666+15668.
[3]Yan J,Sun L R,Zhou Z Y,et al. Homoisoflavonoids from the medicinal plant Portulaca oleracea[J]. Phytochemistry,2012,80:37-41.
[4]Sadeghi G,Karimi A,Shafeie F,et al. The Effects of purslane(PortulacaoleraceaL.)powder on growth performance,carcass characteristics,antioxidant status,and blood metabolites in broiler chickens[J]. Livestock Science,2016,184:35-40.
[5]梁彦,张传军,吕艳荣. 马齿苋多糖对高脂饮食联合链脲佐菌素诱导的糖尿病小鼠的作用及机制[J]. 食品科学,2014,35(3):217-220.
[6]申利红,王建森,李雅,等.植物多糖的研究及应用进展[J].中国农学通报,2011,27(2):349-352.
[7]安晓娟,冯琳,宋红平,等.植物多糖的结构分析及药理活性研究进展[J].中国药学杂志,2012,47(16):1271-1275.
[8]罗祖友,胡筱波,吴谋成.植物多糖的降血糖与降血脂作用[J].食品科学,2007,28(10):596-600.
[9]常改,杨溢,霍飞,等.植物多糖的研究进展及保健功能[J].中国公共卫生,2003,19(11):1394-1395.
[10]谢燕霞,安利国,杨桂文.植物多糖对巨噬细胞的免疫调节作用[J].中国生物化学与分子生物学报,2008,24(4):307-314.
[11]Chen Y G,Shen Z J,Chen X P.Evaluation of free radicals scavenging and immunity-modulatory activities of Purslane polysaccharides[J].International Journal of Biological Macromolecules,2009,45(5):448-452.
[12]Gilabert C E,Hernandez M V R,Parra M á,et al. Characterization of purslane(PortulacaoleraceaL.)accessions:Suitability as ready-to-eat product[J]. Scientia Horticulturae,2014,172:73-81.
[13]Shen H,Tang G,Zeng G,et al. Purification andcharacterization of an antitumor polysaccharide from Portulaca oeracea L.[J]. Carbohydrate Polymers,2013,93(2):395-400.
[14]丁怀伟,姚佳琪,宋少江. 马齿苋的化学成分和药理活性研究进展[J]. 沈阳药科大学学报,2008,25(10):831-837.
[15]姚秋萍,王鹏. 马齿苋不同溶剂提取物清除自由基作用的研究[J]. 食品工业,2014,35(6):76-78.
[16]秦爱丽,沈君琪,陈凌,等. 微波辅助浸提马齿苋活性成分的工艺[J]. 食品研究与开发,2014,35(12):20-23.
[17]米热班古·木太力甫,敬思群.马齿苋多糖提取工艺优选及活性初筛[J].食品与发酵工业,2013,39(5):246-250.
[18]Alam M A,Juraimi A S,Rafii M Y,et al. Effects of salinity and salinity-induced augmented bioactive compounds in purslane(PortulacaoleraceaL.)for possible economical use[J]. Food Chemistry,2015,169:439-447.
[19]崔旻,尹苗,安利国.马齿苋多糖的抗肿瘤活性[J].山东师大学报(自然科学版),2002,17(1):73-76.
[20]汪荔,王征,张娇,等.传统工艺与膜分离技术联合对马齿苋多糖的提取分离与抗氧化活性研究[J].中草药,2016,47(10):1676-1680.
[21]陈凌,陈召桂,骆卢佳,等.不同方法提取马齿苋多糖的抗氧活性比较[J].食品研究与开发,2015,36(22):14-18.
[22]余庆皋,王晓春,熊志青. 马齿苋的不同部位在体内外抗氧自由基作用的比较研究[J]. 实用预防医学,2007,14(2):346-348.
[23]纪丽丽. 超声波辅助提取马齿苋多糖的工艺研究[J]. 黑龙江科学,2014,5(1):22-23.
[24]徐鹤,张海悦. 超高压方法提取马齿苋多糖的工艺研究[J]. 食品科技,2011,36(2):148-153.
[25]王仁雷,周峰,周泉澄,等. 盐碱地马齿苋不同提取液的抗氧化活性研究[J]. 食品工业科技,2013,34(7):49-51,55.
[26]玄红专,桑青,麻建军. 邻苯三酚自氧化法测定不同蜂产品抗氧化活性的研究[J]. 食品科技,2008,(4):137-139.
[27]Lin Y Y,Quah E P L. Antioxidant properties of different cultivars of Portulaca oleracea[J]. Food Chemistry,2007,103(3):734-740.
[28]Oliveira I,Valentao P,Lopes R,et al. Phytochemical characterization and radical scavenging activity of Portulaca oleraceae L. leaves and stems[J]. Microchemical Journal,2009,92(2):129-134.
[29]Alam M A,Juraimi A S,Rafii M Y,et al. Salinity-induced changes in the morphology and major mineral nutrient composition of purslane(PortulacaoleraceaL.)accessions[J]. Biological Research,2016,49:accepted.
[30]Erkan N. Antioxidant activity and phenolic compounds of fractions from Portulaca oleracea L.[J]. Food Chemistry,2012,133(3):775-781.
Study on the antioxidant activities of polysaccharide extracts from different organs ofPortulaceoleraceaL.
ZHANG Xiao-yan,WANG Bo*,HUANG Pan,YAN Fan
(College of Environmental Science and Engineering,Anhui Normal University,Wuhu 241002,China)
The study researched the polysaccharides content and antioxidant activities ofPortulaceoleraceaL. by using ultrasonic extraction method to extract the polysaccharides of the root,stem,leaf and bud. Results presented that the polysaccharides extraction rate in stem was the highest,which reached to 7.65%. The scavenging rates of hydroxyl radical and superoxide anion were 91.42%and 78.02%,when the extract concentration of leaf reached to 9 mg/mL and 10 mg/mL,respectively. When the concentration of polysaccharide extracts in root was 10 mg/mL,it had the highest scavenging capability to DPPH free radical,which could reach to 99.41%.The polysaccharide extracts in root area had high reducibility.When the concentration was 5 mg/mL,the maximum reducibility could reach to 0.80. In the different radical systems,the scavenging capacity to the hydroxyl radical,superoxide anion,DPPH free radicaland reducing ability of polysaccharide extracts from different organs ofPortulaceoleraceaL. were extraordinary,meanwhile,the antioxidant capacity of polysaccharide extracts had a dose-effect relationship with the mass concentration.
PortulaceoleraceaL.;different organs;polysaccharide;free radicals;antioxidant activity
2016-09-09
张晓艳(1991-),女,在读硕士研究生,研究方向:环境与食品安全,E-mail:1078462035@qq.com。
*通讯作者:王波(1974-),女,博士,副教授,研究方向:环境生物学、环境与食品安全,E-mail:wangbohky@163.com。
安徽省高校自然科学研究重点项目(KJ2010A150)。
TS255.1
A
1002-0306(2017)05-0130-05
10.13386/j.issn1002-0306.2017.05.016
