欧姆加热过程对猪肉氧化和体外消化率动态变化的研究
2017-06-01喻倩倩李兴民戴瑞彤
戴 妍,卢 忆,喻倩倩,刘 毅,李兴民,戴瑞彤
(北京海淀区清华东路17号中国农业大学食品科学与营养工程学院,北京 100083)
欧姆加热过程对猪肉氧化和体外消化率动态变化的研究
戴 妍,卢 忆+,喻倩倩,刘 毅,李兴民,戴瑞彤*
(北京海淀区清华东路17号中国农业大学食品科学与营养工程学院,北京 100083)
本文研究了欧姆加热与水浴加热肉块到一定的终点温度(20~100 ℃)时,脂肪和蛋白质氧化、蛋白质表面疏水活性和聚合度、胃蛋白酶、胰蛋白酶和α-凝乳蛋白酶体外消化率的动态变化。结果显示:随着肉块终点温度的升高,蛋白质羰基呈现先下降后上升的趋势,而胰、α-凝乳蛋白酶体外消化率呈现一定的下降趋势。当肉块温度为40 ℃时,欧姆加热组的蛋白质表面疏水活性显著低于(p<0.05)水浴加热处理组。当肉块温度为20 ℃时,欧姆加热组的胰、α-凝乳蛋白酶消化率显著高于水溶加热处理组(p<0.05)。当肉块温度为60 ℃时,欧姆加热组的羰基值和胃蛋白酶体外消化率显著低于(p<0.05)水浴加热处理组,而胰、α-凝乳蛋白酶体外消化率显著高于(p<0.05)水浴加热处理组。当肉块温度为80 ℃时,欧姆加热组的硫代巴比妥酸值显著低于(p<0.05)水浴加热处理组。其余各指标各处理组无显著差异(p>0.05)。蛋白质聚合度、蛋白质疏水活度与胃蛋白酶体外消化率呈现显著负相关关系(p<0.05),因此欧姆加热肉品节约了总加热时间的1/2~5/6,氧化、体外消化率各指标与水浴加热处理组整体上无明显区别。
欧姆加热,水浴加热,体外消化率,肉块,氧化,相关性
肉中蛋白质是为人体提供必需氨基酸的主要营养来源,蛋白质体外消化率对于间接评估肉的营养价值具有非常重要的意义[1-2]。加热可以保证肉品的安全特性和适口性,但它会显著影响肉品的营养价值[3],因为加热过程可能会促使肉中蛋白质降解和氧化,从而影响蛋白质的结构特性和氨基酸的生物利用率[3]。虽然美国USDA建议肉的终点温度要达到71.1 ℃才能保证肉品的安全特性,但是消费者仍然会以嫩度、风味强度、颜色与多汁性来评价肉质的可接受性[4-5]。氧化和热降解的协同作用可以减少蛋白质游离巯基含量,增加羰基、蛋白质聚合物以及表面疏水基团的数量,引起蛋白质体外消化率的下降,最终影响肉品营养和加工特性。同时肉中游离氨基酸还会与脂肪氧化产生的醛类或还原性糖发生反应形成Schiff碱,同样会诱发蛋白质交联、聚合以及营养价值的变化[1,4]。
欧姆加热是一种新型加热技术,它主要通过在食物两端介入电极,通过使食物自身导电而达到加热的目的,欧姆加热的食品比传统加热模式的食品有很多优点,比如用它加热食物的时间更短,产品外观更为均一,产品有更高的蒸煮得率和更好的食用品质等[6-9],欧姆加热技术已经逐渐应用到肉糜、牛肉和水果等食品的加热[1,7,9-10]。目前国内外有关欧姆加热对肉品氧化和营养品质变化的相关研究仍然是空白,因此本次实验比较了欧姆加热与水浴加热肉块到相同终点温度(20~100 ℃)时的脂肪氧化、蛋白质氧化、蛋白质的聚合度,蛋白质的表面疏水性以及体外消化率的差异性,找出这些指标的相关性,为进一步探明欧姆加热肉品氧化及体外消化的机理提供参考。
1 材料与方法
1.1 材料与仪器
猪背最长肌 购自北京市顺义鹏程食品有限公司;三氯乙酸(分析纯)、硫代巴比妥酸(分析纯)、盐酸(分析纯)、EDTANa2(分析纯)、DNPH(分析纯)、乙醇(分析纯)、乙酸乙酯(分析纯)、盐酸胍(分析纯)、β-巯基乙醇(分析纯)、溴酚蓝(分析纯)、尼罗红(分析纯)、甘氨酸(分析纯) 均购于北京索莱宝公司。
自制欧姆加热设备(主要由交流电源、支架箱及加热单元3部分共同组成)[9];电流传感器、DHC8P电压表、DPH8P电流表 温州大华仪器仪表有限公司;热电偶温度计 北京工业温度传感器有限公司制;TS22型绞肉机;BS210S百分之一天平 上海天平仪器厂;DK-8B电热恒温水槽 上海精密实验设备有限公司;FA-25超细匀浆器 上海FLUKO流体机械制造有限公司;GL-20G冷冻离心机 上海安亭科学仪器厂;Evolution60紫外可见分光光度计 美国热电公司;Hitachi F-2500荧光分光光度计 日本Hitachi公司。
1.2 实验方法
1.2.1 猪肉处理 4头6月龄、110 kg重的长白杂交猪宰杀后,胴体经24 h冷却后,分割出8块背最长肌,贮藏于-25 ℃冰箱中,用时置于4 ℃环境下解冻10 h。解冻后肉块的终点温度大约为4 ℃±2 ℃。取猪背最长肌(约300 g),分别进行水浴和欧姆加热处理,对照组(不经过任何处理),每种处理做4个重复。
1.2.2 加热处理方式 欧姆加热:交流电源(50 Hz,3.5 kW);将肉块夹在2个电极之间,采用电压梯度(9 V/cm)进行加热,使肉块的中心温度达到20、40、60、80、100 ℃[8],然后关闭电源,将肉块取出,进行指标分析。水浴加热:将肉块(直径4.2 cm;长度10 cm)用细线捆好,放在水浴槽中,再把水浴槽放到水浴锅中,水浴锅温度设为100 ℃,同样使肉块的中心温度加热到20、40、60、80、100 ℃,然后关闭电源,取出肉块分析指标。
1.2.3 硫代巴比妥酸值(Thiobarbituric acid,TBARS) 测定欧姆和水浴加热的肉块TBARS含量的测试方法根据文献方法[11-12]进行测试。提取碎肉(1.50 g),加入10 mL去离子水,然后取1 mL样品液,加入2 mL缓冲液(15%三氯乙酸,0.375%硫代巴比妥酸,0.25 mol/L盐酸),再加入3 mL 2% BHT溶液,将样液振荡,然后用100 ℃水浴加热15 min发色,冷却后将样品离心(转速为3000×g,离心10 min),溶液的吸光度用紫外可见分光光度仪测定(532 nm),TBARS值可以表示为mg MDA/kg(吸光系数折算为1.56×105mol/L cm-1)。
1.2.4 肌原纤维蛋白质的提取 肌原纤维蛋白质提取采用溶解离心法[7,13],2.50 g切碎的肉样加入到pH6.5的20 mL肌纤维提取缓冲液(150 mmol/L 氯化钠、25 mmol/L氯化钾、3 mmol/L氯化镁,4 mmol/L EDTANa2和1 mmol/L PMSF)中进行匀浆(10000×g,10 s)。然后将样液置于4 ℃离心(5000×g,30 min),将含有肌原纤维蛋白沉淀物的样液用缓冲液(50 mmol/L氯化钾,5 mmol/Lβ-巯基乙醇)冲洗3遍,再用此溶液提取沉淀、匀浆,最终得到的悬浊液为样品液肌原纤维蛋白的提取液。此悬浊液的浓度用双缩脲法(biuret method)测定[14]。
1.2.5 蛋白氧化测定 蛋白羰基(carbonyl)和游离巯基(free thiol)含量的测定是蛋白质氧化最为重要的指标,总蛋白羰基含量测定采用分光光度计法[15]略有改动。准备2份500 μL肌原纤维蛋白溶液,1份加入2 mL 2 mol/L盐酸溶液作为对照组,另1份加入2 mL 10 mmol/L DNPH溶液,室温下放置1 h后,往两份肌原纤维蛋白溶液中加入2 mL 20% 三氯乙酸溶液。然后将样液用1 mL缓冲液(1∶1的乙醇/乙酸乙酯)冲洗,最后将沉淀物溶于2 mL pH6.5的缓冲液(6 mol/L 盐酸胍,20 mmol/L磷酸钾)中,样品液的吸光度用紫外可见分光光度仪比色(370 nm)测定,羰基含量表示为μmol DNPH/mg。蛋白腙的吸光系数为2.2×104mol/L-1cm-1。
1.2.6 蛋白质表面疏水性测定 蛋白质表面疏水性(protein surface hydrophobicity)的测定采用溴酚蓝法[16],略有改动。肌纤维蛋白液用磷酸盐缓冲溶液(20 mmol/L PBS,pH6)稀释至浓度为2 mg/mL。取肌纤维蛋白液(1 mL)加入40 μL溴酚兰(BPB)溶液(1 mg/mL)。将样液置于室温充分混合振荡10 min,然后离心(9000×g,8 min),最后将样液置于比色皿中采用紫外可见分光光度仪比色(595 nm)测定。蛋白质表面疏水性含量计算公式为:溴酚蓝BPB含量(μg)=40 μg×(对照组吸光值-样品组吸光值)/对照组吸光值。
1.2.7 蛋白质聚合度测定 蛋白质聚合度(protein aggregation)用尼罗红荧光比色法测定[17]。肌纤维蛋白液用磷酸盐缓冲液(20 mmol/L PBS,pH6)稀释至浓度为1mg/mL。取2 mL样品液加入40 μL 0.32 mg/mL尼罗红荧光染色液。当样品混合均匀后,直接用荧光分光光度计测定。荧光分光光度计参数设定为:激发波长λex(560 nm),发射波长λem(620 nm)和狭缝宽度(10 nm)。样品的荧光强度表示为(arbitrary units,au)。

表1 欧姆加热与水浴加热猪肉到不同终点温度(20~100 ℃)时脂肪和蛋白质氧化分析
注:同行均值有不同上标字母者(a~e)表示在0.05水平差异显著;同列均值有不同上标字母者(x、y)表示在0.05水平差异显著;OH:欧姆加热;WB:水浴加热;NT:对照组,表2、表3同。1.2.8 蛋白质体外消化率测定 蛋白质体外消化率(protein digestioninvitro)采用酶解法[18],略有改动。肌原纤维蛋白液用33 mmol/L甘氨酸缓冲液(pH1.8)稀释至0.8 mg/mL。然后蛋白液先用胃蛋白酶(gastric pepsin,5 U/mg)进行酶解,37 ℃消化0、10、20、30、40,60 min后用15%三氯乙酸溶液终止酶解,然后离心(9000×g,7 min)。样品液的吸光度用紫外可见分光光度仪比色(280 nm)测定,最后算出酶解速率(ΔOD/h)为胃蛋白酶体外消化率。然后将剩余不溶物用33 mmol/L甘氨酸缓冲液(pH8)冲洗2遍,最后溶解于此溶液中,用胰蛋白酶(trypsin,6.6 U/mg protein)和凝乳蛋白酶(α-chymotrypsin,0.33 U/mg protein)进行酶解,酶解时间为(0、10、20,30 min)后用15%三氯乙酸溶液终止酶解,按上述步骤离心,样品液的吸光度用紫外可见分光光度仪比色(280 nm)测定,最后算出酶解速率(ΔOD/h)为胰、α-凝乳蛋白酶体外消化率。
1.3 统计方法
用SPSS16.0数据分析软件对各指标进行分析,Unpaired Student T-test 用于分析欧姆和水浴处理组的各指标显著性差异(p<0.05);而ANOVA以及Duncan 检测法用于分析同一种处理组不同终点温度条件下(20、40、60、80、100 ℃)各指标的显著性差异(p<0.05)。判断欧姆加热肉块各个指标的相关性,则用Pearson correlation coefficients分析处理。
2 结果与分析
2.1 欧姆加热和水浴加热对于猪肉块加热时间的影响
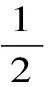

图1 欧姆加热与水浴加热猪肉加热到 不同终点温度的时间-温度图Fig.1 Time-temperature plots for ohmically(OH) and waterbath(WB)cooked pork meat at endpoint temperatures
2.2 脂肪氧化和蛋白质氧化分析
欧姆加热处理组TBARS值呈现了上升的趋势,水浴加热处理组TBARS值则呈现先下降后上升的趋势,当终点温度达到80 ℃以上,TBARS值呈现显著上升的趋势。Bax等[1]也发现随着肉块中心温度高于70 ℃时,TBARS值呈现上升的趋势。当肉块的终点温度达到80 ℃时,欧姆加热组肉块TBARS值(0.14 mg MDA/kg)显著低于(p<0.05)水浴加热处理组(0.25 mg MDA/kg)(表1)。随着终点温度的提高,欧姆加热处理组和水浴加热处理组肉块蛋白质游离巯基呈现了一定的波动,但两个处理组之间蛋白质游离巯基含量无显著性差异(p>0.05)。欧姆加热和水浴加热处理组肉块蛋白羰基含量呈现了先下降后上升的趋势(p<0.05),肉块中肌原纤维蛋白质在加热过程中易发生蛋白氧化反应[17-18]。当肉块终点温度为60 ℃时,欧姆加热处理组羰基含量(0.15 μmol DNPH/mg)显著低于(p<0.05)水浴加热处理组(0.34 μmol DNPH/mg)(表1)。水浴加热处理组肉块的加热时间比较欧姆加热时间长,可能更容易诱发肉块TBARS和蛋白羰基含量的升高。
2.3 蛋白表面疏水性和聚合度分析

表2 欧姆加热与水浴加热猪肉到不同终点温度(20~100 ℃)的蛋白质疏水活度和聚合度的变化分析

表3 欧姆加热与水浴加热猪肉到不同终点温度(20~100 ℃)的蛋白质体外消化率分析

表4 欧姆加热猪肉的氧化和营养各指标相关性分析
注:数值中的数值带*表示指标间有显著相关性,**表示指标间极显著相关性,*p<0.05;**p<0.01。随着终点温度的升高,欧姆加热处理组蛋白质表面疏水性和聚合度呈现先下降后上升的趋势,而水浴加热处理组呈现上升的趋势。在加热过程中,肉中蛋白质氧化可能会诱发蛋白质聚合度的升高[19]。当肉块终点温度为40 ℃时,水浴加热猪肉块的表面疏水性(30.91 μg)显著高于(p<0.05)欧姆加热处理组(11.26 μg)(表2),前人研究的结论表明,肉块中蛋白质疏水活性越高,肌原纤维蛋白的展开程度以及蛋白表面非极性氨基酸暴露程度越高[17,20]。水浴加热方式可能会引起肉块蛋白质剧烈变性和降解,从而引起表面疏水性的提高[7]。欧姆加热处理组肉块的蛋白质聚合度与水浴加热处理组之间无明显差异(p>0.05)。
2.4 蛋白质体外消化率分析
随着肉品终点温度的提高,欧姆加热处理组肉块胃蛋白酶体外消化率呈现了下降的趋势,而水浴加热处理组肉块胃蛋白酶体外消化率两组均呈现了一种先升高后下降的趋势(表3),而胰蛋白酶和α-凝乳蛋白酶体外消化率两组均呈现了先下降后缓慢上升的趋势,Santé-Lhoutellier等也认为随着对肉块进行加热处理,胃蛋白酶、胰蛋白酶以及α-凝乳蛋白酶活力均出现了下降,这样导致了整体蛋白酶体外消化率的下降[17]。肉在加热过程中伴随蛋白质的解聚、氧化可能最终影响人体蛋白酶的消化吸收率[21]。
当肉块的终点温度为60 ℃时,欧姆加热处理组肉块的胃蛋白体外消化率(0.05)显著低于(p<0.05)水浴加热处理组肉块(0.14)。当肉块的终点温度为20 ℃ 和60 ℃ 时,欧姆加热处理组肉块的胰、α-凝乳蛋白酶体外消化率(0.17,0.08)显著高于(p<0.05)水浴加热处理组(表3)。当肉块的终点温度高于60 ℃时,欧姆加热处理组和水浴加热处理组肉块蛋白酶体外消化率整体差异不大。
2.5 相关性分析
TBARS、羰基、巯基、蛋白质疏水相互作用,蛋白质聚合度以及蛋白酶体外消化率的相关性见表4所示。
蛋白羰基含量,蛋白质疏水活性以及蛋白质聚合度呈现显著相关性(p<0.05),蛋白质聚合度显著影响(p<0.05)胃蛋白酶体外消化率,TBARS显著影响(p<0.05)蛋白质羰基含量,可能TBARS通过影响蛋白质羰基含量,间接地影响其他指标的变化,以上结果与参考文献[16]研究结论相似。因为参考文献[16]也发现蛋白质聚合度与胃蛋白酶体外消化率呈现出显著的负相关关系,蛋白质氧化与胰蛋白酶消化率没有必然联系,可能由于蛋白羰基氧化引起蛋白聚合和疏水活性的增加,干扰了胃蛋白酶的识别蛋白和消化蛋白的作用,因此引起胃蛋白酶体外消化作用的减弱。
3 结论
加热生肉块到一定终点温度(20、40、60、80、100 ℃)时,欧姆加热处理组肉块的加热时间大约为水浴加热处理组时间的1/6~1/2,当肉块的终点温度达到80 ℃时,欧姆加热处理组肉块的TBARS值显著低于(p<0.05)水浴加热处理组,当温度为60 ℃时,欧姆加热处理组的羰基值和胃蛋白酶体外消化率显著低于(p<0.05)水浴加热处理组,当温度为20 ℃和60 ℃时,胰、α-凝乳蛋白酶体外消化率显著高于(p<0.05)水浴加热处理组。当温度为40 ℃时,欧姆加热处理组肉块的蛋白疏水活性显著低于(p<0.05)水浴加热处理组。因此,与传统水浴加热方式相比,欧姆加热处理组肉块在显著缩短加热时间的前提下,各种指标除个别温度有差异外,整体无明显区别。蛋白质聚合度、蛋白质疏水活度与胃蛋白酶体外消化率呈现明显的负相关关系(p<0.05)。
[1]Bax M L,Aubry L,Ferreira C,et al. Cooking temperature is a key determinant ofinvitromeat protein digestion rate:investigation of underlying mechanisms[J]. Journal of Agricultural and Food Chemistry,2012,60(10):2569-2576.
[2]Santé-Lhoutellier V,Aubry L,Gatellier P. Effect of oxidation oninvitrodigestibility of skeletal muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry,2007,55(13):5343-5348.
[3]West S E,Harris K B,Haneklausa N,et al. Nutrient Database Improvement Project:The influence of USDA Quality and Yield Grade on the separable components and proximate composition of raw and cooked retail cuts from the beef chuck[J]. Meat Science,2014,97(4):558-567.
[4]Morrel M,Gatellier P,Sayd T,et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science,2006,73(3):536-543.
[5]De Santos F,Rojas M,Lockhom G,et al. Effect of carbon monoxide in modified atmosphere packaging,storage time and endpoint cooking temperature on the internal color of enhanced pork[J]. Meat Science,2007,77(4):520-528.
[6]Tornberg E. Engineering processes in meat products and how they influence their biophysical properties[J]. Meat Science,2013,95(4):800-878
[7]Dai Y,Zhang Q N,Wang L,et al. Changes in shear parameters,protein degradation and ultrastructure of pork following water bath and ohmic cooking[J]. Food and Bioprocess Technology,2014,7(5):1393-1403.
[8]Dai Y,Lu Y,Wu W,et al. Changes in oxidation,color and texture deteriorations during refrigerated storage of ohmically and water bath-cooked pork meat[J]. Innovative Food Science & Emerging Technologies,2014,26:341-346.
[9]Yildiz Turp G,Icier F,et al. Influence of infrared final cooking on color,texture and cooking characteristics of ohmically pre-cooked meatball[J]. Meat Science,2016,114:46-53.
[10]Sarang,Sanjay,Sudhir K,et al. Electrical conductivity of fruits and meats during ohmic heating[J]. Journal of Food Engineering,2008,87(3):351-356.
[11]苑善振,杨红菊,张巧娜,等. 欧姆加热对肉糜制品品质的影响[J]. 食品科技,2013,38(7):150-154.
[12]Soyer A,Özalp B,DalmiÜ,et al. Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J]. Food chemistry,2010,120(4):1025-1030.
[13]Weber J,Bochi V C,Ribeiro C P,et al. Effect of different cooking methods on the oxidation,proximate and fatty acid composition of silver catfish(Rhamdia quelen)fillets[J]. Food Chemistry,2008,106(1):140-146.
[14]Huang F,Huang M,Xu,X,et al. Influence of heat on protein degradation,ultrastructure and eating quality indicators of pork[J]. Journal of the Science of Food and Agriculture,2011,91(3):443-448.
[15]Den Hertog-Meischke M J,Smulders F J,Van Logtestijn J G,et al. The effect of electrical stimulation on the water-holding,capacity and protein denaturation of two bovine muscles[J]. Journal of Animal Science,1997,75(1):118-124.
[16]Santé-Lhoutellier V,Engel E,Aubry L,et al. Effect of animal(lamb)diet and meat storage on myofibrillar protein oxidation andinvitrodigestibility[J]. Meat Science,2008,79(4):777-783.
[17]Santé-Lhoutellier V,Astruc T,Marinova P,et al. Effect of meat cooking on physicochemical state andinvitrodigestibility of myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry,2008,56(4):1488-1494.
[18]Ventanas S,Estevez M,Tejeda J F,et al. Protein and lipid oxidation inLongissimusdorsiand dry cured loin from Iberian pigs as affected by crossbreeding and diet[J]. Meat Science,2006,72(4):647-655.
[19]Promeyrat A,Gatellier P,Lebret B,et al. Evaluation of protein aggregation in cooked meat[J]. Food Chemistry,2010,121(2):412-417.
[20]Chelh I,Gatellier P,Santé-Lhoutellier V. Technical note:A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science,2006,74(4):681-683.
[21]Gatellier P,SantéLhoutellier V. Digestion study of proteins from cooked meat using an enzymatic microreactor[J]. Meat Science,2009,81(2):405-409.
The dynamic changes of ohmic cooking on pork meat oxidation and digestioninvitro
DAI Yan,LU Yi+,YU Qian-qian,LIU Yi,LI Xing-min,DAI Rui-tong*
(College of Food Science and Nutritional Engineering,China Agricultural University and Beijing Higher Institution Engineering Research Center of Animal Product,17 Qinghua East Road,Beijing 100083,China)
In order to investigate the effects of ohmic(OH)and waterbath(WB)cooking on lipid and protein oxidation,protein surface hydrophobicity,aggregation and the changes of pepsin,trpsin andα-chymotrypsin digestion rateinvitroof cooked meat samples at the same endpoint temperatures(EPTs,range,20~100 ℃)were evaluated. The results indicated that as the EPTs was increased,the values of protein carbonyl of cooked meat samples was decreased previously and then increased,whereas the values of trpsin andα-chymotrypsininvitrowas decreased. The OH-cooked samples had significant(p<0.05)lower protein surface hydrophobicity than that of the WB-cooked ones at 40 ℃.The OH-cooked samples had significant(p<0.05)higher trpsin andα-chymotrypsin digestion rateinvitrothan WB-cooked ones at 20 ℃. The OH-cooked meat samples had significant(p<0.05)lower carbonyl,pepsin digestion rateinvitroand higher trpsin andα-chymotrypsin digestion rateinvitrothan WB-cooked ones at 60 ℃. The OH-cooked meat samples had significantly(p<0.05)lower TBARS values than WB-cooked ones at 80 ℃,and no significant difference(p>0.05)was detected between OH and WB-cooked samples on other parameters. The significant negative correlation was observed in protein aggregation,surface hydrophobicity and pepsin digestion rateinvitro(p<0.05). Therefore,the ohmic cooking could save 1/2~5/6 total cooking time,and there was no obvious difference in all detected parameters of oxidation and protein digestioninvitrobetween OH and WB-cooked samples.
ohmic cooking;waterbath cooking;digestioninvitro;meat;oxidation;correlation
2016-08-26+并列第一作者。
戴妍(1986-),女,博士,研究方向:肉品加工技术,E-mail:458754990@qq.com。 卢忆(1990-),女,硕士,研究方向:肉品加工技术,E-mail:1216453232@qq.com。
*通讯作者:戴瑞彤(1966-),女,博士,副教授,从事肉品质量控制方面的研究,E-mail:dairuitong@gmail.com。
国家自然科学基金项目(31271894)。
TS201.3
A
1002-0306(2017)05-0103-05
10.13386/j.issn1002-0306.2017.05.011
