金花茶离体培养体系的建立
2017-05-30林茂杨舒婷唐庆李进华龙定建王华新
林茂 杨舒婷 唐庆 李进华 龙定建 王华新

摘要:【目的】通过愈伤组织发生途径建立金花茶(Camellia nitidissima)的离体培养体系,为金花茶的快速繁殖和种质资源保存提供理论和技术支持。【方法】在金花茶种子萌发阶段以沙子替代培养基进行无菌萌发,以其成熟植株的茎尖、茎段和叶片为外植体,在WPM培养基上添加不同种类和浓度激素进行愈伤组织诱导、愈伤组织分化及生根培养。【结果】金花茶成熟种子去壳、去皮、取出胚乳后在添加无菌液的湿润沙子中培养,平均萌发率为95.40%,平均萌发时间为19.10 d;WPM+2.00 mg/L 6-BA+0.50 mg/L 2,4-D是金花茶子叶、胚轴愈伤组织诱导的适宜培养基;WPM+
2.00 mg/L 6-BA+0.10 mg/L NAA是愈伤组织分化的适宜培养基,分化系数为4.56;1/2WPM+0.50~1.00 mg/L IBA是金花茶生根的适宜培养基,生根率为45.40%~54.00%,生根时间为19.80~20.90 d。【结论】金花茶离体培养可通过胚轴诱导产生愈伤组织进而分化成完整植株。
关键词: 金花茶;离体培养;无菌萌发
中图分类号: S685.14 文献标志码:A 文章编号:2095-1191(2017)03-0475-06
0 引言
【研究意义】金花茶(Camellia nitidissima)属山茶科山茶属常绿灌木或小乔木,原产于我国广西南部、西南部的亚热带地区,自然分布狭窄,资源稀缺,为国家Ⅰ级保护植物,被誉为植物界大熊猫和茶族皇后。金花茶集观赏价值、营养价值和药用价值为一体,其所含的特殊色泽遗传基因具有极重要的科研价值和药用价值,近年来逐渐受到关注,市场开发利用前景广阔。金花茶种子结实率低,自繁能力差,生长速度慢;通过枝条扦插虽可加快种苗繁育速度,但需枝条量大且成活率低,种苗繁殖速度不能满足市场需求,导致金花茶苗木资源紧缺,极大地限制其开发应用。组培快繁是获得大量优质种苗的有效途径之一,也是种质资源保存的重要手段。因此,建立金花茶离体培养体系,对金花茶的快速繁殖和种质资源保存具有重要意义。【前人研究进展】当前有关金花茶组织培养的研究较多。高宇琼和赖钟雄(2010)研究表明,金花茶子叶胚去外表皮后切块,接种于MS+1.5 mg/L 2,4-D+0.5 mg/L KT中,能诱导出愈伤组织并生长良好,成年叶片在MS+1.5 mg/L 6-BA+0.5 mg/L IAA+
4.0 mg/L NAA中愈伤诱导率为98.33%;王友生(2013)研究发现,显脉金花茶幼嫩带芽茎段组织培养的最佳启动培养基为WPM+7.0 mg/L 6-BA+0.25 mg/L NAA,最佳增殖培养基为改良WPM(NO3-∶NH4+=2∶1)+5.0 mg/L 6-BA+0.05 mg/L NAA;杨舒婷等(2013)研究表明,崇左金花茶幼嫩叶片愈伤组织诱导的最佳培养基为改良MS+5.0 mg/L 6-BA+0.1 mg/L 2,4-D,幼嫩茎段愈伤组织诱导的最佳培养基为改良MS+3.0 mg/L 6-BA+ 0.1 mg/L 2,4-D,种子愈伤组织诱导的最佳培养基为改良MS+4.0 mg/L 6-BA+0.6 mg/L 2,4-D;洪永辉等(2016)以防城金花茶种子HF-1为外植体,成功建立了组织培养快繁技术体系;黄昌艳等(2016)以广西防城港金花茶种子为外植体筛选出适宜种子萌发的培养基为MS+1.0 mg/L GA3、继代增殖培养基为MS+3.0 mg/L 6-BA、壮苗培养基为MS+1.0 mg/L 6-BA+0.05 mg/L NAA。【本研究切入点】当前,对金花茶的组培研究所用外植体以茎尖、茎段和叶片为主,在一定程度上对金花茶母株有所损害,以种子为外植体获得无菌外植体时间较长,成本较高;此外,多数研究是以MS培养基为基本培养基,利用木本培养基(WPM)为基本培养基的研究鲜见报道。【拟解决的关键问题】以金花茶种子为外植体,在萌发阶段以沙子替代培养基进行无菌萌发,并以其成熟植株的茎尖、茎段和叶片为外植体,开展以WPM为基本培养基的组培快繁研究,为降低成本、缩短无菌播种时间和快速获得金花茶优质组培种苗提供理论和技术支持,同时为进一步研究其遗传特性和培育新种质提供参考依据。
1 材料与方法
1. 1 试验材料
金花茶当年采收的成熟种子、成熟植株的茎尖、茎段和叶片由广西林业科学研究院园林花卉研究所提供。
1. 2 試验方法
1. 2. 1 培养基及培养条件 WPM培养基中的蔗糖含量30.0 g/L,琼脂含量6.0 g/L,pH 5.8~6.0。1/2WPM培养基中的蔗糖含量15.0 g/L,其余成分及含量均与WPM培养基相同。
培养温度(25±1)℃,光照强度2000 lx,光照时间14~16 h/d。
1. 2. 2 外植体获取 选取饱满种子,先用中性洗涤剂浸泡20~30 min后,在流水下冲洗40~60 min,然后转至超净工作台,用75%酒精浸泡40~60 s,无菌水冲洗3次;再用0.1%升汞浸泡16~20 min,此操作过程中轻轻振荡种子,使升汞与种子充分接触,最后用无菌水冲洗3次。将经消毒灭菌的金花茶种子装入盛有无菌水的组培瓶中浸泡24 h,使其充分吸胀。然后按表1中的方法进行无菌播种,每种处理方法50粒种子,3次重复。
播种完毕即可将培养材料移入培养室进行培养,培养温度21~25 ℃。培养期间不定期检查沙子的湿润程度,若过于干燥,应及时向组培瓶中添加无菌水至沙子湿润为止。每天观察种子的萌发情况,记录、统计种子萌发时间和数量,连续观察30 d。
从金花茶无菌苗成熟植株剪取幼嫩茎尖、茎段及叶片,先用中性洗涤剂浸泡20~30 min后,在流水下冲洗40~60 min,然后转至超净工作台,用75%酒精浸泡40~60 s,无菌水冲洗3次;再用0.1%升汞浸泡16~20 min,最后用无菌水冲洗3次。将经消毒灭菌的茎尖、茎段和叶片接入WPM培养基中。获得的无菌茎尖、茎段和叶片用于下一步试验。
1. 2. 3 愈伤组织诱导
1. 2. 3. 1 子叶和胚轴愈伤组织诱导 从种子无菌苗上切取子叶和胚轴,接种在不同愈伤组织诱导培养基上,每种培养基接种量50个,3次重复。每天观察愈伤组织诱导情况,连续观察30 d后,统计愈伤组织诱导数并计算愈伤组织诱导率。
愈伤组织诱导率(%)=产生愈伤组织的叶片数/接种数×100
1. 2. 3. 2 成熟植株茎尖、茎段和叶片愈伤组织诱导 将获得的无菌茎段、茎尖和叶片接种在不同愈伤诱导培养基上进行愈伤组织诱导,每种培养基接种量50个,3次重复。每天观察愈伤组织诱导情况,连续观察30 d后,统计愈伤组织诱导数和新芽数,并参考1.2.3.1中的方法计算愈伤组织诱导率。
1. 2. 3. 3 愈伤组织分化 将从1.2.3.1中诱导获得的愈伤组织接种在不同愈伤组织分化培养基上,每种培养基接种量50个,3次重复。每天观察愈伤组织分化情况,连续观察30 d后,统计新芽数并计算分化系数。
分化系数=分化出的新芽数/接种数
1. 2. 3. 4 生根培养 当金花茶植株苗高3~4 cm时,将其接种在不同的生根培养基上,每种培养基接种量50株,3次重复。每天观察小苗的生根及生长情况,连续观察20 d后,统计生根植株数和根条数,并计算生根率。
生根率(%)=生根数/接种数×100
1. 3 统计分析
试验数据为3次重复的平均值,采用SPSS 19.0进行Duncans多重比较分析。
2 结果与分析
2. 1 金花茶外植体的获得
由表2可知,不同播种方法的金花茶种子平均萌发率、平均萌发时间不同。方法1的平均萌发率为95.40%,显著高于其他3种方法(P<0.05,下同),平均萌发时间为19.10 d,显著短于其他3种方法;方法2和方法3的平均萌发率及平均萌发时间无显著差异(P>0.05,下同);方法4的平均萌发率为52.80%,显著低于其他3种方法,平均萌发时间为39.50 d,显著长于其他3种方法。说明采用方法1即将金花茶成熟种子去壳、去皮后,取出胚乳,再将胚乳埋入沙中,倒少量无菌液湿润沙子,可在较短时间内获得较高的种子萌发率。
2. 2 愈伤组织的诱导结果
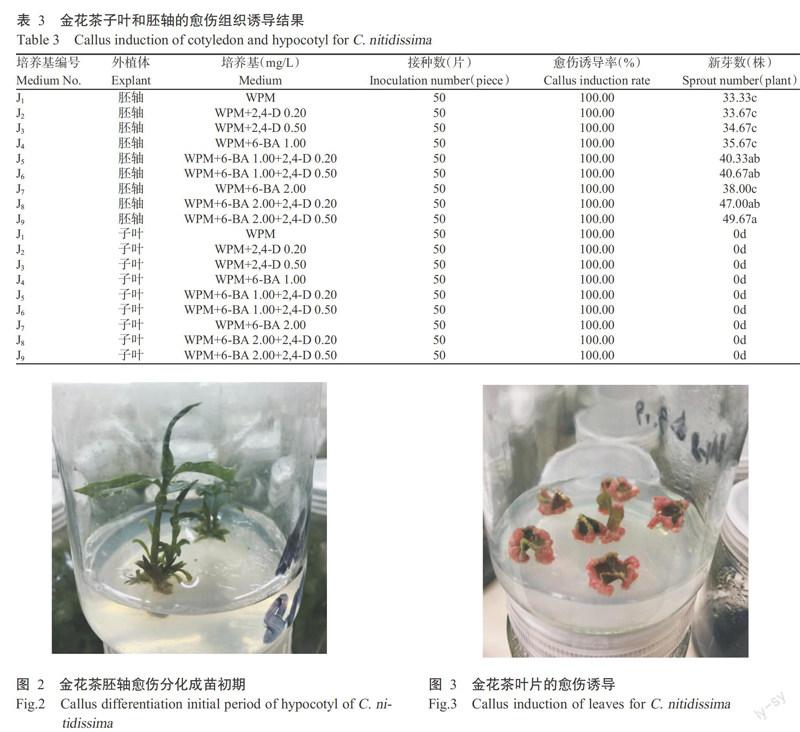
2. 2. 1 子叶和胚轴的愈伤诱导 由表3可知,金花茶种子胚轴和子叶的愈伤诱导率无显著差异,均为100.00%,表明胚轴、子叶的愈伤诱导不受培养基及激素种类和浓度影响;新芽数存在明显差异,胚轴有新芽产生(图1和图2),而子叶产生的新芽数量为0,显著低于由胚轴产生的新芽数。其中,培养基J9中胚轴产生的新芽数最多,为49.67株,显著多于培养基J1、J2、J3、J4和J7,但与培养基J5、J6和J8差异不显著。
综上所述,通过子叶仅产生愈伤组织,无愈伤分化;通过胚轴能产生愈伤组织并进行愈伤分化,WPM+2.00 mg/L 6-BA+0.50 mg/L 2,4-D是适宜金花茶子叶和胚轴愈伤组织诱导的培养基。
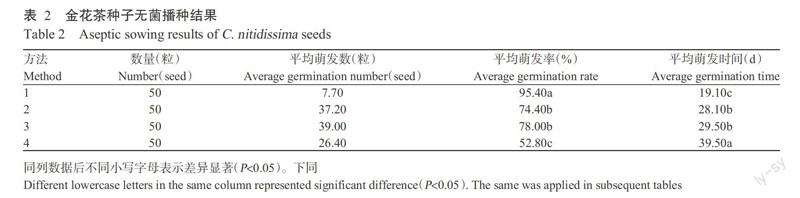
2. 2. 2 成熟植株茎尖、茎段和叶片的愈伤组织诱导 由表4可知,外植体不同其愈伤诱导率也存在明显差异。其中,叶片的愈伤诱导率显著高于茎段和茎尖的愈伤诱导率,茎段的愈伤诱导率的愈伤诱导率又显著低于茎尖的愈伤诱导率,即产生愈伤诱导排序为叶片>茎尖>茎段;在愈伤组织分化中,叶片、茎段和茎尖均未分化出新的不定芽;叶片的愈伤组织主要集中在叶片中脉发生,愈伤组织的颜色为红色,質地疏松(图3),且愈伤组织产生的时间较短。可见,成熟金花茶植株的叶片是进行愈伤组织诱导的适宜外植体。
2. 3 愈伤组织的分化结果
由表5可知,不同激素种类和浓度对金花茶诱导愈伤组织分化的影响不同。培养基L1、L4和L7的分化系数存在显著差异,以培养基L7的分化系数高于培养基L1和L4;培养基L2、L5和L8的分化系数存在显著差异,以培养基L8的分化系数高于培养基L2和L5;培养基L3、L6和L9的分化系数也存在显著差异,以培养基L6的分化系数最高;此外,培养基L6的分化系数显著高于培养基L4和L5,培养基L7、L8和L9间的分化系数无显著差异。说明金花茶愈伤组织分化受激素配比的影响明显,在相同NAA浓度下,随着6-BA浓度的升高,分化系数呈上升趋势,但6-BA浓度为3.00 mg/L时,分化系数有所下降;而在6-BA浓度不变的情况下,随着NAA浓度的增加,分化系数逐渐增大。可见,WPM+2.00 mg/L 6-BA+0.10 mg/L NAA是金花茶愈伤组织分化的最佳培养基,分化系数为4.56,获得组培苗长势好、苗健壮(图4)。
2. 4 生根培养
由表6可知,不同培养基对金花茶生根诱导结果有不同影响。培养基Z7中金花茶组培苗的生根率最高,为54.00%,与培养基Z8(45.40%)和Z3(45.60%)无显著差异,但三者显著高于培养基Z1、Z2、Z4和Z5;Z7培养基的生根时间最短,为19.80 d,与培养基Z8(20.90 d)和Z6(22.20 d)无显著差异,但三者显著短于培养基Z1、Z2、Z3、Z4和Z5;培养基Z7的根长最长,为3.64 cm,与培养基Z8(3.35 cm)和Z2(3.28 cm)无显著差异,但三者显著长于培养基Z1、Z3、Z4、Z5和Z6;各培养基的组培苗根数量间无显著差异。即适宜金花茶生根培养(图5)的培养基为1/2WPM+0.50 mg/L IBA和1/2WPM+1.00 mg/L IBA。
3 讨论
金花茶种子的胚无休眠期,除去外种皮后培养即可迅速萌动发芽(程金水和熊和平,1986)。韦霄等(2010)将大粒径金花茶种子用含水6%湿沙贮藏,获得了较高发芽率,且幼苗长势健壮。本研究结合种子无菌播种方式将金花茶播种方法改进为将金花茶成熟种子去壳、去皮后,取出胚乳,再将胚乳埋沙中,倒少量无菌液湿润沙子。该方法的种子平均萌发率为95.40%、平均萌发时间为19.10 d,均优于接种在WPM培养基上的平均萌发率和平均萌发时间,可能是沙子疏松、透气有利于种子萌发的结果,而WPM培养基的营养成分虽高,但营养成分可能不是种子萌发的必要条件,具体原因有待进一步研究。
通过愈伤组织诱导出胚状体,再对胚状体进行培养是多数研究中建立金花茶离体培养体系的途径之一。本研究在WPM培养基中添加不同浓度2,4-D,通过种子无菌萌发获得的子叶和胚轴均可产生愈伤组织,与张学文等(1994)对茶树种子的研究结果相似,但本研究中仅胚轴产生的愈伤组织发生了分化,子叶的愈伤组织未分化,与颜慕勤和陈平(1980)对油茶、罗忠泽(1986)对金花茶的研究结果一致,可能与2,4-D对发育至某一阶段的未成熟胚具有一定抑制作用有关。
本研究结果表明,以金花茶成熟植株不同外植体诱导产生愈伤组织的排序为叶片>茎尖>茎段,与Pedrso(1995)对山茶的研究结果一致,但在进一步的分化试验中,均未获得分化植株,原因有待进一步研究。此外,能诱导山茶属植物产生体胚的外植体多种多样,本研究发现以胚轴为佳,与林莉(2005)对金花茶的研究结果一致。
4 结论
金花茶离体培养可通过胚轴诱导产生愈伤组织进而分化成完整植株;适宜金花茶胚轴愈伤组织诱导的培养基为WPM+2.00 mg/L 6-BA+0.50 mg/L 2,4-D,适宜愈伤组织分化的培养基为WPM+2.00 mg/L 6-BA+0.10 mg/L NAA,适宜生根的培养基为1/2WPM+0.50~1.00 mg/L IBA。
参考文献:
程金水,熊和平. 1986. 金花茶胚和子叶离体培养诱导植株的研究[J]. 北京林业大学学报,8(3):31-33.
Cheng J S,Xiong H P. 1986. Studies on inducing new plants from embryo culture and cotyledon culture in vitro of Camellia chrysantha(Hu) Tuyama[J]. Journal of Beijing Forestry University,8(3):31-33.
高宇琼,赖钟雄. 2010. 金花茶体胚和叶片愈伤组织培养[J]. 亚热带农业研究,6(2):130-135.
Gao Y Q,Lai Z X. 2010. A study on callus culture from somatic embryos and leaves in Camellia nitidissima Chi.[J]. Subtropical Agriculture Research,6(2):130-135.
洪永辉,樊仲书,陈天增,蔡维挺,施恭明. 2016. 防城金花茶优良个体组培快繁体系研究[J]. 林业勘测设计,(1):8-10.
Hong Y H,Fan Z S,Chen T Z,Cai W T,Shi G M. 2016. Study on tissue culture of Camellia chrysantha Chi[J]. Forestry Prospect and Design,(1):8-10.
黄昌艳,周主贵,王晓国,卢家仕,关世凯,卜朝阳. 2016. 金花茶种子萌发与快速繁殖技术研究[J]. 南方农业学报,47(5):611-616.
Huang C Y,Zhou Z G,Wang X G,Lu J S,Guan S K,Bu Z Y. 2016. Seed germination and rapid propagation of Camellia nitidissima[J]. Journal of Southern Agriculture,47(5):611-616.
林莉. 2005. 金花茶离体培养研究[D]. 福州:福建农林大学.
Lin L. 2005. In vitro culture of Camellia nitidissima Chi.[D]. Fuzhou:Fujian Agriculture and Forestry University.
罗忠泽. 1986. 金花茶及其远缘杂种未成熟胚离体培养的初步研究[J]. 北京林业大学学报,8(4):76-79.
Luo Z Z. 1986. A preliminary study on immature embryo culture in vitro of Camellia chrysantha and its interspecific hybrids[J]. Journal of Beijing Forestry University,8(4):76-79.
王友生. 2013. 顯脉金花茶无菌体系建立及增殖培养研究[J]. 福建林业科技,40(2):73-77.
Wang Y S. 2013. Study on sterility system foundation and multiplication culture of Camellia euphlebia[J]. Journal of Fujian Forestry Science and Technology,40(2):73-77.
韦霄,柴胜丰,蒋运生,唐辉,李锋,赵瑞峰. 2010. 珍稀濒危植物金花茶种子繁殖和生物学特性研究[J]. 广西植物,30(2):215-219.
Wei X, Chai S F, Jiang Y S, Tang H, Li F, Zhao R F. 2010. Seed reproduction and biological characteristics of Camellia nitidissima[J]. Guihaia,30(2):215-219.
颜慕勤,陈平. 1980. 油茶体细胞胚状体的发生[J]. 实验生物学报,13(3):343-347.
Yan M Q,Chen P. 1980. In vitro development of somatic embryoid from oil-tea plant[J]. The Chinese Journal of Experimental Biology,13(3):343-347.
杨舒婷,林茂,王华新,黄连东,聂侃谚,龚建英. 2013. 崇左金花茶的组培诱导愈伤研究[J]. 安徽农业科学,41(1):17-18.
Yang S T,Lin M,Wang H X,Huang L D,Nie K Y,Gong J Y. 2013. Study on tissue culture and callus induction of Chongzuo Camellia[J]. Journal of Anhui Agricuture Sciences,41(1):17-18.
张学文,刘选明,董延瑜,周朴华. 1994. 茶树愈伤组织诱导与共培转化的初步研究[J]. 湖南农学院学报,20(6):550-555.
Zhang X W,Liu X M,Dong Y Y,Zhou P H. 1994. Preliminary studies of callus induction and co-culture transformation of Thea sinensis[J]. Journal of Hunan Agricultural College,20(6):550-555.
Pedrso M C,Hilbert J L,Vasseur J,Pais M. 1995. Polypeptides associated with the induction of direct somatic embryogenesis in Camellia japonica levaes 1. Identification of embryo-specific polypeptides[J]. Journal of Experimental Botany,46(291):1579-1584.
(责任编辑 思利华)
