模拟低温对龙眼果实发育及其果皮H2O2代谢的影响
2017-05-30杨为海邹明宏曾辉万继锋张汉周石胜友陆超忠
杨为海 邹明宏 曾辉 万继锋 张汉周 石胜友 陆超忠

摘 要 以3年生‘储良龙眼盆栽树为试验材料,于花后28 d时采取模拟低温(昼夜15/10 ℃)处理,研究该处理对龙眼果实发育及其果皮过氧化氢(H2O2)含量、过氧化物酶(POD)活性与过氧化氢酶(CAT)活性的影响,以常温(昼夜28/23 ℃)处理为对照。结果表明:模拟低温处理后的龙眼成熟果实单果重明显偏小、发育期显著增加,主要是延长了果实发育前期,但其累积落果率与对照差异不显著。模拟低温期间,果实生长缓慢,落果较少,果皮POD、CAT活性与H2O2含量均低于对照;但从处理后43 d起开始解除模拟低温后,果实发育迅速,落果剧烈,果皮POD、CAT活性及H2O2含量均呈先升后降的变化趋势,且在果实发育中后期均明显高于对照。这表明,模拟低温抑制了果实生长、延长了果实发育期,温度骤然回升引起果皮H2O2的爆发及果皮抗氧化酶活性的提高,进而诱导了果实大量脱落。
关键词 龙眼;果实发育;模拟低温;过氧化氢
中图分类号 S667.2 文献标识码 A
Abstract This study was to investigate the effects of simulated low temperature(15/10 ℃, day/night), treated at 28 days after anthesis in the phytotron, on the fruit development and the pericarp hydrogen peroxide(H2O2)content and its peroxidase(POD)and catalase(CAT)activities in the three-year-old potted trees of longan(Dimocarpus longan Lour. cv. Chuliang), and the treatment of warm temperature(28/23 ℃, day/night)was used as the control. The results showed that a smaller fruit at harvest and a longer period of fruit development chiefly due to a longer early fruit development were significantly occurred in the potted longan trees after treatment of simulated low temperature, while there was no significant difference in the cumulative fruit drop rate compared to those exposed to the control temperature regime. Accompanied by the slower fruit growth and the fewer fruit drop during simulated low temperature, the H2O2 content and POD, CAT activities of pericarp were also lower than those of the control. However, the rapid fruit development and the severe fruit abscission were obviously occurred after removing low temperature from 43 d after treatment, along with the distinctly changes of increasing firstly and decreasing later in the content of H2O2 and the activities of POD and CAT in pericarp which were clearly higher than those of the control in the mid-late stage of fruit growth, suggested that simulated low temperature repressed fruit growth and extended the period of fruit development, and an abrupt raised temperature caused the outburst of H2O2 and the increase of antioxidant enzymes activities in pericarp and thus induced the severe fruit abscission.
Key words longan; fruit development; simulated cold temperature; hydrogen peroxide
doi 10.3969/j.issn.1000-2561.2017.03.008
龍眼(Dimocarpus longan Lour.)是原产中国南方的特色亚热带常绿果树,主要分布在广西、福建、海南等省(区)[1]。近十年来,中国龙眼种植面积略有下降,但收获面积却在逐年增加,已成为中国华南地区最具国际竞争力的水果之一。然而,由于正造龙眼的收获期相对集中且鲜果不耐贮藏、货架期短,产销矛盾较突出,造成龙眼价格偏低、产业效益较低。应用氯酸钾诱导龙眼反季节成花,实现反季节龙眼生产,可延长鲜果供应期,提高市场竞争力。但是,反季节龙眼开花、座果和果实发育均处于不利的气候环境(秋冬季干旱、冬春季低温和夏季高温)下,造成反季节龙眼果实发育生理障碍现象十分严重,成为龙眼反季节生产的瓶颈[2-3]。
低温、高温、干旱等各种逆境是限制植物生长发育、影响作物产量与品质形成的主要非生物胁迫因素。一般认为,龙眼开花坐果的适宜日均温约为20~25 ℃[4],幼果发育期遇连续低温或低温阴雨天气可导致严重落果[5]。与正造龙眼明显不同,越冬反季节龙眼果实发育所经历的气温较低,尤其是果实发育早期遭遇了冬春季的低温与温湿度剧烈波动的不利环境[6]。有研究表明,低温胁迫不仅能诱导果实脱落[5-6],还影响着果实发育进程及其最终大小[7-8]。但目前国内外对越冬反季节龙眼果实发育及其相关生理障碍发生机制的研究较少。
逆境胁迫下,植物体内活性氧大量积累,导致细胞或组织受到氧化胁迫,造成生理性伤害[9-10]。H2O2是一种重要且相对稳定的活性氧,可在细胞间通过跨膜运输方式迅速扩散[11]。低温胁迫期间,植物通过增加SOD等H2O2产生酶类的活性和抑制POD、CAT等H2O2清除酶类的活性来积累H2O2,但H2O2的过度积累可直接破环细胞大分子组份而造成氧化伤害,同时也通过信号分子功能调节许多生理过程中的基因表达[11-14]。研究表明,H2O2可促进辣椒叶片[13]与豆叶柄[15]的脱落;在脱落诱导过程中,苹果幼果[16]及橄榄成熟果实离层[17]中的H2O2含量不断增加;而活性氧清除酶类活性的增加可延迟番茄花和果实的脱落[18]。这些研究暗示着H2O2参与了脱落调控,但其作用机制仍未清楚。
本试验通过人工气候室模拟冬春季低温,研究模拟低温对龙眼果实发育的影响,探索低温诱导龙眼果皮发生的相关生理变化,以期为越冬反季节龙眼栽培生产制定相关技术措施提供依据。
1 材料与方法
1.1 材料
于龙眼自然开花后28 d,将8株3年生的树冠大小、开花坐果较一致的‘储良龙眼盆栽树放置人工气候室进行模拟试验。按照龙眼生长对积温(≥10 ℃)的需求[19],结合越冬反季节龙眼果实发育早期所处的温度环境[6],将其中4株盆栽树模拟低温处理,温度设置方法为:处理后0 d将昼夜温度分别调为20 ℃和15 ℃,处理后1 d时再分别降至15 ℃和10 ℃,并维持此昼夜温度至处理后42 d;处理后43~46 d按日均约升温3 ℃的程序将昼夜温度升温至模拟常温环境(昼夜温度分别为28 ℃和23 ℃),并保持至处理后133 d果实成熟时。另4株盆栽树为对照,始终置于模拟常温环境下。两个人工气候室均模拟自然光照,光照强度约为15 000 lx,相对湿度维持在85%左右,并保持正常供水。
1.2 方法
1.2.1 果实发育动态和落果发生情况调查 果实发育从处理后0 d起开始调查,直至果实成熟采收时结束。在每株龙眼盆栽树上各选3个果穗进行标记,并在每个果穗上选择2个果实作为调查果,测量其果实横径,并调查每一穗的落果数,计算累积落果率。与此同时,在每株盆栽树未标记的果穗上各取4个果实,去果柄后称量其单果重,并立即分离出果皮,经液氮速冻后置于-80 ℃冰箱中备用。
1.2.2 H2O2含量测定 参照Zhou等[20]的方法并有所改动。取0.5 g果皮样品,加入5 mL预冷的三氯乙酸溶液(5%,V/V)和0.2 g聚乙烯吡咯烷酮,待冰浴研磨后于4 ℃下离心20 min,将上清液用25%(V/V)氨水调pH值至8.4,即为H2O2粗提液。取1 mL粗提液,于30 ℃水浴30 min后,加入1 mL显色液于500 nm处测定OD值,以1 mL粗提液中加入100 μg过氧化氢酶作为空白。显色液的配制:将0.01 g 4-氨基安替吡啉与0.01 g苯酚溶于50 mL 0.1 mol/L醋酸缓冲液(pH5.6)中,再加入5 mg辣根过氧化物酶。标准曲线的制备:将5.7 μL 30 % H2O2溶于50 mL 5%三氯乙酸溶液(pH8.4),配制成1 mmol/L H2O2-三氯乙酸溶液,按0、50、100、150、200、250 μmol/L制备标准曲线,重复3次。
1.2.3 过氧化物酶(POD)和过氧化氢酶(CAT)活性测定 称取0.5 g果皮样品,加入5 mL含1%聚乙烯吡咯烷酮的磷酸缓冲液(0.05 mol/L,pH7.8)进行冰浴研磨,在10 000 ×g下离心15 min,上清液即为粗酶提取液。
POD活性测定参照曾韶西等[21]方法,略有改进。取0.1 mL酶液、0.95 mL 0.2%愈创木酚和1.95 mL H2O2(0.1%,V/V),测定OD470 nm值在3分钟内的变化,以每min OD值变化0.01表示一个酶活力单位(U),按“酶活力单位/克鲜重分钟(U/g FW·min)”表示酶活性。
CAT活性采用氧电极法[22]测定,在反应槽內注入2 mL含0.15% H2O2的磷酸缓冲液(50 mmol/L,pH7.8),打开磁力搅拌器,待氧信号稳定2 min后,用进样器准确注入100 μL待测酶液样品,反应3 min,记录放氧动态。所采用的氧电极仪为Hansatech Oxygraph,测定温度为25 ℃。根据放氧曲线的斜率,计算酶活性,单位表示为nmol O2/g FW·min。
1.3 数据统计分析
数据以平均值表示,采用SPSS 16.0统计软件进行统计分析。
2 结果与分析
2.1 模拟低温和常温处理的果实发育比较
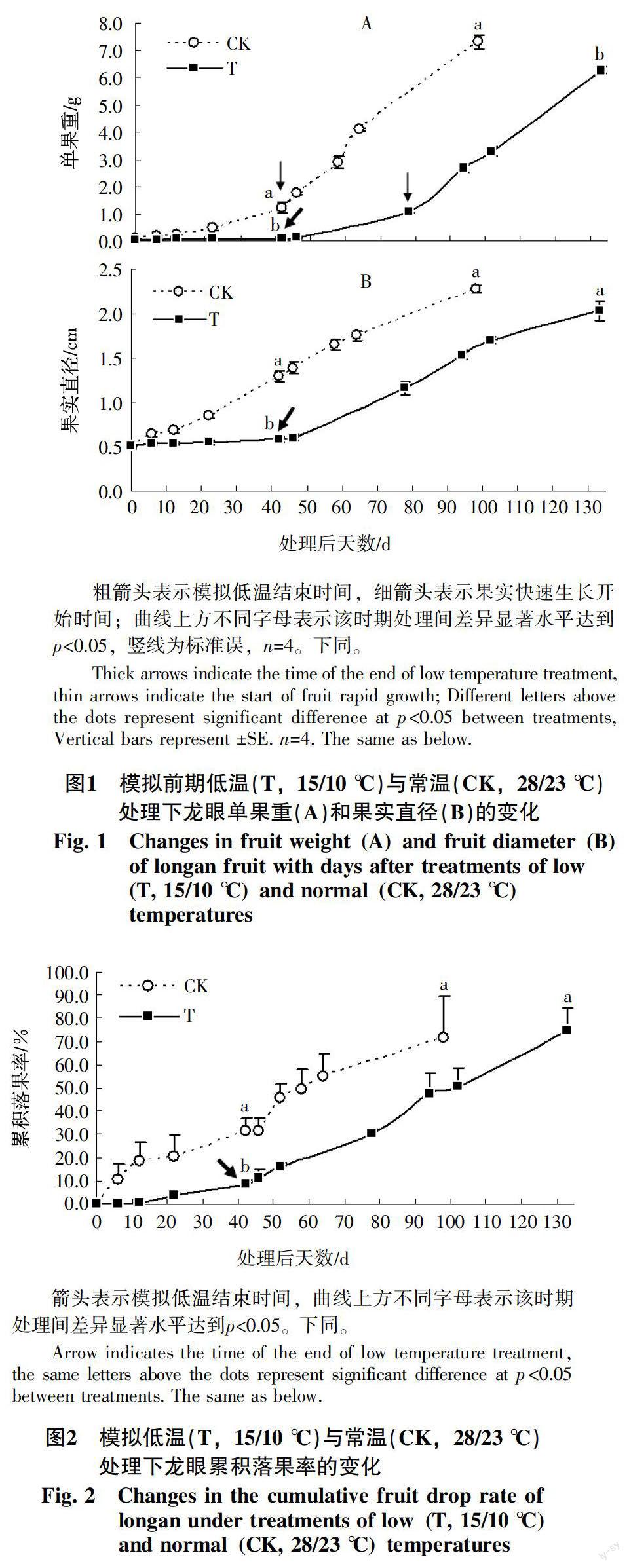
对盆栽龙眼进行模拟冬季低温试验研究发现,在模拟前期低温处理期间(处理后0~42 d)龙眼果实生长缓慢,其单果重和果实直径仅分别增加了0.04 g和0.05 cm,但与此期相对应的对照果实生长明显较快,其单果重和果实直径分别显著增加了1.13 g和0.75 cm(p<0.05);在解除模拟低温、恢复至常温环境后(处理后46~133 d),果实生长速率明显加快,至果实成熟时其单果重和果实直径分别达到了6.26 g和2.04 cm,但比对照成熟果实的单果重(7.30 g)和果实直径(2.28 cm)分别下降了1.04 g和0.24 cm,并且二者之间的果实重量差异达到显著性水平(图1)(p<0.05)。
模拟低温处理和对照处理的龙眼果实发育期也存在明显差异(图1-A)。模拟低温处理明显延长了龙眼果实的发育期,其在处理后133 d(即花后161 d)时果实才达到成熟,比对照果实发育至成熟时(处理后98 d)的发育期(花后126 d)推迟了35 d。然而,这种发育期的差异主要表现在果实发育前期(即果实缓慢生长期),此期模拟低温处理和对照处理的发育时间分别为106 d和70 d,二者相差36 d,而在果实发育后期(即果实快速生长期)二者的发育时间基本相当。
2.2 模拟低温和常温处理的落果率比较
模拟低温处理与对照处理的龙眼累积落果率均持续增加,但不同时期落果幅度差异较大(图2)。在前期低温模拟期间,果实脱落较少,其累积落果率仅为8.4%,而对照处理此期的累积落果率较大,达到31.2%,二者之间差异显著;在解除模拟前期低温处理、后期恢复至常温环境后,其果实累积落果率迅速增加,至果实成熟时此期的累积落果率高达66.1%,明显高于对照此期的累积落果率(40.6%)。就整个发育期而言,模拟低温处理的累积落果率为74.5%,与对照累积落果率(71.8%)基本相当,二者差异不明显。这说明模拟前期低温处理虽然减轻了果实脱落,但恢复至常温环境后却诱发大量落果。
2.3 模拟低温和常温处理的H2O2含量比较
模拟低温处理的龙眼果皮H2O2含量变化与对照基本一致,总体呈波动性下降的趋势(图3)。在模拟前期低温处理期间,其果皮H2O2含量从处理后0 d时的46.31 μg/g FW下降至模拟低温结束时(处理后42 d)的22.77 μg/g FW,但在解除低温、刚恢复至常温后(处理后46 d),其果皮H2O2含量迅速增加至峰值(34.70 μg/g FW),之后便持续下降。然而,对照果皮H2O2含量是在处理后0~22 d时由40.52 μg/g FW下降至27.79 μg/g FW,紧接着在果实刚开始转入快速生长期时(处理后42 d),其果皮H2O2含量迅速增加至35.29 μg/g FW,此后便呈波动下降趋势。相比较之下,模拟低温处理的龙眼果皮H2O2含量在前期低温处理期间低于对照,而在后期恢复至常温环境后其果皮H2O2含量明显高于对照。
2.4 模拟低温和常温处理的果皮POD与CAT酶活性比较
模拟低温处理的龙眼果皮POD活性变化与对照相类似,均呈先升高后下降的趋势(图4-A)。在处理后22 d 之前,处于模拟低温处理的果皮POD活性和对照果实缓慢生长期的活性基本相当。但从处理后42 d开始,模拟低温处理的果皮POD活性因升温至常温后先缓慢后快速增加,至处理后102 d时达到高峰(9334 U/g FW·min);而对照果实因开始转入快速生长期,其果皮POD活性也迅速升高,至处理后64 d时达到高峰(7 872 U/g FW·min)。比较而言,在果实发育中后期,模拟低温处理的果皮POD活性明显高于对照。
模拟低温处理的龙眼果皮CAT活性变化与对照也较一致,大体上呈先升高后下降的趋势(图4-B)。在处理后42 d 之前,模拟低温处理的果皮CAT活性比较稳定;但从低温解除、升温至常温后,其果皮CAT活性迅速增加,至处理后102 d时达到高峰。然而,对照果皮CAT活性在处理后0~64 d时快速升高,之后便下降。比较而言,模拟低温处理的果皮CAT活性在其果实发育中后期要高于对照,而在其果实发育前期却明显低于对照。
3 讨论
对大多数果树而言,果实大小主要是由细胞数目和细胞体积决定的[23]。一般情况下,果实细胞分裂对果实重量的影响比细胞膨大更明显[24-25],但细胞分裂多发生在果实发育早期,故此期影响细胞分裂的因素均会影响果实大小[26]。在众多环境因子中,温度是影响果实大小形成的主要因子。研究表明,经历了较冷凉温度的早花果实要比其晚花果实大[27-29],并认为果实发育前期的较冷凉温度有利于其细胞分裂和大果的最终形成[29-30]。然而,越冬反季节龙眼成熟果实明显偏小,被认为是冬春季的不利气候条件使得其果皮发育不良,进而限制了果实生长[31];经套袋处理提高其早期果实发育的微环境温度,可显著增加其最终果实大小[32]。本研究中,龙眼果实发育早期由于遭遇了模拟低温处理,抑制了早期果实的生长,而解除模拟低温、恢复至常温环境后其果实并没有发生补偿性快速生长,致使其成熟果实大小显著减少。这表明昼夜15/10 ℃的模拟低温使龙眼果实发育遭受到了胁迫,减少了果实生长潜力及其果实大小。
温度也决定着果实发育的进程。对柑橘[28]、荔枝[29,33]等果实的研究表明,较高的温度可加快果实发育,使果实提前成熟。然而,温度对果实发育进程的影响体现在不同的果实发育时期。对‘Elstar苹果果实发育的控温试验表明,果实发育前期的温度对其发育期的影响要比果实发育中后期的大[34]。Suzuki等[35]发现高溫(20 ℃和25 ℃)下日本杏‘Nanko的果实发育期比低温(10 ℃和15 ℃)下的短10 d,其原因是相对的高温条件缩短了果实发育的第Ⅰ期和第Ⅲ期。本研究结果表明,模拟低温处理明显增加了龙眼果实的发育期,并且主要是延长了果实发育前期,也说明果实发育前期的模拟低温导致了龙眼果实发育缓慢,这种情形与越冬反季节龙眼相似[6]。
龙眼在一般年份自然落果并不严重,主要集中在果实发育早期(花后24 d之前)和假种皮快速膨大期(花后66 d之后),其原因主要分别与授粉受精和树体营养状况有关[36]。然而,越冬反季节龙眼果实发育期间遭遇的冬春季低温是导致其剧烈落果的主要原因[3,6]。本试验结果表明,对照龙眼果实脱落主要发生在其幼果发育的花后28~40 d(即处理后12 d之前)以及假种皮快速膨大的花后74 d(即处理后46 d)之后,相对于黄辉白等[36]的报道有所推迟,可能与模拟的光照与温度(28/23 ℃)均不及于其自然环境而导致光合效能较低、同化物积累不足有关。然而,在恒定低温(15/10 ℃)模拟期间(处理后42 d前),龙眼果实脱落较少发生,而解除模拟低温后温度的骤然回升则诱发大量落果,但并未出现比对照或者自然越冬反季节龙眼更为严重的落果[6]。这可能有多方面的原因:其一,模拟的温度不够低,未能造成严重的胁迫反应;其二,模拟的是相对恒定的低温,而非如越冬反季节龙眼经历多次寒潮且伴随温度的剧变。
H2O2是植物体响应低温胁迫所产生的一种非常重要的活性氧,可通过主动提高抗氧化酶(CAT、POD等)的活性以减少体内H2O2积累所造成的氧化损伤[10-12,14]。但H2O2的过度积累不仅使植物细胞功能遭受不可修复性的丧失,还对植物器官脱落具有重要的调控作用[13,15-18]。本研究结果发现,模拟低温处理与对照的龙眼果皮H2O2含量均随果实发育呈波动下降趋势。然而,对照果皮H2O2含量在其果实刚开始转入快速生长期时(处理后42 d)达到一个高峰,可能是因其快速生长时果皮须承受来自假种皮迅速膨大产生的机械胁迫所引起的,因为已有机械胁迫诱发H2O2大量发生的报道[37-38]。同样,模拟低温处理的果皮H2O2在由模拟低温恢复至常温时(处理后46 d)也骤然爆发,这可能是其温度骤然大幅升高所诱导产生的。与果皮H2O2含量变化趋势相反,模拟低温处理与对照的果皮CAT及POD活性在果实成熟前是呈不断增加的态势。但是,当果皮H2O2含量发生高峰时,二者果皮的POD及CAT活性则开始剧烈增加,说明H2O2的大量产生会诱导抗氧化酶类活性的提高[12];同时,此期也正值二者的累积落果率开始进入迅速增长阶段,这表明龙眼果皮H2O2爆发,造成果实受到了氧化损害,并诱导了果实脱落。
参考文献
[1] 卢美英, 欧世金, 徐炯志, 等. 大乌圆龙眼果实生长发育特性和生理落果规律观察[J]. 中国南方果树, 2004, 33(4): 28-29.
[2] 曾祥有, 黎华寿, 曾运友.不同季节施用KCIO3化学调控剂对龙眼促花与果实品质的影响[J]. 生态科学, 2002, 21(3): 220-222.
[3] 黄旭明, 陆洁梅, 王惠聪. 氯酸盐在龙眼生产上的运用和研究现状[J]. 中国南方果树, 2004, 33(3): 29-30.
[4] 钟思强, 黄党源. 影响龙眼开花结果的因素及增产措施[J]. 广西科学院学报, 2001, 17(1): 27-32.
[5] 邓九生, 黄在猛. 龙眼荔枝的果实发育与调控[J]. 广西热作科技, 1998, (2): 1-5.
[6] Yang W H, Zhu X C, Deng S C, et al. Developmental problems in over-winter off-season longan fruit. I: Effect of temperatures[J]. Scientia Horticulturae, 2010a, 126: 351-358.
[7] 耿秀芬, 周广学. 温度条件对草莓生长发育及果实膨大的影响[J]. 辽宁农业职业技术学院学报, 2004, 6(3): 18-20.
[8] 李建国, 黄辉白, 黄旭明. 妃子笑荔枝早花果和晚花果大小不同与温度的关系[J]. 果树学报, 2004, 21(1): 37-41.
[9] Miller G, Suzuki N, Ciftci-Yilmaz S, et al. Reactive oxygen species homeostasis and signalling during drought and salinity stresses[J]. Plant Cell Environment, 2010, 33: 453-467.
[10] Petrov V, Hille J, Mueller-Roeber B, et al. ROS-mediated abiotic stress-induced programmed cell death in plants[J]. Frontier in Plant Science, 2015, 6: 69.
[11] Saxena I, Srikanth S, Chen Z. Cross talk between H2O2 and interacting signal molecules under plant stress response[J]. Frontier in Plant Science, 2016, 7: 570
[12] Prasad T K, Anderson M D, Martin B A, et al. Evidence for chilling-induced oxidative stress in maize seedlings and a regulatory role for hydrogen peroxide[J]. The Plant Cell, 1994, 6: 65-74.
[13] Sakamoto M, Munemura I, Tomita R, et al. Involvement of hydrogen peroxide in leaf abscission signaling, revealed by analysis with an in vitro abscission system in Capsicum plants[J]. The Plant Journal, 2008, 56 (1): 13-27.
[14] 楊 杨, 申 琳, 生吉萍, 等. 外源NO对采后芒果果实低温胁迫后H2O2代谢的影响[J]. 中国农业科技导报, 2013, 15(2): 131-136.
[15] Ueda J, Morita Y, Kato J. Promotive effect of C18-unsaturated fatty acids on the abscission of bean petiole explants[J]. Plant and Cell Physiology, 1991, 32(7): 983-987.
[16] Botton A, Eccher G, Forcato C, et al. Signaling pathways mediating the induction of apple fruitlet abscission[J]. Plant Physiology, 2011, 155(1): 185-208.
[17] Gil-Amado J A, Gomez-Jimenez M C. Regulation of polyamine metabolism and biosynthetic gene expression during olive mature-fruit abscission[J]. Planta, 2012, 235 (6): 1 221-1 237.
[18] Shanker A K, Djanaguiraman M, Sudhagar R, et al. Differential antioxidative response of ascorbate glutathione pathway enzymes and metabolites to chromium speciation stress in green gram (Vigna radiata (L.) R.Wilczek. cv CO4) roots[J]. Plant Science, 2004, 166 (4): 1 035-1 043.
[19] 黄致远, 李隆华, 张义刚. 龙眼北缘区幼龄果园春季管理技术要点[J]. 西南园艺, 2005, 33(1): 43-44.
[20] Zhou B Y, Wang J H, Guo Z F, et al. A simple colorimetric method for determination of hydrogen peroxide in plant tissues[J]. Plant Growth Regulation, 2006, 49(2-3): 113-118.
[21] 曾韶西, 王以柔, 刘鸿先. 不同胁迫处理提高水稻幼苗抗旱性期间膜保护系统的变化比较[J]. 植物学报, 1997, 39(4): 308-314.
[22] Rio L A D, Ortega M G, Lopez A L, et al. A more sensitive modification of the catalase assay with the Clark oxygen electrode: Application to the kinetic study of the pea leaf enzyme[J]. Analytical Biochemistry, 1977, 80(2): 409-415.
[23] 曾 骧. 果树生理学[M]. 北京: 北京农业大学出版社, 1992.
[24] Higashi K, Hosoya K, Ezura H. Histological analysis of fruit devlopment between two melon (Cucumis melo L. reticulatus) genotypes setting a different size of fruit[J]. Journal of Experimental Botany, 1999, 50: 1 593-1 597.
[25] 李建国, 黄旭明, 黄辉白, 等. 大果型和小果型荔枝品種果实发育细胞学和生理学比较[J]. 果树学报, 2002, 19(3): 158-162.
[26] Harada T, Kurahashi W, Yanai M, et al. Involvement of cell proliferation and cell enlargement in increasing the fruit size of Malus species[J]. Scientia Horticulturae, 2005, 105: 447-456.
[27] Cruz-Castillo J G, Laws G S, Woolley D J. The influence of the time of anthesis, seed factor(s), and the application of a growth regulator mixture on the growth of kiwifruit[J]. Acta Horticulturae, 1991, 297: 475-480.
[28] Marsh K B, Richardson A C, Macrae E A. Early- and mid-season temperature effects on the growth and composition of satsuma mandarins[J]. Journal of Horticultural Science and Biotechnology, 1999, 74(4): 443-451.
[29] 李建国, 黄辉白, 黄旭明. 妃子笑荔枝早花果和晚花果大小不同与温度的关系[J]. 果树学报, 2004, 21(1): 37-41.
[30] Greybe E, Bergh O. The effect of winter chilling on cell division and multiplication pre-anthesis and thus on final fruit size of Royal Gala apples in South Africa[J]. Acta Horticulturae, 2000, 519: 113-120.
[31] Yang W H, Deng S C, Zhu X C, et al. Developmental problems in over-winter off-season longan fruit. II: Development of pericarp structure[J]. Scientia Horticulturae, 2010b, 126: 359-365.
[32] Yang W H, Zhu X C, Bu J H, et al. Effects of bagging on fruit development and quality in cross-winter off-season longan[J]. Scientia Horticulturae, 2009, 120: 194-200.
[33] 谭宗琨, 何 燕, 欧钊荣, 等. “禾荔” 荔枝果实发育进程与温度条件的关系[J]. 气象, 2006, 32(12): 96-101.
[34] Tromp J, Romer C A R. Influence of temperature on fruit ripeness at harvest is other than expected[J]. Fruitteelt Den Haag, 1995, 85(50): 14-15.
[35] Suzuki N, Wang X, Inoue H.Effects of temperature on fruit development in Japanese apricot cv. Nanko[J]. Environment Control in Biology (Japanese), 1995, 33(4): 245-251.
[36] 黄辉白. 热带南亚热带果树栽培学[M]. 北京: 高等教育出版社, 2003, 48-74
[37] 刘 艳, 黄卫东, 战吉宬, 等.机械伤害和外源茉莉酸诱导豌豆幼苗H2O2系统性产生[J]. 中国科学, 2004, 34(6): 501-509.
[38] 张 雯, 沈应柏, 沈瑗瑗. 机械损伤对复叶槭叶片过氧化氢含量的影响[J]. 林業科学研究, 2007, 20(1): 25-129.
