菌根真菌与樱桃苗建立共生组织的培养基筛选
2017-05-30王慧娟吴曰程张忠兰杨守军潘仕梅
王慧娟 吴曰程 张忠兰 杨守军 潘仕梅

摘要:【目的】筛选适宜菌根真菌与樱桃苗建立共生组织的培养基,为提高樱桃组培苗移栽成活率提供参考依据。【方法】在培养基为DE、1/2DE、1/4DE及1/8DE的樱桃组培苗瓶中分别接种纯化菌根真菌,接种30、40、50和60 d后分别测定樱桃组培苗根系的侵染率、株高、叶片酶活性、根系分枝数及组培苗成活率,筛选出适宜菌根真菌与樱桃组培苗建立共生组织的培养基。【结果】培养基为DE和1/2DE的樱桃组培苗在接种菌根真菌30和50 d后全部死亡,培养基为1/4DE和1/8DE的樱桃组培苗在接种菌根真菌60 d后仍保持20.0%和70.0%的成活率。接种菌根真菌30 d后,培养基为1/4DE 和1/8DE樱桃组培苗的根系侵染率、根系分枝数、株高及叶片过氧化物酶活性逐渐增加,在接种菌根真菌后60 d达最大值。【结论】在组培苗培养过程中接种菌剂使其根系菌根化,实际上是组培苗、菌根真菌和培养基间复杂的相互反应结果。1/8DE可作为较适宜菌根真菌与樱桃组培苗建立菌根共生组织的培养基。
关键词: 樱桃苗;菌根真菌;培养基;共生体系;生长发育
中图分类号: S662.5 文献标志码:A 文章编号:2095-1191(2017)05-0844-05
Screening medium for symbioses establishment between mycorrhizal fungi and Prunus pseudocerasus seedlings
WANG Hui-juan, WU Yue-cheng, ZHANG Zhong-lan, YANG Shou-jun, PAN Shi-mei*
(Yantai Institute, China Agricultural University, Yantai, Shandong 264670, China)
Abstract:【Objective】Medium for symbioses establishment between mycorrhizal fungi and Prunus pseudocerasus seedlings was screened in order to provide reference for improving transplanting survival rate of tissue-cultured P. pseudocerasus seedlings. 【Method】Tissue-cultured P. pseudocerasus seedlings in media DE, 1/2DE, 1/4DE and 1/8DE were inoculated. Root infection rate,plant height,leaf enzyme activity,branch number of root and survival rate of tissue-cultured seedlings were determined after 30, 40, 50 and 60 d of inoculation. Culture medium suitable for symbiosis between mycorrhizal fungi and P. pseudocerasus seedlings was selected. 【Result】The seedlings in DE and 1/2DE media died 30 and 50 d after mycorrhizal fungi inoculation, seedlings in media 1/4DE and 1/8DE remained 20.0% and 70.0% survival rates respectively. Root infection rate,branch number of root,plant height and leaf peroxidase activity of P. pseudocerasus seedlings gradually increased in 1/4DE and 1/8DE media 30 d after treatment and reached the peaks 60 d after inoculation. 【Conclusion】Inoculation of fungi during seedling culture process can make the root mycorrhizal, which is the complicated reaction among tissue-cultured seedlings, mycorrhizal fungi and medium. 1/8DE culture medium is beneficial for symbioses establishment between P. pseudocerasus seedlings and mycorrhizal fungi.
Key words: cherry seedling; mycorrhizal fungi; medium; symbioses; development and growth
0 引言
【研究意義】组培快繁技术的发展促进了果树育种工作的进程,也为长期保存果树种质资源提供了新手段,但与大田条件下生产的苗木相比,组培苗因具有非功能性根系,叶片叶绿素含量和光合速率很低,没有或仅有发育很差的表皮及气孔,常导致在移栽驯化阶段过量失水、长势弱而死亡,成活率较低(刘文科和杨其长,2005;段元杰等,2016)。因此,选用适宜的培养基、提高组培苗在试管内阶段和驯化阶段的生理状况及品质,对其适应环境变异能力、成活力及定植后的生长和产量至关重要。目前,生产上所用樱桃苗木多为组培脱毒苗,新建樱桃园苗木死亡率较高,除栽培管理措施不当等因素外,樱桃苗木根系不发达、过短或少有须根均为导致苗木死亡的主要原因(侯东梅,2016;王德欢等,2016)。菌根真菌能促进寄主植物对矿质营养吸收、碳氮循环、水分吸收和提高光合速率,进而改善其生长发育、有效成分积累及抗逆性(程俐陶等,2009)。因此,在樱桃苗组培过程中接种高效菌根真菌并避免或减少培养基污染现象发生,建立菌根真菌与樱桃苗共生体系,尽早实现苗木菌根化,对提高樱桃苗移栽成活率具有重要意义。【前人研究进展】Smith和Read(1997)研究认为,菌根真菌能与陆地上80%的植物形成良好的共生关系,植物为真菌的生长繁殖提供光合产物,真菌为寄主植物提供生长发育所需养分。菌根真菌在根系上成功定植后,能改变寄主植物根的构型,促进寄主根系多分枝,增加不定根数量和根系直径,延长根系寿命,进一步促进根系对养分的吸收,同时能形成较庞大的菌丝网络将植物根系辐射不到土壤中的养分吸收,通过菌丝传递给根系,提高土壤养分的有效性,避免缺素症状发生(Schellenbaum et al.,1991;Harrier and Watson,2004;张金莲等,2015;伍荣冬等,2016)。金辉等(2009)研究发现,接种菌根真菌的铁皮石斛苗长势旺盛,茎粗壮呈红紫色,产生新根多,根系发达。李景蕻和张丽华(2015)采用菌根技术与组培技术相结合,创建药用兰科植物组培苗与菌根真菌共生的培养体系,不仅为工厂化生产种苗提供重要借鉴方式,还为保护和利用野生兰科药用植物资源提供了一条新途径。王晓国等(2016)研究认为,几乎所有兰科植物都与真菌共生,可将真菌应用于兜兰种群恢复。【本研究切入点】目前,未见菌根真菌与樱桃组培苗共生培养研究的报道。【拟解决的关键问题】在培养基为DE、1/2DE、1/4DE和1/8DE的樱桃组培苗瓶中接种菌根菌剂,分析菌根真菌对樱桃苗生长发育的影响,为建立樱桃组培苗与菌根真菌共生体系、提高樱桃苗移栽成活率提供参考依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试植物及菌根菌剂 供试红灯樱桃(Prunus pseudocerasus)组培苗由中国农业大学烟台研究院苗木组培中心提供。供试菌根菌剂为地表球囊霉(Glomus versiforme),含分离孢子15个/mL,由青岛农业大学提供。
1. 1. 2 菌根真菌分离纯化及共生培养基 参考贾东贝等(2011)的方法进行菌根真菌分离纯化。DE培养基参照Dijke和Eck(1995)的方法配制,培养基配方:1.0 mmol/L CaCl2,0.5 mmol/L MgSO4,1.0 mmol/L K2SO4,0.4 mmol/L KH2PO4,100.0 μmol/L FeSO4,25.0 μmol/L H3BO3,33.0 μmol/L MnCl2,2.8 μmol/L ZnSO4, 1.0 μmol/L NaMoO4,140.0 μmol/L Na2-EDTA,1.0 g/L 酵母浸膏,9.0 g/L可溶性淀粉,8.0 g/L琼脂,pH 6.0。
1. 2 试验方法
1. 2. 1 试验设计 将纯化菌剂分别接种至培养基为DE、1/2DE、1/4DE和1/8DE的樱桃组培苗瓶中,每瓶接种2块约0.5 cm2菌塊,每处理10瓶樱桃组培苗,4次重复。每瓶含1棵长势相近、根系发育良好的樱桃苗,苗高约3.81 cm,根系分枝数平均为7.1条,其中根长0~0.50 cm的根系2.6条,0.51~1.00 cm的根系0.5条,1.01~1.50 cm的根系4.0条,≥1.51 cm的根系0条。接种后在无菌室中观察记录组培苗的生长状况。
1. 2. 2 测定项目及方法 接种30 d后分别测定樱桃组培苗根系的侵染率、株高、叶片酶活性、根系分枝数及组培苗成活率,此后每隔10 d测定1次,共测定4次。菌根真菌侵染率测定采用台盼蓝染色法(Koske and Gemma,1989),过氧化氢酶活性测定采用Barber法(Barber,1980),根系分枝数分4个等级,即分别计数长度分别为0~0.50、0.51~1.00、1.01~1.50和≥1.51 cm的根系数量。
1. 3 统计分析
试验数据采用SAS 6.0进行统计分析。
2 结果与分析
2. 1 接种菌根真菌对樱桃组培苗根系侵染率的影响
从图1可看出, DE培养基中的樱桃组培苗在接种菌根真菌30 d后全部死亡,樱桃组培苗根系的侵染率为0;1/2DE培养基中的樱桃组培苗在接种菌根真菌后30和40 d,根系侵染率分别为2.5%和4.8%,接种后50和60 d组培苗全部死亡,根系侵染率为0;1/4DE和1/8DE培养基中的樱桃组培苗根系侵染率与接种时间呈正相关,在接种后30~60 d,根系侵染率分别由3.3%和7.8%升至17.4%和36.4%。方差分析结果表明,接种60 d后,1/8DE培养基中樱桃组培苗的根系侵染率显著高于DE、1/2DE和1/4DE培养基(P<0.05,下同)。说明1/8DE培养基利于菌根真菌繁殖,促进根系侵染率的提高。
2. 2 接种菌根真菌对樱桃组培苗根系分枝数的影响
由表1可知,DE培养基中的樱桃组培苗在接种菌根真菌30 d后全部死亡,各根系长度等级的根系分枝数均为0,显著低于相应1/2DE、1/4DE和1/8DE培养基中樱桃组培苗的根系分枝数,1/2DE、1/4DE和1/8DE培养基中樱桃组培苗的根系分枝数间差异不显著(P>0.05,下同);接种菌根真菌40 d后,DE培养基中樱桃组培苗各根系长度等级的根系分枝数均为0,1/4DE和1/8DE培养基中樱桃组培苗各根系长度等级的根系分枝数差异不显著(1.01~1.50 cm长度等级的根系分枝数除外),但均与DE培养基中根系分枝数存在显著差异;接种菌根真菌50 d后,1/8DE培养基中0.51~1.50 cm长度等级樱桃组培苗的根系分枝数显著高于其他培养基处理组,接种菌根真菌60 d后4个长度等级樱桃组培苗的根系分枝数间差异显著。说明1/8DE培养基更有利于樱桃组培苗根系与菌根真菌共生生长。
2. 3 接种菌根真菌对樱桃组培苗株高的影响
由表2可知,培养基DE和1/2DE中的樱桃组培苗在接种菌根真菌后30和50 d全部死亡,株高为0;培养基1/4DE和1/8DE中的樱桃组培苗在接种菌根真菌后30~40 d,株高差异不显著,但显著高于培养基DE和1/2DE中樱桃组培苗的株高;在接种菌根真菌后50~60 d,1/8DE培养基中樱桃组培苗的株高分别比1/4DE培养基中樱桃组培苗显著提高10.4%和11.1%。说明1/8DE培养基利于菌根真菌与根系建立共生组织,促进樱桃组培苗生长。
2. 4 接种菌根真菌对樱桃组培苗叶片酶活性的影响
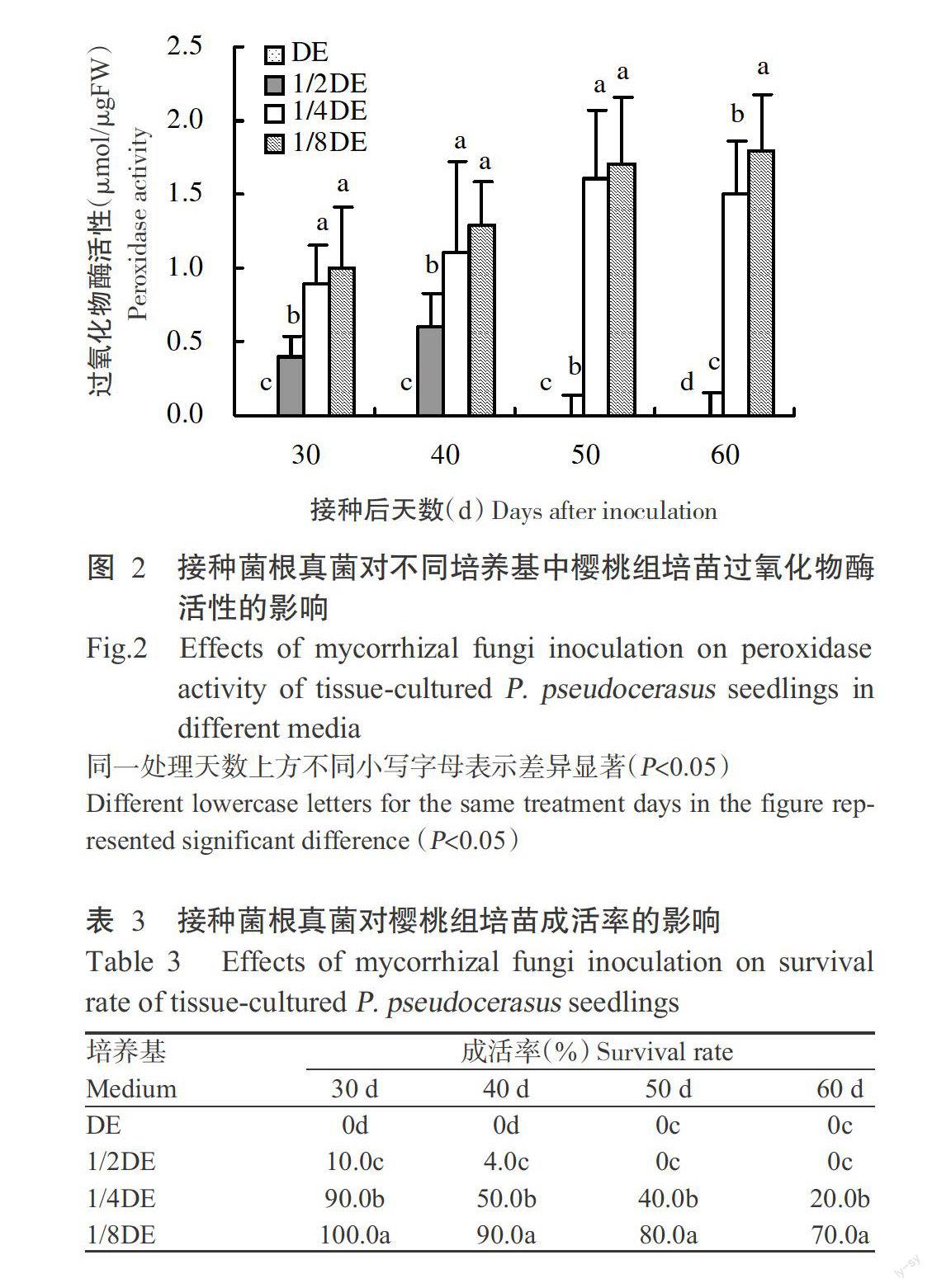
从图2可看出,培养基DE、1/2DE、1/4DE和1/8DE中的樱桃组培苗在接种菌根真菌30和60 d后其叶片过氧化物酶活性分别为0、0.4、0.9、1.0 μmol/μgFW和0、0、1.5、1.8 μmol/μgFW。其中,接种菌根真菌后培养基1/4DE和1/8DE中樱桃组培苗叶片的过氧化物酶活性均显著高于培养基DE和1/2DE中的樱桃组培苗;培养基1/8DE中樱桃组培苗叶片的过氧化物酶活性始终高于1/4DE培养基,但仅在接种菌根真菌60 d后存在显著差异。说明1/8DE培养基较适宜樱桃苗与菌根真菌共生,有利于提高樱桃组培苗的抗性。
2. 5 接种菌根真菌对樱桃组培苗成活率的影响
从表3可看出,接种菌根真菌后30~60 d,培养基DE中樱桃组培苗的成活率均为0;接种后30 d,培养基1/2DE、1/4DE和1/8DE中樱桃组培苗的成活率分别为10.0%、90.0%和100.0%;随着接种时间的延长,樱桃组培苗的成活率逐渐下降,至接种后50 d,培养基1/2DE、1/4DE和1/8DE中樱桃组培苗的成活率分别降至0、40.0%和80.0%;至接种后60 d,培养基1/8DE中樱桃组培苗的成活率仍高达70.0%,为1/4DE组培苗成活率(20.0%)的3.5倍。说明1/8DE培养基能为樱桃组培苗生长提供有利环境,提高成活率。
3 讨论
Harrier和Watson(2004)研究认为,不同菌根真菌分离体与不同植物品种间的容纳性存在差异,植物品种接种菌根真菌时应选择对菌根共生利益最优的菌根真菌分离体,本研究结果与其一致,选用培养基为DE和1/2DE的樱桃组培苗接种菌根真菌,组培苗分别在接种30和50 d后全部死亡,可能是培养基DE和1/2DE的營养较丰富,真菌繁殖速率较高,培养基表面被菌丝完全遮蔽造成培养基中溶解氧减少导致根系逐渐腐烂的缘故,而选用培养基为1/4DE和1/8DE的樱桃组培苗接种菌根真菌,接种后60 d成活率仍分别达20.0%和70.0%。
本研究结果表明,培养基为1/4DE和1/8DE的樱桃组培苗接种菌根真菌后根系的分枝数和长度随接种真菌时间的延长逐渐大于培养基DE和1/2DE,说明所选用的菌根真菌能与樱桃组培苗根系形成良好的共生体系,为菌根真菌的功能发挥提供了前提条件,与Berta等(1993)研究获得的菌根真菌在根系上侵染成功后能在时间、空间、数量及结构方面改变根系形态的结论相似,也与Hooker等(1995)对辣椒的研究结果一致。接种菌根真菌促进了樱桃组培苗根系长度和分枝数增加,提高了菌根化樱桃组培苗根系对养分的吸收能力,进而促进株高增加,与金辉等(2009)研究认为铁皮石斛组培苗与菌根真菌共培养可提高铁皮石斛根系对养分的吸收能力、促进幼苗生长的结论一致。李海燕等(2003)研究发现,AM真菌侵染寄主根系能激发寄主的防御反应,提高其过氧化物酶、苯丙氨酸解氨酶、β-1,3葡聚糖酶及几丁质酶等与抗病性有关的酶系的活性,进而使寄主植物对病虫害的再次进攻产生快速反应,提高抗病虫能力,本研究结果与其相似,菌根真菌与樱桃组培苗共生培养后,菌根化樱桃组培苗叶片的过氧化物酶活性明显高于无菌根樱桃组培苗,成活率显著升高。
在组培苗培养过程中接种菌剂使其根系菌根化,实际上是组培苗、菌根真菌和培养基间复杂的相互反应结果。因此,所选用的培养基应适当降低其营养元素含量(但能保证组培苗对养分的最低需求),以避免或抑制真菌过快繁殖,本研究中,1/8DE能为樱桃组培苗与菌根真菌形成共生体系提供较理想的场所,促进樱桃组培苗生长发育。
4 结论
在组培苗培养过程中接种菌剂使其根系菌根化,实际上是组培苗、菌根真菌和培养基间复杂的相互反应结果。1/8DE可作为较适宜菌根真菌与樱桃组培苗建立菌根共生组织的培养基。
参考文献:
程俐陶,刘作易,郭巧生. 2009. 药用植物丛枝菌根研究进展[J]. 中草药,40(1):156-160. [Cheng L T,Liu Z Y,Guo Q S. 2009. Advances in research on the mycorrhizal fungi of medicinal plants[J]. Chinese Medicinal Herb,40(1):156-160.]
段元杰,刘海刚,孟富宣,杨玉皎,周军. 2016. 枣树花药组织培养研究进展[J]. 江西农业学报,28(11):47-50. [Duan Y J,Liu H G,Meng F X,Yang Y J,Zhou J. 2016. Research progress in tissue culture of Chinese jujube anther[J]. Acta Agriculturae Jiangxi,28(11):47-50.]
侯东梅. 2016. 新植大樱桃死亡率高的原因及对策[J]. 山西果树,(1):28-29. [Hou D M. 2016. Reason and countermeasure of high mortality of new planted cherry[J]. Shanxi Fruits,(1):28-29.]
贾东贝,杨涛,肇莹,马晓颖,李冰宇. 2011. 2株越橘菌根培养条件的研究[J]. 江苏农业科学,39(2):466-468. [Jia D B,Yang T,Zhao Y,Ma X Y,Li B Y. 2011. Research of two cowberry mycorrhizal culture[J]. Jiangsu Agriculture Science,39(2):466-468.]
金辉,许忠祥,陈金花,韩素芬,葛颂,罗毅波. 2009. 铁皮石斛组培苗与菌根真菌共培养过程中的相互作用[J]. 植物生态学报,33(3):433-441. [Jin H,Xu Z X,Chen J H,Han S F,Ge S,Luo Y B. 2009. Interaction between tissue-cultured seedlings of dendrobium officinale and mycorrhizal fungus during symbiotic culture[J]. Journal of Plant Ecology,33(3):433-441.]
李海燕,刘润进,李艳杰,束怀瑞,李玉. 2003. AM真菌和胞囊线虫对大豆根内酶活性的影响[J]. 菌物系统,22(4):613-619. [Li H Y,Liu R J,Li Y J,Shu H R,Li Y. 2003. Influence of mycorrhizal fungi Heterodera glycines on enzyme activity on soybean root[J]. Mycosystema,22(4):613-619.]
李景蕻,张丽华. 2015. 药用兰科植物组培苗菌根化技术在种苗生产中的应用[J]. 应用技术,(8):133-134. [Li J H,Zhang L H. 2015. Application of tissue culture and mycorrhizal technology of medicinal orchid plants for seedling production[J]. Application Technology,(8):133-134.]
刘文科,杨其长. 2005. 菌根生物技术在植物组培苗生产中的应用[J]. 农业工程技术:温室园艺,(9):44-45. [Liu W K,Yang Q Z. 2005. Application of mycorrhizal biotechnology in the production of plant tissue culture seedlings[J]. Agriculture Engineering Technology:Greenhouse Horticulture,(9):44-45.]
王德欢,施先锋,张娜,葛米红,李爱成,周谟兵. 2016. 红掌组织培养育苗技术的研究进展[J]. 贵州农业科学,44(10):107-110. [Wang D H,Shi X F,Zhang N,Ge M H,Li A C,Zhou M B. 2016. Research progress in tissue culture seedling-raising technique of Anthurium andraeanum[J]. Guizhou Agricultural Sciences,44(10):107-110.]
王晓国,卢家仕,周主贵,李秀玲,陈廷速,卜朝阳. 2016. 带叶兜兰菌根真菌分离和初步鉴定[J]. 西南农业学报,29(2):316-320. [Wang X G,Lu J S,Zhou Z G,Li X L,Chen T S,Bu C Y. 2016. Isolation and preliminary identification of mycorrhizal fungi from Paphiopedilum hirsutissimun(Orchidaceae)[J]. Southwest China Journal of Agricultural Sciences,29(2):316-320.]
伍荣冬,韦金凡,龙艳艳,雷崇华,谭裕模,李廷化,陈廷速. 2016. 丛枝菌根真菌对宿根蔗生长的影响[J]. 西南农业学报,29(11):2648-2652. [Wu R D,Wei J F,Long Y Y,Lei C H,Tan Y M,Li T H,Chen T S. 2016. Effect of inoculation of arbuscular mycorrhizal fungi on ratoon sugarcane grown in field[J]. Southwest China Journal of Agricultural Sciences,29(11):2648-2652.]
张金莲,黄振瑞,车江旅,谭裕模,王维赞,李冬萍,龙艳艳,卢文祥,李松,陈廷速. 2015. AM菌剂对大田甘蔗根际土壤AM真菌种群影響[J]. 西南农业学报,28(1):269-273. [Zhang J L,Huang Z R,Che J L,Tan Y M,Wang W Z,Li D P,Long Y Y,Lu W X,Li S,Chen T S. 2015. Effcet of arbuscular mycorrhizal(AM) inoculum application on sugar-
cane rhizosphere AM fungi communities[J]. Southwest China Journal of Agricultural Sciences,28(1):269-273.]
Barber J M. 1980. Catalase and peroxidase in primary leaves during development and senescence[J]. Zeitschrift für Pf-
lanzenphysiologie,97(2):135-144.
Berta G,Fusconi A,Trotta A. 1993. VA mycorrhizal infection and the morphology and function of root system[J]. Environmental & Experimental Botany,33(1):159-173.
Dijke E,Eck N D. 1995. Effects of mycorrhizal fungi on in vitro nitrogen response of some Dutch indigenous orchid species[J]. Canada Journal of Botany,73(8):1203-1211.
Harrier L A,Watson C A. 2004. The potential role of arbuscular mycorrhizal fungi in the bioprotection of plants against soil-borne pathogens in organic and/or other sustainable farming systems[J]. Pest Management Science,60(2):149-157.
Hooker J E,Black K E,Pery R L,Atkinson D. 1995. Arbuscular mycorrhizal induced alteration to root longevity of poplar[J]. Plant Soil,172(2):327-329.
Koske R E,Gemma J N. 1989. A modified procedure for staining roots to detect VA mycorrhizae[J]. Mycological Research,92(4):486-505.
Schellenbaum L,Tisserant B,Berta G,Ravolanirina F,Gianinazzi S,Fitter A H. 1991. Influence of endomycorrhizal infection on root morphology in a micropropagated woody plant species[J]. Annals Botony,68(2):135-141.
Smith S E,Read D J. 1997. Mycorrhizal Symbiosis[M]. New York:Academic Press.
(责任编辑 思利华)
