马铃薯悬浮细胞对温度胁迫的生理响应机制
2017-05-30余斌黄锐南运有孔娜娜党仁美拜占玲刘娟
余斌 黄锐 南运有 孔娜娜 党仁美 拜占玲 刘娟

摘要:选择马铃薯品种大西洋和甘农薯5号的悬浮细胞为研究对象,通过分析其在5 ℃、20 ℃及40 ℃环境下的细胞相对生长量、质膜离子渗漏率、细胞活力值、渗透调节物质质量分数、光合系统ⅡFv/Fm来阐明马铃薯在温度胁迫下的生理适应机制。结果表明,不同马铃薯品种对温度胁迫的适应性不同,环境温度为5 ℃时马铃薯悬浮细胞的生长状态最好。
关键词:马铃薯;悬浮细胞;温度胁迫
中图分类号:S532 文献标志码:A 文章编号:1001-1463(2017)07-0015-05
doi:10.3969/j.issn.1001-1463.2017.07.006
Abstract:The suspension cell of Atlantic and Gannong 5 cultivars are selected as the research object. Through the analysis in the 5 ℃ and 20 ℃ and 40 ℃ under the environment of relative cell growth, plasma membrane ion leakage rate, cell viability, osmolyte concentration, photosystem II Fv/Fm, To elucidate the physiological adaptation mechanism of potato under temperature stress. The result showed different potato cultivars had significantly different adjustment to temperature stress. The suspension cell of potato grew best when the temperature reached 5 ℃.
Key words:Potato;Suspension cell;Temperature stress
植物在生長发育过程中会受到各种不利的生物和非生物因子的影响,如高温、低温[1 - 2 ]、 干 旱[3 ]、高盐[4 ]、病虫侵害等。温度作为一种重要的非生物因素,对植物的生长发育有重要影响。每种植物的生长发育都有特定的温度需求。马铃薯是世界第四大栽培作物[5 ],对温度较为敏感,是一种喜冷凉怕热的作物,其发育最适温度是13~18 ℃。当温度达到30 ℃左右时植株生长就会受到影响,呼吸作用旺盛,光合作用降低,同时蒸腾作用加强;当温度低于-2~-1 ℃时,就会受冻,低于-4 ℃植株就会死亡。近年来世界气候异常现象频繁出现,极端气候事件对农业经济和生态环境造成极大危害[6 ]。我国农业设施环境简陋,控温能力不强,再加上近年来国际、国内碳排放量问题严重,加剧气温变化。温度胁迫在今后很长一个时期内仍然会成为威胁我国农业生产的一个重要因素。据保守估计,我国马铃薯因高温干旱及低温霜冻灾害年损失率高达25% 以上[7 ]。因此,研究并增强马铃薯自身对温度胁迫的抵抗能力对稳定我国的粮食生产安全具有重要作用。
面对上述严峻的形势,近年来在农业生产上,有关植物对逆境响应机制的研究在生命科学领域的位置越来越突出[8 ],其中温度胁迫对作物生长的研究也备受关注,而利用细胞学方法可以在不同生理条件和环境因素下,对细胞形态、生长速度、活力、功能及相互作用进行系统研究,从而为温度胁迫下植物的细胞功能调控机制、植物响应胁迫的机理研究提供新的突破口。
马铃薯是怕霜冻、忌炎热的温度敏感型作物,研究马铃薯悬浮细胞在极温逆境下的生理适应机制,对科学地解释马铃薯对极端环境的适应机制有非常重要的意义,可为生产实践中降低高、低温胁迫对马铃薯的伤害而提高产量提供理论依据。
1 材料与方法
1.1 供试材料
大西洋(Atlantic)、甘农薯5号2个马铃薯品种的脱毒试管苗。
1.2 实验方法
1.2.1 制备马铃薯悬浮细胞 将大西洋、甘农薯5号2个马铃薯品种的脱毒试管苗叶片切口后,接在脱分化培养基(MS+2,4-D 2.5 mg/L+KT 0.8 mg/L+LH 0.7 g/L + 3%蔗糖,pH 5.8)上,28 d后将诱导出的愈伤组织转至愈伤继代培养基(MS+ 2,4-D 2.0 mg/L+ NAA 1.0 mg/L +YE 200 mg/L + 天门冬素100 mg/L + 3%蔗糖,pH 5.8)培养,每隔21 d继代一次,共继代3次,培养在20 ℃黑暗培养箱中进行。以继代培养后的愈伤组织作为悬浮细胞培养的起始材料,用镊子把愈伤组织夹碎后置于含20 mL液体培养基的l00 mL三角瓶内。组成液体培养基(MS+2,4-D 2.0 mg/L+NAA 1.0 mg/L+ CH 250 mg/L+3%蔗糖,pH 5.8)。三角瓶置于旋转式摇床中。在120 r/min,20 ℃,黑暗下培养。每5 d继代1次。
1.2.2 胁迫处理 悬浮细胞经过35 d的继代悬浮培养后,分别放置在20 ℃、5 ℃和40 ℃培养箱(光周期为光照16 h、暗培养8 h,培养瓶表面光强50 mmoL/m2·s )中,悬浮培养15 d后进行各项生理指标测定。
1.2.3 相对生长量测定 采用称量法。悬浮细胞经过35 d的继代悬浮培养后,接种到新培养基(称重W1)上,称重培养基与悬浮细胞总重(W1+2),进行胁迫处理(方法同上)15 d后,再次称重处理后的培养基与悬浮细胞的总重(W′1+2),将处理后的悬浮细胞转移到新的培养基,对处理后的培养基也进行称重(W′)。相对生长量的计算公式为:(W′1+2- W′)-(W1+2 - W1)。
1.2.4 相对电导率的测定 相对电导率反映了离子渗漏情况,应用Rapacz [9 ]方法测定电导率。取处理后的悬浮细胞0.25 g,加5 mL去离子水,测定电导率(Ct)。为测定100%电解质泄漏率,最后一次测定后将测试管加盖煮沸20 min,冷却后测定杀死样电导率(Ck)。相对电导率(RCt)按Tsarouhas[10 ] 的公式计算:RCt =(Ct / Ck)×100。
1.2.5 细胞TTC还原能力测定 根据Ishikawa[11 ]的TTC还原法测定。取处理后的悬浮细胞0.5 g置1小瓶,加3 mL的0.08%TTC溶液(用50 mmol/L,pH 7.5的磷酸钠缓冲液配制),加盖置黑暗静置24 h后,吸去TTC溶液,收集样品,用蒸馏水清洗3次。吸去水溶液,加3 mL 95%的乙醇上盖,置60 ℃恒温箱10 min。冷却后摇匀,于酶标仪上测OD485,以处理前的样品作为对照,以光密度值的大小表示细胞活力。
1.2.6 游离脯氨酸质量分数测定 采用酸性茚三酮法[12 ]。取处理后的悬浮细胞材料0.5 g用液氮研磨至粉末状,加入3%磺基水杨酸研磨提取,离心(20 000 r,5 min),上清液加入冰醋酸和茚三酮试剂,沸水浴中加热10 min。提取液中加入4 mL甲苯,混匀,静置后取甲苯层,用紫外可见分光光度仪测定OD520。
1.2.7 光合系统ⅡFv/Fm的测定 将处理后的悬浮细胞置于暗处适应15 min以上,待细胞完全暗适应后用便携式叶绿素荧光分析仪PAM2100进行测定。
2 结果与分析
2.1 温度胁迫处理下马铃薯悬浮细胞相对生长量的变化
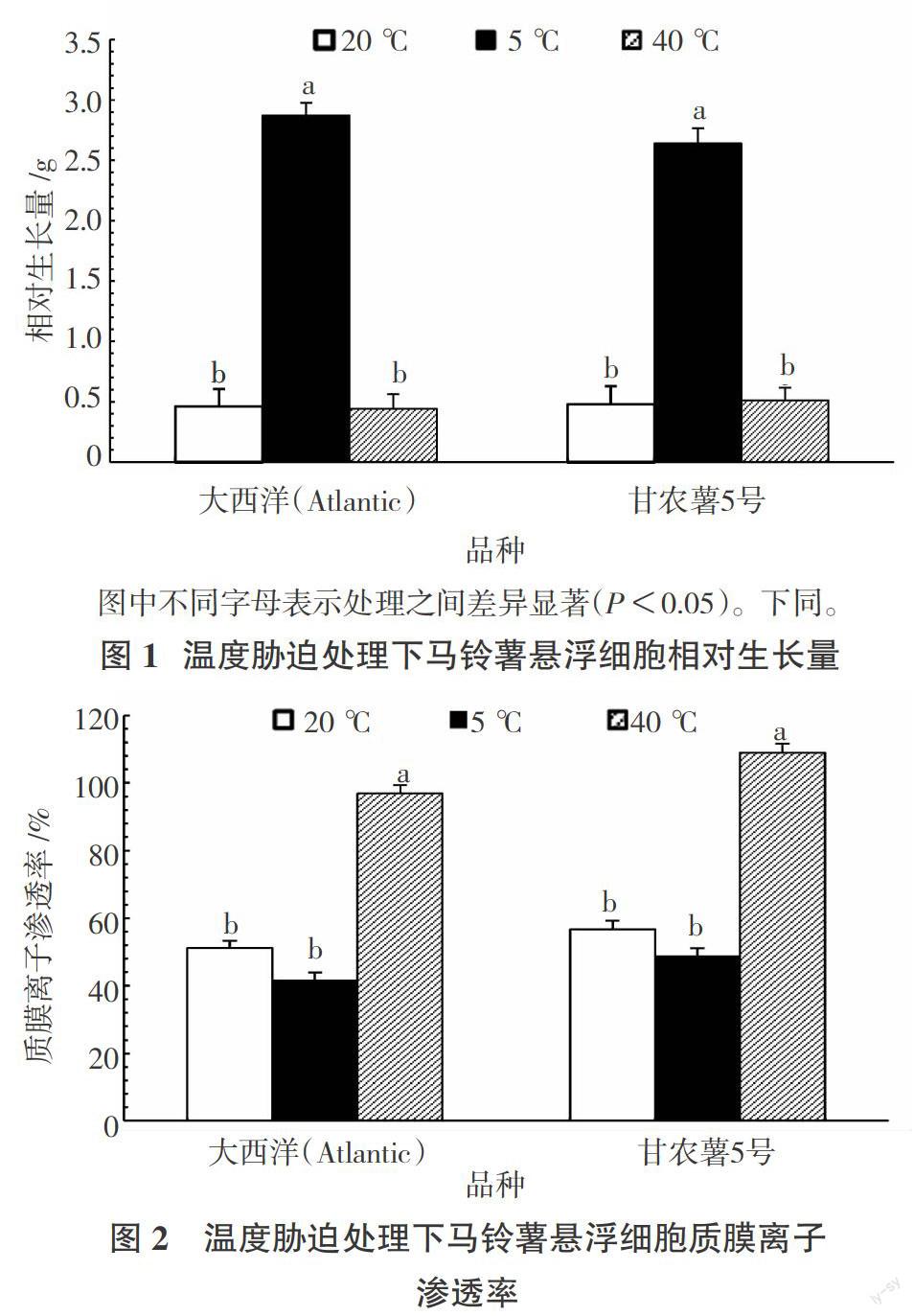
为测定5 ℃低温胁迫及40 ℃高温胁迫对马铃薯悬浮细胞生长的影响,将经过继代培养的悬浮细胞,接种0.05 g进行胁迫处理15 d后,通过称量法测定处理后的相对生长量。结果表明:5 ℃低温环境下,2个马铃薯品种的悬浮细胞的生长量显著高于20 ℃常温与40 ℃高温。20 ℃常温与40 ℃高温环境下的馬铃薯悬浮细胞生长量无显著差异。3个温度条件下,2个马铃薯品种之间悬浮细胞生长量无显著差异。表明5 ℃的低温更加适合马铃薯悬浮细胞生长(图1)。
2.2 温度胁迫处理对马铃薯质膜离子渗漏率的影响
植物在遭受低温或高温胁迫时,质膜的结构被破损,导致细胞原生质内含物外渗、离子渗漏,并引发很多生理功能丧失。通过电导率法来测定所得的质膜离子渗透率已广泛用于植物抗冻、抗热性评价的生理指标。如图2所示,2个品种的马铃薯悬浮细胞在20 ℃及40 ℃高温环境下的质膜离子渗透率都高于5 ℃,且40 ℃环境下马铃薯悬浮细胞的质膜离子渗漏率显著高于5 ℃、20 ℃,说明马铃薯细胞膜在高温环境下伤害较为严重。大西洋(Atlantic)在40 ℃和20 ℃环境下质膜离子渗漏率均低于甘农薯5号,说明其在高温胁迫下具有更好的适应性。
2.3 温度胁迫处理对马铃薯悬浮细胞活力的影响
细胞活力即在细胞群体中活细胞占总细胞数的百分比。利用TTC还原法测定的细胞活力值,可直接表明细胞活力。如图3所示,5 ℃下2个马铃薯悬浮细胞活力值均为最高;其次为20 ℃;在40 ℃高温下2个马铃薯悬浮细胞活力值均处于较低水平,由此可见,在5 ℃低温环境下马铃薯悬浮细胞活力最强,在40 ℃高温时细胞膜的完整性受到破坏,细胞活力受到影响。大西洋(Atlantic)在5 ℃、20 ℃和40 ℃环境下悬浮细胞活力均高于甘农薯5号。
2.4 温度胁迫处理下马铃薯悬浮细胞游离脯氨酸质量分数的变化
在正常条件下,植物游离脯氨酸含量很低,但遇干旱、低温等逆境时,游离脯氨酸便会大量积累,主要是在逆境中对植物起到保护作用,因此脯氨酸可作为植物抗逆性的一项生化指标。通过检测马铃薯悬浮细胞游离脯氨酸质量分数的变化发现(图4),在5 ℃低温处理下马铃薯悬浮细胞中的游离脯氨酸质量分数显著高于20 ℃和40 ℃环境中的游离脯氨酸,40 ℃高温处理与20 ℃的测定值基本相等。在20 ℃和40 ℃环境中,大西洋(Atlantic)和甘农薯5号的游离脯氨酸质量分数无显著差别,在5℃环境下,大西洋(Atlantic)悬浮细胞中的游离脯氨酸质量分数显著高于甘农薯5号,说明大西洋(Atlantic)较甘农薯5号在5 ℃环境下具有更强的低温保护性。
2.5 温度胁迫处理下马铃薯悬浮细胞光合系统ⅡFv/Fm值的变化
原初光能转化率效(Fv/Fm)反映了光合系统Ⅱ的光能转化效率,所以光合系统ⅡFv/Fm值的变化可用来表示细胞在逆境胁迫下的适应机制。从图5可以看出,大西洋(Atlantic)和甘农薯5号在5℃低温处理下的光合效能较20 ℃增高,但变化不显著,而40℃高温胁迫下光合效能显著下降。说明低温对光合系统Ⅱ影响较低,细胞能维持稳定的光合效率,对低温有较强的适应性;而高温胁迫破坏了光合系统Ⅱ,阻碍了光能转化的进行。在不同温度下大西洋(Atlantic)较甘农薯5号光合效率均高,说明大西洋(Atlantic)吸收光能的能力强。
3 结果与讨论
本研究通过对马铃薯普通栽培品种大西洋和甘农薯5号的悬浮细胞在5 ℃、20 ℃及40 ℃条件下进行处理,分析其细胞的相对生长量、质膜离子渗漏率、细胞活力值。发现不同马铃薯品种对温度胁迫的适应性不同,大西洋(Atlantic)悬浮细胞的相对生长量、细胞活力值均高于甘农薯5号,而质膜离子渗透率低于甘农薯5号。在不同温度下,5 ℃条件下2个品种马铃薯的悬浮细胞相对生长量、细胞活力值均高于20 ℃及40 ℃,质膜离子渗透率低于20 ℃及40 ℃。5 ℃条件更适合马铃薯悬浮细胞的生长,40 ℃使得细胞结构发生变化并出现损伤现象,悬浮细胞生长受到影响。目前,对植物在温度胁迫下的响应机制的研究探讨多集中在形态学、生理生化以及分子生物学等方面。自发现植物的解剖结构与其耐盐性密切相关,植物细胞具有与之相适应的超微结构以来,很长一段时间内细胞学研究植物抗逆方法大多以对细胞微观结构的观察为主,期间陆续出现不同逆境胁迫对小麦[13 ]、玉米[14 ]、大豆[15 ]、番茄[16 ]、烟 草[17 ]等多种植物叶肉细胞超微结构影响的研究,表明所有植物细胞在逆境情况下均会影响细胞的相对生长量、破坏膜结构导致大量的原生质内含物和离子外渗、细胞活力值降低。
在植物细胞对温度胁迫的生理响应机制方面,王海燕等[18 ]发现低温胁迫可使发菜悬浮细胞的光合作用受到伤害。本研究中,马铃薯悬浮细胞在5 ℃时光合作用比20 ℃及40 ℃条件下高,在5 ℃大细胞的适应能力更强,经过一段时间的低温适应,细胞能维持稳定的光合效率。马铃薯品种大西洋(Atlantic)比甘农薯5号适应性更好。徐胜 等[19 ]发现,植物在高温胁迫下,由于体内活性氧代谢失调和自由基的积累,渗透调节物质大量积累,植物的抗逆性增强。本研究中,在温度胁迫时,不同品种马铃薯悬浮细胞的渗透调节物质游离脯氨酸质量分数都增高,大西洋(Atlantic)悬浮细胞在5 ℃时比甘农薯5号显著增高,马铃薯悬浮细胞的调节物质的积累使其细胞能够调控自身的物质,以避免温度胁迫对其细胞结构和身体机能带来严重的伤害。大西洋(Atlantic)悬浮细胞在5 ℃游离脯氨酸质量分数高,其对逆境的调控能力强,大大降低了胁迫所引起的伤害。
参考文献:
[1] 任彩虹,闫桂琴,郜 刚,等. 高温胁迫对马铃薯幼苗叶片生理效应的影响[J]. 中国马铃薯,2007,21(1):5-10.
[2] 杨超英,王 芳,王 舰. 低温驯化对马铃薯半致死温度的影响[J]. 江苏农业科学,2014,42(4):80-81;87.
[3] 孙梅霞,祖朝龙,徐经年. 干旱对植物影响的研究进展[J]. 安徽农业科学,2004,32(2):365-367
[4] 方先文,张所兵,王艳平,等. 高盐浓度处理对水稻苗期生长的影响[J]. 江苏农业科学,2011,39(3):69-71.
[5] 罗其友,刘 洋,高明杰,等. 中国马铃薯产业现状与前景[J]. 农业展望,2015(3):35-40.
[6] 关明阳. 世界马铃薯的生产现状及展望[J]. 中国马铃薯,1993,7(2):126-128.
[7] 谢开云,屈冬玉,金黎平,等. 中国马铃薯生产力与世界先进国家的比较[J]. 世界农业, 2008(5):35-38.
[8] 张亚军,王丽学,陈 超,等. 植物对逆境的响应机制研究进展[J]. 江西农业学报,2011,23(9):60-65.
[9] RAPACZ M. Frost resistance and cold acclimation abilities of spring-type oilseed rape[J]. Plant Science,1999,147(1):55-64.
[10] TSAROUHAS V, KENNEY W A, ZSUFA L Z. Application of two electrical methods for the rapid assessment of freezing resistance in Salixeriocephala[J]. Biomass and Bioenergy,2000,19(3):165-175.
[11] ISHIKAWA E, BAE S K,MIYAWAKI O,et al. Freezing injury of cultured rice cells analyzed by dielectric measurement[J]. Jounral of Fermentation and Bioengineering,1997,83(3):222-226.
[12] 郝建軍,康宗利,于 洋,等. 植物生理学实验技术[M]. 北京:化学工业出版社,2006.
[13] 王 静,续惠云. 水分胁迫对春小麦苗期叶肉细胞和气孔数的影响[J]. 西北植物学报,2000,20(5):842-846.
[14] 魏和平,德容千. 淹水对玉米叶片细胞超微结构的影响[J]. 植物学报:英文版,2000,42(8):811-817.
[15] 章 艺,刘 鹏,史 锋,等. 过量Fe2+对大豆叶肉细胞超微结构的影响[J]. 植物营养与肥料学报,2005,11(1):87-91.
[16] 王冬梅,许向阳,李景富,等. 热胁迫对番茄叶肉细胞叶绿体超微结构的影响[J]. 园艺学报2004,31(6):820-821.
[17] 王程栋,王树声,胡庆辉. 干旱胁迫对烤烟叶肉细胞超微结构的影响[J]. 中国农学通报,2012,28(7):104-108.
[18] 王海燕,贡保东珠,李雨遥,等. 发菜悬浮细胞对低温胁迫的生理响应机制[J]. 兰州大学学报,2011,47(2):77-82.
[19] 徐 胜,何兴元,陈 玮,等. 热锻炼对高羊茅和多年生黑麦草抗高温能力的影响[J]. 生态学报,2008,28(1):162-171.
(本文责编:陈 珩)
