玉米种子萌发响应淹水胁迫的定量蛋白质组学研究
2017-05-30张玮阮龙张欣左晓龙
张玮 阮龙 张欣 左晓龙

摘要[目的]从蛋白质组水平上研究淹水胁迫对玉米种子萌发的影响,筛选重要蛋白质,阐明相关的代谢通路,为深入研究植物种子萌发过程中的耐淹机制提供新的思路。[方法]以玉米自交系196为试验材料,对种子萌发进行淹水胁迫72 h处理,利用TMT标记结合LC-MS/MS的定量蛋白质组学技术对蛋白质组成进行分析,对差异表达的蛋白质进行鉴定及功能分析。[结果]此次试验总共鉴定到1 456个蛋白,通过比较、筛选,鉴定到281个差异蛋白,其中244个上调蛋白,37个下调蛋白。通过对差异表达的蛋白质进行了GO功能富集分析和KEGG通路富集分析,发现这些差异蛋白大多参与了碳代谢、糖酵解过程、氨基酸代谢、抗逆与胁迫等过程。[结论]试验表明淹水胁迫抑制了玉米种子的萌发,通过不同代谢类型的动态变化和不同的信号转导来提高种子耐受性。
关键词玉米;定量蛋白质组学;淹水胁迫
中图分类号S513文献标识码A文章编号0517-6611(2017)09-0134-03
Study on Quantitative Proteomics of Maize Seed Germination in Response to Waterlogging Stress
ZHANG Wei1,RUAN Long1,ZHANG Xin2,ZUO Xiaolong1*
(1.Tobacco Research Institute,Anhui Academy of Agricultural Sciences,Hefei,Anhui 230031;2.School of Life Sciences,Anhui Agricultural University,Hefei,Anhui 230036)
Abstract[Objective] To study the effects of waterlogging stress on maize seed germination from the level of proteome, screen important proteins and elucidate the related metabolic pathways,which provide new ideas for further study of flooding mechanism during seed germination.[Method]We chose maize inbred lines 196 as experimental materials to study the seeds germination under water stress for 72 hours.The protein composition was analyzed by TMT-labeled LC-MS/MS quantitative proteomics techniques.The differentially expressed proteins were analyzed by identification and functional analysis.[Result]A total of 1 456 proteins were identified in this trial.By comparison,we identified 281 differential proteins,of which 244 were upregulated proteins and 37 downregulated proteins.Through GO analysis and KEGG pathway analysis,we found those differential proteins were involved in the process of carbon metabolism,glycolysis,amino acid metabolism and stress resistance.[Conclusion]The experiment shows that waterlogging stress inhibits the germination of maize seed,and the seeds improve tolerance by dynamic changes of different metabolic types and different signal transduction.
Key wordsMaize;Quantitative proteomics;Waterlogging stress
我國黃淮海地区是夏玉米生产的重要区域[1],这一区域的玉米种子在播种出苗过程中,刚好处于高湿、多雨季节。种子萌发是植物个体发育过程中最关键的时期,处于萌发时期的玉米种子对水分需求十分敏感,土壤水分过饱和会影响玉米种子的正常发育,使玉米种子的萌发受到抑制[2]。研究表明,种子在萌发时期长期处于逆境条件下,其生理、生化、遗传和代谢等指标会发生复杂的变化[3]。目前,有关玉米种子萌发抗逆的研究多集中在盐胁迫[4]、水分胁迫[5]、外源激素调控[6]、真菌感染[7]、冷胁迫[8]、重金属胁迫[9]等方面。而针对涝渍胁迫下种子萌发的蛋白响应机制研究少见报道。揭示玉米种子对涝渍胁迫的响应机制,可以为玉米耐涝性的研究和耐涝种质的创制提供理论依据。
目前,质谱技术已逐渐成为蛋白质组学研究的主流技术。随着蛋白质组学研究的不断深入,定量蛋白质组学已成为蛋白质组学研究的热点之一。定量蛋白质组学主要是针对不同状态下蛋白质的表达量进行分析比较,既可以鉴定出表达的蛋白质,又能对其丰度进行精确定量。TMT是目前定量蛋白质组学最为常用的体外化学标记法之一。它是一种串联质量标签,可以与位于肽段N末端和氨基酸侧链的氨基特异性结合。TMT标记最大的一个优势就是标记效率高,可以同时对多达10个样品进行分析,有效节省了质谱分析所用的时间和成本。该研究利用玉米自交系196为材料,采用TMT标记定量蛋白质组学技术,以期能检测种子在涝渍过程中一些重要蛋白质的表达模式,了解其功能,继而揭示其在蛋白质组水平上的响应机制。
1材料与方法
1.1供试材料
以玉米自交系196为供试材料,由安徽省农业科学院烟草研究所供种。
1.2玉米种子萌发培养
选取大小一致且无破损的玉米种子,用10%次氯酸钠消毒10 min,蒸馏水冲洗干净,再用滤纸吸干表面水分,将种子均匀播于沙盘上,使沙盘完全浸没于水中,置于人工气候箱中25 ℃暗培养,对照组正常条件下萌发。由于对照组在培养40 h后胚根将突破种皮完成萌发,所以将對照的时间点选在胚根即将突破种皮之前。处理组在淹水处理72 h后从沙中取出,剥胚进行后续试验。
1.3玉米种子定量蛋白质组学分析
1.3.1玉米胚的总蛋白提取。参照三氯乙酸(TCA)/丙酮法提取玉米种子胚中的蛋白质。具体操作步骤:称取0.5 g玉米胚在液氮下研磨,而后加入1.5 mL预冷的TCA-2ME-丙酮溶液,旋涡振荡1 min,混匀后置于-20 ℃1 h,10 000 r/min、4 ℃离心10 min,弃上清,加入1.5 mL预冷的2ME-丙酮溶液悬浮沉淀,以去除TCA,置于-20 ℃1 h,10 000 r/min、4 ℃离心15 min,弃上清,重复1次。将蛋白粉末在室温下挥干后于8 mol/L尿素中室温复溶。
1.3.2胰蛋白酶水解和TMT标记蛋白质定量。
复溶的蛋白浓度用BCA(Solarbio,Beijing)法测定。每个样品取100 μg蛋白,用二硫苏糖醇还原和碘乙酰胺烷基化后,再用胰蛋白酶(Promega,Fitchburg)37 ℃酶解过夜。为了准确定量蛋白,使用Thermo公司的TMT试剂标记酶解后的样品。取15 μL溶解好的TMT试剂加到蛋白溶液中,混匀后室温标记反应1 h,然用5%的羟胺终止反应。用128标记淹水72 h处理后的胚蛋白样品,用130标记对照。终止反应后将标记完的样品进行混合,用Waters公司的Sep-Pak除盐柱除盐,之后样品用HPLC分离肽段。
1.3.3 LC-MS/MS分析及质谱鉴定。
酶解后的产物经TMT标记后上nano-HPLC分离,之后进入Thermo Q Exactive质谱仪中。nano-HPLC的分离条件为流速250 nL/min,时长2 h,流动相A为0.1%的甲酸溶液,流动相B为0.1%的乙腈溶液。所用的分離柱是自制的填充C-18(孔径300 A、粒径5 μm)的石英毛细管柱(直径75 μm,长度150 mm)。一级质谱的扫描在Orbitrap中进行,扫描范围为400~1 800 m/z,分辨率75 000。每个一级质谱后面接着10次数据依赖性的二级质谱扫描。得到的二级谱图利用Proteome Discoverer(1.4)软件在Zea mays数据库中进行搜库分析。Score值小于5一般认为可信度较低。试验结果TMT比值128比130大于1.50,认为这些蛋白是上调蛋白;试验结果TMT比值128比130小于0.67,认为这些蛋白是下调蛋白。玉米蛋白搜库数据库从UniProt上下载。差异蛋白用EasyGO软件进行富集分析。
2结果与分析
2.1淹水胁迫对玉米种子萌发形态的影响
每隔24 h,对淹水处理的种子进行观察。由观察可知,淹水24 h,种子处于快速吸水阶段,对照组和处理组没有明显变化;淹水48 h,对照组的胚根突破种皮,处理组的种子依旧没有变化;淹水72 h,对照组胚根迅速伸长,胚芽长出,而处理组的种子鲜重基本保持不变,生长依旧处于停滞状态,这说明淹水处理能明显抑制种子的萌发。
2.2淹水胁迫下玉米种子蛋白质组分析
试验中,将胚内蛋白酶解成肽段,使用TMT6-128标记淹水处理组肽段,使用TMT6-130标记对照组肽段。将不同试验组的肽段混合在一起,使用LC-MS/MS仪器进行分析。加入标记后,同一条序列肽段的氨基端和赖氨酸上的氨基就带有了TMT标记。经过高能诱导解离,产生了带标记的2种碎片离子,这2种碎片的相对离子强度代表蛋白质中肽段的丰度。
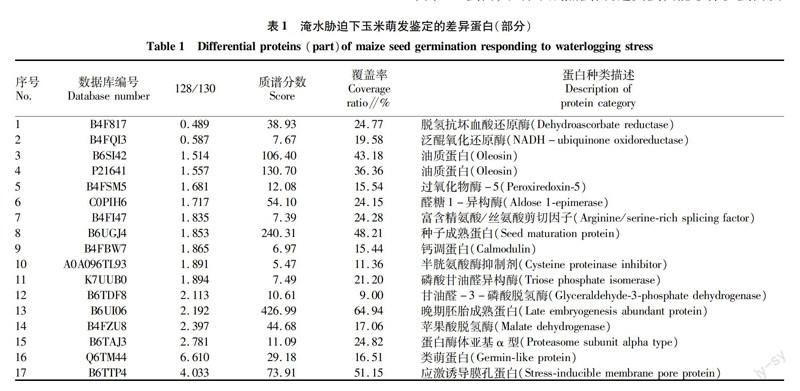
试验总共鉴定到1 456个蛋白,通过筛选、鉴定,发现在淹水处理下,玉米胚内共得到281个差异蛋白,其中244个上调蛋白,37个下调蛋白。
通过对差异蛋白进行GO功能富集分析,从生物过程、细胞组分、分子功能3个方面对所有相应的蛋白数量进行了分类,结果如图1所示。从图1可以看出,按生物过程来分,大部分的蛋白都与代谢过程和细胞过程相关,其次有11%的蛋白是与刺激响应相关的蛋白,这些蛋白可能与淹水胁迫下种子的应激反应有关;按照细胞组分来分类,这些上调蛋白有55%分布于细胞质和细胞的其他部位;按照分子功能来看,39%的蛋白具有结合作用,34%的蛋白是代谢相关的酶类,另外27%的蛋白具有细胞骨架蛋白的功能。
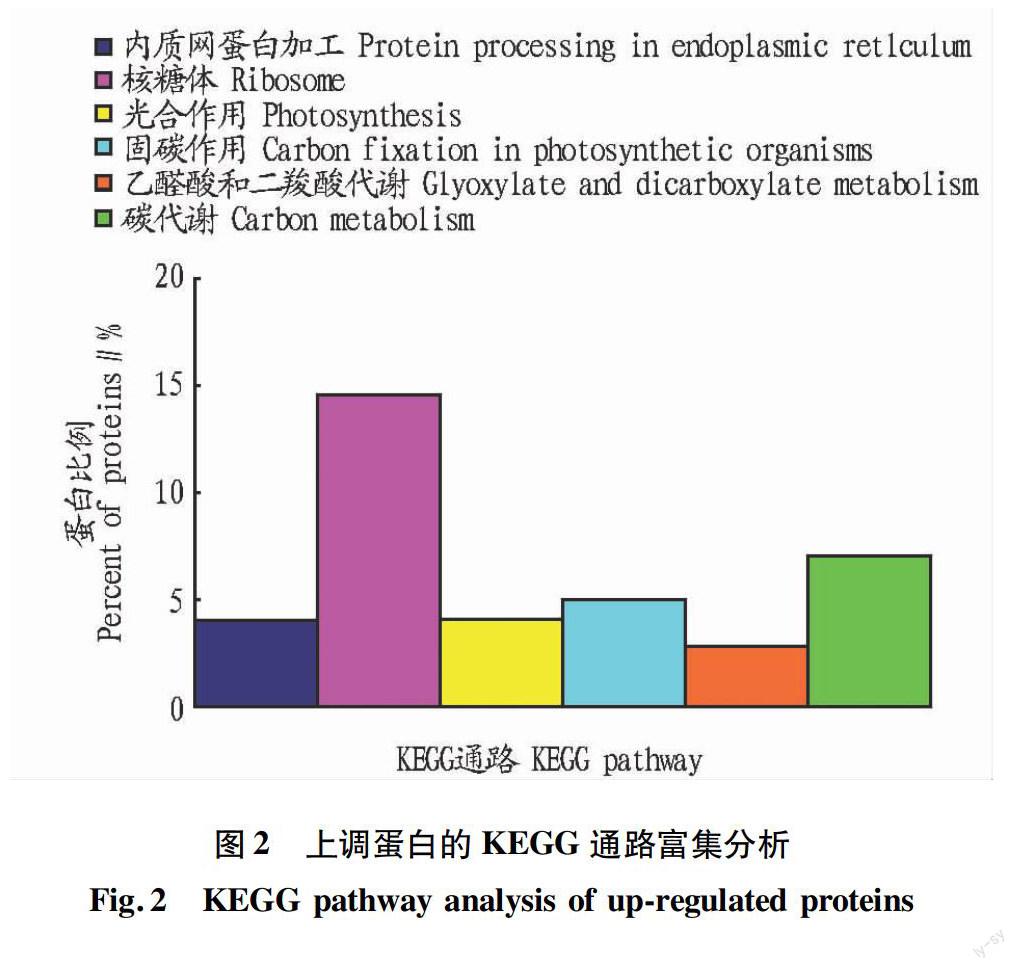
对所鉴定的上调蛋白进行了KEGG Pathway代谢通路富集分析,发现涉及38个KEGG 通路,其中P<0.05的有6个通路(图2),包括核糖体通路、碳代谢通路、糖酵解通路等。研究表明,淹水胁迫影响了玉米萌发的多个生理代谢通路。
通过定量蛋白质组分析,定量了一些鉴定到的差异蛋白(表1)。在淹水胁迫下,萌发种子胚中脱氢抗坏血酸还原酶下调至0.49倍。NADH泛醌氧化还原酶下调了0.59倍。贮藏物相关蛋白均上调,丰度为1.50倍,有的甚至高达9.10倍。糖酵解过程中相关蛋白,例如甘油醛3磷酸脱氢酶表达丰度也累积增加。一些调节脂类的蛋白表达丰度升高,表明脂肪酸的合成可能增强了种子对逆境的适应性。还鉴定到一些热激蛋白,在淹水胁迫下,不同热激蛋白的变化规律并不相同,编号为B4F817的Class I heat shock protein 1发生了下调,降低至0.49倍,另外6个鉴定到的热激蛋白均上调,丰度在1.60倍~4.23倍。
安徽农业科学2017年
3结论与讨论
种子萌发过程中,吸涨水的种子打破休眠并激活了多种代谢活性,包括贮藏物相关蛋白。这些蛋白对环境因素比较敏感,例如淀粉能够为萌发过程中的呼吸和代谢中间物的合成提供碳源[10],是主要能源物质。该研究中,淀粉合酶(K7V1M1,uniprot编号)、油质类蛋白(B6SI42,uniprot编号)表达丰度显著增加。这表明在淹水胁迫下,种子可能加强了淀粉合成途径,从而有利于积累更多的能源。
种子萌发过程需要大量的能量。糖酵解能为萌发过程中的能量供应提供基本的代谢中间物。多个研究表明在植物中过表达甘油醛-3-磷酸脱氢酶基因能提高种子的萌发率[11]。该试验中甘油醛-3-磷酸脱氢酶在淹水处理后丰度增加,可能是由于在淹水条件下,种子萌发处于低氧环境下,只能靠糖酵解途径来增加能量,抵抗逆境。
该试验还鉴定出一类疏水蛋白,即晚期胚胎发生丰富蛋白(LEA蛋白)和种子成熟蛋白。这类蛋白能够保护蛋白质
的结构,维持膜的稳定性,是一种脱水保护剂[12]。这类蛋白对环境变化也比较敏感,可以在营养生长过程中被干旱、盐渍、渗透胁迫、ABA等诱导表达。该试验中,在淹水胁迫下,uniprot编号为B6SGN7的胚胎蛋白和编号为Q6TM44的萌发类蛋白丰度上调表达,这与HUANG等[13]在干旱胁迫下对玉米种子萌发的蛋白质组研究结果一致。另外,热激蛋白是一类受温度或其他逆境诱导而表达的逆境胁迫蛋白。它能防止蛋白质变性,帮助蛋白的正常折叠,使其恢复原有的空间构象和生物活性。该试验还鉴定出一批小分子热激蛋白,在淹水条件下,能夠增加种子的耐受性。
玉米的蛋白质组学研究已经应用于各个领域,但是大部分的蛋白都未能得到有效的鉴定。在该试验中,鉴定出来的蛋白有33%分子功能未知,70%的蛋白KEGG通路未知,这就导致研究方法存在诸多局限性。未来随着蛋白质组学研究的快速发展,期望能够更快更好地完善玉米的蛋白质组数据库,使其在玉米相关研究中的应用越来越广泛。
参考文献
[1]
余卫东,冯利平,盛绍学,等.黄淮地区涝渍胁迫影响夏玉米生长及产量[J].农业工程学报,2014,30(13):127-136.
[2] 陈国平,赵仕孝,杨洪友,等.玉米涝害及其防御措施的研究:I.芽涝对玉米出苗及苗期生长的影响[J].华北农学报,1988,3(2):12-17.
[3] 朱敏,史振声,李凤海.玉米耐涝机理研究进展[J].玉米科学,2015,23(1):122-127,133.
[4] 孟令波.玉米種子萌发的蛋白质组学研究[D].哈尔滨:东北林业大学,2008.
[5] FINCHSAVAGE W E,BLAKE P S,CLAY H A.Desiccation stress in recalcitrant Quercus robur L.seeds results in lipid peroxidation and increased synthesis of jasmonates and abscisic acid[J].J Exp Bot,1996,47(298):661-667.
[6] KOORNNEEF M,VAN EDEN J,HANHART C,et al.Genetic finestructure of the GA1 locus in the higher plant Arabidopsis thaliana[J].Genet Res,1983,41(1):57-68.
[7] SCOTT S J,JONES R A.Quantifying seed germination responses to low temperatures:Variation among Lycopersicon spp.[J].Environ and Exp Bot,1985,25(2):129-137.
[8] RAJJOU L,BELGHAZI M,HUGUET R,et al.Proteomic investigation of the effect of salicylic acid on Arabidopsis seed germination and establishment of early defense mechanisms[J].Plant Physiol,2006,141(3):910-923.
[9] CAMPO S,CARRASCAL M,COCA M,et al.The defense response of germinating maize embryos against fungal infection:A proteomics approach[J].Proteomics,2004,4(2):383-396.
[10] ZEEMAN S C,KOSSMANN J,SMITH A M.Starch:Its metabolism,evolution,and biotechnological modification in plants[J].Annu Rev of Plant Biol,2010,61(1):209-234.
[11] ZHANG X H,RAO X L,SHI H T,et al.Overexpression of a cytosolic glyceraldehyde3phosphate dehydrogenase gene OsGAPC3 confers salt tolerance in rice[J].Plant Cell,Tiss and Organ Cult,2011,107:1-11.
[12] GOYAL K,WALTON L J,TUNNACLIFFE A.LEA proteins prevent protein aggregation due to water stress[J].Biochem J,2005,388:151-157.
[13] HUANG H,MOLLER I M,SONG S Q.Proteomics of desiccation tolerance during development and germination of maize embryos[J].J Proteomics,2012,75(4):1247-1262.
