羽裂报春苣苔的组织培养研究
2017-05-30闫海霞关世凯黄昌艳邓杰玲何荆洲张自斌卜朝阳
闫海霞 关世凯 黄昌艳 邓杰玲 何荆洲 张自斌 卜朝阳


摘 要 以羽裂报春苣苔的叶片为外植体,通过研究不同灭菌方法、不同植物生长调节剂种类和浓度对组织培养的影响,建立了羽裂报春苣苔的组织培养体系。结果表明:羽裂报春苣苔适宜的外植体灭菌方法为采用75%酒精灭菌20 s,无菌水冲洗3次;然后用0.1%升汞灭菌6 min,无菌水冲洗3次;再用0.1%升汞灭菌6 min,无菌水冲洗3次,成活率为55.40%。不定芽的诱导培养基为MS+6-BA 1.0~2.0 mg/L+NAA 0.01~0.10 mg/L,诱导率达100.00%。在适宜的增殖培养基MS+6-BA 2.0 mg/L+NAA 0.05 mg/L+活性炭0.1 g/L上,增殖系数高达8.61;在生根培养基MS+IBA 0.5 mg/L+活性炭0.1 g/L上,生根率达100.00%,生根时間为19.10 d。移栽基质为泥炭 ∶ 珍珠岩 ∶ 河沙=4 ∶ 1 ∶ 1(V ∶ V ∶ V),移栽成活率为99.60%。
关键词 羽裂报春苣苔;组织培养;二次灭菌;活性炭
中图分类号 Q949.778.4 文献标识码 A
Tissue Culture of Primulina pinnatifida
YAN Haixia, GUAN Shikai, HUANG Changyan, DENG Jieling,
HE Jingzhou, ZHANG Zibin, BU Zhaoyang*
Flower Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
Abstract With the leaves of Primulina pinnatifida as the explants, the tissue culture technique system of P. pinnatifida was studied based on the effects of sterilization methods, plant growth regulator types and concentrations. The results showed that the suitable method for the sterilization of the explants was the leaves were sterilized in 75% alcohol for 20 seconds, then soaked in 0.1% HgCl2 for 6 minutes, and soaked in 0.1% HgCl2 for another 6 minutes. The survival rate of the explants was 55.40%. The suitable culture medium for adventitious bud induction was MS+6-BA 1.0-2.0 mg/L+NAA 0.01-0.1 mg/L, the most suitable culture medium for adventitious bud multiplication was MS+6-BA 2.0 mg/L+NAA 0.05 mg/L+activated carbon 0.1 g/L, and the multiplication coefficient was 8.61. The optimum culture medium for rooting culture was MS+IBA 0.5 mg/L+activated carbon 0.1 g/L, and the rooting rate was 100%. For the cultivation, the suitable ratio of transplanting medium of the in vitro plantlets was peat ∶ perlite ∶ sand 4 ∶ 1 ∶ 1(V ∶ V ∶ V), and the survival rate of transplanting of the in vitro plantlets reached 99.60%.
Key words Primulina pinnatifida; tissue culture; secondary sterilization; activated carbon
doi 10.3969/j.issn.1000-2561.2017.09.015
羽裂报春苣苔(Primulina pinnatifida)属苦苣苔科报春苣苔属的多年生草本植物[1],中国是该种的分布中心,主要分布点为广西、广东北部、贵州东南部、湖南南部、江西、福建西部、浙江南部和西部。羽裂报春苣苔畏热,忌阳光直射,需要较高的空气湿度和土壤湿度,因此常见于海拔600~1 500 m的谷林中石上或溪边。全草可供药用,用于治疗跌打损伤等症;此外,还具有极高的观赏价值,应用前景广阔。
目前有关羽裂报春苣苔的研究极少,仅在资源调查中有涉及[2-3]。羽裂报春苣苔可以采用种子繁殖或叶片扦插,但种子细小,采收及播种较繁琐,且繁殖速度慢,系数小。而组织培养技术繁殖周期短、繁殖系数大,后代整齐一致,并且能保持母本的优良性状,已被广泛应用于该属的其他植物上[4-14],但未见关于羽裂报春苣苔组织培养的报道。本研究以羽裂报春苣苔的叶片为外植体,对其开展组织培养技术研究,拟建立其组织培养快速繁殖体系,以便生产大量的种苗应用于生产和资源保护。
1 材料与方法
1.1 材料
羽裂报春苣苔来自广西农业科学院花卉研究所。
1.2 方法
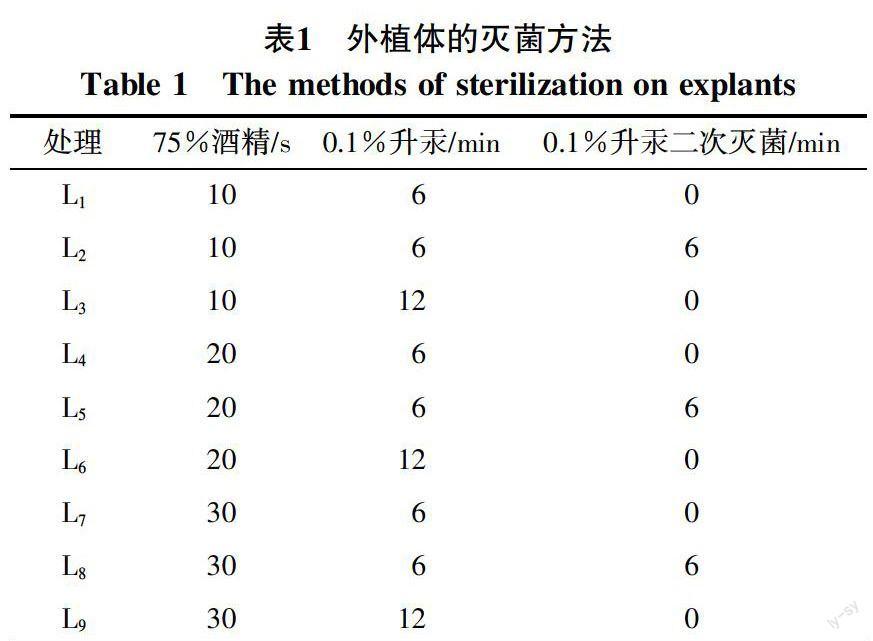
1.2.1 外植体的消毒灭菌 2016年3~4月份,取羽裂报春苣苔的叶片,用洗衣粉溶液浸泡25~30 min后在流水下冲洗干净(30 min),并用软毛刷轻轻刷洗叶片;然后转入超净工作台;先用棉球蘸取75%酒精拭擦叶片表面,无菌水冲洗3次,将叶片按照表1的灭菌方法进行灭菌,每种灭菌剂灭菌后均要用无菌水冲洗3次,使用0.1%升汞灭菌过程中要轻轻震荡使升汞充分接触叶片;将叶片切成3 cm×3 cm大小,接入MS培养基,每种灭菌方法处理数量为50个,每个处理重复3次,培养温度为(25±1)℃,光照时间为每天14~16 h,下同。连续15 d观察污染、成活情况,并统计、计算污染率、成活率:
污染率/%=污染数/接种数×100;
成活率/%=未污染的成活数/接种数×100。
1.2.2 初代培养 将已成活的叶片切成1.5 cm×1.5 cm大小,接入初代诱导培养基中,每种培养基接种数量为50个,每个处理重复3次;培养50 d后,统计发生不定芽的叶片数量,并计算诱导率。
诱导率/%=叶片发生不定芽的数量/接种数×100。
1.2.3 增殖培养 将具有2片以上叶片的不定芽切取下来,接入增殖培养基中,每种培养基接种数量为50个,每个处理重复3次;培养20 d后,统计新芽数量,并计算增殖系数。
增殖系数=产生新芽数/接种数。
1.2.4 生根培养 将增殖培养获得的具有3~4片叶的组培芽,接种在不同的生根培养基中,每种培养基接种数量为50个,重复3次;培养40 d后,统计生根的植株数以及生长情况,并计算生根率。
生根率/%=生根植株数/接种数×100。
1.2.5 炼苗移栽 将组培苗移出培养室后在自然条件下炼苗4~5 d;洗净培养基移栽到不同的基质上,每种基质移栽数量为50株,每个处理重复3次,浇透定根水后,将移栽小苗置于有遮阳网的荫棚下,透光率为40%~50%;采用间歇性喷雾系统控制空气相对湿度,每2 h喷雾1次,喷雾时间每次40 s,确保空气相对湿度在85%以上,早晚分别浇透水1次;移栽后7~10 d即可成活,成活率达100%。培养20 d后,统计成活的植株数以及生长情况,并计算移栽成活率。
移栽成活率/%=移栽成活植株数/移栽数×100。
1.3 统计分析
采用统计软件SPSS 19.0对数据进行差异显著性测验(Duncan′s多重比较)。
2 结果与分析
2.1 外植体的消毒灭菌
由表2可看出,L3的污染率显著低于L1,其成活率显著高于L1;L6的污染率显著低于L4,其成活率显著高于L4;L9的污染率和成活率均显著低于L7;L2的污染率显著高于L3,其成活率显著低于L3;L5、L6的污染率无显著差异,但L5的成活率显著高于L6;L8的污染率和成活率显著高于L9。由此表明,采用升汞一次灭菌时,当酒精灭菌时间为10~20 s时,随着升汞灭菌时间的增加,污染率显著下降,成活率显著上升;当酒精灭菌时间为30 s时,污染率和成活率均显著下降。采用升汞二次灭菌时,当酒精灭菌时间为20~30 s时,二次灭菌的成活率显著上升。由此可知,羽裂报春苣苔的外植体宜采用升汞二次灭菌法,即先用75%酒精灭菌20 s,无菌水冲洗3次,然后用0.1%升汞灭菌6 min,无菌水冲洗3次,再用0.1%升汞灭菌6 min,无菌水冲洗3次,成活率为55.40%。
2.2 初代培养
由表3可知,9个处理之间的诱导率无显著差异,均为100.00%,而每个处理的诱导时间却有所不同。Y1的诱导时间显著高于其余处理;Y2、Y3、Y4、Y5的诱导时间显著高于Y6、Y7、Y8、Y9的诱导时间,而Y2、Y3、Y4、Y5之间的诱导时间无显著差异;Y6、Y8、Y9之间的诱导时间无显著差异。上述结果表明,附加了不同植物生长调节剂种类和浓度的培养基对不定芽的诱导率影响不大,但对诱导时间有影响。可见,植物生长调节剂不是羽裂报春苣苔不定芽诱导的必要因素,但却决定着不定芽诱导时间的长短,一定浓度的6-苄氨基腺嘌呤(6-BA)和萘乙酸(NAA)有利于缩短诱导时间。在培养基MS+6-BA 1.0~2.0 mg/L+NAA 0.01~0.10 mg/L上,不定芽诱导率为100.00%,长势良好,培养时间为20.30~24.50 d(图1、图2)。
2.3 增殖培养
由表4可看出,J1、J2、J3的增殖系数存在显著差异,其中,J3的增殖系数显著高于J1、J2,为8.61;J6的增殖系数显著低于J4、J5;J7的增殖系数显著低于J8、J9;J3、J6、J9的增殖系数存在显著差异。由此表明,在含有0.1 mg/L活性炭的培养基上,增殖系数随6-BA浓度的增加而显著增加;在含有0.5 mg/L活性炭的培養基上,增殖系数随6-BA浓度的增加先上升后下降,增加趋势不明显但下降较显著;当活性炭含量为1.0 mg/L时,增殖系数的增加趋势逐渐不显著;在含有2.0 mg/L 6-BA的培养基上,增殖系数随活性炭含量的增加有显著变化,呈现先下降后增加的趋势,但仍以活性炭为0.1 mg/L的增殖系数最高。可见,不同的6-BA浓度以及活性炭含量,对羽裂报春苣苔不定芽增殖的影响无明显的规律性,但在培养基MS+6-BA 2.0 mg/L+NAA 0.05 mg/L+活性炭0.1 g/L上,其增殖系数最高,为8.61,植株长势好且健壮,是适宜的增殖培养基(图3、图4)。
2.4 生根培养
从表5可知,S2、S3、S4的生根率显著高于其他处理,均为100.00%;S8的生根率显著高于S5、S6、S7,为92.20%;S5的生根率显著低于其他处理,为79.00%,且其生根时间最长,为29.90 d;S2、S3、S4的生根时间显著低于其他处理,其中S3的生根时间最短,为19.10 d。由此可知,添加了吲哚丁酸(IBA)的培养基有利于植株的生根,同时有利于缩短生根的时间。综上可知,羽裂报春苣苔的最佳生根培养基为MS+IBA 0.5 mg/L+活性炭0.1 g/L,生根率达100.00%,生根时间需要19.10 d,植株长势好且健壮,根多(图5)。
2.5 炼苗移栽
由表6可看出,不同的移栽基质,对羽裂报春苣苔的成活率有不同的影响。基质M3的成活率显著高于其他基质,为99.60%,且小苗长势好,植株健壮;基质M1的成活率显著低于其他基质,为88.60%,小苗长势差,植株细弱。结果表明,单一使用泥炭,或者将泥炭与珍珠岩或河沙进行混合不利于植株的移栽,而将泥炭、珍珠岩、河沙混合使用,成活率可达99.60%。综上可知,羽裂报春苣苔的适宜移栽基质为M3,泥炭 ∶ 珍珠岩 ∶ 河沙=4 ∶ 1 ∶ 1(V ∶ V ∶ V),植株长势好且健壮(图6)。
3 讨论
羽裂报春苣苔没有明显的地上茎,选取茎段做外植体对母株的伤害极大;花梗也可作为适宜的外植体,但花梗在花期才能取用,取材时间受到了限制;此外,植物带苞片的花蕾也能作为外植体进行组培快繁[13],但同样存在取材时间受限的问题。综上考虑可知,叶片取材不受时间、季节的限制,对植株的伤害也极小,是理想的外植体类型。但以叶片为外植体进行灭菌时,由于叶片布满茸毛、大量外生菌隐藏于茸毛中并滋生[15],灭菌时间不好把握,容易造成外植体受灭菌剂毒害而死亡或外植体因消毒不彻底而被污染。因此,苦苣苔外植体的表面消毒具有一定的困难,外植体在培养过程中污染率较高、成活率较低。以往的文献报道中,均采用一次灭菌,用70%酒精表面消毒30~45 s,用无菌水冲洗3次后再放入0.1%升汞浸泡灭菌5~8 min,并不停振荡,最后再用无菌水冲洗5~8次[16-18]。这种一次灭菌的方法虽然操作过程简单,但成活率较低。本研究采用升汞二次灭菌的方法对叶片进行灭菌。先用75%酒精灭菌20 s,无菌水冲洗3次,然后用0.1%升汞灭菌6 min,无菌水冲洗3次,再用0.1%升汞灭菌6 min,无菌水冲洗3次,主要是为了降低升汞对叶片的毒害,从而提高外植体的成活率。采用本灭菌方法,成活率可达55.40%。
苦苣苔科植物的叶片扦插繁殖容易,因此在组培中的植株再生及生根也较容易,但仍需要一定的植物生长调节剂刺激,才能达到快速获得组培苗的目的。在现有的苦苣苔科植物的组织培养研究结果中,多数培养基均添加了细胞分裂素和生长素,以此来进行不定芽的诱导和继代增殖培养,如6-BA和NAA。本研究得出羽裂报春苣苔不定芽的诱导培养基为MS+6-BA 1.0~2.0 mg/L+NAA 0.01~0.10 mg/L,增殖培养基为MS+6-BA 2.0 mg/L+NAA 0.05 mg/L+活性炭0.1 g/L,这与前人的研究结果是一致的。如王俐等[19]在进行猫耳朵的组织培养时,在MS培养基上添加6-BA 3.0 mg/L和NAA 0.2 mg/L,出芽率达到100%;此外,还有MS+6-BA 0.1 mg/L+NAA 0.1 mg/L[13,20]以及MS+6-BA 1.0 mg/L+NAA 0.5 mg/L[21-22]也取得较好的培养效果。由此表明,植物生长调节剂是影响苦苣苔科植物组织培养的重要影响因子;另外,在进行羽裂报春苣苔的初代培养时,不添加任何植物生长调节剂也可诱导出不定芽,但所需时间较长,可见6-BA和NAA对不定芽的诱导起促进作用。
本研究以叶片为外植体,建立了羽裂报春苣苔的组织培养体系,适宜的外植体灭菌方法如下:采用75%酒精灭菌20 s,无菌水冲洗3次,然后用0.1%升汞灭菌6 min,无菌水冲洗3次,再用0.1%升汞灭菌6 min,無菌水冲洗3次,成活率为55.40%;不定芽的诱导培养基为MS+6-BA 1.0~2.0 mg/L+NAA 0.01~0.10 mg/L,诱导率达100.00%;适宜的增殖培养基为MS+6-BA 2.0 mg/L+NAA 0.05 mg/L+活性炭0.1 g/L,增殖系数高达8.61;生根培养基为MS+IBA 0.5 mg/L+活性炭0.1 g/L,生根率100.00%,生根时间需要19.10 d;移栽基质为泥炭 ∶ 珍珠岩 ∶ 河沙=4 ∶ 1 ∶ 1(V ∶ V ∶ V),移栽成活率为99.60%。
参考文献
[1] 韦毅刚. 华南苦苣苔科植物[M]. 南宁: 广西科学技术出版社, 278-279.
[2] 温 放. 广西苦苣苔科观赏植物资源调查与引种研究[D]. 北京: 北京林业大学, 2008.
[3] 温 放, 张启翔. 广西苦苣苔科野生观赏植物资源的调查、引种及现状分析[C]//2007年中国园艺学会观赏园艺专业委员会年会论文集. 北京: 中国林业出版社, 2007: 60-65.
[4] 文 弢, 娄 丽, 侯 娜, 等. 大苞短毛唇柱苣苔离体培养和快速繁殖[J]. 天然产物研究与开发, 2016, 28: 350-353.
[5] 侯 娜, 田晓瑞, 娄 丽, 等. 荔波唇柱苣苔离体叶片不定芽的诱导及植株再生[J]. 林业科技开发, 2015, 29(4): 67-70.
[6] Fu C M, Xian K H, He J X, et al. Rapid Propagation of Chirita Ophiopogoides in Vitro[J]. Agricultural Science & Technology, 2015, 16(12): 2 677-2 681.
[7] 潘 梅, 戚华莎, 黄 赛, 等. 烟叶唇柱苣苔叶片分化与植株再生研究[J]. 北方园艺, 2014(23): 83-86.
[8] 张占江, 李 翠, 韦 莹, 等. 珍稀濒危药用植物弄岗唇柱苣苔离体保存研究[J]. 北方园艺, 2014, (4): 136-138.
[9] 张占江, 李 翠, 吕惠珍, 等. 条叶唇柱苣苔组织培养研究[J]. 种子, 2013, 32(9): 19-22.
[10] 韦 啸, 唐赛春, 黄素梅. 三苞唇柱苣苔花梗的离体培养[J]. 北方园艺, 2011(16): 144-147.
[11] 余海霞, 凌征柱, 黄雪彦, 等. 三苞唇柱苣苔的组织培养与快速繁殖[J]. 植物生理学通讯, 2010, 46(11): 1 177-1 178.
[12] 梁桂友. 三种苦苣苔科植物组织培养快速繁殖研究[D]. 北京: 北京林业大学, 2007: 6-7.
[13] 温 放, 李湛东, 张启翔. 牛耳朵的离体培养和快速繁殖[J]. 植物生理学通讯, 2006, 42(5): 906.
[14] 黄素梅. 三苞唇柱苦芭苔组织培养快速繁殖技术研究[D]. 南宁: 广西大学, 2005.
[15] 李 翠, 凌征柱, 姚绍嫦, 等. 苦苣苔科植物组织培养研究进展[J]. 安徽农业科学, 2010, 38(31): 17 387-17 388, 17 390.
[16] 汤正辉, 石 雷, 陈维伦, 等. 半蒴苣苔的组织培养和快速繁殖[J]. 植物生理学通讯, 2005, 41(3): 333.
[17] 汤正辉, 石 雷, 陈维伦, 等. 台闽苣苔的组织培养和快速繁殖[J]. 植物生理学通讯, 2005, 41(4): 497.
[18] 汤正辉, 石 雷, 陈维伦, 等. 异裂苣苔的组织培养和快速繁殖[J]. 植物生理学通讯, 2005, 41(5): 643.
[19] 王 俐, 龙春林. 猫耳朵的组织培养[J]. 植物生理学通讯, 2005, 39(3): 233.
[20] 瞿素萍, 屈云慧, 苏 艳. 鲸鱼花的组织培养和快速繁殖[J]. 北方园艺, 2005(1): 77.
[21]邱云亮. 非洲紫罗兰叶片试管快繁体系建立的研究[J]. 温室园艺, 2005(6): 48-49.
[22] 谭晓风, 邓建军, 胡晓义, 等. 莨山唇柱苣苔组织培养与植株再生[J]. 经济林研究, 2009, 27(3): 24-27.
