HNL、PCT、CRP及膜联蛋白A1对COPD合并呼吸系统感染的诊断价值
2017-05-25黄志卫陆玲
黄志卫,陆玲
(1钦州市第一人民医院,广西钦州535000;2北海市第四人民医院)
HNL、PCT、CRP及膜联蛋白A1对COPD合并呼吸系统感染的诊断价值
黄志卫1,陆玲2
(1钦州市第一人民医院,广西钦州535000;2北海市第四人民医院)
目的 探讨血清中性粒细胞载脂蛋白(HNL)、降钙素原(PCT)、C反应蛋白(CRP)及外周血单个核细胞中膜联蛋白A1表达对慢性阻塞性肺疾病(COPD)合并呼吸系统感染的诊断价值。方法 选择COPD患者152例,其中合并呼吸系统病毒感染47例(病毒感染组)、细菌感染63例(细菌感染组)、无感染42例(对照组)。分别采用ELISA法、化学发光法和免疫速率法检测各组血清HNL、PCT、CRP,采用实时荧光定量PCR(qRT-PCR)和Western blot法检测各组外周血单个核细胞中膜联蛋白A1 mRNA及蛋白表达。结果 细菌感染组血清HNL、PCT、CRP水平高于病毒感染组和对照组(P均<0.05),病毒感染组HNL、PCT、CRP水平与对照组比较P均>0.05。细菌感染组HNL、PCT、CRP阳性率分别为94.58%、85.71%、73.02%,均高于病毒感染组和对照组(P均<0.05),病毒感染组血清HNL、PCT、CRP阳性率与对照组比较P均>0.05。以对照组为阴性组,以细菌感染组为阳性组构建ROC曲线,HNL、PCT、CRP诊断细菌感染的灵敏度分别为91.43%、82.91%和78.22%,特异度分别为94.71%、91.35%和82.44%,阳性预测值分别为90.21%、70.81%和60.73%。细菌感染组及病毒感染组患者外周血单个核细胞中膜联蛋白A1 mRNA及蛋白表达水平较对照组均升高,病毒感染组高于细菌感染组(P均<0.05)。结论 联合检测血清HNL、PCT和CRP有助于COPD合并呼吸系统细菌感染和病毒感染的鉴别诊断,外周血单个核细胞中膜联蛋白A1的表达可作为其有力补充。
慢性阻塞性肺疾病;中性粒细胞载脂蛋白;降钙素原;C反应蛋白;膜联蛋白A1;呼吸系统感染
慢性阻塞性肺疾病(COPD)是一种以气流阻塞为特征的慢性呼吸道疾病,易出现反复急性加重,导致肺功能恶化甚至呼吸衰竭[1,2]。COPD急性加重常由微生物感染诱发[3],然而病原体培养等手段费用较高且耗时较长。因此,早期诊断COPD患者呼吸系统是否并发微生物感染及感染微生物的类型,有助于早期干预,预防感染急性加重。研究显示,细菌感染患者血清中性粒细胞载脂蛋白(HNL)和降钙素原(PCT)水平明显升高,可用于细菌感染的早期诊断、预后判断及疗效监测[4]。膜联蛋白A1是近年新发现的一种抗炎蛋白,在调节炎症代谢产物及单核细胞黏附过程中发挥重要作用[5]。本研究根据COPD患者感染的微生物类型(细菌感染和病毒感染)进行分组,比较其血清HNL、PCT、CRP及外周血单个核细胞中膜联蛋白A1 mRNA及蛋白的表达,探讨上述指标在COPD患者合并呼吸系统感染的诊断价值,为临床鉴别诊断提供快速、准确、方便的实验室指标。
1 资料与方法
1.1 临床资料 收集2014年6月~2016年6月我院收治的COPD患者152例,男91例、女61例,年龄40~90岁。均符合2014版GOLD中的诊断标准。合并呼吸系统细菌感染63例(经细菌培养证实),男39例、女24例,年龄(67±12)岁;病毒感染47例(经相关病毒抗体检测证实),男28例、女19例,年龄(69±10)岁;无感染42例,男24例、女18例,年龄(65±8)岁。入选者近期未给予抗生素或抗病毒药物治疗。排除孕妇、合并其他感染性疾病、恶性肿瘤、严重肝肾功能不全等疾病患者。
1.2 血清HNL、PCT、CRP检测 采集空腹静脉血,离心分离血清,使用Rayto RT-6000全自动酶标仪检测HNL,全自动生化分析仪检测PCT、CRP。所有操作均严格按试剂盒说明书进行。
1.3 外周血单个核细胞中膜联蛋白A1 mRNA表达检测 采用实时荧光定量PCR方法。使用总RNA提取试剂盒提取外周血单个核细胞中的总RNA,逆转录合成cDNA。以cDNA为模板,按照qPCR试剂盒说明书配制反应体系,进行扩增反应。采用Premer Premier软件设计引物,引物序列:上游5′-CCTGGATCGCATAATGAAGA-3′;下游5′-CTAAGCCACCCATCAGATTGAGA-3′。反应条件:95 ℃ 10 min;95 ℃ 15 s,59 ℃ 30 s,72 ℃ 30 s,40个循环。以GAPDH为参照进行相对定量分析,用2-ΔΔCt法计算目的基因相对表达量。
1.4 外周血单个核细胞中膜联蛋白A1蛋白表达 使用蛋白提取试剂盒提取外周血单个核细胞全蛋白,取20 μL进行十二烷基硫酸钠聚丙烯酰胺SDS-PAGE凝胶电泳,半干转15 V 6 min,5%脱脂奶粉封闭2 h,加入一抗4 ℃摇床孵育过夜,加入HRP标记的二抗,室温摇床孵育2 h。凝胶成像分析仪上成像并进行分析。以β-actin为内参,计算膜联蛋白A1与β-actin内参灰度值的比值。

2 结果
2.1 三组血清HNL、PCT、CRP水平比较 细菌感染组血清HNL、PCT、CRP较病毒感染组和对照组升高(P均<0.05),病毒感染组各指标与对照组比较,P均>0.05。见表1。
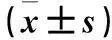
表1 各组血清HNL、PCT、CRP水平比较
注:与对照组比较,*P<0.05;与病毒感染组比较,#P<0.05。
2.2 各组HNL、PCT、CRP阳性率比较 以HNL>55.9 μg/L、PCT>0.05 μg/L、CRP>10 mg/L为阳性。各组HNL、PCT、CRP阳性率见表2。细菌感染组HNL、PCT、CRP阳性率高于病毒感染组和对照组(P均<0.05),病毒感染组与对照组比较,P均>0.05。
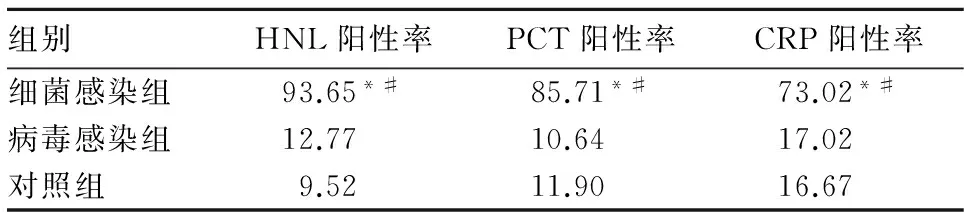
表2 各组HNL、PCT、CRP阳性率比较(%)
注:与对照组比较,*P<0.05;与病毒感染组比较,#P<0.05。
2.3 HNL、PCT、CRP对COPD合并呼吸系统感染的诊断价值 由于病毒感染组血清HNL、PCT、CRP水平及阳性率与对照组比较无统计学差异,故本研究以细菌感染组为阳性组、对照组为阴性组构建ROC曲线,结果显示,HNL和PCT的敏感性、特异性和阳性预测值均高于传统检测指标CRP,具有更好的诊断价值。见表3。
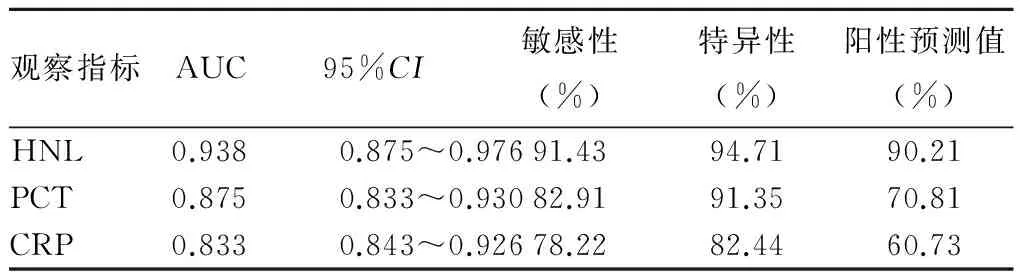
表3 血清HNL、PCT、CRP对COPD合并呼吸系统细菌感染的诊断价值
2.4 各组外周血单个核细胞中膜联蛋白A1 mRNA及蛋白表达比较 细菌感染组及病毒感染组外周血单个核细胞中膜联蛋白A1 mRNA及蛋白表达较对照组升高(P<0.05或<0.01),病毒感染组高于细菌感染组(P均<0.01)。见表4。
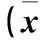
表4 各组外周血单个核细胞中膜联蛋白A1 mRNA及蛋白表达比较±s)
注:与对照组比较,*P<0.05,**P<0.01;与细菌感染组比较,#P<0.01。
3 讨论
COPD急性加重指疾病过程中,患者短期内咳嗽、咳痰、气喘和(或)喘息加重,痰量增多,呈脓性或黏液脓性,可伴发热等炎症明显加重的表现,易导致肺功能恶化,甚至呼吸衰竭,危及患者的生命[6]。COPD的急性加重常由微生物感染诱发,主要包括细菌、病毒和真菌等[7,8]。病原体的分离培养是诊断细菌感染的金标准,但细菌培养操作复杂,需要特定的生长时间和生长环境;对标本要求高,临床上以不合格标本居多;检出率较低,需多次留取样本反复送检,给患者和医务人员造成负担。由于以上种种原因,导致医务人员不能及时制定治疗方案,错过最佳治疗时间,延误病情。病原体抗原或抗体检测的敏感性和特异性均较高,但检测试剂只针对一种病原体,临床应用具有一定的局限性。因此,早期诊断COPD患者呼吸系统是否并发微生物感染及感染微生物的类型,有助于在感染早期对COPD患者进行诊断和干预,预防COPD急性加重。
HNL是载脂蛋白超家族成员,是中性粒细胞的脱颗粒产物,在天然免疫的铁消耗抑菌策略中主要作为乳铁蛋白的抗菌作用的补充[9]。文献报道,HNL比WBC、ESR、CRP等更能用于细菌感染的早期诊断和动态监测,是近年来备受关注的感染性指标。PCT由116个氨基酸组成活性的降钙素前体,主要在肝脏产生,其他如单核细胞也可产生。文献报道,PCT能够有效预测院内感染患者的病死率,与感染密切相关[10,11]。CRP的临床应用广泛,主要用于细菌和病毒感染的鉴别诊断,但其峰值出现常常滞后于炎症的发生,且在类风湿活动期、肿瘤等疾病患者的体内亦有增高,因此CRP临床应用效果并不理想。本研究结果显示,COPD合并细菌感染组HNL、PCT、CRP水平显著高于COPD合并病毒感染组及对照组,说明三者可用于细菌感染的早期诊断,并可用于COPD合并细菌感染和病毒感染的鉴别诊断。细菌感染组血清HNL和PCT的敏感性、特异性、阳性预测值均高于CRP,说明HNL和PCT对COPD合并细菌感染的诊断价值优于CRP,且以HNL更优。
膜联蛋白A1是一种重要的炎症调控蛋白,在炎性代谢产物生成、中性粒细胞、单核细胞与内皮细胞黏附的过程中起重要作用[5,12],但膜联蛋白A1的表达在COPD合并细菌或病毒感染患者外周血单个核细胞中的表达变化如何未见报道。本研究显示,细菌感染组和病毒感染组外周血单个核细胞中膜联蛋白A1 mRNA及蛋白表达均较对照组升高,且病毒感染组高于细菌感染组。说明膜联蛋白A1的表达变化可作为鉴别细菌和病毒感染的指标。由于病毒感染时HNL、PCT、CRP表达无明显变化,而膜联蛋白A1表达显著升高,因此膜联蛋白A1可作为病毒性感染诊断的有力补充。文献报道,miRNA、p38磷酸化状态等可调控膜联蛋白A1表达[13,14],但在COPD合并细菌或病毒感染患者外周血单个核细胞中膜联蛋白A1的表达变化机制尚未可知,需进一步研究。
综上所述,血清HNL、PCT联合外周血单个核细胞膜联蛋白A1检测,有利于COPD合并细菌或病毒感染的鉴别诊断;且三者检测操作简单、耗时较短、适用性强,值得临床推广应用。
[1] Yuan LF, Dai X, Yang M,et al. Potential treatment benefits and safety of roflumilast in COPD: a systematic review and meta-analysis[J]. Int J Chron Obstruct Pulmon Dis, 2016,11:1477-1483.
[2] Wedzicha JA, Seemungal TAR. COPD exacerbations:defining their cause and prevention[J]. Lancet, 2007,370(9589):786-796.
[3] Lee SW, Kuan CS, Wu LS, et al. Metagenome and metatranscriptome profiling of moderate and severe COPD sputum in taiwanese han males[J]. PLoS One, 2016,11(7):e0159066.
[4] 胡宏波,詹前美,刘和艳.HNL和PCT检测对儿童急性细菌性呼吸道感染的诊断价值[J].中国热带医学,2010,10(2):223-225.
[5] Zhao B,Wang J, Liu L, et al. Annexin A1 translocates to nucleus and promotes the expression of pro-inflammatory cytokines in a PKC-dependent manner after OGD/R[J]. Sci Rep, 2016,6:27028.
[6] Kim JK, Lee SH, Lee BH, et al. Factors associated with exacerbation in mild- to-moderate COPD patients[J]. Int J Chron Obstruct Pulmon Dis, 2016,11:1327-1333.
[7] Hosseini SS, Ghasemian E, Jamaati H, et al. Association between respiratory viruses and exacerbation of COPD:a case-control study[J]. Infect Dis (Lond), 2015,47(8):523-529.
[8] Miravitlles M, Anzueto A. Role of infection in exacerbations of chronic obstructive pulmonary disease[J]. Curr Opin Pulm Med, 2015,21(3):278-283.
[9] Yu Z, Jing H, Hongtao P, et al. Distinction between bacterial and viral infections by serum measurement of human neutrophil lipocalin (HNL) and the impact of antibody selection[J]. J Immunol Methods, 2016,432:82-86.
[10] Karia W, Oberhoffer M, Meier-Hellmann A, et al. Procalciton in A new indicator of the systemic response to severe infection[J]. Infection, 1997,25(6):329-334.
[11] 王金荣,高攀,郭淑芬,等.ICU患者医院感染的死亡危险因素分析:2009年至2015年864例病例回顾[J].中华危重病急救医学,2016,28(8):704-708.
[12] Swa HL, Blackstock WP, Lim LH, et al. Quantitative proteomics profiling of murine mammary gland cells unravels impact of annexin-1 on DNA damage response, cell adhesion, and migration[J]. Mol Cell Proteomics, 2012,11(8):381-393.
[13] Suh YE, Raulf N, Gäken J, et al. MicroRNA-196a promotes an oncogenic effect in head and neck cancer cells by suppressing annexin A1 and enhancing radioresistance[J]. Int J Cancer, 2015,137(5):1021-1034.
[14] Tang J, Chen X, Tu W, et al. Propofol inhibits the activation of p38 through up-regulating the expression of annexin A1 to exert its anti-inflammation effect[J]. PLoS One, 2011,6(12):e27890.
10.3969/j.issn.1002-266X.2017.06.017
R563
B
1002-266X(2017)06-0051-03
2016-07-28)
