肺腺癌组织中RNA结合蛋白38的表达及意义
2017-05-25尚自强王洪江杜同心王勇涛冯雪童莹
尚自强,王洪江,杜同心,王勇涛,冯雪,童莹
(1新疆医科大学附属肿瘤医院,乌鲁木齐830011;2新疆维吾尔自治区肿瘤防治研究所)
肺腺癌组织中RNA结合蛋白38的表达及意义
尚自强1,王洪江1,杜同心1,王勇涛1,冯雪2,童莹1
(1新疆医科大学附属肿瘤医院,乌鲁木齐830011;2新疆维吾尔自治区肿瘤防治研究所)
目的 观察肺腺癌组织中RNA结合蛋白38(RNPC1)mRNA和蛋白的表达,探讨其在肺腺癌发生发展中的作用。方法 取50例肺腺癌患者的癌组织(观察组)和对应的癌旁组织(对照组)。采用RT-PCR法检测两组RNPC1 mRNA相对表达量,Western blot法检测两组RNPC1蛋白相对表达量。结果 观察组RNPC1 mRNA及蛋白的相对表达量分别为0.357±0.170、0.294±0.149;对照组分别为0.271±0.128、0.206±0.099;观察组RNPC1 mRNA及蛋白表达量均高于对照组(P均<0.01)。RNPC1 mRNA表达与肺腺癌患者TNM分期、浸润深度、淋巴结转移有关(P均<0.05),RNPC1蛋白表达与肺腺癌患者浸润深度、TNM分期有关(P均<0.05)。结论 RNPC1在肺腺癌组织中呈高表达,在肺腺癌的发生发展过程中起重要作用。
肺肿瘤;肺腺癌;RNA结合蛋白38;肿瘤浸润;肿瘤分期
肺癌是目前全世界发病率最高的恶性肿瘤,多数患者发现时已为晚期,丧失了手术治疗机会。目前兴起的分子靶向治疗在手术、放化疗等传统方式之外开辟了新的治疗途径。RNA结合蛋白38(RNPC1)是公认的致癌基因,可通过抑制抑癌基因p53的表达,促进肿瘤发生发展。国外报道,RNPC1在前列腺癌、结直肠癌、淋巴瘤等多种肿瘤组织中呈高表达,但关于其在肺腺癌中的表达情况少见报道。
本研究观察了肺腺癌组织中RNPC1基因及蛋白的表达情况,探讨RNPC1基因在肺腺癌发生发展中的作用。
1 资料与方法
1.1 临床资料 随机选取2012年10月~2015年6月新疆医科大学附属肿瘤医院收治的肺腺癌患者50例,男40例、女10例,年龄41~79(64.1±9.6)岁。TNM分期Ⅰ期16例、Ⅱ期16例、Ⅲ期18例,细胞分化程度低分化9例、中分化33例、高分化8例,浸润深度T1~T2期35例、T3~T4期15例,合并淋巴结转移27例。术中取癌组织(观察组)以及远隔癌灶5 cm以上癌旁正常组织(对照组)。标本取材后立即置于液氮中速冻,-80 ℃保存备用。
1.2 RNPC1 mRNA表达检测 采用RT-PCR法。采用Primer5.0软件设计引物,由上海生工生物工程股份有限公司合成。RNPC1上游引物:5′-ACTACCGACGCCTCGCTCAG-3′,下游引物5′-CCCAGATATGCCAGGTTCAC-3′,扩增片段长度约200 bp;内参GAPDH上游引物5′-CGCGGGCTCTCCAGAACATCAT-3′,下游引物5′-CCAGCCCCAGCGTCAAAGGTG-3′,扩增片段长度约301 bp。应用TRIzol法提取组织总RNA,逆转录获得cDNA,以cDNA为模板进行扩增。扩增条件:95 ℃预变性5 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃ 6 min。取扩增产物5 μL、Marker 3 μL,2%琼脂糖凝胶电泳,Imaging Lab凝胶图像处理系统分析目标条带及内参条带的积分光密度值,以目的基因与内参GAPDH积分光密度值的比值作为RNPC1 mRNA的相对表达量。
1.3 RNPC1蛋白表达检测 采用Western blot法。按照试剂盒说明进行蛋白提取及总蛋白浓度测定。按制胶试剂盒制胶,于12%分离胶及5%浓缩胶上电泳,冰浴中转膜。转膜后5%脱脂牛奶室温封闭120 min,加入鼠抗人RNPC1单克隆抗体(1∶200,美国Santa Cruz公司)或内参β-actin(1∶750)置摇床,4 ℃孵育过夜,孵育二抗(1∶7 500)后使用ECL发光试剂盒曝光显影。所得图像采用Imaging Lab图像分析软件进行分析。RNPC1蛋白主要作用由其亚型RNPC1a发挥,故测定RNPC1a蛋白调整体积与同一标本内参蛋白β-actin调整体积的比值作为RNPC1蛋白的相对表达量。
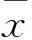
2 结果
2.1 两组RNPC1 mRNA及蛋白表达比较 观察组和对照组RNPC1 mRNA的相对表达量分别为0.357±0.170、0.271±0.128,RNPC1蛋白的相对表达量分别为0.294±0.149、0.206±0.099,观察组RNPC1 mRNA及蛋白表达均高于对照组(P均<0.01)。
2.2 RNPC1 mRNA及蛋白表达与肺腺癌患者临床病理特征的关系 RNPC1 mRNA表达与肺腺癌TNM分期、浸润深度、有无淋巴结转移有关(P均<0.05),RNPC1蛋白表达与肺腺癌浸润深度、TNM分期有关(P均<0.05)。见表1。
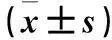
表1 RNPC1 mRNA及蛋白表达与肺腺癌患者临床病理特征的关系
3 讨论
随着分子靶向治疗研究的进展,目前肺癌已有包括EGFR、ALK、KRAS、VEGF基因等分子靶向治疗药物,但这些靶向药物的最佳适用人群尚不能包含全部肺癌患者,且分子靶向治疗药物存在不良反应多、耐受性差、耐药等不足[1]。因此寻找新的基因靶点,将会丰富肺癌临床分子靶向治疗的选择。
抑癌基因p53在保护基因组的完整性和预防癌症的发生过程中起重要作用,p53功能缺失是肿瘤发生发展的重要因素[2]。RNPC1可通过抑制p53的翻译发挥其在肿瘤发生发展过程中的作用。p53基因5′端的非翻译区(UTR)或3′端的UTR为RNPC1抑制p53表达的区域[3]。RNPC1定位于20q13[4],编码一个RNA结合蛋白,表达为两个亚型,即含有239个氨基酸的RNPC1a和含121个氨基酸的RNPC1b[5]。RNPC1a可阻止真核生物起始因子4E(eIF4E)结合p53 mRNA。它依赖其氨基端结合在p53 mRNA上,同时其羧基端控制区与eIF4E结合,通过这种方式阻止eIF4E与p53 mRNA结合。其结果是p53的翻译起始复合体被破坏,从而降低p53的翻译水平[4,6],促进肿瘤的发生发展。RNPC1作为公认的致癌基因,其基因位点在多种肿瘤中表达活跃,包括前列腺癌、卵巢癌、结直肠癌、慢性淋巴细胞白血病、食管癌、乳腺癌和胃癌细胞MGC-823[7~13]。本研究结果显示,RNPC1 mRNA及蛋白在肺腺癌组织中呈高表达,其表达水平与患者性别、年龄及肿瘤分化程度无关。RNPC1 mRNA与肿瘤浸润程度、淋巴结转移及临床病理分期关系密切;RNPC1蛋白与肿瘤浸润程度及临床病理分期关系密切。表明RNPC1在肿瘤发生发展中具有重要作用。
综合目前国内外相关报道,绝大多数研究结果提示RNPC1对肿瘤的发生发展主要起促进作用。然而,Xue等[14]在乳腺癌中的研究与本文结论相反,他们发现RNPC1在乳腺癌组织中的表达低于癌旁组织。研究表明,RNPC1可以靶向调节p53、MDM2等多个基因,但对这些靶基因的调节作用不尽相同。一方面,RNPC1可抑制p53的翻译促进肿瘤发生;另一方面,其可通过结合MDM2基因3′端UTR的多个位点抑制MDM2表达,而MDM2基因编码的蛋白p90能与p53基因结合,使p53基因失去正常功能[15]。这或许是RNPC1在不同肿瘤组织中有不同功能的作用基础。
综上所述,RNPC1与肺腺癌关系密切,其高表达提示肺腺癌浸润深度较深,TNM分期较晚。RNPC1可促进肺腺癌的发生发展,可能成为人类肺腺癌分子靶向治疗的一个潜在靶点。
[1] 刘世青,毕建伟.非小细胞肺癌的分子靶向治疗进展[J].山东医药,2010,50(21):102-103.
[2] Vogelstein B, Lane D, Levine AJ. Surfing the p53 network[J]. Nature, 2000,408(6810):307-310.
[3] Zhang J, Cho SJ, SHU L, et al. Translational repression of p53 by RNPC1, a p53 target overexpressed in lymphomas[J]. Genes Dev, 2011,25(14):1528-1543.
[4] Ding Z, Yang HW, Xia TS, et al. Integrative genomic analyses of the RNA-binding protein, RNPC1, and its potential role in cancer prediction[J]. Int J Mol Med, 2015,36(2):473-484.
[5] Shu L, Yan W, Chen X. RNPC1, an RNA-binding protein and a target of the p53 family, is required for maintaining the stability of the basal and stress-induced p21 transcript[J]. Genes Dev, 2006,20(21):2961-2972.
[6] Zhang M, Zhang J, Chen X, et al. Glycogen synthase kinase 3 promotes p53 mRNA translation via phosphorylation of RNPC1[J]. Genes Dev, 2013,27(20):2246-2258.
[7] 季春梅,黄雯,杨年钊,等.RNPC1基因对胃癌细胞MGC-823增殖、迁移及侵袭的影响[J].江苏医药,2016,42(5):507-510.
[8] Varga D, Deniz M, Schwentner L, et al. Ovarian cancer: in search of better marker systems based on DNA repair defects[J]. Int J Mol Sci, 2013,14(1):640-673.
[9] Labbe DP, Nowak DG, Deblois G, et al. Prostate cancer genetic-susceptibility locus on chromosome 20q13 is amplified and coupled to androgen receptor-regulation in metastatic tumors[J]. Mol Cancer Res, 2014,12(2):184-189.
[10] Du M, Jiao S, Bien SA, et al. Fine-mapping of common genetic variants associated with colorectal tumor risk identified potential functional variants[J]. PLoS One, 2016,11(7):e0157521.
[11] 唐青青,陆伟,张海健,等.白血病中RNA结合蛋白RNPC1的表达及意义[J].中华临床医师杂志(电子版),2014,8(5):830-833.
[12] Ginestier C, Cervera N, Finetti P, et al. Prognosis and gene expression profiling of 20q13-amplified breast cancers[J]. Clin Cancer Res, 2006,12(15):4533-4544.
[13] Frankel A, Armour N, Nancarrow D, et al. Genome-wide analysis of esophageal adenocarcinoma yields specific copy number aberrations that correlate with prognosis[J]. Genes Chromosomes Cancer, 2014,53(4):324-338.
[14] Xue JQ, Xia TS, Liang XQ, et al. RNA-binding protein RNPC1: acting as a tumor suppressor in breast cancer[J]. BMC Cancer, 2014,14(1):1-13.
[15] Meng X, Franklin DA, Dong J, et al. MDM2-p53 pathway in hepatocellular carcinoma[J]. Cancer Res, 2014,74(24):7161-7167.
王洪江(E-mail: whj71210@sina.com)
10.3969/j.issn.1002-266X.2017.06.015
R734.2
B
1002-266X(2017)06-0045-03
2016-08-15)
