铜绿假单胞菌临床分离株生物膜、群体感应相关基因及耐药性分析*
2017-05-25税剑邹明祥王海晨李军刘文恩晏群中南大学湘雅医院检验科长沙410008
税剑,邹明祥,王海晨,李军,刘文恩,晏群(中南大学湘雅医院检验科,长沙 410008)
·微生物生物膜·
铜绿假单胞菌临床分离株生物膜、群体感应相关基因及耐药性分析*
税剑,邹明祥,王海晨,李军,刘文恩,晏群
(中南大学湘雅医院检验科,长沙 410008)
目的 研究临床分离铜绿假单胞菌生物膜形成能力、群体感应相关基因携带情况与耐药性间的关系。方法 结晶紫染色法半定量分析94株铜绿假单胞菌生物膜形成能力,K-B法测定菌株的耐药性,PCR检测菌株的群体感应相关基因lasI、lasR、rhlI、rhlR,分析不同生物膜形成能力铜绿假单胞菌的耐药性差异及群体感应相关基因携带情况对生物膜形成的影响。结果 所测94株铜绿假单胞菌中有89株(94.7%)具有成膜能力,其中成膜能力弱阳性22株(23.4%),成膜能力阳性44株(46.8%),成膜能力强阳性23株(24.5%)。不同成膜能力铜绿假单胞菌对阿米卡星、妥布霉素、庆大霉素的耐药率不同(P<0.05),其中成膜能力强阳性菌株对阿米卡星的耐药率高于成膜能力阳性和弱阳性菌株(P<0.05),对妥布霉素、庆大霉素的耐药率高于弱阳性菌株(P<0.05)。所测94株铜绿假单胞菌有91株携带lasI、lasR、rhlI、rhlR基因,2株lasR基因缺失,1株lasI、lasR、rhlI、rhlR基因缺失。lasR基因缺陷型菌株以及lasI、lasR、rhlI、rhlR基因缺陷型菌株成膜能力阴性,对常规抗菌药物敏感。结论 绝大多数铜绿假单胞菌临床分离株具有较强的生物膜形成能力,铜绿假单胞菌耐药性与生物膜形成能力具有一定的相关性,群体感应相关基因影响生物膜形成。
铜绿假单胞菌;生物膜;耐药性;群体感应相关基因
铜绿假单胞菌(Pseudomonasaeruginosa)是临床最常见的革兰阴性非发酵杆菌。研究发现,铜绿假单胞菌容易粘附于惰性生物材料或机体表面形成生物膜,后者阻碍抗生素对膜内细菌的杀灭作用,从而引起慢性持续性感染[1]。铜绿假单胞菌形成生物膜的过程受群体感应(quorum sensing,QS)系统调控[2]。铜绿假单胞菌的QS系统包括las系统和rhl系统,其中las系统由lasI基因和lasR基因组成,rhl系统由rhlI基因和rhlR基因组成[3]。本研究拟在体外建立一种铜绿假单胞菌生物膜半定量检测方法,对94株临床菌株的生物膜能力进行测定,分析其耐药性与生物膜成膜能力的相关性,同时对94株临床分离菌株的QS相关基因(lasI、lasR、rhlI、rhlR)进行检测,探讨其对生物膜形成的影响。
1 材料与方法
1.1 菌株 收集2016年6月至9月中南大学湘雅医院临床分离的铜绿假单胞菌94株,剔除同一患者相同部位重复分离的相同细菌。其中63株来源于痰,10株来源于分泌物,5株来源于尿液标本,4株来源于血液,3株来源于胆汁,9株来源于其他标本(包括组织块、引流液、支气管肺泡灌洗液、大便、腹水等)。经法国生物梅里埃公司Vitek 2 Compact微生物鉴定系统鉴定到种。质控菌株为ATCC 27853购自国家卫生和计划生育委员会临床检验中心。
1.2 抗菌药物药敏纸片 抗菌药物药敏纸片购自英国Oxiod公司,种类包括哌拉西林/他巴唑坦、头孢哌酮/舒巴坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、阿米卡星、妥布霉素、庆大霉素、环丙沙星、左氧氟沙星。
1.3 主要试剂及仪器 LB液体培养基自行配制,1 g/L结晶紫(北京索莱宝公司),95%乙醇(长沙市洁玉消毒用品厂),2×Taq PCR Master Mix试剂(北京百泰克生物技术公司),DNA marker DL-2000(大连宝生物工程公司),琼脂糖(西班牙Biowest公司),引物由上海生工公司合成。96孔聚苯乙烯组织培养板(美国Corning公司),台式恒温振荡培养箱(上海比朗公司),恒温培养箱(上海永兴医化器械制造厂), Vitek 2 Compact全自动微生物分析系统、比浊仪(法国生物梅里埃公司),InGenius凝胶成像分析系统(英国Syngene公司),ABI 2720基因扩增仪(美国ABI公司),Hoefer PS 2A200水平电泳仪(美国Hoefer公司),高速冷冻离心机(Eppendorf公司),多功能酶联仪(奥地利TECAN公司)。
1.4 细菌药敏试验 用K-B法测定铜绿假单胞菌的耐药性,实验方法、质量控制及判断标准参考美国临床和实验室标准化协会(CLSI)2013年标准[4]。
1.5 生物膜半定量测定 参照文献[5],稍加改进。将临床分离株转种至血平板,于37 ℃恒温箱培养24 h。从血平板上挑取单个菌落接种至5 mL液体LB培养基,37 ℃振荡培养18 h。用比浊仪调整菌液浓度为0.5麦氏浊度单位,吸取100 μL调整后的菌液加入组织培养板的加样孔。于37 ℃恒温箱培养24 h,吸弃液体培养基,生理盐水清洗培养孔3次,去除浮游菌,自然晾干。每孔加入100 μL 1 g/L结晶紫染液染色15 min,弃染液,在流水下缓慢冲洗3次,自然晾干。每孔加入100 μL 95%乙醇,混匀2 min,酶联仪570 nm处比色读取吸光度(A)值,每株菌做5个复孔。5个阴性对照孔每孔仅加100 μL LB液体培养基。阴性对照的平均A值加上其标准差定义为Ac,待测孔A与Ac比较。生物膜形成能力可分为4类:阴性(-):无生物膜形成,A≤Ac;弱阳性(+):Ac
1.6 PCR扩增初筛QS相关基因 采用煮沸法提取细菌总DNA。根据文献[6]合成4对引物,引物序列见表1。PCR反应体系为20 μL,包括2×Taq PCR Master Mix 10 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板2 μL,蒸馏水6 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,相应温度(见表1)退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸7 min。扩增产物经10 g/L琼脂糖凝胶电泳(100 V)40 min后,用凝胶成像系统观察结果并拍照。

表1 群体感应相关基因引物序列
1.7 统计学分析 用SPSS 21.0软件进行。不同成膜能力铜绿假单胞菌耐药率的比较进行行×列卡方检验,两两比较采用Fisher确切概率法或χ2分割法,以P<0.05为差异具有统计学意义。
2 结果
2.1 铜绿假单胞菌药敏结果 94株铜绿假单胞菌的药敏结果显示,铜绿假单胞菌对氨曲南、亚胺培南的耐药率分别高达46.8%、36.2%,对阿米卡星的耐药率最低,为9.6%。94株铜绿假单胞菌对11种抗菌药物的药敏结果见表2。
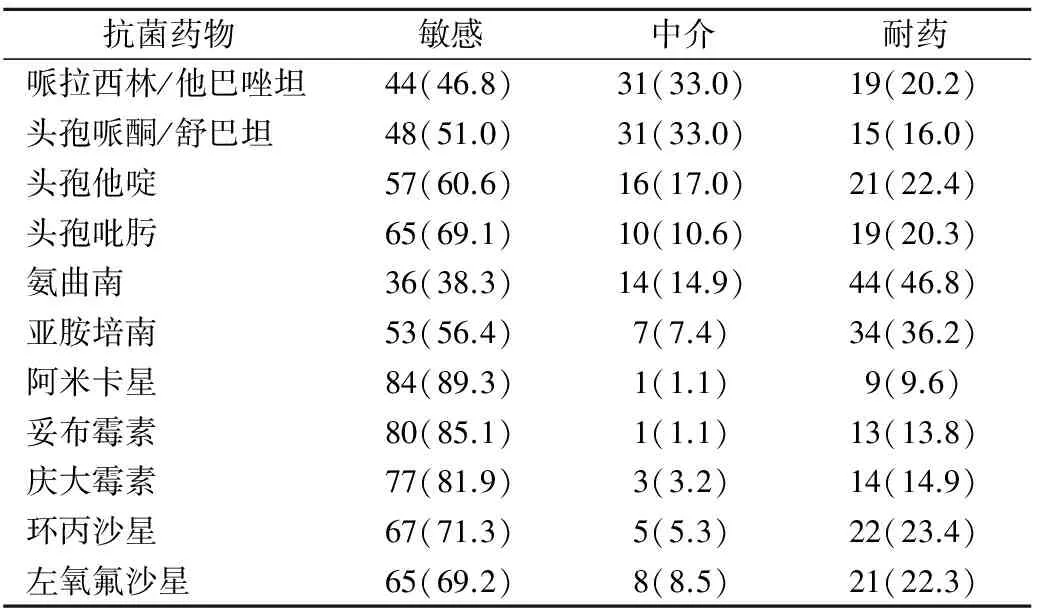
表2 94株铜绿假单胞菌对11种抗菌药物的药敏结果[n(%)]
2.2 生物膜半定量测定 结晶紫染色法半定量测定培养24 h的94株铜绿假单胞菌的成膜能力,其中成膜能力阴性5株(5.3%),弱阳性22株(23.4%),阳性44株(46.8%),强阳性23株(24.5%)。
2.3 铜绿假单胞菌耐药性与成膜能力关系分析 根据成膜能力的不同,对临床分离的94株铜绿假单胞菌进行分组。不同成膜能力铜绿假单胞菌对阿米卡星、妥布霉素、庆大霉素的耐药率不同,差异具有统计学意义(P<0.05)。其中,成膜能力强阳性菌株对阿米卡星的耐药率高于阳性(χ2=4.823,P<0.05)和弱阳性菌株(P=0.022),对妥布霉素、庆大霉素的耐药率高于弱阳性菌株(P均<0.05)。不同成膜能力铜绿假单胞菌对其他常用抗菌药物的耐药性差异无统计学意义(P>0.05)。见表3。
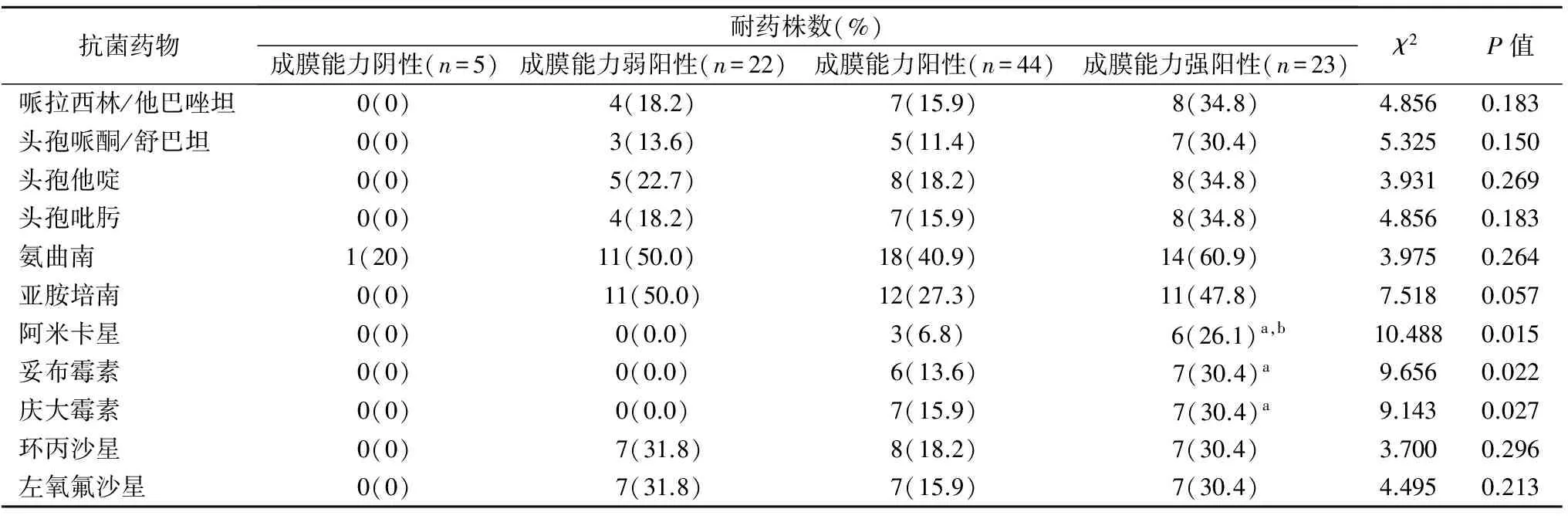
表3 94株铜绿假单胞菌不同成膜能力的耐药性比较
注:a,与成膜能力弱阳性组比较,P<0.05;b,与成膜能力阳性组比较,P<0.05。
2.4 PCR扩增QS相关基因结果及与成膜能力关系分析 临床分离94株铜绿假单胞菌QS相关基因PCR扩增分析发现, 91株携带lasI、lasR、rhlI、rhlR基因,其中89株能形成生物膜;1株lasI、lasR、rhlI、rhlR基因缺陷,不能形成生物膜;2株lasR基因缺陷,也不能形成生物膜。4个基因部分菌株电泳结果见图1。

注:M,DNA marker DL2000;1~15,检测菌株;7,lasI、lasR、rhlI、rhlR缺陷菌株;9、12,lasR缺陷菌株。
图1 部分菌株群体感应相关基因PCR产物电泳分析
3 讨论
本研究通过96孔组织培养板体外构建生物膜,94株临床分离铜绿假单胞菌中有89株具有不同程度的成膜能力,与李晓霞等[7]、周俊立等[8]研究结果相近。经统计学分析,发现不同成膜能力的菌株对阿米卡星、妥布霉素、庆大霉素的耐药性差异具有统计学意义,其中成膜能力强阳性菌株对阿米卡星的耐药率高于阳性和弱阳性菌株,对妥布霉素、庆大霉素的耐药率高于弱阳性菌株。目前细菌生物膜耐药机制主要有2个学说。(1)抗菌药物渗透障碍学说:生物膜中含有大量蛋白质、多糖、胞外DNA等物质,可以有效减缓抗菌药物的渗透,降低其中抗菌药物的浓度,其成膜能力越强,胞外基质越厚,对抗菌药物渗透的阻力越大。同时生物膜的某些组分还可以与抗菌药物结合,阻止抗菌药物与细菌接触。(2)营养限制学说:生物膜底层细菌由于缺氧、缺营养,长期处于休眠状态(称之为饥饿细胞),这种状态下的细菌对抗菌药物不敏感[9]。生物膜的特殊结构以及其中细菌表型的异质性,使成熟的生物膜高度耐药,在临床抗感染治疗中,即使选择体外试验敏感的抗菌药物,依然难以清除生物膜病灶。因此,在临床抗感染治疗中要特别注意生物膜相关感染,使用高效抗菌药物及时清除生物膜,降低持续慢性感染发生率。
QS是广泛存在细菌群体中的依赖细菌密度的信号通讯系统[10]。细菌在生长繁殖过程中会分泌大量信号分子,当信号分子浓度达到一定阈值时,与其受体结合,直接或者间接启动相应基因表达,从而调控细菌毒力因子的产生、生物膜的形成,增强细菌的致病性和耐药性。本研究对94株铜绿假单胞菌临床分离株的QS相关基因进行PCR扩增,产物进行琼脂糖凝胶电泳并成像,发现有91株菌均携带lasI、lasR、rhlI、rhlR基因,1株菌出现4个基因同时缺陷,2株菌出现lasR基因缺陷。通过对这些菌株的成膜能力对比,发现群体感应相关基因缺陷菌株均不能形成生物膜,且对常规抗菌药物敏感。本研究发现其中有2株菌QS相关基因正常但菌株成膜能力阴性,分析其原因可能是铜绿假单胞菌在生物膜形成过程中产生了抑制生物膜的物质。Kolodkin等[11]研究发现枯草芽胞杆菌在形成生物膜过程中产生一种能够抑制生物膜的D-氨基酸,Carlos等[12]证实D-氨基酸也具有抑制铜绿假单胞菌生物膜功能。因此,我们推测铜绿假单胞菌QS相关基因正常但成膜能力阴性,可能与其成膜过程中产生抑制生物膜的物质有关。接下来,我们将通过高效液相色谱法(high-performance liquid chromatography,HPLC)分离出这种能够抑制生物膜的物质并对其作用进行研究。研究表明,QS系统对生物膜的形成发挥重要的调控作用,而生物膜的形成又与细菌耐药密切相关。因此通过对QS相关基因进行研究,有望找到抗生物膜的新靶点,从而有效控制慢性持续感染。
[1]Zhao K, Tseng BS, Beckerman B,etal. Psl trails guide exploration and microcolony formation inPseudomonasaeruginosabiofilms[J]. Nature, 2013, 497(7449):388-391.
[2]Hentzer M, Wu H, Andersen JB,etal. Attenuation ofPseudomonasaeruginosavirulence by quorum sensing inhibitors[J]. EMBO J, 2003, 22(15): 3803-3815.
[3]Wang M, Schaefer AL, Dandekar AA,etal. Quorum sensing and policing ofPseudomonasaeruginosasocial cheaters[J]. Proc Natl Acad Sci U S A,2015,112(7): 2187-2191.
[4]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; 23rd informational supplement[S]. CLSI document M100-S23. Wayne, PA: CLSI, 2013.
[5]Li X, Yan Z, Xu J. Quantitative variation of biofilms among strains in natural populations ofCandidaalbicans[J]. Microbiology, 2003, 149(2):353-362.
[6]Aboushleib HM, Omar HM, Abozahra R,etal. Correlation of quorum sensing and virulence factors inPseudomonasaeruginosaisolates in Egypt[J]. J Infect Dev Ctries, 2015, 9(10):1091-1099.
[7]李晓霞,郭阳,张瑞琴,等. 铜绿假单胞菌耐药率与生物被膜形成能力之间的相关性分析[J].中华医院感染学杂志,2014,24(12):2868-2870.
[8]周俊立,李柏生,叶小华,等. 医院分离铜绿假单胞菌多药耐药与细菌生物被膜之间的关系[J].广东医学,2015, 36(4): 512-513.
[9]Conlon BP, Nakayasu ES, Flech LE,etal. Activated ClpP kills persisters and eradicates a chronic biofilm infection[J]. Nature, 2013, 503(7476):365-370.
[10]Dandekar AA, Chugani S, Greenberg EP. Bacterial quorum sensing and metabolic incentives to cooperate[J]. Science, 2012, 338(6104):264-266.
[11]Kolodkin G, Romero D, Cao S,etal. D-amino acids trigger biofilm disassembly[J].Science, 2010, 328(5978):627-629.
[12]Carlos J, Sanchez J, Kevin S,etal. D-amino acids enhance the activity of antimicrobials against biofilms of clinical wound isolates ofStaphylococcusaureusandPseudomonasaeruginosa[J]. Antimicrob Agents Chemother, 2014, 58(8): 4353-4361.
(本文编辑:刘群)
Analysis for biofilm, quorum sensing related genes and drug resistance in clinical isolates ofPseudomonasaeruginosa
SHUIJian,ZOUMing-xiang,WANGHai-chen,LIJun,LIUWen-en,YANQun
(DepartmentofClinicalLaboratory,XiangyaHospital,CentralSouthUniversity,Changsha410008,Hunan,China)
Objective To study the relationship between biofilm-forming ability, distribution of quorum sensing related genes and antibiotic resistance in clinical isolates ofPseudomonasaeruginosa. Methods The biofilm-forming ability of 94 clinical isolates was analyzed semi-quantitatively by crystal violet staining. The antibiotic resistance of the isolates was determined by K-B method. Quorum sensing related genes,lasI,lasR,rhlRandrhlI, were detected by PCR. The differences of drug resistance ofPseudomonasaeruginosawith different biofilm-forming ability and the effects of quorum sensing related genes on biofilm-forming ability were analyzed. Results Of the 94 isolates, 89(94.7%) showed biofilm-forming ability. The 89 isolates consisted of 22(23.4%) isolates with weakly positive biofilm-forming ability, 44(46.8%) with positive biofilm-forming ability and 23(24.5%) with strongly positive biofilm-forming ability. The strains ofPseudomonasaeruginosawith different biofilm-forming ability showed different drug resistance rates to amikacin, tobramycin and gentamicin(P<0.05). The drug resistance rate of the strains with strong positive biofilm-forming ability to amikacin was higher than that of the strains with positive and weakly positive biofilm-forming ability(P<0.05), and the drug resistance rates to tobramycin and gentamicin were higher than those of the strains with weakly positive biofilm-forming ability(P<0.05). Of the 94 isolates, 91 strains carriedlasI,lasR,rhlIandrhlRgene and 2 strains only lostlasRgene, and 1 strain lost all the 4 genes. The strains with onlylasRgene deficiency or all thelasI,lasR,rhlIandrhlRgene deficiencies showed negative biofilm-forming ability, and were sensitive to conventional antimicrobial agents. Conclusion Most of the clinical isolates ofPseudomonasaeruginosain this study showed strong ability of biofilm-forming ability which may correlate positively to partial antibiotic resistance. The quorum sensing related genes may affect biofilm formation ofPseudomonasaeruginosa.
Pseudomonasaeruginosa; biofilm; antibiotic resistance; quorum sensing related genes
湖南省发展和改革委员会资助项目(湘发改投资[2014]658号)。
税剑,1986年生,男,硕士研究生,技师,从事细菌耐药机制研究。
邹明祥,主任技师,硕士研究生导师,博士,E-mail:zoumingxiang@126.com。
10.13602/j.cnki.jcls.2017.04.04
R446.5
A
2017-01-17)
