鲍曼不动杆菌分泌物对铜绿假单胞菌及其生物膜的作用*
2017-05-25谭芮辰佘鹏飞陈丽华王妍乐伍勇中南大学湘雅三医院检验科长沙410013
谭芮辰,佘鹏飞,陈丽华,王妍乐,伍勇(中南大学湘雅三医院检验科,长沙 410013)
·微生物生物膜·
鲍曼不动杆菌分泌物对铜绿假单胞菌及其生物膜的作用*
谭芮辰,佘鹏飞,陈丽华,王妍乐,伍勇
(中南大学湘雅三医院检验科,长沙 410013)
目的 探讨鲍曼不动杆菌培养上清对铜绿假单胞菌的浮游菌生长及生物膜形成的影响。方法 收集鲍曼不动杆菌标准菌株(ATCC 19606和ATCC 1195)和临床菌株(AB23、AB39和AB53),提取6、12、16、24和48 h培养上清液。利用96孔板结合结晶紫染色法检测其培养上清液对铜绿假单胞菌标准菌株PAO1及其生物膜形成的影响;配制2×LB培养基,排除营养消耗对铜绿假单胞菌的影响;并进一步利用相对分子质量3 000蛋白质浓缩管对其培养上清液进行分离浓缩,初步探讨鲍曼不动杆菌培养上清液中有效成分的相对分子质量。结果 12~24 h内的鲍曼不动杆菌培养上清液,抑制铜绿假单胞菌增殖的效果最为显著,为便于操作,本实验采用16 h培养上清液进行后续实验。50% ATCC 1195和ATCC 19606培养上清液能显著抑制铜绿假单胞菌标准菌株PAO1浮游菌的增殖,可分别使其630 nm处的吸光度从0.688±0.014和0.692±0.014减少至0.431±0.023和0.428±0.020(t=16.780,P<0.05;t=18.500,P<0.05);且50% ATCC 1195和ATCC 19606培养上清液能显著抑制铜绿假单胞菌PAO1生物膜的形成,可使生物膜的形成量(A570 nm)从2.071±0.068和1.986±0.023减少至1.639±0.042和1.525±0.202(t=9.358,P<0.05;t=3.924,P<0.05);此外,与50%鲍曼不动杆菌培养上清液组相比,培养上清液中相对分子质量<3 000的成分抑制作用显著,可使生物膜的形成量从1.177±0.040减少至1.056±0.030(t=4.192,P<0.05),而>3 000的成分并无抑制作用。结论 鲍曼不动杆菌分泌物能有效抑制铜绿假单胞菌浮游菌的增殖和生物膜的形成,其有效蛋白质成分相对分子质量<3 000。
鲍曼不动杆菌;铜绿假单胞菌;生物膜;培养上清液
生物膜是细菌粘附于介质(如:医疗器械、黏膜组织)表面形成的具有立体结构的聚合物。物理屏障、突变率增加和滞留菌的形成等因素可使细菌耐药性增加10~1 000倍不等[1-2]。铜绿假单胞菌(Pseudomonasaeruginosa, PA)是一种常见的条件性致病菌,常引起免疫力低下患者的院内感染,如呼吸机相关肺炎、肺囊性纤维化肺炎、角膜炎、皮肤软组织感染和败血症等[2]。PA有极强的生物膜形成能力,给临床的治疗带来极大的困难[3]。近年来,研究者从植物提取物[4]、细菌自身分泌的某些小分子物质[5]以及“老药新用”[6]等方面着手,试图挖掘某些新型生物膜抑制剂。但这些研究绝大多数还停留于基础实验或动物实验阶段,因种种局限尚未能用于临床。我们在临床实践中发现,鲍曼不动杆菌(Acinetobacterbaumanii, AB)与PA几乎很少共存于同一培养基中,因而,我们推断这两种细菌某些菌株之间可能存在相互抑制的作用。本研究从AB与PA菌群本身的相互作用出发,探索新型的生物膜抑制剂。
1 材料与方法
1.1 菌株来源 3株AB临床菌株(AB23、AB39和AB53)于2014年1月至2015年1月分离自中南大学湘雅三医院检验科,同一患者不同时间分离的菌株仅统计1次。AB标准菌株(ATCC 19606和ATCC 1195)由本实验室保存,PA标准菌株PAO1由南开大学生命科学院乔明强教授惠赠。菌株鉴定均采用Vitek 2 Compact全自动微生物分析系统。
1.2 试剂与仪器 结晶紫(天津市化学试剂一厂);LB肉汤(北京奥博星公司);Vitek 2 Compact全自动微生物分析系统(法国生物梅里埃公司);0.22 μm无菌过滤器、相对分子质量3 000蛋白质浓缩管(德国Millpore公司);96孔细胞培养板(美国Corning/Costar公司);Elx800自动酶联仪(美国Bio-Tek公司)。
1.3 AB培养上清液的提取 挑取血琼脂平板上过夜培养的AB标准菌株ATCC 19606单个菌落于装有15 mL LB肉汤培养基的50 mL离心管中,37 ℃、180 r/min振荡培养。培养6、12、16、24和48 h后,分别3 000×g离心15 min,取上清液,用0.22 μm无菌过滤器进行过滤,取滤液,保存备用。
1.4 AB培养上清液对PAO1浮游菌的影响 挑取血琼脂平板上的PAO1单个菌落于含有15 mL LB肉汤培养基的离心管中,于恒温摇床37 ℃ 180 r/min培养16 h,3 000×g离心15 min后取沉淀。用15 mL LB肉汤稀释AB培养16 h的培养上清液至相应的浓度(100%、50%、25%、12.5%、6.25%、3.13%),挑取PAO1单个菌落,并用生理盐水调节菌悬液浓度至0.5 麦氏浊度单位,分别加100 μL此菌悬液至已稀释的AB培养上清液中,于恒温摇床37 ℃ 180 r/min分别培养6、12、16、24和48 h后,各取200 μL菌悬液于96孔板中,用酶联仪检测630 nm处的吸光度(A630 nm),即为细菌的相对生长量。分别绘制时间-生长曲线和浓度-生长曲线。
1.5 AB培养上清液对PAO1生物膜的影响 PAO1于LB肉汤中于恒温摇床37 ℃、180 r/min过夜培养,用无菌生理盐水调节浓度至0.5麦氏浊度单位,备用。用LB肉汤培养基对倍稀释AB培养16 h上清液,分别取196 μL加入96孔细胞培养板中,每孔再分别加入4 μL备用的PAO1菌悬液,吹打混匀后,置湿盒中37 ℃静置温育24 h。弃去未与孔壁或孔底结合的浮游菌,用无菌生理盐水轻洗3次,再分别加入200 μL 0.5 mg/mL结晶紫溶液,静置染色15 min后,再用无菌生理盐水轻洗3次以去除未与细菌结合的结晶紫,于烤箱烘干后,分别加入200 μL 95%乙醇溶液,置摇床温育20 min,使结晶紫充分溶解后于酶联仪检测570 nm处的吸光度(A570 nm),即为生物膜的相对量[7]。为排除AB培养上清液中LB肉汤营养消耗的影响,本试验同时配制1×LB 和2×LB肉汤(即:按照LB肉汤说明书配制的基础上,当加入一份双蒸水时加两份LB培养基粉末),分别对倍稀释AB标准菌株ATCC 1195培养16 h的上清液,进行浮游菌抑制试验和生物膜形成抑制试验,方法同上。
1.6 AB上清液有效成分初探 用蛋白质浓缩管将AB上清液分成蛋白质相对分子质量<3 000 和>3 000两个部分(蛋白质浓缩管离心后,上层保留的为相对分子质量<3 000的成分,而下层为相对分子质量>3 000的成分),分别进行生物膜形成抑制试验,方法同1.5。
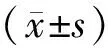
2 结果
2.1 不同培养时间的AB上清液对PAO1浮游菌的抑制能力不同 将不同培养时间的对照组(仅有LB肉汤)与PAO1作用后浮游菌增殖量设置为100%时,浓度为25%和50%的AB标准菌株ATCC 19606培养上清液均对PAO1浮游菌的增殖有一定的抑制作用。其中,16 h的AB上清液抑制效果最为显著,故选择16 h培养上清液进行后续实验。25%和50%的AB培养上清液与PAO1分别作用16 h后,与仅有LB肉汤的对照组相比,可使其浮游菌的增殖量分别从(1.249±0.046)%减少至(1.005±0.051)%和(0.732±0.045)%(t=6.153,P<0.05;t=13.92,P<0.05)。见图1。
2.2 AB培养上清液对PAO1浮游菌和生物膜的抑制能力具有剂量依赖性 AB临床菌株AB23、AB39和AB53和标准菌株ATCC 1195、ATCC 19606的16 h培养上清液与PAO1作用24 h后均可同时抑制PAO1浮游菌的增殖和生物膜的形成。当ATCC 1195和ATCC 19606培养上清液的浓度为50%时,可显著抑制PAO1浮游菌的增殖,与仅有LB肉汤的对照组相比,可分别使PAO1在630 nm处的吸光度从0.688±0.014和0.692±0.014减少至0.431±0.023和0.428±0.020(t=16.780,P<0.05;t=18.500,P<0.05)。50%的ATCC 1195和ATCC 19606培养上清液可使PAO1生物膜的形成量从2.071±0.068和1.986±0.023减少至1.639±0.042和1.525±0.202(t=9.358,P<0.05;t=3.924,P<0.05)。随着浓度升高,其抑制能力越强,具有显著的剂量依赖性。见图2。
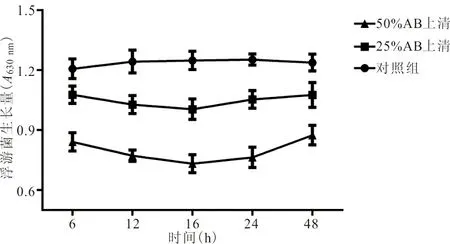
图1 不同培养时间的AB培养上清液对PAO1浮游菌的影响
注:A,浮游菌;B,生物膜。
图2 不同浓度的AB培养上清液对PAO1的影响
2.3 不同浓度培养基对PAO1的影响 2×LB肉汤在一定程度上可以促进PAO1浮游菌的增殖(P<0.05),但并不影响AB培养上清液对生物膜的抑制作用(P>0.05)。见图3。

注:A,浮游菌;B,生物膜;*与仅有LB培养液的对照组比较,P<0.05。
图3 不同浓度培养基对PAO1的影响
2.4 AB上清液有效成分初探 将浓度为50%的AB培养上清液用蛋白质浓缩管进行浓缩和分离。蛋白质相对分子质量<3 000部分与50%AB培养上清液组相比,可使生物膜的形成量从1.177±0.040减少至1.056±0.030(t=4.192,P<0.05);而蛋白质相对分子质量>3 000部分具有显著促进生物膜形成的作用,与加50%AB培养上清液对照组相比,可使生物膜的形成量增加至1.677±0.102(t=7.904,P<0.05)。因此,我们推测AB培养上清液中抑制PAO1生物膜形成的有效成分蛋白质相对分子质量<3 000。见图4。
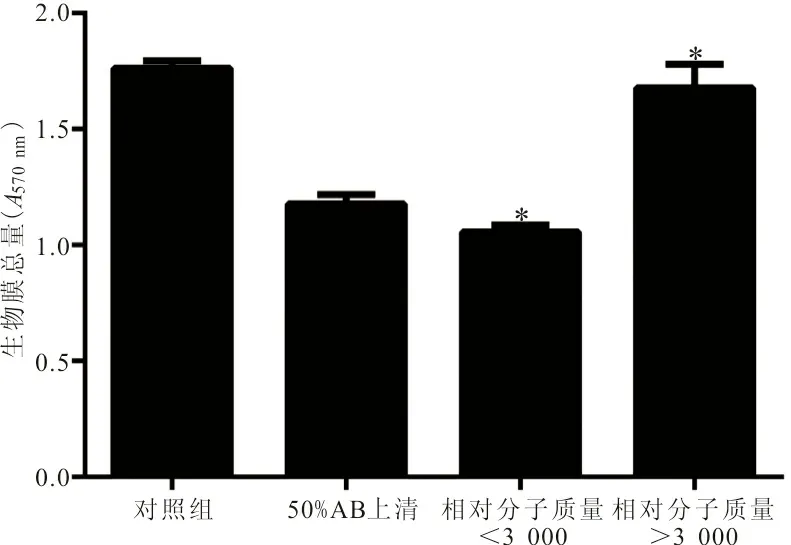
注:*:与50%AB培养上清液对照组比较,P<0.05。
图4 AB上清液中不同分离成分对PAO1生物膜的影响
3 讨论
本研究发现,AB培养16 h的上清液能显著抑制PA标准菌株PAO1的浮游菌增殖和生物膜的形成。并且,我们推测这种对浮游菌的抑制作用部分原因可能是因为其培养肉汤的营养成分消耗而导致,而AB上清液中存在特异性的生物膜抑制成分(相对分子质量<3 000)抑制PAO1生物膜的形成。
人体内的细菌并非以单一形式存在,不同种属细菌之间可共存,并能相互促进或抑制。如肠道菌群,不同种属的细菌之间相互作用,共同维持肠道的稳态,当这种自稳态被打破,将引发相关疾病[8]。近年来,研究者发现PA与不同菌属之间往往存在相互作用[9-13]。而目前国内外尚无AB与PA之间的相互作用的相关报道。而本研究发现AB培养上清液对PA浮游菌增殖和生物膜的形成有显著的抑制作用。
PA生物膜主要由菌体、胞外多糖、胞外DNA和胞外蛋白质组成。其从起始粘附到生物膜的成熟和分散过程的整个生理周期均受到群体密度感应(quorum sensing, QS)系统和第二信使环鸟苷二磷酸(c-di-GMP)的精确调控[14-15]。因此,我们推测AB上清液培养液对PA生物膜的的抑制作用可能是通过干扰其QS系统和c-di-GMP的正常调控作用,并进一步抑制细菌粘附和胞外基质相关基因的表达而完成。本实验团队在后续的研究中将对其具体的作用机制进行探讨。
[1]伍勇,陈丽华. 重视细菌生物被膜导致的细菌耐药及其解决方案[J]. 中华检验医学杂志,2014,37(10):725-727.
[2]Mulcahy LR, Isabella VM, Lewis K.Pseudomonasaeruginosabiofilms in disease[J]. Microb Ecol, 2014, 68(1): 1-12.
[3]Chatterjee M, Anju CP, Biswas L,etal. Antibiotic resistance inPseudomonasaeruginosaand alternative therapeutic options[J]. Int J Med Microbiol, 2016, 306(1):48-58.
[4]Kim HS, Lee SH, Byun Y,etal. 6-Gingerol reducesPseudomonasaeruginosabiofilm formation and virulence via quorum sensing inhibition[J]. Sci Rep, 2015, 5: 8656.
[5]Qu L, She P, Wang Y,etal. Effects of norspermidine onPseudomonasaeruginosabiofilm formation and eradication[J]. Microbiology Open, 2016,5(3):402-412.
[6]El-Mowafy SA, Abd El Galil KH, El-Messery SM,etal. Aspirin is an efficient inhibitor of quorum sensing, virulence and toxins inPseudomonasaeruginosa[J]. Mcrob Pathog, 2014,74:25-32.
[7]He JZ, Wang SD, Wu TX,etal. Effects of ginkgoneolic acid on the growth, acidogenicity, adherence, and biofilm of Streptococcus mutans in vitro[J]. Folia Microbiol, 2013, 58(2):147-153.
[8]Gagnière J, Raisch J, Veziant J,etal. Gut microbiota imbalance and colorectal cancer[J]. World J Gastroenterol, 2016, 22(2): 501-518.
[9]Nguyen AT, Oglesby-Sherrouse AG. Interactions betweenPseudomonasaeruginosaand Staphylococcus aureus during co-cultivations and polymicrobial infections[J]. Appl Microbiol Biotechnol, 2016,100(14): 6141-6148.
[10]Culotti A, Packman AI.Pseudomonasaeruginosapromotes Escherichia coli biofilm formation in nutrient-limited medium[J]. PLoS One, 2014, 9(9): e107186.
[11]Briard B, Heddergott C, Latgé JP. Volatile compounds emitted byPseudomonasaeruginosastimulate growth of the fungal pathogen Aspergillus fumigatus[J]. Mbio, 2016, 7(2): e00219.
[12]Manavathu EK, Vager DL, Vazquez JA. Development and antimicrobial susceptibility studies of in vitro monomicrobial and polymicrobial biofilm models with Aspergillus fumigatus andPseudomonasaeruginosa[J]. BMC Microbiol, 2014, 14: 53.
[13]Smith K, Rajendran R, Kerr S,etal. Aspergillus fumigatus enhances elastase production inPseudomonasaeruginosaco-cultures[J]. Med Mycol, 2015, 53(7): 645-655.
[14]Lee J, Zhang L. The hierarchy quorum sensing network inPseudomonasaeruginosa[J]. Protein Cell, 2015, 6(1): 26-41.
[15]Ha DG, O′Toole GA. c-di-GMP and its effects on biofilm formation and dispersion: aPseudomonasaeruginosareview[J]. Microbiol Spectr, 2015, 3(2): MB-0003-2014.
(本文编辑:刘群)
Effect ofAcinetobacterbaumanniisecretions onPseudomonasaeruginosacell growth and biofilm formation
TANRui-chen,SHEPeng-fei,CHENLi-hua,WANGYan-le,WUYong
(DepartmentofLaboratoryMedicine,TheThirdXiangyaHospitalofCentralSouthUniversity,Changsha410013,Hunan,China)
Objective To investigate the effects ofAcinetobacterbaumanniiculture supernatants on planktonic cell growth and biofilm formation ofPseudomonasaeruginosa. Methods The standard isolates(ATCC 19606, ATCC 1195) and clinical isolates(AB23,AB39,AB53) ofAcinetobacterbaumanniiwere collected and the 6, 12, 16, 24 and 48 hour-cultured supernatants were extracted. The effects of the culture supernatants on the biofilm formation ofPseudomonasaeruginosaPAO1 were detected on the 96-well plate combined with crystal violet staining. Two-fold concentration of LB medium was prepared to eliminate the effects of nutrition consumption ofAcinetobacterbaumanniiduring culture onPseudomonasaeruginosagrowth. The active ingredients in the supernatant ofAcinetobacterbaumanniiculture medium were investigated by using the concentrated tube containing protein with relative molecular mass 3 000. Results The most suitable period forAcinetobacterbaumanniiculture supernatant extraction was between 12 to 24 hours, so the 16 hour-cultured supernatant was chosen for next experiments. The 50% culture supernatant ofAcinetobacterbaumanniiATCC 1195 and ATCC 19606 significantly inhibited the planktonic cell growth ofPseudomonasaeruginosaPAO1, in which the absorbance at 630 nm reduced from(0.688±0.014) and(0.692±0.014) to(0.431±0.023) and(0.428±0.020) respectively(t=16.780,P<0.05;t=18.500,P<0.05). The 50% culture supernatant ofAcinetobacterbaumanniiATCC 1195 and ATCC 19606 also significantly inhibited the biofilm formation ofPseudomonasaeruginosaPAO1 with decreased absorbance at 570 nm from(2.071±0.068) and(1.986±0.023) to(1.639±0.042) and(1.525±0.202) respectively(t=9.358,P<0.05;t=3.924,P<0.05). The biofilm inhibitory effect of the protein with relative molecular mass less than 3 000 was obviously observed by reducing amount of biofilm formation from(1.177±0.040) to(1.056±0.030)(t=4.192,P<0.05), while there was no inhibitory effect of the proteins with relative molecular mass more than 3 000 in the composition. ConclusionAcinetobacterbaumanniiculture supernatant could effectively inhibit the planktonic cell growth and biofilm formation ofPseudomonasaeruginosaand the relative molecular mass of active ingredients in the culture supernatant may be less than 3 000.
Acinetobacterbaumanii;Pseudomonasaeruginosa; biofilm; culture supernatant
湖南省自然科学基金(12JJ3092;2015JJ2188;2015JJ3165)。
谭芮辰,1992年生,女,硕士研究生,研究方向为临床检验诊断学;佘鹏飞,1991年生,男,硕士研究生,研究方向为临床检验诊断学。两位对本文贡献等同,共为第一作者。
伍勇,教授,E-mail:wuyong_xy@126.com。
10.13602/j.cnki.jcls.2017.04.03
R446.5
A
2017-02-05)
