阿司匹林对铜绿假单胞菌生物膜形成和分散的影响*
2017-05-25王央霞高戈郑涛涛中南大学湘雅医学院医学检验系长沙4003澧县红十字会医院感染科湖南澧县45000
王央霞,高戈,郑涛涛(.中南大学湘雅医学院医学检验系,长沙 4003;.澧县红十字会医院感染科,湖南澧县 45000)
·微生物生物膜·
阿司匹林对铜绿假单胞菌生物膜形成和分散的影响*
王央霞1,高戈1,郑涛涛2
(1.中南大学湘雅医学院医学检验系,长沙 410013;2.澧县红十字会医院感染科,湖南澧县 415000)
目的 探讨阿司匹林对铜绿假单胞菌生物膜的形成和分散的作用。方法 微量肉汤稀释法检测铜绿假单胞菌浮游菌对阿司匹林的敏感性;通过微孔板构建生物膜,结合结晶紫染色探讨阿司匹林对铜绿假单胞菌生物膜的形成和分散的影响;通过微孔板结合稀释平板计数法检测阿司匹林对铜绿假单胞菌初始粘附能力的影响。结果 铜绿假单胞菌标准菌株PAO1和临床菌株PA18、PA53和PA67对阿司匹林MIC值分别为5 mg/mL、2.5 mg/mL、5 mg/mL和5 mg/mL。当阿司匹林浓度为2.5 mg/mL时可显著抑制PAO1和PA18生物膜的形成(t=5.65,P<0.05;t=5.06,P<0.05),当其浓度分别为1.25 mg/mL和0.313 mg/mL时能显著抑制PA67和PA53生物膜的形成(t=4.10,P<0.05;t=5.12,P<0.05)。2.5 mg/mL阿司匹林可显著分散PAO1和PA18培养24 h形成的生物膜(t=6.45,P<0.05;t=6.26,P<0.05),1.25 mg/mL和0.313 mg/mL时可显著分散PA67和PA53形成的生物膜(t=7.82,P<0.05;t=9.18,P<0.05)。2.5 mg/mL阿司匹林能显著抑制铜绿假单胞菌的初始粘附(P<0.05)。结论 阿司匹林能有效抑制铜绿假单胞菌的初始粘附能力和生物膜的形成,并对已形成生物膜具有分散能力。
阿司匹林;铜绿假单胞菌;生物膜;初始粘附;结晶紫染色
铜绿假单胞菌(Pseudomonasaeruginosa,PA)是一种常见的革兰阴性条件致病菌,常见于院内感染[1]。PA能粘附于物体或人体组织表面并相互聚集,分泌胞外多糖、DNA和蛋白质等物质将自身包裹,形成的“蘑菇状”膜性聚合物即为生物膜。生物膜状态下PA的耐药性比浮游菌增强10~1 000倍,给临床治疗带来极大困难[2]。传统抗菌药物难以有效根治PA生物膜引起的感染。残留于人体内的PA在不断受到亚抑菌浓度抗生素的刺激下,易发生突变而产生耐药性[3-4]。新型抗生素的研发已难以跟上细菌产生耐药性的步伐。因此,“老药新用”成为了当今研究的热点。阿司匹林作为一种非甾体类解热镇痛消炎药被广泛应用于心血管及风湿免疫性疾病,近年来研究发现阿司匹林具有广谱抗菌活性[5],然而其对细菌生物膜的影响尚处于研究阶段。
1 材料和方法
1.1 菌株来源 标准菌株PAO1由湘雅三医院检验科惠赠。临床菌株(PA18、PA53、PA67)分离自2015年4月至6月中南大学湘雅三医院临床非重复痰液标本分离菌株。
1.2 仪器与试剂 Vitek 2 Compact全自动微生物分析仪(法国生物梅里埃公司);96孔细胞培养板(美国Corning公司);多功能微孔板检测酶联仪(美国BioTek公司);M-H肉汤(美国BD公司);LB肉汤(北京陆桥公司);结晶紫颗粒(天津中信凯泰化工公司);阿司匹林(上海阿拉丁生化公司)。
1.3 药敏试验 将配备好的阿司匹林母液用M-H肉汤倍比稀释(0.078~20 mg/mL),以未加阿司匹林的M-H肉汤作为空白对照。在96孔板中每孔分别加入100 μL,制备微量稀释盘。将菌悬液调至0.5麦氏浊度单位,作1∶20稀释,使其菌含量为5×106CFU/mL,取10 μL上述菌悬液加入至制备好的微量稀释盘中。35 ℃培养16~20 h,肉眼所见能完全抑制细菌生长的最低药物浓度判为最低抑菌浓度(MIC)值。实验重复3次,每次设3个复孔。
1.4 生物膜形成抑制试验 挑取单个菌落置于LB肉汤中37 ℃ 200 r/min培养16 h,3 000×g离心20 min后用生理盐水调整菌悬液浓度至1麦氏浊度单位。取LB肉汤倍比稀释至不同浓度(0.078~10 mg/mL)的阿司匹林溶液各198 μL分别加入96孔板,以未加阿司匹林的LB肉汤作为阴性对照,再向每孔分别加入2 μL备用的PA菌悬液。37 ℃培养24 h后,用生理盐水漂洗3次去除浮游菌。(1)结晶紫染色:用微量移液器吸干微孔中残余液体,各孔加入200 μL 5 g/L结晶紫溶液,振荡器上摇15 min,弃染液,生理盐水漂洗3~5次去除未结合结晶紫溶液,风干后各孔加入200 μL 95%乙醇溶液,以洗脱与生物膜结合的结晶紫,静置20 min后于多功能酶联仪检测570 nm处的吸光度(A570 nm)[6]。(2)阴性对照孔和加入2.5 mg/mL阿司匹林的实验孔进行平板菌落稀释计数:向去除浮游菌的微孔中各加入200 μL无菌生理盐水,超声振荡(频率:40 kHz;功率:200 W)15 min使粘附于孔壁和孔底的生物膜分散成浮游状态,用生理盐水倍比稀释后取10 μL稀释菌悬液均匀涂布于羊血琼脂平板,于培养箱隔夜培养后选取长有5~20个菌落的平板计数菌落数量。实验重复3次,每次设3个复孔。
1.5 24 h生物膜分散试验 1麦氏浊度单位PA菌悬液制备同1.4。将上述菌液100倍稀释,每孔取100 μL加入96孔板,37 ℃静置培养24 h后,用生理盐水漂洗3次。每孔分别加入110 μL倍比稀释的阿司匹林溶液(0.078~20 mg/mL),37 ℃静置温育24 h。用生理盐水漂洗3次去除浮游菌,再进行结晶紫染色,对阴性对照孔和加入2.5 mg/mL阿司匹林的实验孔进行平板菌落稀释计数。以下步骤同结晶紫染色法和平板菌落稀释计数法。实验重复3次,每次设3个复孔。
1.6 阿司匹林对PA初始粘附的影响 1麦氏浊度单位PA菌悬液制备同1.4。96孔板中每孔分别加入196 μL用LB肉汤倍比稀释的阿司匹林溶液(0.313~10 mg/mL),不加阿司匹林的LB肉汤作为对照。实验孔和对照孔分别加入4 μL PA菌悬液。置37 ℃静置培养30 min后,生理盐水漂洗3次,再向各孔中加入200 μL生理盐水,超声振荡(频率:40 kHz;功率:200 W)15 min使生物膜转化成浮游状态。用稀释平板计数法检测微孔中细菌的浓度,具体见1.4所述。细菌初始粘附率(%)=阿司匹林实验组细菌浓度/未加药对照组细菌浓度×100%。实验重复3次,每次设3个复孔。
1.7 统计学分析 用SPSS 17.0软件进行。正态分布计量资料以均值±标准差表示,组间比较用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 PA对阿司匹林的敏感性 采用微量肉汤稀释法测得PAO1、PA18、PA53和PA67对阿司匹林的MIC值分别为5 mg/mL、2.5 mg/mL、5 mg/mL和5 mg/mL。
2.2 阿司匹林抑制PA生物膜的形成 当阿司匹林浓度为2.5 mg/mL时可显著抑制PAO1和PA18生物膜的形成,使PAO1生物膜总量A570 nm从2.256±0.250减少至1.142±0.232(t=5.65,P<0.05),使PA18生物膜总量A570 nm从1.814±0.323减少至0.683±0.213(t=5.06,P<0.05);当阿司匹林的浓度为1.25 mg/mL时可显著抑制PA67生物膜的形成,使其生物膜总量A570 nm从2.536±0.261减少至1.670±0.256(t=4.10,P<0.05);当阿司匹林的浓度为0.313 mg/mL时可显著抑制PA53生物膜的形成,使其生物膜总量A570 nm从2.777±0.166减少至2.191±0.108(t=5.12,P<0.05)。且随着阿司匹林浓度的增高,其抑制PA生物膜形成的能力越强,呈现出明显的剂量依赖性,见图1。当阿司匹林的浓度为2.5 mg/mL时还能显著抑制PAO1、PA67、PA53和PA18生物膜的形成(P均<0.05),见表1。
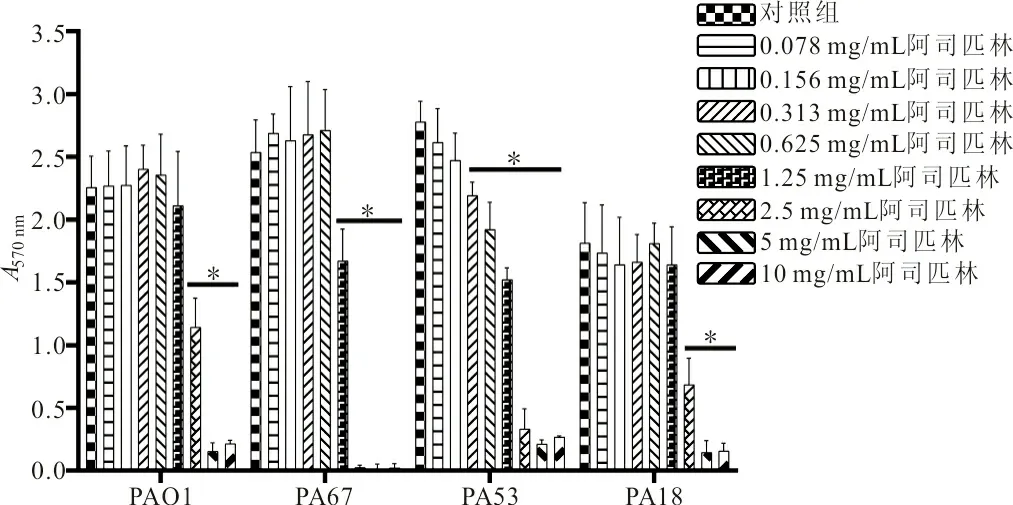
注: *,各组分别与未加药的对照组相比,P<0.05。
图1 阿司匹林抑制PA生物膜的形成
表1 阿司匹林对PA生物膜形成活菌计数的影响(×108CFU/mL)
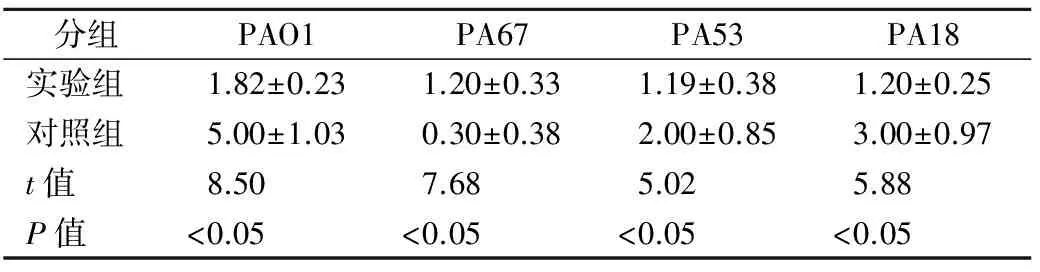
分组PAO1PA67PA53PA18实验组1.82±0.231.20±0.331.19±0.381.20±0.25对照组5.00±1.030.30±0.382.00±0.853.00±0.97t值8.507.685.025.88P值<0.05<0.05<0.05<0.05
2.3 阿司匹林分散24 h PA生物膜 当阿司匹林浓度为2.5 mg/mL时可显著分散PAO1和PA18形成的24 h生物膜,使PAO1生物膜总量A570 nm从2.357±0.095减少至1.022±0.112(t=6.45,P<0.05),使PA18生物膜总量A570 nm从1.298±0.060减少至0.352±0.255(t=6.26,P<0.05);浓度为1.25 mg/mL时可显著分散PA67形成的生物膜,使其生物膜总量A570 nm从2.461±0.154减少至1.053±0.271(t=7.82,P<0.05);而0.313 mg/mL阿司匹林即可显著分散PA53形成的生物膜,使其生物膜总量A570 nm从2.418±0.069减少至2.041±0.014(t=9.18,P<0.05),且阿司匹林对PA生物膜的分散作用亦呈现出明显的剂量依赖性。见图2。此外,当阿司匹林的浓度为2.5 mg/mL时能显著减少成熟24 h PAO1、PA67、PA53和PA18生物膜中活菌的数量(P均<0.05)。见表2。
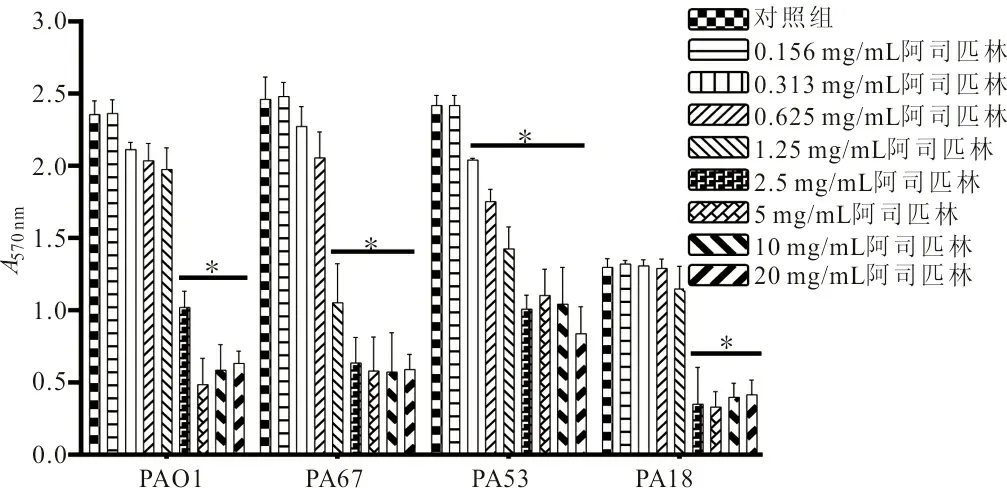
注:*,各组分别与未加药的对照组相比,P<0.05。
图2 阿司匹林分散PA已形成的24 h生物膜
表2 阿司匹林对PA生物膜分散活菌计数的影响(×108CFU/mL)
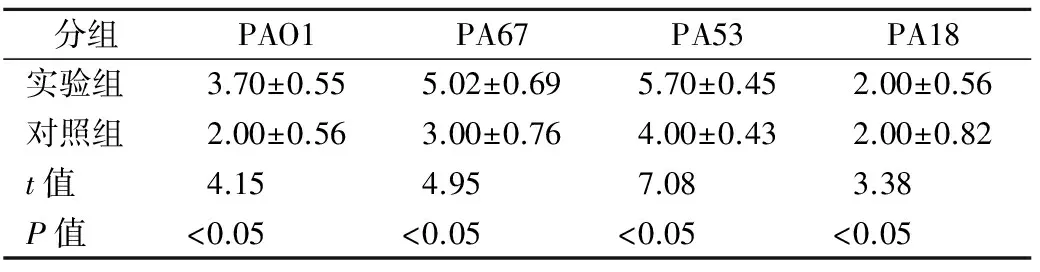
分组PAO1PA67PA53PA18实验组3.70±0.555.02±0.695.70±0.452.00±0.56对照组2.00±0.563.00±0.764.00±0.432.00±0.82t值4.154.957.083.38P值<0.05<0.05<0.05<0.05
2.4 阿司匹林抑制PA的初始粘附 当阿司匹林浓度为2.5 mg/mL时能显著抑制PA的初始粘附,与未加药的阴性对照组相比,可分别使PAO1、PA18和PA53的粘附率从100%减少至(55.00±5.11)%(t=8.21,P<0.05)、(46.47±4.32)%(t=13.58,P<0.05)和(62.68±6.53)%(t=6.39,P<0.05);当阿司匹林浓度为1.25 mg/mL时就能显著抑制PA67的初始粘附能力,使其粘附率从100%下降至(42.86±2.30)%(t=11.75,P<0.05)。且随着阿司匹林的浓度升高,其抑制作用明显增强。见图3。
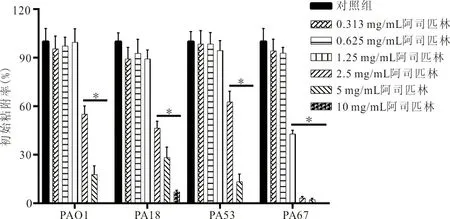
注:*,各组分别与未加药的对照组相比,P<0.05。
图3 阿司匹林抑制PA的初始粘附
3 讨论
前期体外研究发现,阿司匹林具有广泛的抗真菌、细菌和病毒的作用[5]。此外,阿司匹林与传统抗生素联用时,还具有协同抑制真菌的作用[7]。然而,有关阿司匹林对生物膜状态下细菌的影响还尚未完全阐明。
本研究发现,阿司匹林能有效抑制或分散PA生物膜。此作用可能是通过干扰PA的群体感应(quorum sensing,QS)系统而实现。QS系统是细菌间进行信号分子交流的系统,调节着生物膜的整个生理周期,对生物膜的形成至关重要。PA的QS系统主要由las、rhl和pqs3条主要通路构成,其共同受到lasI/R上游调节系统的调控。PA QS系统之间的信号分子主要包括两种:3-OH-C12-HSL和C4-HSL。研究发现,阿司匹林不仅能抑制QS系统相关基因如lasI、lasR、rhlI、rhlR、pqsR和pqsA的表达,还能与3-OH-C12-HSL和C4-HSL信号分子竞争受体,影响下游信号的转导[8]。
本研究发现阿司匹林能显著抑制PA的初始粘附能力。PA的生物膜形成过程大致分为4个主要步骤:(1)细菌的初始粘附;(2)生物膜形成期;(3)生物膜成熟期;(4)生物膜分散期[9-10]。其中,细菌的初始粘附期是生物膜形成的第一步,决定着生物膜的形成与否。PA的初始粘附通常发生在细菌与介质表面接触的前30 min左右。这段时间内,PA通过自身鞭毛的摆动,逐渐游向介质表面,并通过菌毛及其他粘附因子与介质表面粘附,定植后形成后期生物膜成熟的基础平台[10]。而本研究发现,阿司匹林能有效抑制PA的初始粘附,可能是通过抑制细菌鞭毛运动能力,并抑制PA纤毛和某些粘附因子的表达而完成,从而达到阻断生物膜的形成。
本研究测得阿司匹林的MIC及有效抑制生物膜浓度值达到mg/mL级别,这可能会进一步增加阿司匹林在人体内的毒副作用,超过人体的耐受量。但后期研究或开发应用可以考虑将阿司匹林与常规抗生素联合应用,减少阿司匹林剂量的同时促进抗生素杀灭细菌生物膜的效果,同时延缓细菌的耐药性。总之,阿司匹林能有效抑制PA浮游菌的生长、初始粘附能力和生物膜的形成,并能进一步分散已形成的24 h生物膜,有望开发成为新型抗PA生物膜药物,解决临床棘手问题。
[1]Gonçalves-de-Albuquerque CF, Silva AR, Burth P,etal. Possible mechanisms ofPseudomonasaeruginosa-associated lung disease[J]. Int J Med Microbiol, 2016, 306(1): 20-28.
[2]Rybtke M, Hultqvist LD, Givskov M,etal.Pseudomonasaeruginosabiofilm infections: community structure, antimicrobial tolerance and immune response[J]. J Mol Biol, 2015, 427(23): 3628-3645.
[3]Marr AK, Overhage J, Bains M,etal. The Lon protease ofPseudomonasaeruginosais induced by aminoglycosides and is involved in biofilm formation and motility[J]. Microbiology, 2007, 153(Pt2): 474-482.
[4]屈琳,刘凤霞.亚抑菌浓度头孢他啶对铜绿假单胞菌生物膜的影响[J]. 临床检验杂志, 2016, 34(8): 590-593.
[5]Zhou Y, Wang G, Li Y,etal. In vitro interactions between aspirin and amphotericin B against planktonic cells and biofilm cells ofCandidaalbicansandC.parapsilosis[J]. Antimicrob Agents Chemother, 2012, 56(6): 3250-3260.
[6]Nesse LL, Berg K, Vestby LK. Effects of norspermidine and spermidine on biofilm formation by potentially pathogenicEscherichiacoliandSalmonellaentericawild-type strains[J]. Appl Environ Microbiol, 2015, 81(6): 2226-2232.
[7]Rosato A, Catalano A, Carocci A,etal. In vitro interactions between anidulafungin and nonsteroidal anti-inflammatory drugs on biofilms ofCandidaspp[J]. Bioory Med Chem, 2016, 24(5): 1002-1005.
[8]El-Mowafy SA, Abd El Galil KH, El-Messery SM,etal. Aspirin is an efficient inhibitor of quorum sensing, virulence and toxins inPseudomonasaerugunosa[J]. Microb Pathog, 2014, 74: 25-32.
[9]Berne C, Ducret A, Hardy GG,etal. Adhesins involved in attachment to abiotic surfaces by gram-negative bacteria[J]. Microbiol Spectr, 2015, 3(4): MB-0018-2015.
[10]Santiago C, Lim KH, Loh HS,etal. Inhibitory effect ofDuabangagrandifloraon MRSA biofilm formation via prevention of cell-surface attachment and PBP2a production[J]. Molecules, 2015, 20(3): 4473-4482.
(本文编辑:刘群)
Effects of aspirin on formation and dispersion ofPseudomonasaeruginosabiofilm
WANGYang-xia1,GAOGe1,ZHENGTao-tao2
(1.DepartmentofLaboratoryMedicine,XiangyaMedicalSchoolofCentralSouthUniversity,Changsha410013,Hunan; 2.DepartmentofInfectiousDiseases,LixianRedCrossHospital,Lixian415000,Hunan,China)
Objective To explore the effects of aspirin on formation and dispersion ofPseudomonasaeruginosa(P.aeruginosa) biofilm. Methods The broth microdilution method was used to detect the minimal inhibitory concentration(MIC) of aspirin forP.aeruginosa. The anti-biofilm effects of aspirin onP.aeruginosawere determined on the microtiter plates combined with crystal violet staining. The serial dilution method for counting colony number on microtiter plate was used to explore the effects of aspirin on initial adherence ofP.aeruginosa. Results The MIC values of aspirin against PAO1, PA18, PA53 and PA67 strains ofPseudomonasaeruginosawere 5, 2.5, 5 and 5 mg/mL respectively. Aspirin significantly inhibited the formation and dispersion of the biofilm of PAO1 and PA18 strains(t=5.65,P<0.05 andt=5.06,P<0.05 for inhibition;t=6.45,P<0.05 andt=6.26,P<0.05 for dispersion) at the concentration of 2.5 mg/mL. Similar effects were also found in the determination for PA67 and PA53 strains(t=6.45,P<0.05 andt=6.26,P<0.05 for inhibition;t=7.82,P<0.05;t=9.18,P<0.05 for dispersion) at aspirin concentration of 1.25 and 0.313 mg/mL respectively. Aspirin inhibited the initial adherence ofP.aeruginosaat the concentration of 2.5 mg/mL(P<0.05). Conclusion Aspirin could significantly inhibit the initial adherence and biofilm formation ofP.aeruginosaand disperse the 24 hour-formed mature bioiflm.
aspirin;Pseudomonasaeruginosa;biofilm;initial attachment;crystal violet staining
湖南省自然科学基金(2015JJ4073);湖南省教育厅科学研究项目(15C0145);中南大学研究生自主探索创新课题(2016zzts501)。
王央霞,1990年生,女,大学本科,医学检验专业。
高戈,讲师,E-mail:ggboxy@163.com。
10.13602/j.cnki.jcls.2017.04.02
R446.5
A
2016-11-14)
