含2H吡唑结构的甲酰腙衍生物的合成与抗菌活性研究
2017-05-23王海潮李红侠
王海潮,李红侠
宿州学院生物与食品工程学院,宿州,234000
含2H吡唑结构的甲酰腙衍生物的合成与抗菌活性研究
王海潮,李红侠
宿州学院生物与食品工程学院,宿州,234000
合成了8个含2H吡唑结构的甲酰腙衍生物,并运用通过核磁共振氢谱、碳谱、质谱、元素分析对化合物进行了分析表征,确定了化合物的组成和结构,同时测定了它们对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞菌的抑菌活性。结果表明:大部分化合物具有较好的抑制作用,其中化合物F4的抑菌效果最好,对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞菌的MIC浓度分别为0.39、0.78、0.78、1.57 μg/mL,优于对照药青霉素G和氯霉素。
2H吡唑;甲酰腙衍生物;合成;抗菌活性
酰腙化合物具有优良的生物活性、较低的毒性,以及抗肿瘤、抗菌、抗病毒、抗糖尿病等生物活性[1]。-CONHN=CH-基团在生化反应中起到转氮基作用,其中碳氮双键是该类化合物具有抗菌活性的效应基团[2],在农药、医药和分析试剂等方面一直是人们广泛研究的对象;同时该类化合物在治疗一些疾病和抑菌方面已有广泛的应用[3]。二氢吡唑类氮杂环化合物广泛分布在自然界中,具有较强的生物活性,如抗炎、抗糖尿病、抗高血压、抗抑郁、抗惊厥、镇静、麻醉、止痛等性能[4-10],而有关含二氢吡唑结构的甲酰腙衍生物的抗菌活性研究相对较少。
为了进一步探索酰腙类衍生物以及二氢吡唑类类化合物作为母体的生物活性,根据生物活性叠加原理,将上述两类化合物的核心结构进行拼接和修饰,以研制出抗菌活性更高、谱更广而且毒性较低的高效抗菌药物。本文选择萘甲醛和苯乙酮为原料,合成含萘环的查尔酮,再和对氨基苯甲酸甲酯反应生成含二氢吡唑环的苯甲酸甲酯,然后与水合肼反应生成苯甲酰肼化合物,最后与苯甲醛反应生成8种新型含二氢吡唑结构的甲酰腙化合物。通过核磁共振氢谱(1H-NMR)、核磁共振碳谱(13C-NMR)、质谱(ESI-MS)、元素分析(EA)以及熔点分析对化合物进行表征,并测试它们对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞菌的抑菌活性。
1 实验部分
1.1 实验仪器与试剂
实验仪器:X-4 MP显微熔点测定仪(北京泰克有限公司),Varian XL-400 型核磁光谱仪(美国Bruker公司),Mariner System 5304 型质谱仪(英国Isoprime公司),VarioE L111 CHN 元素分析仪(深圳市优科斯机电科技有限公司)。
试剂:对氨基苯甲酸甲酯、2-萘甲醛、苯乙酮、对甲氧基苯甲醛、乙醇、水合肼(80%,工业级)、醋酸、DMF等均为分析纯,购自国药集团化学试剂有限公司。
1.2 菌种
金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(B.subtilis)铜绿假单胞菌(P.Aeruginosa)和大肠杆菌(E.coli.),宿州学院生物与食品工程学院保藏。
1.3 实验路线
试剂和反应条件:(a)EtOH,KOH,室温,6~8 h;(b) C8H10N2O2,EtOH,HAc,80℃,20~24 h;(c)MeOH,N2H4·H2O(80%),DMF,70℃,20~24 h;(d)ArCHO,EtOH,HAc,室温,6~8 h。具体合成路线见图1。

图1 化合物F1~F8的合成路线

化合物R1R2R3R4F1FHHHF2HFHHF3HHFHF4HFHFF5HClHHF6HHClHF7HClClHF8HHBrH
1.4 实验方法1.4.1 查尔酮的合成
称取0.5 g(3.0 mmol) 2-萘甲醛和等物质量的不同取代基的苯乙酮3.0 mmol放入盛有25 mL无水乙醇的反应瓶中,加入过量的KOH(2 mL)作催化剂,在室温下反应6~8 h,得到黄色的沉淀产物,过滤,用石油醚和乙酸乙酯(5∶1)的混合物洗涤沉淀3次,得到含有不同取代基的查尔酮C1~C8。
1.4.2 含二氢吡唑环的苯甲酸甲酯的合成
在20 mL乙醇溶液中加入0.46 g(3.0 mmol) 对氨基苯甲酸甲酯和等摩尔C1~C8,在80℃下回流反应20~24 h,生成淡黄色的含二氢吡唑环的苯甲酸甲酯产物,所得粗产物在乙醇、乙酸乙酯和丙酮(1∶1∶0.5)混合试剂中重结晶,得到纯产物D1~D8。
1.4.3 苯甲酰肼化合物的生成
取D1-D83.0 mmol 加到10 mL DMF 溶剂中使其完全溶解,逐滴加入过量的水合肼(80%)5 mL,在20 mL甲醇溶液中70℃下回流反应20~24 h,取出,加50 mL水有沉淀析出,用3倍体积的乙酸乙酯萃取,重复3次。收集有机层,用无水硫酸钠除水,真空抽滤除去有机溶剂,得到含二氢吡唑环的苯甲酰肼化合物的中间产物E1~E8。
1.4.4 目标化合物的合成
向50 mL圆底烧瓶中加入对氧基苯甲醛2.0 mmol、E1~E82.0 mmol、无水乙醇20 mL,再加1 mL醋酸作催化剂,室温下反应6~8 h,待反应物反应完全,停止反应。反应液析出固体,抽滤,用少量乙醇洗涤固体,所得沉淀产物用石油醚和乙酸乙酯(V/V=2∶1)经过200~300目的硅胶柱过柱,产物即目标化合物F1~F8。
1.5 抑菌实验
微生物敏感性实验用对倍稀释法,测定药物的最低抑菌浓度(MIC)。细菌菌株采用革兰氏阳性菌(金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(B.subtilis))和革兰氏阴性菌(铜绿假单胞菌(P.Aeruginosa)和大肠杆菌(E.coli)),实验用培养基为牛肉膏蛋白胨培养基,供试菌经斜面培养基活化,接入液体培养基,于37℃摇床培养24 h 稀释备用。将目标化合物用50% DMSO溶液配置成浓度为0.5 mg/mL的母液,用PBS缓冲液对倍稀释到100,50,25,12.5,6.25,3.13,1.57,0.78,0.39 μg/mL,加入到无菌的96孔板中,每孔180 μL,每个浓度做3个平行;用青霉素G和氯霉素稀释相同倍数的浓度作阳性对照。待菌悬液浓度为5×107~5×108CFU/mL时,每孔再加入20 μL菌悬液继续在37℃无菌培养18 h,记录细菌不再生长的的浓度,即为MIC浓度。
2 结果与讨论
2.1 化合物的结构分析
所合成的化合物F1~F8都经过1H-NMR、13C-NMR、ESI-MS、EA以及熔点分析确证。目标化合物的1H NMR 中,MeO-的化学位移在δ3.79,ArH的化学位移在δ6.99~7.94范围内,NH在δ7.98~8.02之间,=CH在δ8.3左右,见图2。所有产物均为固体,但氟取代的化合物为淡黄色,氯为橘黄色,溴为棕黄色固体,所合成的化合物颜色随卤素取代基的原子量的增加而加深;产率在62%~90%之间;熔点在236~246℃之间。
2.1.1 4-(3-(2-氟)-5-(2-萘基)-4,5-二氢吡唑)-4-甲氧基苯甲酰腙 (F1)
淡黄色固体,产率,85.32%.m.p.244℃~246℃。1H NMR (400 MHz,DMSO-d6):3.29~3.34(dd,J1=5.52 Hz,J2=5.72 Hz,1H);3.79 (s,3H);4.11~4.18 (dd,J1=12.20 Hz,J2=12.32 Hz,1H);5.80~5.84 (dd,J1=5.60 Hz,J2=5.28 Hz,1H);6.99~7.01 (d,J=8.16 Hz,2H);7.13~7.15(d,J=8.48 Hz,2H);7.28~7.33(t,2H);7.40~7.52(m,5H);7.61~7.63(d,J=7.92 Hz,2H);7.73~7.75 (d,J=8.40 Hz,2H);7.88~7.94 (m,3H);7.98~8.02 (t,1H);8.30 (s,1H);11.42 (s,1H).13C NMR (100 MHz,DMSO-d6):163.53,162.31,161.08,149.22,146.85,146.76,139.62,133.42,132.88,129.66,129.40,128.85,128.97,128.94,128.94,128.77,128.71,128.24,128.07,127.57,126.61,125.08,124.24,123.30,116.16,114.74,112.49,63.23,60.43,55.73,43.42。MS m/z:[M+H]+543.6 (C34H28FN4O2)。
2.1.2 4-(3-(3-氟)-5-(2-萘基)-4,5-二氢吡唑)-4-甲氧基苯甲酰腙 (F2)
淡黄色固体,产率,75.6%,m.p.240℃~242℃。1H NMR (400 MHz,DMSO-d6):3.29~3.35(dd,J1=5.56 Hz,J2=5.76 Hz,1H);3.79 (s,3H);4.02~4.09(dd,J1=12.28 Hz,J2=12.48 Hz,1H);5.84~5.88(dd,J1=5.64 Hz,J2=5.48 Hz,1H);6.99~7.01(d,J=8.48 Hz,2H);7.14~7.17(d,J=8.84 Hz,2H);7.24~7.28(t,1H);7.38~7.40(d,J=8.52 Hz,1H);7.48~7.54(m,3H);7.61~7.67(dd,J1=8.44 Hz,J2=7.80 Hz,4H);7.72~7.74(d,J=8.68 Hz,2H);7.88~7.93(m,4H);8.29(s,1H);11.42(s,1H)。13C NMR(100 MHz,DMSO-d6):163.08,162.32,161.09,149.11,146.82,146.64,139.82,133.32,132.90,129.65,129.40,128.99,128.97,128.94,128.95,128.76,128.72,128.24,128.07,127.57,126.65,125.02,124.24,123.30,116.16,114.72,112.45,63.36,60.24,55.72,43.42。MS m/z:[M+H]+543.6 (C34H28FN4O2)。
2.1.3 4-(3-(4-氟)-5-(2-萘基)-4,5-二氢吡唑)-4-甲氧基苯甲酰腙(F3)
淡黄色固体,产率,62.50%。m.p.236℃~238℃。1H NMR(400 MHz,DMSO-d6):3.28~3.34(dd,J1=5.52 Hz,J2=5.64 Hz,1H);3.79(s,3H);4.02~4.09(dd,J1=7.08 Hz,J2=5.44 Hz,1H);5.80~5.84(dd,J1=5.68 Hz,J2=5.52 Hz,1H);6.99~7.01(d,J=8.48 Hz,2H);7.11~7.13 (d,J=8.80 Hz,2H);7.29~7.33(t,2H);7.38~7.40(dd,J1=1.28 Hz,J2=1.12 Hz,1H);7.49~7.51(t,2H);7.61~7.63(d,J=8.28 Hz,2H);7.72~7.74(d,J=8.68 Hz,2H);7.86~7.93(m,6H);8.29(s,1H);11.41(s,1H)。13C NMR (100 MHz,DMSO-d6):163.93,163.06,162.29,161.07,149.00,146.87,146.66,139.82,133.39,132.90,129.66,129.40,128.99,128.97,128.94,128.94,128.77,128.71,128.24,128.07,127.57,126.61,125.08,124.24,123.30,116.16,114.74,112.49,63.33,60.23,55.71,43.42。MS m/z:[M+H]+543.6(C34H28FN4O2)。
2.1.4 4-(3-(3,5-二氟)-5-(2-萘基)-4,5-二氢吡唑)-4-甲氧基苯甲酰腙 (F4)
黄色固体,产率,69.3%。m.p.238℃~240℃。1H NMR(400 MHz,DMSO-d6):3.30~3.36(dd,J1=5.52 Hz,J2=7.92 Hz,1H);3.79(s,3H);3.99~4.07(dd,J1=12.36 Hz,J2=12.44 Hz,1H);5.87~5.92(dd,J1=5.64 Hz,J2=5.52 Hz,1H);6.99~7.01(d,J=8.40 Hz,2H);7.17~7.19(d,J=8.80 Hz,2H);7.29~7.33(t,1H);7.38~7.40(d,J=8.48 Hz,1H);7.48~7.54(m,4H);7.61~7.63(d,J=8.28 Hz,2H);7.72~7.74(d,J=8.68 Hz,2H);7.88~7.94 (m,4H);8.29(s,1H);11.43 (s,1H)。13C NMR (100 MHz,DMSO-d6):163.09,161.07,153.53,149.96,146.85,146.58,133.93,139.14,133.41,132.89,129.66,129.63,129.37,128.92,128.22,128.07,127.86,127.56,126.98,126.59,124.92,124.26,123.18,114.75,112.44,104.02,63.17,56.46,55.73,43.51。MS m/z:[M+H]+561.6 (C34H27F2N4O2)
2.1.5 4-(3-(3-氯)-5-(2-萘基)-4,5-二氢吡唑)-4-甲氧基苯甲酰腙 (F5)
橘黄色固体,产率,87.21%。m.p.241℃~243℃。1H NMR(400 MHz,DMSO-d6):3.29~3.34(dd,J1=5.48 Hz,J2=5.64 Hz,1H);3.79(s,3H);4.01~4.08(dd,J1=12.16 Hz,J2=12.48 Hz,1H);5.84~5.88(dd,J1=5.52 Hz,J2=5.60 Hz,1H);6.98~7.00(d,J=8.48 Hz,2H);7.14~7.16(d,J=8.88 Hz,2H);7.38~7.44(m,2H);7.49~7.51(t,2H);7.60~7.62 (d,J=7.12 Hz,3H);7.72~7.74(d,J=8.76 Hz,2H);7.80~7.82 (d,J=7.80 Hz,1H);7.87~7.93 (m,4H);8.01(s,1H);8.29(s,1H);11.41(s,1H)。13C NMR (100 MHz,DMSO-d6):170.21,163.07,161.09,149.72,14690,146.43,139.52,134.32,133.32,132.90,131.37,129.67,129.40,129.35,128.28,128.08,127.56,126.98,126.66,125.11,124.24,123.51,114.75,112.60,63.20,55.72,43.42。MS m/z:[M+H]+560.0 (C34H28ClN4O2)。
2.1.6 4-(3-(4-氯)-5-(2-萘基)-4,5-二氢吡唑)-4-甲氧基苯甲酰腙(F6)
橘黄色固体,产率,66.67%。m.p.237℃~239℃。1H NMR(400 MHz,DMSO-d6):3.27~3.32(dd,J1=5.44 Hz,J2=5.62 Hz,1H);3.79(s,3H);4.01~4.06(dd,J1=5.92 Hz,J2=7.32 Hz,1H);5.81~5.86(dd,J1=5.72 Hz,J2=5.56 Hz,1H);6.98~7.00(d,J=8.48 Hz,2H);7.13~7.15(d,J=8.80 Hz,2H);7.38~7.40 (dd,J1=1.40 Hz,J2=1.36 Hz,1H);7.49~7.54(dd,J1=4.00 Hz,J2=8.64 Hz,4H);7.61~7.63(d,J=8.28 Hz,2H);7.72~7.74(d,J=8.68 Hz,2H);7.83~7.93(m,6H);8.30(s,1H);11.42(s,1H)。13C NMR (100 MHz,DMSO-d6):170.81,163.01,161.08,148.79,146.89,146.47,139.73,134.11,133.39,132.90,131.27,129.67,129.40,129.25,128.20,128.08,127.56,126.98,126.63,125.11,124.24,123.51,114.75,112.60,63.40,60.22,55.72,43.19。MS m/z:[M+H]+560.0 (C34H28ClN4O2)。
2.1.7 4-(3-(3,4-二氯)-5-(2-萘基)-4,5-二氢吡唑)-4-甲氧基苯甲酰腙 (F7)
橘黄色固体,产率,3.45%。m.p.243℃~245℃。1H NMR(400 MHz,DMSO-d6):3.32~3.37(dd,J1=5.44 Hz,J2=5.64 Hz,1H);3.79(s,3H);4.01~4.08(dd,J1=12.60 Hz,J2=12.60 Hz,1H);5.85~5.90(dd,J1=5.80 Hz,J2=5.48 Hz,1H);6.98~7.00(d,J=8.48 Hz,2H);7.15~7.17(d,J=8.80 Hz,2H);7.38~7.40(d,J=8.48 Hz,1H);7.49~7.51(t,2H);7.61~7.63(d,J=8.20 Hz,2H);7.71~7.74(t,3H);7.79~7.82 (dd,J1=1.72 Hz,J2=1.72 Hz,1H);7.87~7.93(m,4H);8.02(s,1H);8.29 (s,1H);11.42(s,1H)。13C NMR (100 MHz,DMSO-d6):163.08,161.07,149.89,146.78,146.47,139.52,134.32,133.39,132.87,131.27,129.67,129.40,129.25,128.20,128.08,127.56,126.98,126.33,125.11,124.24,123.51,114.75,112.60,60.52,55.72,43.42。MS m/z:[M+H]+594.5(C34H27Cl2N4O2)。
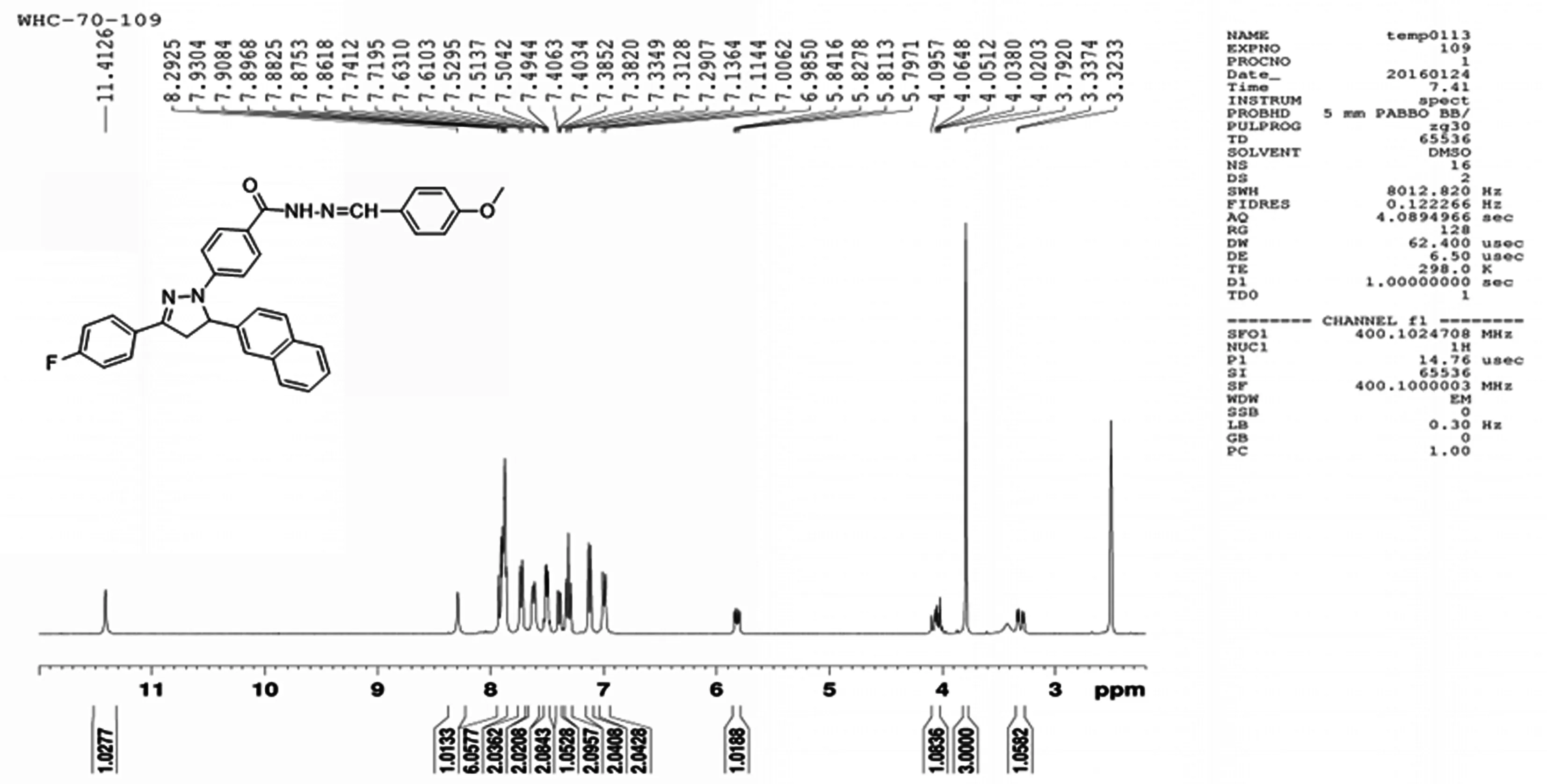
图2 F3化合物1H-NMR谱图
2.1.8 4-(3-(4-溴)-5-(2-萘基)-4,5-二氢吡唑)-4-甲氧基苯甲酰腙(F8)
棕黄色固体,产率,70.90%。m.p.238℃~240℃。1H NMR(400 MHz,DMSO-d6):3.26~3.32(dd,J1=5.44 Hz,J2=5.68 Hz,1H);3.79(s,3H);4.01~4.08(dd,J1=11.96 Hz,J2=12.12 Hz,1H);5.81~5.85(dd,J1=5.60 Hz,J2=5.44 Hz,1H);6.98~7.00(d,J=8.00 Hz,2H);7.13~7.15(d,J=8.48 Hz,2H);7.38~7.40 (d,J=8.32 Hz,1H);7.49~7.51(t,2H);7.61~7.67(dd,J1=8.04 Hz,J2=8.44 Hz,4H);7.72~7.77(t,4H);7.87~7.93(m,4H);8.29(s,1H);11.41(s,1H)。13C NMR (100 MHz,DMSO-d6):163.00,161.08,148.86,146.89,146.47,139.71,133.38,132.90,131.60,129.67,129.40,128.94,128.43,128.25,127.55,126.98,126.63,125.11,124.23,123.53,122.83,114.75,112.61,63.40,55.73,43.12。MS m/z:[M+H]+604.5(C34H28BrN4O2)。

图3 F3化合物13C-NMR谱图
2.2 抑菌数据分析
化合物F1~F8的抑菌活性见表2。所有化合物的MIC浓度在0.39~100 μg/mL之间,大部分化合物对革兰氏阳性菌和阴性菌有较好的抑菌效果,且同一化合物的抑菌效果对阳性菌优于对阴性菌。在这些化合物中,F4的抑菌效果最好,优于对照药青霉素G和氯霉素。F4对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞菌的MIC浓度分别为0.39、0.78、0.78和1.57 μg/mL;青霉素G 和氯霉素对相应的菌种的MIC浓度为0.78、0.78、1.57、3.13 μg/mL和1.57、1.57、3.13、6.25 μg/mL。
从表2可以看出,化合物的取代基的个数、取代基的位置以及不同元素的取代基对化合物的抑菌效果有重要影响。从取代基的个数看,双取代基的活性大于单取代基,例如F4含有2个-F取代基,其抑菌活性大于F1、F2和F3(均含有一个-F取代基);F7含有2个-Cl取代基,活性大于含有一个取代基的F5和F6。从取代基的位置看,间位>邻位>对位,从对金黄色葡萄球菌的抑菌效果看,F2(0.78μg/mL)>F1(1.57μg/mL)>F3(3.13μg/mL);F5>F6。从不同元素取代基看,氟>氯>溴,F1~F4(-F)对同一菌种的抑菌活性>F5~F7(-Cl) >F8(-Br)。
注:所有数据平行测定3次取平均值。
3 结束语
本文以萘甲醛和苯乙酮为起始原料,经过醛酮缩合、亲核加成、酰肼反应和酰腙反应生成含2H吡唑结构的甲酰腙衍生物,通过核磁共振氢谱(1H-NMR) 、核磁共振碳谱(13C-NMR) 、质谱(ESI-MS)、元素分析(EA)对化合物进行了结构表征,并测试了它们对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞菌的抑菌活性,大部分化合物具有良好的抗菌活性。
[1]倪振杰,薛思佳,王静,等.1-取代哌啶-4-酮芳甲酰腙的合成及其抗白血病活性[J].有机化学,2011,32(2):222-226
[2]Park H J,Lee K,Park S J,et al.Identification of antitumor activity of pyrazole oxime ethers[J].Bioorg Med Chem Lett,2005,15:3307-3312
[3]郭应臣,陈欣,卓立宏.水杨酸阱的合成、表征及抑菌活性[J].化学研究与应用,2004,16(4):580-582
[4]Yuan J,Wang S,Luo Z,et al.Synthesis and biological evaluation of compounds which contain pyrazole,thiazole and naphthalene ring as antitumor agents[J].Bioorganic & Medicinal Chemistry Letters,2014,24:2324-2328
[5]Park H J,Lee K,Park,et al.Synthesis and antibacterial activity of a novel series of potent DNA gyrase inhibitors.Pyrazole derivatives[J].J Med Chem,2004,47:3693-3696
[6]Sridhar R,Perumal P T,Etti S,et al.Design,synthesis and anti-microbial activity of 1H-pyrazole carboxylates[J].Bioorg Med Chem Lett,2004,14:6035-6040
[7]Bebernitz G R,Argentieri G,Battle B,et al.The effect of 1,3-diaryl-[1H]-pyrazole-4-acetamides on glucose utilization in ob/ob mice[J].J Med Chem,2001,44:2601-2611
[8]Li-Weber M.New therapeutic aspects of flavones:the anticancer properties of Scutellaria and its main active constituents Wogonin,Baicalein and Baicalin[J].Cancer Treat Rev,2009,35:57-68
[9]Neuhouser M L.Dietary flavonoids and cancer risk:evidence from human population studies[J].Nutr Cancer,2004,50:1-7
[10]Tao X X,Duan Y T,Chen L W,et al.Design,synthesis and biological evaluation of pyrazolyl-nitroimidazole derivatives as potential EGFR/HER-2 kinase inhibitors[J].Bioorg Med Chem Lett,2016,26:677-683
(责任编辑:汪材印)
2017-01-09
安徽省高校优秀青年人才支持计划一般项目(gxyq2017091);宿州学院自然科学研究重点项目“含二氢吡唑骨架的香豆素衍生物的设计、合成及生物活性研究”(2016yzd04)。
王海潮(1977-),安徽宿松人,硕士,讲师,研究方向:药物合成。
10.3969/j.issn.1673-2006.2017.03.028
TQ450.1;O626.2
A
1673-2006(2017)03-0100-06
