FOXO1在乳腺癌中的表达及临床意义
2017-05-19陈宝英张英黄胜超颜泽铭何敢
陈宝英,张英,黄胜超,颜泽铭,何敢
(广东医学院附属医院肿瘤中心1、乳腺科2,广东 湛江 524001)
FOXO1在乳腺癌中的表达及临床意义
陈宝英1,张英1,黄胜超2,颜泽铭2,何敢2
(广东医学院附属医院肿瘤中心1、乳腺科2,广东 湛江 524001)
目的 探讨FOXO1在乳腺癌发生发展过程中的作用及其临床意义。方法选取2012年6月至2013年1月在广东医学院附属医院经病理证实的乳腺癌组织、癌旁正常乳腺组织、乳腺良性病变组织分别50例、37例、20例,采用免疫组织化学法及实时荧光定量PCR法(RT-PCR)检测各组标本的FOXO1蛋白及mRNA的表达。结果FOXO1蛋白在癌性组的染色阳性率为46.0%,而在良性组和癌旁组中阳性率分别为75.0%、70.2%;RT-PCR检测结果显示,癌性组、癌旁组、良性组的FOXO1 mRNA表达量分别为(0.526±0.011)、(0.885±0.017)、(0.841±0.026),FOXO1蛋白及FOXO1 mRNA在癌性组标本中的表达均较癌旁组及良性组明显降低,差异均有统计学意义(P<0.05)。乳腺癌组织中FOXO1蛋白的表达及FOXO1 mRNA与肿瘤大小、腋窝淋巴结转移有关(P<0.05),而与患者绝经状态、年龄、人表皮生长因子受体2(Her-2)、雌激素受体(ER)、孕激素受体(PR)及Ki-67无关(P> 0.05)。结论FOXO1蛋白及mRNA的表达与乳腺癌肿瘤大小、腋淋巴结转移有关,可作为判断乳腺癌预后的生物学指标之一。
乳腺癌;FOXO1;免疫组化;实时荧光定量PCR
FOXO1是具有潜在抗肿瘤血管生成及转移的抑癌基因,它的表达缺失或下降与肿瘤的发生发展有密切关系。相关研究表明FOXO1在细胞凋亡、细胞增殖和代谢等多种生理效应中起重要作用。很多人类肿瘤,如弥漫性大B细胞淋巴瘤、结肠癌、胃癌、甲状腺癌等均发现FOXO1的表达缺失,并且与疾病的发生密切相关[1-6]。而在乳腺癌中关于FOXO1的表达的研究报道尚未见到。本研究检测乳腺癌组织中FOXO1的表达,探讨FOXO1与乳腺癌的关系,现将结果报道如下:
1 资料与方法
1.1 一般资料 收集2012年6月至2013年1月在广东医学院附属医院经病理证实的乳腺癌标本50例,癌旁乳腺组织标本(病理证实无癌性病变的乳腺组织)37例,乳腺良性组织20例。所有乳腺癌患者均未接受任何化疗、放疗、内分泌治疗及靶向治疗;乳腺良性病变的患者包括乳腺纤维腺瘤16例、纤维囊性乳腺病3例、乳腺腺病1例。50例乳腺癌患者年龄26~83岁,其中<50岁24例,≥50岁26例;乳腺浸润性导管癌40例,浸润性小叶癌6例,乳腺黏液癌3例,混合型1例。乳腺癌分期根据2002年美国癌症联合会(AJCC)的分期标准进行分期:其中Ⅰ~Ⅱ期39例,Ⅲ期11例;27例患者腋窝淋巴结有转移,23例患者腋窝淋巴结无转移。
1.2 主要试剂 兔抗人FOXO1单克隆抗体购自北京博奥森生物科技有限公司;免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司;Trizol总RNA提取试剂盒D9108B、逆转录试剂盒RR036A、逆转录试剂盒RR036A均购自大连宝生物工程公司。
1.3 检测方法
1.3.1 免疫组化检测FOXO1的表达 标本用10%甲醛固定,石蜡包埋,常规切片;免疫组织化学SP染色按照试剂盒操作步骤进行。结果判断采用IP评分[7-8]:①染色强度,细胞无染色:0分,淡黄色:1分,棕黄色:2分,棕褐色:3分;②阳性细胞数,染色细胞数< 10%:0分;染色细胞数10%~30%:1分;染色细胞数31%~60%:2分;染色细胞数>60%:3分。两项乘积,计分>2分为阳性,计分<2则为阴性。
1.3.2荧光实时定量PCR检测FOXO1 mRNA 在http://www.ncbi.nlm.nih.gov/pubmed查找所需基因的序列,用Primer PREMIER5.0设计并筛选引物,到http:// blast.ncbi.nlm.nih.gov/Blast.cgi上将所设计的引物进行同源性分析。设计引物FOXO1-F:5'-CCAGCCCAAA CTACCAAAAATA-3'和FOXO1-R:5'-GAGGAGAGTCAGAAGTCAGCAAC-3'。进行PCR扩增,产物长度为165 bp。PCR的主要步骤:95℃5 s,60℃30 s,40 cycles;95℃5 s,60℃ 1 min,95℃1 cycle,50℃30 s。结果计算采用目前常用的2-ΔΔCt方法来进行相对定量分析。
1.4 统计学方法 应用SPSS17.0统计软件进行数据分析,计量资料以均数±标准差(x-±s)表示,组间两两比较采用t检验,计数资料比较采用χ2检验,相关性分析采用Spearman检验,以P<0.05为差异有统计学意义。
2 结果
2.1 FOXO1蛋白的表达情况 FOXO1蛋白主要表达于胞膜和胞质,FOXO1蛋白在乳腺癌组织中的染色阳性率为46.0%(23/50),而在乳腺良性病变和癌旁乳腺组织中阳性率分别为75.0%(15/20)、70.3% (26/37)。FOXO1蛋白在乳腺癌组织中的阳性表达与在癌旁组织中的阳性表达差异有统计学意义(P< 0.01);FOXO1蛋白在乳腺癌组织中的阳性表达与在乳腺良性病变组织中的阳性表达比较差异有统计学意义(P<0.01);FOXO1蛋白在乳腺癌旁组织中的阳性表达与在乳腺良性病变组织中的阳性表达比较差异无统计学意义(P>0.05)。表明FOXO1蛋白在乳腺癌组织中的表达显著下调,见图1。
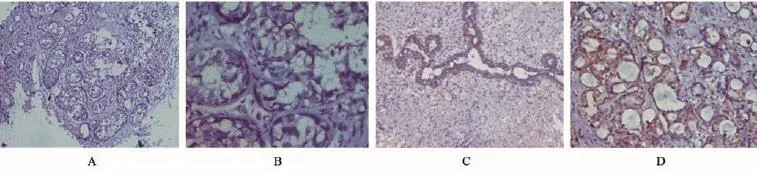
图1 FOXO1蛋白在不同乳腺组织中的表达(免疫组化SP法)
2.2 FOXO1表达与临床病理参数关系 FOXO1蛋白在乳腺癌组织中的阳性表达与腋窝淋巴结转移、肿瘤大小有关,差异均有统计学意义(P<0.05),肿瘤直径大于2 cm较小于2 cm、腋窝淋巴结有转移较无转移、晚期较早期的乳腺癌组织中FOXO1蛋白阳性表达率低;FOXO1蛋白表达与年龄、绝经状态、人表皮生长因子受体2(Her-2)、雌激素受体(ER)、孕激素受体(PR)、Ki-67表达无关,差异均无统计学意义(P>0.05),见表1。
2.3 FOXO1 mRNA的表达情况 RT-PCR结果显示,癌性组、癌旁组、良性组的FOXO1 mRNA表达量(lg△Ct)分别为(0.526±0.011)、(0.885±0.017)、(0.841± 0.026),FOXO1 mRNA在乳腺癌癌性组表达显著降低,差异均有统计学意义(P<0.05),见表2。
2.4 FOXO1 mRNA表达与临床病理参数的关系 RT-PCR显示,FOXO1 mRNA在早期、肿瘤直径小、不伴淋巴结转移的乳腺癌组织中FOXO1 mRNA的相对表达量较高(P<0.05);不同绝经状态、不同年龄阶段及不同Her-2、ER、PR、Ki-67的乳腺癌组中FOXO1 mRNA阳性表达率差异均无统计学意义(P> 0.05),见表1。

表1 FOXO1蛋白表达及FOXO1 mRNA表达与乳腺癌临床病理参数的关系
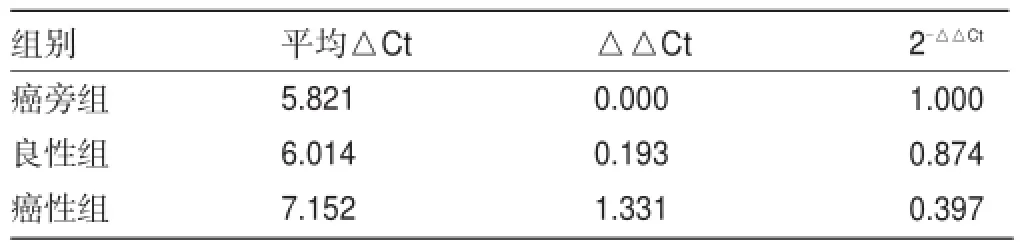
表2 不同组别FOXO1 mRNA的相对表达量
3 讨 论
乳腺癌是常见的恶性肿瘤之一,其发病率高居女性肿瘤的首位,且发病年龄呈年轻化,女性一生中患乳腺癌的概率为10%,每年约50万人死于该病并以2%~3%的速度逐年递增[9-12]。而针对乳腺癌的治疗主要采用手术、放疗、化疗、内分泌治疗、靶向治疗等治疗方法,虽然可以延长患者的生存时间,但复发和转移的比率仍较高[13-14]。因此研究寻找乳腺癌的早期诊断指标和治疗的新靶点任重而道远。
FOXO作为Forkhead转录因子大家族最重要的一个亚群,广泛表达于人体的各种正常组织中[15]。FOXO亚群由FOXO1、FOXO3a、FOXO4和FOXO6四个成员组成[16]。FOXO转录因子参与许多生理和病理过程,包括细胞凋亡、细胞周期阻滞、糖代谢、细胞分化和发展、肿瘤抑制等。环境条件的变化如生长因子、营养、氧化应激和照射,可以调节FOXO蛋白的活动,从而确保在细胞中的特异转录程序。人体内通过翻译后修饰如磷酸化、乙酰化、甲基化、泛素化、亚细胞定位,以及直接的蛋白质相互作用来调节FOXO的活动[17]。近来的研究证实了FOXO是PI3k/Akt信号通路的下游靶点基因,包括FOXO1、FOXO3a、FOXO4,其中自噬活性因子FOXO1在肿瘤的发生发展中发挥重要作用[18]。而p53与FOXO具有相似的靶基因,提示这两种蛋白在细胞内可能起协同作用抑制肿瘤的发生[19]。此外,FOXO与SMAD转录因子结合形成复合体,通过上调p21的表达,引起细胞周期G1期停止[20]。因此重新激活FOXO1转录因子的活性可能成为治疗这类肿瘤的一种新策略[21]。
本研究应用免疫组织化学方法及RT-PCR法检测乳腺癌组织、乳腺良性病变组织、癌旁乳腺组织中FOXO1蛋白的表达,发现FOXO1蛋白在乳腺癌组织中的阳性表达率明显低于乳腺良性病变和癌旁乳腺组织的阳性表达率(P<0.05),而乳腺良性病变与癌旁组织的阳性表达率差异无统计学意义(P>0.05);RT-PCR检测结果发现FOXO1 mRNA在乳腺癌组织中呈低表达水平,仅为癌旁正常组的0.397倍,与正常组织及癌旁组织比较差异有显著统计学意义(P< 0.05)。而FOXO1 mRNA在乳腺良性病变组织中表达减少不显著,而乳腺良性病变组织及正常组织相比较差异无统计学意义(P>0.05)。提示FOXO1可能参与乳腺癌的发病过程,但FOXO1参与乳腺癌发病过程的具体机制尚需要进一步研究。
本研究通过分析FOXO1与淋巴结转移、肿瘤大小等临床病理参数之间的关系,发现FOXO1蛋白在乳腺癌组织中的阳性表达与腋窝淋巴结转移、肿瘤大小有关,差异有统计学意义(P<0.05),肿瘤直径大于2 cm较小于2 cm、腋窝淋巴结有转移较无转移乳腺癌组织中FOXO1蛋白阳性率低;FOXO1蛋白表达与绝经状态、年龄、临床分期、Herb-2、ER、PR、Ki67表达无关,经χ2检验,差异无统计学意义(P>0.05)。FOXO1 mRNA的表达与绝经状态、年龄、Her-2、ER、PR、Ki-67差异无统计学意义(P>0.05);而肿瘤直径大于2 cm较小于2 cm表达强度显著减少(P<0.05),淋巴结无转移的乳腺癌组织较淋巴结转移的乳腺癌组织表达强度明显减少(P<0.05);TNM分期早期的乳腺癌组织中FOXO1 mRNA表达量明显升高(P<0.05)。肿瘤的大小及腋窝淋巴结转移情况与乳腺癌患者的预后密切相关,FOXO1蛋白及mRNA的表达与乳腺癌肿瘤大小、腋淋巴结转移有关,提示FOXO1可能与乳腺癌的预后有关,但能否成为判断乳腺癌患者预后的生物学指标尚需要大量的深入研究。
[1]Nakamura N,Ramaswamy S,Vazquez F,et al.Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN[J].Mol Cell Biol,2000,20(23):8969-8682.
[2]Zhang H,Pan Y,Zheng L,etal.FOXO1 inhibits Runx2 transcriptionalactivity and prostate cancer cell migration and invasion[J].Cancer Res,2011,71(9):3257-3267.
[3]Trinh DL,Scott DW,Morin RD,et al.Analysis of FOXO1 mutations in diffuse large B-cell lymphoma[J].Blood,2013,121(18): 3666-3674.
[4]Zhao Y,Li X,Ma K,et al.The axis of MAPK1/3-XBP1u-FOXO1 controls autophagic dynamics in cancer cells[J].Autophagy,2013,9 (5):794-796.
[5]Diep CH,Charles NJ,Gilks CB,et al.Progesterone receptors induce FOXO1-dependent senescence in ovarian cancer cells[J].Cell Cycle,2013,12(9):1433-1449.
[6]Essers MA,de Vries-Smits LM,Barker N,et al.Functional interaction between beta-catenin and FOXO in oxidative stress signaling [J].Science,2005,308(5725):1181-1184.
[7]黄水传,梁忠锃,张远起,等.TIP30在乳腺癌中的表达及其与血管生成的关系[J].广东医学,2013,34(9):1372-1375.
[8]何敢,喻嫦娥,吴海滨,等.NuSAP在乳腺癌中的表达及临床意义[J].中国普通外科杂志,2015,24(5):707-711.
[9]周源,刘新梅.VEGF-A在乳腺癌中的新认知及进展[J].海南医学, 2015,26(5):696-698.
[10]Jemal A,Sieqel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[11]韩婷婷,叶长生,刘民锋,等.中国1973—2009年女性乳腺癌死亡率流行趋势[J].广东医学,2014,35(12):1931-1933.
[12]胡小辉,黄胜超,吴海滨,等.Hiwi在乳腺癌组织中的表达及其临床意义[J].实用医学杂志,2014,30(24):3976-3978.
[13]陈博,韦尉东.miRNA在乳腺癌耐药中的作用及其相关机制的研究进展[J].广东医学,2014,35(17):2791-2794.
[14]陈俊妮,袁波,林洁,等.5年内复发的乳腺癌临床特点分析[J].海南医学,2014,25(18):2726-2728.
[15]Anderson MJ,Viars CS,Czekay S,et al.Cloning and characterization of three human forkhead genes that comprise an FKHR-like gene subfamily[J].Genomics,1998,47(2):187-199.
[16]Huang H,Tindall DJ.Dynamic FoxO transcription factors[J].J Cell Sci,2007,120(Pt15):2479-2487.
[17]Lu H,Huang H.FOXO1:a potential target for human diseases[J]. Curr Drug Targets,2011,12(9):1235-1244.
[18]Huang H,Regan KM,Wang F,et al.Skp2 inhibits FOXO1 in tumor suppression through ubiquitin-mediated degradation[J].Proc Natl Acad Sci U S A,2005,102(5):1649-1654.
[19]Greer EL,Brunet A.FOXO transcription factors at the interface between longevity and tumor suppression[J].Oncogene,2005,24(50): 7410-7425.
[20]Seoane J,Le HV,Shen L,et al.Integration of Smad and forkhead pathways in the control of neuroepithelial and glioblastoma cell proliferation[J].Cell,2004,117(2):211-223.
[21]Singh A,Plati J,Khosravi-Far R.Harnessing the tumor suppressor function of FOXO as an alternative therapeutic approach in cancer [J].Curr Drug Targets,2011,12(9):1311-1321.
Expression of FOXO1 gene in breast carcinoma and its clinical significance.
CHEN Bao-ying1,ZHANG Ying1, HUANG Sheng-chao2,YAN Ze-ming2,He-gan2.Department of Oncology1,Department of Breast Surgery2,Affiliated Hospitalof Guangdong Medical University,Zhanjiang 524001,Guangdong,CHINA
ObjectiveTo investigate the occurrence and development of FOXO1 gene process and its clinical significance in breastcarcinoma.MethodsThe protein and mRNAexpression of FOXO1 gene were detected in 50 cases of breastcarcinoma,20 cases of benign breastlesion and 37 cases of adjacentnormalbreasttissue by an immunohistochemical method(steptavidin peroxidase,SP)and fluorescence-based real-time reverse transcription PCR(RT-PCR). These tissue samples were taken from the patients who admitted to the Affiliated Hospital of Guangdong Medical College from June 2012 to January 2013.ResultsThe positive rate of FOXO1 protein in the cancer group was 46.0%, while the positive rates in the benign group and the adjacent group were respectively 75.0%and 70.2%.The results of RT-PCR showed that the expression of FOXO1 mRNA in the cancer group,the adjacent cancer group and the benign group were(0.526±0.011),(0.885±0.017),(0.841±0.026),respectively;the protein and mRNA expression of FOXO1 gene in the cancer group were significantly lower than those in the adjacent cancer group and benign group(P<0.05). The protein and mRNAexpression of FOXO1 gene was associated with tumor size,lymph node metastasis(P<0.05),but ithad no relationship with menopausalstatus,age,HER2 receptor protein(HER2),estrogen receptor(ER),progesterone receptor(PR),Ki67(P>0.05).ConclusionThe protein and mRNA expression of FOXO1 gene is associated with tumor size and axillary lymph node metastasis,which means that FOXO1 can be used as one of the biologicalparameters to determine the prognosis of breastcarcinoma.
Breastcarcinoma;FOXO1;Immunohistochemistry;Real-time quantitative PCR
R737.9
A
1003—6350(2017)09—1383—04
10.3969/j.issn.1003-6350.2017.09.003
2016-10-03)
陈宝英。E-mail:xgjrwk@163.com
