新型Rho激酶抑制剂WAR5抑制APP/PS1小鼠炎性反应的作用研究
2017-05-18辛延乐谷青芳于婧文姜维佳肖保国尉杰忠马存根
吴 昊,辛延乐,谷青芳,于婧文,姜维佳,柴 智,肖保国,4,尉杰忠*,马存根,*
(1.山西医科大学第一临床医学院神经内科,山西 太原 030001;2.山西大同大学脑科学研究所,山西 大同 037009;3.山西中医学院“2011”协同创新中心/神经生物学研究中心,山西 太原 030024;4.复旦大学华山医院神经病学研究所,上海 200025)
新型Rho激酶抑制剂WAR5抑制APP/PS1小鼠炎性反应的作用研究
吴 昊1,2,辛延乐1,2,谷青芳2,于婧文2,姜维佳3,柴 智3,肖保国2,4,尉杰忠2*,马存根1,2,3*
(1.山西医科大学第一临床医学院神经内科,山西 太原 030001;2.山西大同大学脑科学研究所,山西 大同 037009;3.山西中医学院“2011”协同创新中心/神经生物学研究中心,山西 太原 030024;4.复旦大学华山医院神经病学研究所,上海 200025)
目的探讨新型Rho激酶抑制剂WAR5对阿尔茨海默病( Alzheimer disease,AD)的治疗效果及其作用机制。方法雌性APP/PS1双转基因小鼠(鼠龄8月),随机分为AD组和WAR5治疗组。WAR5组腹腔注射WAR5化合物,AD组腹腔注射生理盐水,持续2个月。水迷宫实验检测各组小鼠的认知功能;免疫荧光,Western blot技术检测AD相关病理及炎症信号通路的变化,包括Aβ,p-tau,TLR4和p-NF-κB。结果与AD组比较,WAR5治疗能有效改善APP/PS1双转基因小鼠认知功能,减少AD标志性病理产物Aβ,p-tau的产生(P<0.05)。同时能够下调中枢神经系统内TLR4(P<0.05),p-NF-κB的表达水平(P<0.05)。结论WAR5对APP/PS1双转基因小鼠认知功能改善有效。WAR5可能成为治疗AD的一个候选药。
WAR5化合物;阿尔茨海默病;Rho激酶抑制剂;磷酸化核转录因子-κB
在进入老龄化社会后,阿尔茨海默病(Alzheimer Disease,AD)越来越受关注。β-淀粉样蛋白(β-amyloid,Aβ)是老年斑(Senile plaques,SP)的核心成分,与胞内过度磷酸化Tau蛋白聚集形成的神经原纤维缠结(neurofibrillary tangles,NFTs)共同为AD关键病理产物。有研究表明,Toll样受体/核因子-κB信号通路激活参与AD脑内的炎症反应,已发现其高表达与病理产物Aβ的聚集呈正相关[1,2]。Rho/Rho激酶(Rho kinase,ROCK)作为机体内广泛存在的一种信号传递通路,参与炎症反应、细胞凋亡等生命活动。近来研究发现,在AD时有ROCK的激活和表达,而应用ROCK抑制剂进行干预后均可改善临床症状和病理状况[3]。WAR5是本实验室使用的一种新型的Rho激酶抑制剂[4],本实验主要探讨了WAR5对APP/PS1双转基因小鼠的治疗效果及对TLR4与磷酸化NF-κB的抑制作用。
1 材料与方法
1.1 实验材料
水迷宫软件SMART V3.0及硬件购自深圳瑞沃德生命科技有限公司;酶标仪购买于Thermo公司;凝胶成像分析仪购自Bio-Rad;BCA蛋白定量试剂盒购自中国碧云天生物技术有限公司;一抗Aβ,p-tau,TLR4,p-NF-κB和β-actin等抗体购自cell signaling,Western blot二抗购自cell signaling,免疫组化二抗购自cell signaling;冰冻切片机购自Leica;WAR5化合物由天津红日药业股份有限公司提供。
研究对象:8月龄,体重26~28 g,雌性APP/PS1双转基因小鼠
1.2 主要方法
1.2.1 动物分组及给药处理
雌性APP/PS1双转基因小鼠在洁净级动物室正常喂养,随机分为AD组和WAR5组,每组8只,WAR5组腹腔注射WAR5化合物2个月(40 mg/kg/天),AD组腹腔注射相同剂量生理盐水。
1.2.2 水迷宫实验
水迷宫硬件设备是由直径为80 cm的圆形水池及直径为9 cm的站台组成,水温(25.0±0.5)℃,液面高出平台区(即SW区)2 cm。整个水迷宫硬件设备分为4个象限(NW,NE,SW,SE)和八个区域(Border NW zone,Internal NW zone,Border NE zone,Internal NE zone,Border Internal SW zone,Border SE zone,Internal SE zone),平台在SW区。
学习训练:周期为5天,每天上下午各一次,将小鼠从东西南北四个方向随机放入水池,训练小鼠从起点到达平台,时长60 s/次;如果在60 s期间小鼠不能成功到达平台,则进行引导,小鼠在平台停留60 s。
认知功能测定:训练结束后,进行5天的认知功能测定,将小鼠从东西南北四个方向随机放入水池,自由游动60秒,SMART V3.0系统控制的摄像头跟踪并记录以下指标:在平SW区活动度占总活动度的比例(Global Activity in SW (%))、入水到平台时间(Latency to Target)、到平台路径距离(Mean Distance to Target)、第一次到达SW区时间(Latency 1st Entrance to SW)、在SW区滞留时间占总时间的比例(Time in SW(%))、在SW区路径距离占总路径距离的比例(Distance in SW (%))。
1.3 标本采集
行为学实验后,0.3%戊巴比妥钠麻醉,生理盐水心脏灌注,各组4只取脑组织,提取蛋白,BCA定量,用于Western blot;其余小鼠生理盐水灌注,4%多聚甲醛灌流固定,分离脑,经10%、20%和30%蔗糖溶液梯度24小时脱水,OCT包埋,以10 μm厚度做冠状位冰冻连续切片,用于免疫荧光染色。
Western blot 蛋白样品(30 μg)与等体积的2×Laemnli上样缓冲液混匀,100 °C水浴5 min,10% SDS-PAGE不连续凝胶电泳分离。40 V湿式电转移2 h。PVDF 膜于5%脱脂牛奶封闭2 h。用5%脱脂牛奶分别稀释抗Aβ(1:1000)、抗p-tau(1:1000)、抗TLR4(1:1000)、抗p-NF-κB(1:1000)及抗β-actin(1:10000),分别加至膜上,4℃孵育过夜。次日1:10000稀释相应荧光偶联的二抗,室温孵育2 h。洗膜5 min,3次,Bio-Rad凝胶成像分析仪检测染色条带,以检测蛋白条带灰度与内参照β-actin 的灰度比值表示。
1.4 免疫荧光染色
冰冻切片经1×P B S洗5 m i n,3次;染抗A β(1:1000)、抗p-tau(1:1000)、抗TLR4(1:1000)、抗p-NF-κB(1:1000);4℃孵育过夜;次日1×PBS洗5 min,3次;AlexaFlour 555或AlexaFlour 488荧光标记的二抗室温孵育2 h;1×PBS洗5 min,3次,50%甘油封片镜检。
1.5 统计学处理
数据用均数±标准差(mean±SD)来表示,采用GraphPad Prism 5.0统计软件进行处理。组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 WAR5改善APP/PS1双转基因小鼠的认知功能
通过分析水迷宫实验的数据,我们发现,两组动物在Global Activity in SW (%)(图1a)没有变化,说明两组小鼠不存在体能上的差异。但是,WAR5治疗后,小鼠的Latency to Target(图1b)、Mean Distance to Target(图1c)以及Latency 1st Entrance to SW(图1d)均明显减少;Time in SW(%)(图1e)明显增加、Distance in SW (%)(图1f)明显增加。
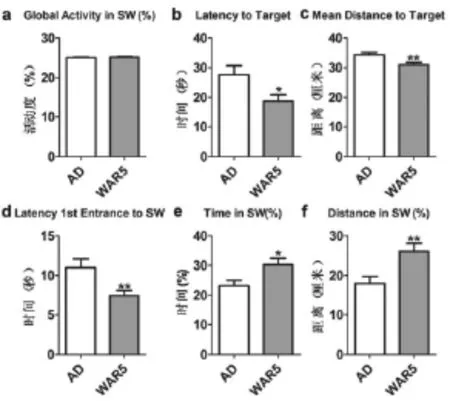
图1 不同组别动物行为学测试6项指标统计学比较
2.2 WAR5减少Aβ与p-tau的在中枢神经系统的表达
如图2a和2b所示,WAR5治疗可明显抑制Aβ和p-tau的表达 ;Western blot实验结果进一步证明WAR5治疗明显降低Aβ与p-tau在小鼠脑组织中的表达(图2c)。
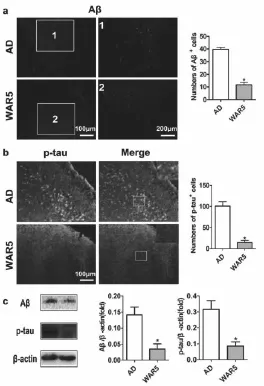
图2 不同组Aβ与p-tau免疫荧光染色及统计计数和Aβ与p-tau的Western blot结果
2.3 WAR5抑制TLR4与p-NF-κB的表达
本实验通过免疫荧光和Western blot技术进一步检测WAR5对该信号通路的影响,结果显示:WAR5治疗明显降低TLR4、p-NF-κB的表达(图3)。

图3 不同组p-NF-κB免疫荧光染色及统计计数和TLR4与p-NF-κB的Western blot结果
3 结 论
Rho激酶抑制剂可减少Aβ1-42 的产生[5]。作为临床上常用的ROCK激酶抑制剂,法舒地尔主要用于血管痉挛方面的治疗,后来研究发现其还具有抑制炎症、清除自由基及调控细胞活动等作用[6]。但却存在治疗的安全窗比较小、不易长期使用等诸多限制,因此选用一个副作用小,疗效确切的新型药物成为当务之急,本实验所选用的WAR5化合物是法舒地尔的异构体,有研究表明,WAR5与法舒地尔相比,可减少小鼠CNS内CD68+巨噬细胞和CD4+T细胞的浸润,推测WAR5可减少炎性细胞跨内皮细胞迁徙,减少BBB通透性,从而改善小鼠症状;并且WAR5扩血管作用小且治疗安全窗大[7]。因此我们可以推测,在安全且有效的剂量(40 mg/kg/天)使用范围内,WAR5治疗AD模型小鼠也具有安全窗大、给药后动物的存活率高等优点[4]
因此本实验探讨WAR5对AD的治疗效果和机制具有重要意义。AD临床上有明显的记忆和认知功能的损伤,并且进行性加重。水迷宫实验显示,AD组和WAR5组在到达平台区域的时间和距离以及活动的频率存在明显统计学差异,各项指标中WAR5组表现均优于AD组,说明WAR5可明显改善AD小鼠的认知和记忆能力。
AD病因和发病机制较为复杂,有研究表明Aβ的沉积可通过影响Tau蛋白的磷酸化促进NFTs的产生[8]。在炎症的环境下,神经元细胞也有可能通过自身代谢产生更多的Aβ,进一步扩大炎症反应[9]。TLRs/NF-κB信号通路激活所引起的炎症反应可能是AD发病中炎症损伤的一种重要机制。在AD病理中,Aβ沉积引起TLR4的表达增加,并且诱导NF-κB的激活,进一步加重组织损伤[10-11]。通过药物抑制TLRs/ NF-κB信号通路激活,降低机体炎症损伤已成为治疗AD的重要靶点,我们的实验结果显示WAR5可以明显降低APP/ PS1双转基因小鼠脑内Aβ和p-tau,TLR4/NF-κB蛋白的表达,预示WAR5在治疗AD方面具有一定的潜能。
综上所述,新型Rho激酶抑制剂WAR5对阿尔茨海默病的免疫炎症反应有明显的临床治疗和症状改善作用,包括改善了小鼠的认知和记忆能力,减少了AD的病理产物,对炎症反应进行了抑制。这可能为进一步探索AD损伤CNS后神经功能的恢复及其调控方法提供实验依据。
[1] Lue LF,Kuo YM,Beach T,et al.Microglia activation and antiinflammatory regulation in Alzheimer’s Disease[J].Mol Neurobiol,2010,41:115-128.
[2] Capiralla H,Vingtdeux V,Zhao HT,et a1.Resveratrol mitigates lipopolysaccharide and Aβ-mediated microglial inflammation by inhibiting the TLR4/NF-κB/STAT signaling cascade[J]. Neurochem,2012,120:461-472.
[3] Mueller BK,Mack H,Teusch N. Rho kinase,a promising drug target for neurological disorders[J].Nat Rev Drug Discov,2005,4(5):387-398.
[4] Li YH,Yu JZ,Xin YL,et al.Protective effect of a novel Rho kinase inhibitor WAR-5 in experimental autoimmune encephalomyelitis by modulating infammatory response and neurotrophic factors[J]. Experimental and Molecular Pathology,2015,99(2):220-228.
[5] Linterman MA,Rigby RJ,Wong RK,et al.Follicular helper T cells are required for systemic autoimmunity[J].J Exp Med,2009,206(3):561-576.
[6] Matsui T,Maeda M,Doi Y,et al.Rho-kinase phosphorylates COOH-terminal threonines of ezrin/radixin/moesin (ERM) proteins and regulates their head-to-tail association[J].J Cell Biol,2008,140(3):647-657.
[7] 辛延乐,李艳花,丁智斌,等.WAR5、Fasudil治疗EAE的疗效比较及作用机制研究[J].中国神经免疫学和神经病学杂志,2016,23(2):93-99.
[8] Ramser EM,Gan KJ,Decker H,et al.Amyloid–beta oligomers induce tau–independent disruption of BDNF axonal transport via calcineurin activation in cultured hippocampal neurons[J].Mol Biol Cell,2013,24(16):2494–2505.
[9] Sastre M,Walter J,Gentleman SM.Interactions between APP secretases and inflammatory mediators[J].Neuroinflammati on,2008,5(25):1-11.
[10] Combs CK,Karlo JC,Kao SC,and Landreth GE.β-amyloid stimulation of microglia anti monocytes results in TNF-αdependent expression of inducible nitric oxide synthase and neuronal apoptosis[J].Journal of Neuroscience,2001,21:1179-1188.
[11] M T H e n e k a,M K O'B a n i o n.I n f l a m m a t o r y processes in Alzheimer’s disease[J].Journal of Neuroimmunology,2007,184:69-91.
本文编辑:吴玲丽
Suppressive effect of WAR5,a novel Rho kinase inhibitor,on the infammatory responses of AD mice
WU Hao1,2, XIN Yan-le1,2, GU Qing-fang2, YU Jing-wen2, JIANG Wei-jia3, CHAI Zhi3, XIAO Bao-guo2,4, YU Jie-zhong2, MA Cun-gen1,2,3
(1.Department of Neurology, the First Clinical Medical College of Shanxi Medical University, Shanxi Taiyuan 030001, China; 2.Institute of Brain Science of Shanxi Datong University, Shanxi Datong 037009, China; 3."2011" Collaborative Innovation Center/Research Center of Neurobiology Shanxi University of Traditional Chinese Medicine,Shanxi Taiyuan 030024,China; 4.Institute of Neurology,Fudan University Huashan Hospital, Shanghai 200025, China)
ObjectiveTo explore the therapeutic effect and and mechanism of a novel Rho kinase inhibitor WAR5 on alzheimer disease (AD).MethodsFemale APP/PS1 transgenic mice were randomly divided into AD group and WAR5 group when mice grow to 8 months.The AD group received intraperitoneal injection by saline for 2 months,while the WAR5 group given the WAR5 compound during the same time.We used the Morris water maze test to measure the cognitive competence of each group.Then we used to immunofluorescence method and Western blot experiment to test changes of the relevant pathological and inflammatory signal pathways,such as Aβ,ptau,TLR4 and p-NF-κB.ResultsThrough the treat of WAR5,there is a better spatial learning and memory,WAR5 reduce the symbolic pathological products of AD,including Aβ,p-tau (P<0.05),and reduce the expression level of TLR4,p-NF-κB in central nervous system (P<0.05).ConclusionThe novel Rho kinase inhibitor WAR5 is effectively improve function of spatial learning and memory in APP/PS1 transgenic mice,thus WAR5 may be a candidate drug to treat the AD.
WAR5 compound; Alzheimer disease; Rho kinase inhibitor; P-NF-κB
R320.54
B
ISSN.2095-8242.2017.010.1805.03
国家自然科学基金(81272163、81471412);山西省回国留学人员重点科研资助项目(2014-重点7);山西省大同市科技局基础研究计划项目(2014105-1)
尉杰忠(1975-),男,副教授,硕士生导师
通讯作者:马存根(1960-),男,博士,教授,博导,E-mail:macungen2001@163.com
