以表阿霉素为基础的化疗对乳腺癌合并糖尿病患者心脏毒性的影响
2017-05-18孙芳毅王红芳刘英姿
孙芳毅,王红芳,施 靖,刘英姿
1.050011河北省石家庄市,河北医科大学第四医院心内科 2.050011河北省石家庄市,河北中医学院药学院 3.050011河北省石家庄市,河北医科大学第四医院科研处 4.050011河北省石家庄市,河北医科大学第四医院神经外科
·全科医生技能发展·
以表阿霉素为基础的化疗对乳腺癌合并糖尿病患者心脏毒性的影响
孙芳毅1,王红芳2*,施 靖3,刘英姿4
1.050011河北省石家庄市,河北医科大学第四医院心内科 2.050011河北省石家庄市,河北中医学院药学院 3.050011河北省石家庄市,河北医科大学第四医院科研处 4.050011河北省石家庄市,河北医科大学第四医院神经外科
目的 分析目前临床常用的以表阿霉素为基础的化疗对合并糖尿病的女性乳腺癌患者的心脏毒性。方法 选择2013年10月—2015年10月于河北医科大学第四医院乳腺中心行根治性肿瘤切除术后经病理检查明确为诊断乳腺癌的女性患者108例,均预行以表阿霉素为基础的化疗(表阿霉素+环磷酰胺),3周为1个疗程,共6个疗程。其中合并2型糖尿病患者55例作为糖尿病化疗组,不合并糖尿病患者53例作为非糖尿病化疗组。同时期于内分泌科门诊入选年龄匹配的无乳腺癌的女性2型糖尿病患者50例作为糖尿病对照组。乳腺癌患者均于应用化疗方案前(基线时)及化疗结束后、糖尿病对照组于入组时及4.5个月后测定常规指标、多普勒超声检查指标及氧化应激指标。结果 糖尿病化疗组最终入选50例患者,非糖尿病化疗组最终入选50例患者。基线时,糖尿病化疗组与糖尿病对照组总胆固醇、三酰甘油、糖化血红蛋白均高于非糖尿病化疗组(P<0.05);化疗结束后,3组患者Δ体质指数、Δ血压、Δ血红蛋白、Δ总胆固醇、Δ三酰甘油、Δ糖化血红蛋白比较(P>0.05)。基线时,糖尿病化疗组及糖尿病对照组左房室瓣舒张早期血流速度/左房室瓣舒张早期运动速度(E/Ea)高于非糖尿病化疗组(P<0.05);化疗结束后,糖尿病化疗组ΔEa低于糖尿病对照组及非糖尿病化疗组,ΔE/Ea高于糖尿病对照组及非糖尿病化疗组(P<0.05)。基线时,糖尿病化疗组及糖尿病对照组血清超氧化物歧化酶(SOD)低于非糖尿病化疗组,丙二醛(MDA)高于非糖尿病化疗组(P<0.05);化疗结束后,3组ΔSOD、ΔMDA组间两两比较,差异均有统计学意义(P<0.05)。结论 以表阿霉素为基础的化疗导致女性乳腺癌合并糖尿病患者出现了明显加重的心脏舒张功能受损,提示同时合并糖尿病加重了以表阿霉素为基础的化疗对心脏的损害。
乳腺肿瘤;糖尿病;表阿霉素;心脏毒素类;放化疗,辅助
慢性及迟发性心脏毒性是指在蒽环类药物化疗后数月或数年发生的心脏损害,早期表现为可逆性左心室组织和功能的亚临床心脏损害[1],进一步发展则可出现左心功能障碍,严重者可出现扩张型心肌病,最终发生充血性心力衰竭。如果在亚临床心脏损害阶段进行早期治疗,可使心功能障碍完全改善[2-3]。因此早期监测和提前预防蒽环类药物引起的心脏毒性尤为重要。
已有大量研究证实2型糖尿病与乳腺癌相关,糖尿病患者中乳腺癌的发病率约增加20%[4-5]。然而目前针对乳腺癌合并糖尿病患者行辅助化疗的临床研究,国内外均少有报道。本研究以合并糖尿病的女性乳腺癌患者为观察对象,行以表阿霉素为基础的化疗,于化疗前后应用组织多普勒以及氧化应激指标进行评估,旨在分析以表阿霉素为基础的辅助化疗对合并糖尿病的女性乳腺癌患者的心脏毒性。
1 资料与方法
1.1 临床资料 选择2013年10月—2015年10月于河北医科大学第四医院乳腺中心行根治性肿瘤切除术后经病理检查明确诊断为乳腺癌的女性患者108例,均按照国际标准化指南预行以表阿霉素为基础的辅助化疗(表阿霉素+环磷酰胺)6个疗程。其中合并2型糖尿病[6]患者55例为糖尿病化疗组,平均年龄为(55.2±3.8)岁;不合并糖尿病患者53例为非糖尿病化疗组,平均年龄为(54.9±2.7)岁。同期于本院内分泌科门诊选择与上述两组患者年龄匹配的无乳腺癌的女性2型糖尿病患者50例作为糖尿病对照组,平均年龄为(54.8±4.1)岁。3组患者的年龄间差异无统计学意义(F=0.180,P=0.835)。研究对象均签署知情同意书,研究方案及患者知情同意书均经河北医科大学第四医院伦理委员会审核通过,临床试验注册号 ChiCTR-IPR-16007759。
1.2 纳入标准 (1)血压<140/90 mm Hg(1 mm Hg=0.133 kPa);(2)超声心动图示左心室射血分数(LVEF)≥50%;(3)肝肾功能正常;(4)未合并应用血管紧张素转化酶抑制剂(ACEI)、β-受体阻滞剂、钙通道抑制剂及类固醇类等药物;(5)未服用维生素C、维生素E等影响氧化应激指标的药物;(6)采血前1周内无2型糖尿病急性并发症、无严重2型糖尿病慢性并发症,未发生创伤、手术、感染等急性应激事件;(7)正常窦性心律。
1.3 排除标准 (1)高血压史、甲状腺功能亢进及减低史、肝肾疾病史;(2)冠心病、充血性心力衰竭及目前存在症状者、心肌病及瓣膜病等明确的结构性心脏疾病史;(3)放、化疗史;(4)心电图示缺血性ST-T段改变、病理性Q波及完全性左束支传导阻滞、房室传导阻滞、持续性心房扑动、心房颤动、房性心动过速和/或起搏心律。
1.4 方法
1.4.1 研究方案 乳腺癌患者化疗方案为EC(表阿霉素+环磷酰胺)方案,表阿霉素80 mg/m2(d1)+环磷酰胺 500 mg/m2(d1)静脉注射,每3周为1个疗程,共6个疗程。乳腺癌患者于应用化疗方案前(基线时)及化疗结束后(第2次),糖尿病对照组于入组时(基线时)及4.5个月后(第2次)测定常规指标(身高、体质量、血压、血红蛋白、总胆固醇、三酰甘油、糖化血红蛋白),同时行经胸多普勒超声检查及氧化应激指标测定。
1.4.2 多普勒超声检查 使用Philips IE33型彩色多普勒超声显像仪,配备S5-1心脏探头,探头频率为2~5 MHz。用改良的Simpson′s法计算LVEF。采用脉冲多普勒左房室瓣血流频谱法,测量左房室瓣舒张早期血流速度(E)。启动组织多普勒成像模式,将脉冲多普勒取样容积依次置于左房室瓣环间隔部及外侧壁,测量2个位点的左房室瓣环收缩期速度峰值(Sa)、左房室瓣环舒张早期运动速度(Ea)并计算均值,计算2个位点的E/Ea。测量时各指标取5个心动周期的平均值。多普勒超声检查均由1位经验丰富的超声医师严格按照美国超声心动图检査操作指南[7]进行,并由另1位高年资超声医师审核。
1.4.3 氧化应激指标测定 研究对象均于禁食12 h后清晨空腹抽取肘静脉血5 ml,2 000 r/min离心10 min,提取血清,分装后置-80 ℃超低温冰箱保存。待标本集齐后,同期测定。采用黄嘌呤氧化酶法测定血清超氧化物歧化酶(SOD),硫代巴比妥酸法测定血清丙二醛(MDA)。
计算所有测定指标化疗结束后与基线时差值,用Δ表示。

2 结果
2.1 3组一般情况 糖尿病化疗组中3例患者出现严重骨髓抑制、1例患者出现严重肝功能损害、1例患者失访而退出研究,最终50例患者入选。非糖尿病化疗组中2例患者出现严重骨髓抑制、1例患者出现严重肝功能损害而退出研究,最终50例患者入选。糖尿病化疗组与非糖尿病化疗组患者化疗结束时均无肿瘤相关死亡、肿瘤复发及心力衰竭症状。两组患者表阿霉素总剂量480mg/m2,环磷酰胺总剂量3 000mg/m2。糖尿病化疗组与非糖尿病化疗组乳腺癌分期比较,差异无统计学意义(P<0.05),糖尿病对照组与糖尿病化疗组糖尿病史、糖尿病用药情况比较,差异均无统计学意义(P>0.05,见表1)。
2.2 3组常规指标比较 基线时,3组体质指数、血压、血红蛋白比较,差异均无统计学意义(P>0.05);糖尿病化疗组与糖尿病对照组总胆固醇、三酰甘油、糖化血红蛋白均高于非糖尿病化疗组,差异有统计学意义(P<0.05)。化疗结束后,3组患者Δ体质指数、Δ血压、Δ血红蛋白、Δ总胆固醇、Δ三酰甘油、Δ糖化血红蛋白比较,差异均无统计学意义(P>0.05,见表2)。
2.3 3组多普勒超声检查指标比较 基线时,3组LVEF、Sa、Ea比较,差异无统计学意义(P>0.05);糖尿病化疗组及糖尿病对照组E/Ea高于非糖尿病化疗组,差异有统计学意义(P<0.05)。化疗结束后,3组ΔLVEF、ΔSa比较,差异无统计学意义(P>0.05);糖尿病化疗组△Ea低于糖尿病对照组及非糖尿病化疗组,ΔE/Ea高于糖尿病对照组及非糖尿病化疗组,差异均有统计学意义(P<0.05)。
2.4 3组氧化应激指标比较 基线时,糖尿病化疗组及糖尿病对照组SOD低于非糖尿病化疗组,MDA高于非糖尿病化疗组,差异有统计学意义(P<0.05)。化疗结束后,3组ΔSOD、ΔMDA组间两两比较,差异均有统计学意义(P<0.05,见表4)。
3 讨论
3.1 多普勒超声检查指标变化LVEF是临床常用的检测指标,但只有当心肌严重受损或心脏整体功能受损时才会出现异常改变,因此不适合早期检测亚临床心肌功能损害,而经多普勒超声检查的收缩功能参数Sa及舒张功能参数Ea、E/Ea可提前检测出患者左心室局部收缩及舒张功能是否减退[8-10],多项研究发现蒽环类药物早期主要影响心脏的舒张功能[11-12]。LOTRIONTE等[13]观察到在应用蒽环类药物后LVEF无明显变化,而E/Ea则持续下降。本研究显示,化疗结束后,非糖尿病化疗组与糖尿病对照组比较,ΔLVEF、ΔSa、ΔEa、ΔE/Ea均无明显差异,提示在近4.5个月的观察期内无明显心脏毒性表现,这与目前国内外多项研究结果一致[14],进一步证实目前临床常规采用的较低剂量的表阿霉素辅助化疗,在无糖尿病的乳腺癌患者中应用是相对安全的。
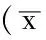
表4 3组氧化应激指标比较±s)
注:SOD=超氧化物歧化酶,MDA=丙二醛;与非糖尿病化疗组比较,aP<0.05;与糖尿病化疗组比较,bP<0.05

表1 3组患者临床资料
注:a为t值,-代表无此数据

表2 3组常规指标比较
注:与非糖尿病化疗组比较,aP<0.05

表3 3组多普勒超声检查指标比较±s)
注:LVEF=左心室射血分数,Sa=左房室瓣环收缩期速度峰值,Ea=左房室瓣环舒张早期运动速度;与非糖尿病化疗组比较,aP<0.05;与糖尿病化疗组比较,bP<0.05
在2型糖尿病患者中,心脏舒张功能障碍是其唯一早期异常表现[15-16]。本研究显示,与非糖尿病化疗组基线时比较,糖尿病化疗组及糖尿病对照组心脏舒张功能参数E/Ea升高,而收缩功能参数LVEF、Sa无明显差异,表明糖尿病患者在基线时即存在心脏舒张功能受损状态;化疗结束后,与非糖尿病化疗组及糖尿病对照组比较,糖尿病化疗组舒张功能参数ΔEa明显降低、ΔE/Ea明显升高,表明蒽环类药物化疗导致糖尿病患者心脏舒张功能受损。从而提示同时合并糖尿病在加重蒽环类药物化疗心脏损害方面发挥着重要作用。
3.2 氧化应激指标变化 蒽环类药物诱导心脏毒性的主要机制可能是通过螯合铁离子触发心肌的氧化应激反应,促进氧自由基、尤其是羟自由基生成,从而导致心肌细胞线粒体DNA受损以及心肌细胞膜脂质过氧化等,最终导致心肌细胞凋亡。SOD及MDA是常用的评估氧化应激水平的指标。本研究观察到化疗结束后,非糖尿病化疗组较糖尿病化疗组ΔSOD明显降低,ΔMDA明显升高,进一步证实表阿霉素可以降低体内清除自由基的能力,产生过多的脂质过氧化产物,从而可能导致心肌细胞的损伤。
高血糖能够破坏机体天然的抗氧化机制,因此氧化应激参与了糖尿病整个发病过程[17-18]。本研究显示,与非糖尿病化疗组基线时比较,糖尿病化疗组及糖尿病对照组SOD明显降低、MDA明显升高。表明糖尿病患者在基线时即存在机体氧化应激损伤,抗氧化能力被削弱。化疗结束时后,与非糖尿病化疗组及糖尿病对照组比较,糖尿病化疗组ΔSOD、ΔMDA均明显升高。表明糖尿病患者应用表阿霉素化疗后,尽管剂量相对较低,但仍降低了患者体内的抗氧化能力,导致更多的脂质过氧化产物的堆积,进而可能导致心肌细胞损伤加重。
总之,本研究以女性乳腺癌合并糖尿病患者为观察对象,探讨应用蒽环类药物化疗后发生的心肌损害情况。本研究应用的化疗方案为表阿霉素+环磷酰胺,理论上不能完全排除环磷酰胺对心脏的影响。有研究显示环磷酰胺导致的心脏损伤主要表现为大剂量(>1.55 g·m-2·d-1)应用后,于治疗后1~3周内发生急性心脏损伤[19],主要为致命性心力衰竭。本研究采用的环磷酰胺剂量为500 mg·m-2·d-1,同时所有患者于观察期限内未出现心力衰竭临床表现。故考虑本研究检测到的心脏损害表现仍与表阿霉素有关。另外样本量较小,观察时间较短,本研究结论有待于更大规模试验进一步验证。
作者贡献:孙芳毅进行文章的构思与设计,文章的可行性分析,文献/资料的收集、整理,撰写论文;施靖、刘英姿进行论文的修订,英文的修订;孙芳毅、王红芳负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1] ZUPPINGER C,TIMOLATI F,SUTER T M.Pathophysiology and diagnosis of cancer drug induced cardiomyopathy[J].Cardiovasc Toxicol,2007,7(2):61-66.DOI:10.1007/s12012-007-0016-2.
[2] CARDINALE D,COLOMBO A,LAMANTIA G,et al.Anthracycline-induced cardiomyopathy:clinical relevance and response to pharmacologic therapy[J].J Am Coll Cardiol,2010,55(3):213-220.DOI:10.1016/j.jacc.2009.03.095.
[3] AIROLDI M,AMADORI D,BARNI S,et al.Clinical activity and cardiac toler ability of non-pegylated liposomal doxorubicin in breastcancer:a synthetic review[J].Tumori,2011,97(6):690-692.DOI:10.1700/1018.11082.
[4] LIPSCOMBE L L,FISCHER H D,AUSTIN P C,et al.The association between diabetes and breast cancer stage at diagnosis:a population-based study[J].Breast Cancer Res Treat,2015,150(3):613-620.DOI:10.1007/s10549-015-3323-5.
[5] BOYLE P,BONIOL M,KOECHLIN A,et al.Diabetes and breast cancer risk:a meta-analysis[J].Br J Cancer,2012,107(9):1608-1617.DOI:10.1038/bjc.2012.414.
[6] Canadian Diabetes Association Clinical Practice Guidelines Expert Committee,GOLDENBERG R,PUNTHAKEE Z.Definition,classification and diagnosis of diabetes,prediabetes and metabolic syndrome[J].Can J Diabetes,2013,37 Suppl 1:S8-11.DOI:10.1016/j.jcjd.2013.01.011.
[7] LANG R M,BIERIG M,DEVEREUX R B,et al.Recommendations for chamber quantification:a report from the American Society of Echocardiography′s Guidelines and Standards Committee and the Chamber Quantification Writing Group,developed in conjunction with the European Association of Echocardiography,a branch of the European Society of Cardiology[J].J Am Soc Echocardiogr,2005,18(12):1440-1463.DOI:10.1016/j.echo.2005.10.005.
[8] SANDERSON J E,YIP G W K.Heart failure with a normal ejection fraction[J].Circulation,2009,338:652.DOI:10.1136/bmj.6 52.
[9] IWAHASHI N,KIMURA K,KOSUGE M,et al.E/e′two weeks after onset is a powerful predictor of cardiac death and heart failure in patients with a first-time st elevation acute myocardial infarction[J].J Am Soc Echocardiogr,2012,25(12):1290-1298.DOI:10.1016/j.echo.2012.09.010.
[10] SHARP A S,TAPP R J,THOM S A,et al.Tissue Doppler E/E′ ratio is a powerful predictor of primary cardiac events in a hypertensive population:an ASCOT substudy[J].Eur Heart J,2010,31(6):747-752.DOI:10.1093/eurheartj/ehp498.
[11] LOTRIONTE M,CAVARRETTA E,ABBATE A,et al.Temporal changes in standard and tissue Doppler imaging echocardiographic parameters after anthracycline chemotherapyin women with breast cancer[J].Am J Cardiol,2013,112(7):1005-1012.DOI:10.1016/j.amjcard.2013.05.038.
[12] DI LISI D,BONURA F,MACAIONE F,et al.Chemotherapy-induced cardiotoxicity:role of the tissue Doppler in the early diagnosis of left ventricular dysfunction[J].Anticancer Drugs,2011,22(5):468-472.DOI:10.1097/CAD.0b013e3283443704.
[13] LOTRIONTE M,CAVARRETTA E,ABBATE A,et al.Temporal changes in standard and tissue doppler imaging echocardiographic parameters after anthracycline chemotherapyin women with breast cancer[J].Am J Cardiol,2013,112(7):1005-1012.DOI:10.1016/j.amjcard.2013.05.038.
[14] APPEL J M,ZERAHN B,MØLLER S,et al.Long-term heart function after adjuvant epirubicin chemotherapy for breast cancer[J].Acta Oncol,2012,51:1054-1061.DOI:10.3109/0284186X.2012.702920.
[15] MIKI T,YUDA S,KOUZU H,et al.Diabetic cardiomyopathy:pathophysiology and clinical features[J].Heart Fail Rev,2013,18(2):149-166.DOI:10.1007/s10741-012-9313-3.
[16] NUNES S,SOARES E,FERNANDES J,et al.Early cardiac changes in a rat model of prediabetes:brain natriuretic peptide overexpression seems to be the best marker[J].Cardiovasc Diabetol,2013,12(1):1-11.DOI:10.1186/1475-2840-12-44.
[17] KIM C H.Expression of extracellular superoxide dismutase protein in diabetes[J].Arch Plast Surg,2013,40(5):517-521.DOI:10.5999/aps.2013.40.5.517.
[18]GAO X,LV D M,WANG Y,et al.Correlation between KCNQ1 gene polymorphism and type 2 diabetes mellitus in Huaihai region of China[J].Fam Med Community Health,2014,2(1):15-19.
[19]SENKUS E,JASSEM J.Cardiovascular effects of systemic cancer treatment[J].Cancer Treat Rev,2011,37(4):300-311.DOI:10.1016/j.ctrv.2010.11.001.
(本文编辑:赵跃翠)
Effect of Epirubicin-based Chemotherapy on Cardiotoxicity of Breast Cancer Patients Combined with Diabetes
SUNFang-yi1,WANGHong-fang2*,SHIJing3,LIUYing-zi4
1.DepartmentofCardiology,FourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China2.CollegeofPharmacy,HebeiUniversityofTraditionalChineseMedicine,Shijiazhuang050011,China3.OfficeofScientificResearch,FourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China4.DepartmentofNeurosurgery,FourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China
*Correspondingauthor:WANGHong-fang,Lecturer;E-mail:ydsysfy2012@163.com
Objective To analyze the effect of epirubicin-based chemotherapy on cardiotoxicity of breast cancer female patients combined with diabetes.Methods A total of 108 female patients underwent radical resection of the tumor in the breast center of Fourth Hospital of Hebei Medical University from October 2013 to October 2015 were selected and were clearly diagnosed with breast cancer after the pathological examination.The epirubicin-based chemotherapy(epirubicin+cyclophosphamide) was conducted firstly,3 weeks a course and totally 6 courses.Among the subjects,55 patients combined with type 2 diabetes were assigned into diabetic chemotherapy group and 53 patients not combined with diabetes were assigned into non-diabetic chemotherapy group.At the same time,50 age-matched female diabetic patients without breast cancer in the outpatient of endocrinology department were selected as the diabetic control group.Measurement of routine indicators,Doppler ultrasound inditators,and oxidative stress indicators were conducted to patients with breast cancer before the application of chemotherapy regimens(baseline) and after chemotherapy,and to patients in diabetic control group at the time of enrollment and after 4.5 months.Results Fifty patients were selected from diabetic chemotherapy group and non-diabetic chemotherapy group respectively.At baseline,total cholesterol,triglyceride and glycosylated hemoglobin in diabetic chemotherapy group and diabetic control group were higher than those in non-diabetic chemotherapy group(P<0.05).There were no significant differences in Δbody mass index,Δblood pressure,Δhemoglobin,Δtotal cholesterol,Δtriglyceride and Δglycosylated hemoglobin among patients in the three groups after chemotherapy(P>0.05).At baseline,E/Ea in diabetic chemotherapy group and diabetic control group was higher than that in non-diabetic chemotherapy group(P<0.05).At the end of chemotherapy,ΔEa in diabetic chemotherapy group was significantly lower than that in diabetic control group and non-diabetic chemotherapy group,and its ΔE/Ea was significantly higher than that in diabetic control group and non-diabetic chemotherapy group(P<0.05).At baseline,SOD in diabetic chemotherapy group and diabetic control group was lower than that in non-diabetic chemotherapy group,MDA was higher than that in non-diabetic chemotherapy group(P<0.05).After chemotherapy,there were significant differences in ΔSOD and ΔMDA in pairwise comparison between groups(P<0.05).Conclusion The epirubicin-based chemotherapy leads to a significant aggravation in diastolic dysfunction among female breast cancer patients combined with diabetes,and indicates that combination of diabetes aggravates themyocardial damage of the epirubicin-based chemotherapy.
Breast neoplasms;Diabetes mellitus;Epirubicin;Cardiotoxins;Chemoradiotherapy,adjuvant
R 737.9
A
10.3969/j.issn.1007-9572.2017.15.022
2016-11-25;
2017-03-10)
*通信作者:王红芳,讲师;E-mail:ydsysfy2012@163.com
孙芳毅,王红芳,施靖,等.以表阿霉素为基础的化疗对乳腺癌合并糖尿病患者心脏毒性的影响[J].中国全科医学,2017,20(15):1898-1902.[www.chinagp.net]
SUN F Y,WANG H F,SHI J,et al.Effect of epirubicin-based chemotherapy on cardiotoxicity of breast cancer patients combined with diabetes[J].Chinese General Practice,2017,20(15):1898-1902.
