半枝莲氯仿极性部位提取物促进人结肠癌细胞凋亡及其逆转耐药的机制研究
2017-05-17张铃方翌蔡巧燕林珊魏丽慧彭军
张铃,方翌,蔡巧燕,林珊,魏丽慧,彭军
(福建中医药大学中西医结合研究院,福建福州350122)
半枝莲氯仿极性部位提取物促进人结肠癌细胞凋亡及其逆转耐药的机制研究
张铃,方翌,蔡巧燕,林珊,魏丽慧,彭军
(福建中医药大学中西医结合研究院,福建福州350122)
目的研究半枝莲氯仿极性部位提取物(ECSB)促进人结肠癌细胞的凋亡及其逆转HCT-8/5-FU细胞对5-FU耐药的机制。方法用ECSB干预结肠癌细胞株HCT-8,用Gexp技术检测其细胞凋亡相关基因的表达;用5-FU、ECSB联合5-FU干预耐药细胞株HCT-8/5-FU,检测其耐药相关基因的表达。结果在ECSB干预48 h后,能显著下调HCT-8的Bcl-2表达,并且升高Caspase 8的表达,但不影响Bax的表达;ECSB联合5-FU给药后,HCT-8/5-FU的LRP表达比5-FU给药显著下降。结论ECSB通过上调Bax/Bcl-2和Caspase 8的表达促进HCT-8细胞的凋亡,下调LRP的表达增强HCT-8/5-FU对5-FU的敏感性。
半枝莲氯仿极性部位提取物;结肠癌;细胞凋亡;耐药性
结肠癌(colorectal carcinoma,CRC)是常见的恶性肿瘤,其女性发病率排名世界第二,男性发病率排名世界第三[1]。目前,治疗结肠癌的主要方法为手术切除,但容易发生复发、转移。结肠癌属于复杂的系统性疾病,其发病原因涉及多通路、多靶点,而目前的一些化疗药物都是单靶点药物,容易造成严重的毒副作用,并且耐药率高,因此寻找有效低毒的化疗药物是目前研究的热点。半枝莲(Scutellaria barbata D.Don)为我国传统的抗肿瘤中草药,其主要成分为黄酮类、二萜类化合物,还包括生物碱、甾体和多糖等[2]。在临床上半枝莲主要应用于治疗肝癌、胃癌、直肠癌、食道癌、肺癌等,疗效显著。实验研究表明半枝莲通过抑制肿瘤生长、增强免疫功能、抗氧化和抗突变等发挥抗癌作用[3]。本课题前期研究发现:半枝莲的四个极性部位提取物(氯仿、乙酸乙酯、正丁醇、石油醚)均能有效抑制结肠癌细胞的生长,其中半枝莲氯仿极性部位提取物(ECSB)的作用最为显著[4],且ECSB还能增强耐5-FU细胞株对5-FU的敏感性,但具体作用机制不明确。因此本实验进一步研究ECSB抑制人结肠癌细胞的生长及其逆转耐药性的作用机制。
1材料
1.1材料与细胞株半枝莲购自福建中医药大学国医堂。结肠癌HCT-8、HCT-8/5-FU细胞购自南京凯基生物科技发展有限公司。
1.2试剂RPMI-1640培养基购自南京凯基生物科技发展有限公司;胰蛋白酶、胎牛血清、Trizol购自美国Invitrogen公司;引物合成、DEPC处理水购自上海生物工程有限公司;Taq酶购自美国Sigma公司;GenomeLabTM Gexp start kit试剂盒、分离胶、甲酰胺(SLS)、DSS-400均购自德国Beckman公司。1.3主要仪器CO2培养箱购自Heal Force公司;PCR扩增仪购自美国Bio-rad公司;GenomeLabTM Gexp遗传分析系统购自德国Beckman公司。
2方法
2.1半枝莲不同极性部位提取物的制备取500 g半枝莲全草,粉碎后用85%乙醇回流提取3次,合并提取液,减压浓缩至无醇味,加水混悬后,依次用石油醚、氯仿、乙酸乙酯、正丁醇萃取制备半枝莲的不同极性部位,分别得到石油醚极性部位提取物(EPESB)、氯仿极性部位提取物(ECSB)、乙酸乙酯极性部位提取物(EEASB)、正丁醇极性部位提取物(ENBSB)。ECSB进一步用旋转蒸发仪蒸干,获得的浸膏用DMSO超声溶解,配置成200 mg/mL溶液,4℃保存备用。在所有细胞实验中的DMSO浓度均≤0.25%。
2.2细胞培养结肠癌HCT-8细胞经含10%胎牛血清的RPMI-1640培养基(含100 U/mL青霉素和100 μg/mL链霉素)培养后,置37℃,5%CO2培养箱进行传代培养。HCT-8/5-FU细胞除了在完全培养基中加入15 μg/mL 5-FU外,其余培养条件和HCT-8细胞一致。
2.3RNA的提取取对数生长期细胞,进行细胞计数,HCT-8以4×105个/孔接种于6孔板中,加入150 μg/mL ECSB干预48 h;HCT-8/5-FU以4×105个/孔接种于6孔板中,分别设置5-FU组(3200 μM)、5-FU+ECSB低剂量组(3200 μM 5-FU+50 μg/mL ECSB)、5-FU+ECSB中剂量组(3200 μM 5-FU+100 μg/mL ECSB)干预细胞48 h。48 h后,去上清液并用PBS洗涤3次,加入500 μL Trizol,吹打细胞,把液体转至1.5 mL离心管,放置5 min;加入100 μL氯仿,剧烈振荡,室温放置3 min;4℃,12 000 rpm离心15 min;取上清液300 μL到新离心管中,加入250 μL异丙醇,轻摇,放置10 min;4℃,12 000 rpm离心10 min,弃上清液,加入1 mL 75%乙醇洗涤沉淀;4℃,12 000 rpm离心5 min,去掉上清,室温放置5 min;酒精完全挥发后,用10~20 μL DEPC水溶解RNA。
2.4细胞基因表达检测
2.4.1基因扩增采用10 μL的RT体系,其中含:2 μL 5×RT buffer,1 μL Mix下游引物(500 nmol/L),0.5 μL RT逆转录酶,2.5 μL KanR,2.5 μL(10 ng/μL)样品,1.5 μL ddH2O。逆转录反应程序:48℃1 min,42℃1 h,95℃5 min,4℃hold。采用10 μL的PCR体系,其中含:2 μL MgCl2,2 μL PCR buffer,1 μL Mix上游引物(200 nmol/L),0.7 μL Taq酶,4.3 μL RT产物。PCR反应程序:94℃1 min(94℃30 s,55℃30 s,70℃1 min)×35个循环。
2.4.2毛细管电泳在上样板的每个孔中均分装30 μL的SLS+DSS-400混合液,取1 μL PCR产物加入其中,用枪头搅拌均匀,最后在每孔覆盖一滴石蜡油。同时在缓冲液板中每孔加入8滴的分离缓冲液,上机选择Frag-3分离方法进行毛细管电泳。
2.4.3Gexp试验条件优化对引物浓度、模板含量进行RT-PCR条件的优化。设置3个内参基因(TBP、GAPDH、CYPLOPHOH),将其峰值求几何均数,B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、含半胱氨酸的天冬氨酸蛋白水解酶8(Caspase 8)、肺耐药相关蛋白(LRP)的峰值与该几何均数的峰值相除,得到基因表达的相对含量。
2.5统计学方法所有数据应用Excel 2003和DPS v6.55软件进行分析处理,所有实验数据均为计量资料,采用单因素方差分析。
3结果
3.1ECSB对HCT-8细胞凋亡相关基因的影响前期实验表明:半枝莲的四个极性部位提取物(EPESB、ECSB、EEASB、ENBSB)中ECSB对人结肠癌HCT-8细胞的生长抑制作用最显著[5],但具体机制不明确。因此,本研究在此基础上初步探讨ECSB抑制HCT-8细胞生长的作用机制。Bax/Bcl-2决定着细胞的凋亡,两者表达量比的升高会直接导致细胞的程序性死亡。如图1所示:ECSB干预结肠癌HCT-8细胞48 h后,能显著降低Bcl-2的表达量,对Bax的表达量则无明显影响。细胞凋亡的各种途径还涉及Caspase蛋白,在ECSB干预后,Caspase 8的表达量升高。这些都提示ECSB能有效抑制结肠癌细胞生长的机制之一是通过促进细胞凋亡。

图1ECSB对HCT-8细胞Bax、Bcl-2、Caspase 8表达量的影响
3.2ECSB对HCT-8/5-FU细胞耐药相关基因的影响前期研究还发现:ECSB除了能有效抑制细胞生长外,还能增强耐5-FU细胞株对5-FU的敏感性,但具体作用机制仍不明确[6]。HCT-8/5-FU是由HCT-8细胞株在5-FU长期的诱导下所产生的耐药株,因此,采用HCT-8/5-FU细胞株进行耐药性的相关机制研究。肿瘤产生耐药的作用机制非常复杂,其中涉及到LRP的异常表达。如图2所示:HCT-8/5-FU在5-FU干预下,LRP表达量显著提高,表明该细胞株对5-FU产生明显的耐药。而在ECSB联合5-FU给药后,HCT-8/5-FU的LRP表达量能显著下调,这说明,ECSB逆转HCT-8/5-FU细胞株耐药可能是通过LRP所介导的通路。
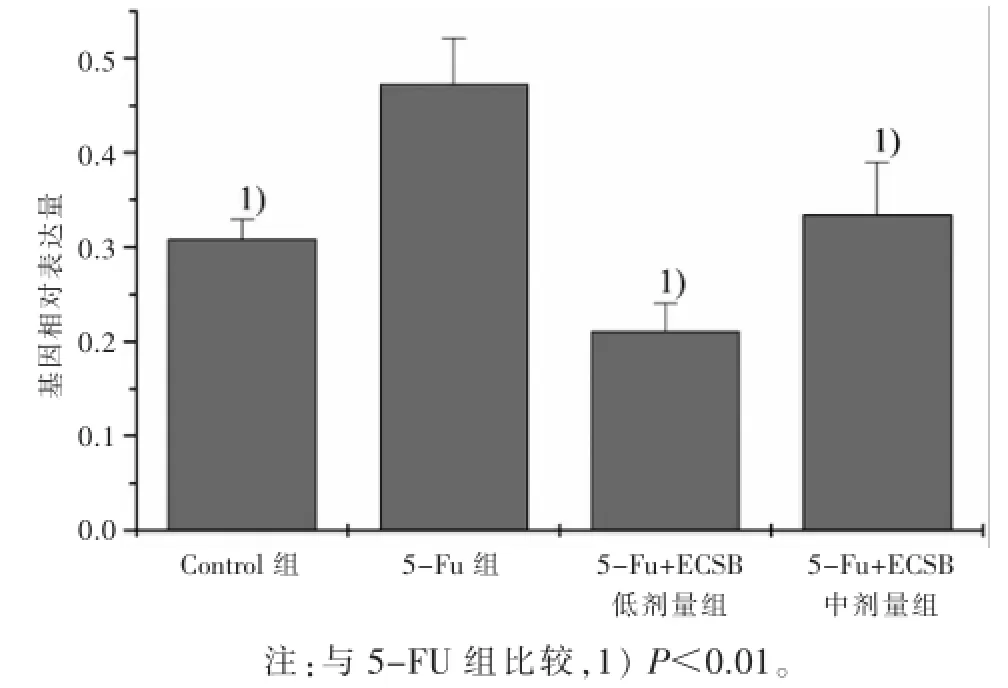
图2ECSB对HCT-8/5-FU细胞LRP表达量的影响
4讨论
细胞凋亡是细胞程序性死亡(program cell death,PCD)中的一种,在肿瘤发生、发展以及治疗过程中具有重要功能。目前认为细胞凋亡主要有外源性途径和内源性途径,外源性途径即死亡受体途径,内源性途径包括线粒体途径和内质网途径。其中线粒体途径还分为两种类型:一是通过激活Caspase通路促进凋亡;二是不依赖Caspase途径,而是通过线粒体释放AIF(凋亡诱导因子)直接导致凋亡的发生。除了线粒体的AIF途径外,其余的途径均与Caspase有关,如死亡受体通路,可经由死亡受体(Fas、TNF等)于FADD结合激活Caspase 8,从而产生Caspase相关蛋白的级联反应而促进凋亡的发生[7]。Bcl-2家族蛋白通过线粒体通路的信号传导决定了细胞凋亡,其中Bcl-2维持线粒体膜的完整性阻止细胞色素C(CytC)的释放而发挥抗凋亡作用。而Bax是一种促凋亡蛋白,也属于Bcl-2家族,常以二聚体或多聚体的形式存在,其激活可破坏线粒体膜,释放CytC,从而引起凋亡。本研究发现:在ECSB干预下,HCT-8的Caspase 8表达量显著升高,同时能上调Bax/Bcl-2,这说明ECSB能通过多条途径诱导细胞凋亡。
肿瘤耐药(multidrug resistance,MDR)是现在化疗失败的主要原因之一,其作用机制非常复杂,不同肿瘤细胞对于同种药物可能存在多种的耐药机制,甚至同种肿瘤细胞对于相同的药物都存在不同的耐药机制。其中LRP表达于多种肿瘤细胞,介导了MDR的产生。LRP分子量为110KD左右,位于16号染色体短臂(16p13.12-16p11.2),与各种药物的跨膜转运有关,但其不属于ABC转运体超家族[8]。LRP可能通过以下机制介导MDR:可以阻止以细胞核为靶点的药物进入核内甚至让进入核内的药物被泵出核外;亦能让细胞质中的药物转运至囊泡,囊泡通过胞吐作用将药物排出细胞外[9]。本研究表明:在5-FU干预下,HCT-8/5-FU的LRP表达量显著升高,但ECSB能下调由5-FU导致的LRP表达量的上升,这说明ECSB能通过调控LRP来逆转结肠癌对5-FU的耐药性。但细胞产生耐药的机制非常复杂,ECSB逆转HCT-8/5-FU的耐药性可能同时还涉及其他通路,需要后续的进一步研究。
[1]JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]王文蜀,周亚伟,叶蕴华,等.半枝莲中黄酮类化学成分研究[J].中国中药杂志,2004,29(10):957-959.
[3]祝勇军,张春容,曹伦.半枝莲抗肿瘤作用研究进展[J].中国中医急症,2006,15(5):533-535.
[4]张铃,林久茂,蔡巧燕,等.半枝莲不同极性部位提取物体外抗结肠癌活性研究[J].福建中医药,2013,44(6):54-56.
[5]ZHANG L,CAI Q,LIN J,et al.Chloroform fraction of Scutellaria barbata D.Don promotes apoptosis and suppresses proliferation in human colon cancer cells[J].Molecular Medicine Reports,2014,9(2):701-706.
[6]张铃,方翌,林久茂,等.半枝莲氯仿极性部位逆转人结肠癌HCT-8/5-FU耐药性研究[J].福建中医药,2013,44(5):54-56.
[7]谢昆,李兴权.细胞凋亡的信号通路[J].山东农业大学学报(自然科学版),2015,46(4):514-518.
[8]LARA P C,PRUSCHY M,ZIMMERMANN M,et al.MVP and vaults:a role in the radiation response[J].Radiation Oncology,2011,6(148):1-9.
[9]DE MORAES A C R,MARANHO C K,RAUBER G S,et al. Importance of detecting multidrug resistance proteins in acute leukemia prognosis and therapy[J].Journal of clinical laboratory analysis,2013,27(1):62-71.
R285.5
A
1000-338X(2016)06-0037-03
2016-10-02
福建省自然科学基金项目(2015J01687);福建省卫生厅青年科研项目(2014-2-29);
张铃(1986—),女,理学硕士,实验师,主要从事中药抗肿瘤机制研究。
彭军(1969—),男,研究员,医学博士,博士生导师。
E-mail:pjunlab@hotmail.com
