桃采后褐腐病生防酵母菌的筛选及鉴定
2017-05-17卢彩鸽刘德文刘伟成张殿朋
王 晨,卢彩鸽,刘德文,刘伟成,刘 娅,张殿朋*
(1.石河子大学 食品学院,新疆 石河子 832000; 2.北京市农林科学院 植物保护环境保护研究所,北京 100094)
桃采后褐腐病生防酵母菌的筛选及鉴定
王 晨1,2,卢彩鸽2,刘德文2,刘伟成2,刘 娅1,张殿朋2*
(1.石河子大学 食品学院,新疆 石河子 832000; 2.北京市农林科学院 植物保护环境保护研究所,北京 100094)
为筛选对由美澳型核果褐腐病菌(Moniliniafructicola)引起的桃褐腐病具有抑制作用的酵母菌株,采用平板对峙的试验方法,从新疆北部12个地区分离的102株酵母菌中筛选出7株对桃褐腐病菌具有显著抑制作用的酵母菌株,其中菌株EEQS-7D拮抗活性最强,该菌株对桃褐腐病菌的抑菌率达78.90%。人为打孔接种活体试验结果表明,该菌株可显著降低桃褐腐病发病程度,抑制率达51.83%。生防相关性状检测结果显示,该菌株能够产生蛋白酶,透明圈直径达到34.5 mm,说明EEQS-7D主要通过分泌蛋白酶达到抑制桃褐腐病的效果。通过对菌株EEQS-7D的形态特征观察、生理生化测试以及26S rDNA序列分析,鉴定该菌株为出芽短梗霉(Aureobasidiumpullulans)。
桃褐腐病; 生物防治; 酵母菌; 筛选; 鉴定; 出芽短梗霉
据统计,桃采摘后因为褐腐病引发桃子腐败变质而导致的损失高达50%[1]。目前,在世界范围内发生较为普遍的桃褐腐病菌有3种:美澳型核果褐腐病菌(Moniliniafructicola)、核果褐腐病菌(Monilinialaxa)和仁果褐腐病菌(Moniliniafructigena)[2]。其中,美澳型核果褐腐病菌引发的桃褐腐病是造成桃腐败的最主要原因[3]。桃褐腐病导致桃果实在贮藏过程中出现大量腐烂变质,直接影响桃的品质,经济损失严重。因此,人们迫切希望找到有效的方法来抑制桃褐腐病的发生。目前主要采用的方法是气调、调节压强、适当降低贮藏温度等物理方法配合使用化学合成农药[4]。但这些化学农药在抑制桃褐腐病的同时,也对环境和人体健康造成了巨大的危害。
利用微生物生防菌剂综合治理病虫害,减少有害的化学药剂的使用,已成为应用前景最好的替代手段之一[5]。随着人们对生防菌的广泛关注,一些能抑制桃采后褐腐病的丝状真菌[6-7]、酵母[8-10]和细菌[11-13]逐渐被发现并应用。与其他生防菌株相比,酵母菌分泌的抑菌物质没有过敏源等有害物质,对人体的毒害作用微乎其微[14],且酵母菌的营养需求简单,易于培养,更利于大规模生产[15]。最近报道的李属假丝酵母(Candidapruni)[3]、出芽短梗霉(Aureobasidiumpullulans)[9]等均对桃褐腐病有良好的生防作用。尽管国内外利用酵母菌株防治桃褐腐病取得了一定进展,但大多数酵母生防制剂还处于试验阶段,距离实际应用和推广还有很多的问题需要解决,如防治效果的加强、规模化防效测定以及环境因素的影响等。因此,筛选到防效好、适应性广的酵母菌是桃褐腐病生物防治工作面临的关键问题。
新疆维吾尔自治区位于北纬34°25′~48°10′、东经73°40′~96°18′,区内形成明显的温带大陆性气候,天气干旱少雨,昼夜温差大(-50~49 ℃)。在此特殊生境下存活的微生物可能会具备独特的生物与生理活性。为了寻找新的生防酵母来源,针对在新疆地区北部分离的102株酵母菌,采用平板对峙法和活体试验相结合,从中筛选对桃褐腐病具有生防效果的菌株,以期为桃褐腐病的防治和新型生物农药的开发奠定基础。
1 材料和方法
1.1 材料
酵母菌:共102株,分离自新疆12个生态环境差异较大地区采集的土样。
桃褐腐病菌(Moniliniafructicola):从北京市平谷区采集的感病桃子上分离、纯化,通过-80 ℃超低温甘油管保存在北京市农林科学院生防微生物研究室。
试验用桃:购于北京市农林科学院附近市场,为新采摘桃子,品种为久保。
1.2 试剂及药品
化学药品与试剂均为分析纯,购自中国国药集团化学试剂有限公司;分子生物学试剂购自Tiangen Biotech公司;引物合成及测序由北京天一辉远生物科技有限公司完成。
1.3 培养基
酵母菌株活化培养基:YPD培养基(加硫酸链霉素,终质量浓度为100 mg/mL)[3];菌株分离与平板对峙培养基:PDA培养基[16];生防相关性状检测培养基[17]:CAS培养基(检测嗜铁素)、几丁质培养基(检测几丁质酶)、脱脂牛奶琼脂培养基(检测蛋白酶)、刚果红培养基(检测纤维素酶)、Pikovskaya’s琼脂培养基(检测磷酸酯酶)。
除脱脂牛奶琼脂培养基需在115 ℃条件下灭菌20 min外,其余培养基均在121 ℃条件下灭菌20 min后待用。
1.4 生防酵母菌株的离体筛选
采用平板对峙法。将供试的桃褐腐病菌接种于PDA平板上,在28 ℃条件下培养3 d后,用灭过菌的打孔器打取菌片,然后用无菌接种针将菌片菌丝面朝下移植于PDA平板中心。用接种环挑取少量酵母菌,在病原真菌菌片两侧等距离划线,以仅接病原菌的平板为对照(CK),每种处理3个重复,28 ℃恒温培养,每天记录病原菌菌落直径,6 d后计算抑菌率。抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%[18]。
1.5 生防酵母菌株的活体筛选
以离体筛选出的生防酵母菌株作为复筛对象。选取大小、成熟度、色泽较为一致的桃子,先经1%的NaClO溶液浸泡消毒1 min,再用无菌蒸馏水冲洗,然后用灭过菌的打孔器(直径3 mm)在桃果实表面打出4个对称的伤口,用移液器在伤口上滴加30 μL 1×105个/mL的桃褐腐病菌孢子悬浮液,25 ℃下放置2 h自然风干,再接种30 μL 1×108cfu/mL的酵母菌菌悬液。以病原菌孢子悬浮液和无菌水处理作对照(CK),同样晾干后置于25 ℃条件下培养,逐日记录桃果实的病斑直径,6 d后计算抑菌率。抑菌率=(对照病斑直径-处理病斑直径)/对照病斑直径×100%。每个处理选取15个果实,2次重复。根据筛选结果,选取离体和活体抑菌活性强的菌株作为下一步深入研究对象。
1.6 菌株EEQS-7D的生防相关性状检测
将菌株EEQS-7D在28 ℃条件下培养24 h后,点种于生防相关性状检测培养基平板上(每个处理设3个重复),28 ℃培养72 h后进行观察记录。根据平板上晕圈或透明圈直径的大小,初步检测EEQS-7D的产素能力[19]。
1.7 菌株EEQS-7D的鉴定
1.7.1 形态特征鉴定 将酵母菌株EEQS-7D在YPD平板上28 ℃活化培养,3 d后观察菌株的菌落形态、大小、颜色、透明度、突起和边缘情况。用显微镜观察该菌株的菌体形态结构,并拍照。
1.7.2 分子生物学鉴定 采用酵母菌PCR扩增通用引物(NL1-f:5′-GCATATCAATAAGCGGAGGAAAAG-3′;NL4-r:5′-GGTCCGTGTTTCAAGACGG-3′)扩增26S rDNA序列。扩增产物用1%的琼脂糖凝胶电泳进行检测,目标条带经切胶回收纯化后,送至北京天一辉远公司进行测序。将测定的序列提交GenBank数据库中,并与现有的同源性较近的菌株序列进行比对。进化距离的计算采用邻接法[20],进化树分支模式的稳定性用MEGA 5.0软件[21]分析,采用bootstrap法(复次数为1 000)构建进化树。
1.7.3 生理生化试验 参考《酵母菌的特征与鉴定手册》[22]。
1.8 数据处理
数据处理均采用SPSS统计软件。
2 结果与分析
2.1 生防酵母菌株的离体筛选结果
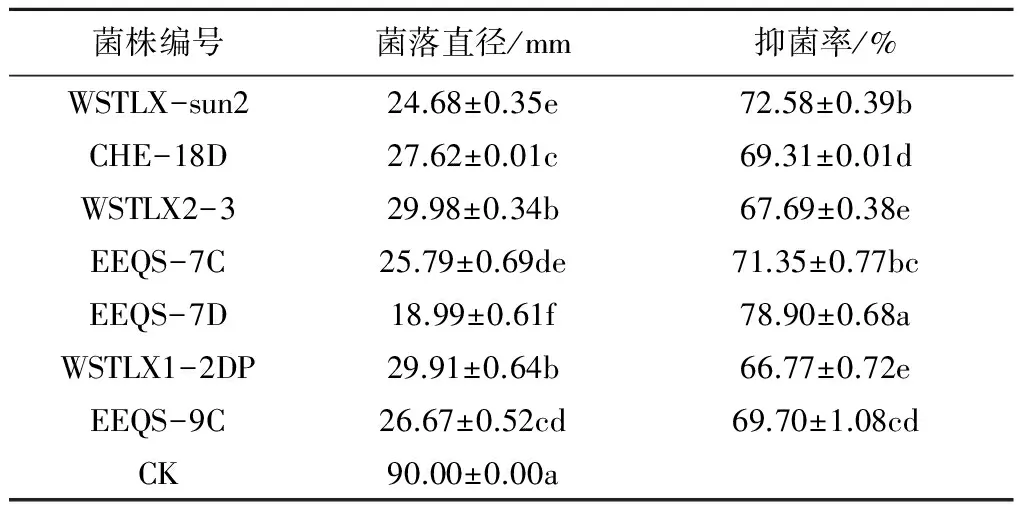
采用平板对峙法对分离自新疆土样的102株酵母菌进行筛选,结果表明,其中20株酵母菌对桃褐腐病菌具有一定的抑制作用,部分结果见图1和表1。

图1 拮抗桃褐腐病菌生防酵母的筛选
菌株编号菌落直径/mm抑菌率/%WSTLX-sun224.68±0.35e72.58±0.39bCHE-18D27.62±0.01c69.31±0.01dWSTLX2-329.98±0.34b67.69±0.38eEEQS-7C25.79±0.69de71.35±0.77bcEEQS-7D18.99±0.61f78.90±0.68aWSTLX1-2DP29.91±0.64b66.77±0.72eEEQS-9C26.67±0.52cd69.70±1.08cdCK90.00±0.00a
注:同列不同小写字母表示处理间差异显著(P<0.05),下同。
试验筛选出7株对桃褐腐病菌具有较强抑制作用的酵母菌株,抑菌率均在65%以上,分别为WSTLX-sun2、WSTLX2-3、EEQS-7C、EEQS-7D、EEQS-18D、WSTLX1-2DP、EEQS-9C,其中EEQS-7D的抑菌率最高,达到了78.90%(表1)。
2.2 生防酵母菌株的活体筛选结果
从表2可知,酵母菌株EEQS-7D、CHE-18D和WSTLX1-2DP的抑菌效果较好,处理后6 d对桃褐腐病菌的抑菌率分别为51.83%、51.43%和46.66%,病斑直径分别为28.89 mm、29.13 mm和32.00 mm。图2为部分酵母菌株处理桃子的发病情况,可以看出,EEQS-7D处理的桃子发病最轻。综合离体和活体的抑菌活性筛选结果,将EEQS-7D菌株确定为下一步深入研究对象。

表2 不同的酵母菌悬浮液对桃子病斑直径的影响

图2 不同处理桃子的发病情况
2.3 菌株EEQS-7D的生防相关性状检测结果
在生防相关性状检测中,菌株EEQS-7D在蛋白酶检测平板上能够形成明显的透明圈,其直径达到34.5 mm(图3),在其他检测平板上没有这种现象,说明EEQS-7D主要通过分泌蛋白酶达到抑制桃褐腐病的效果。
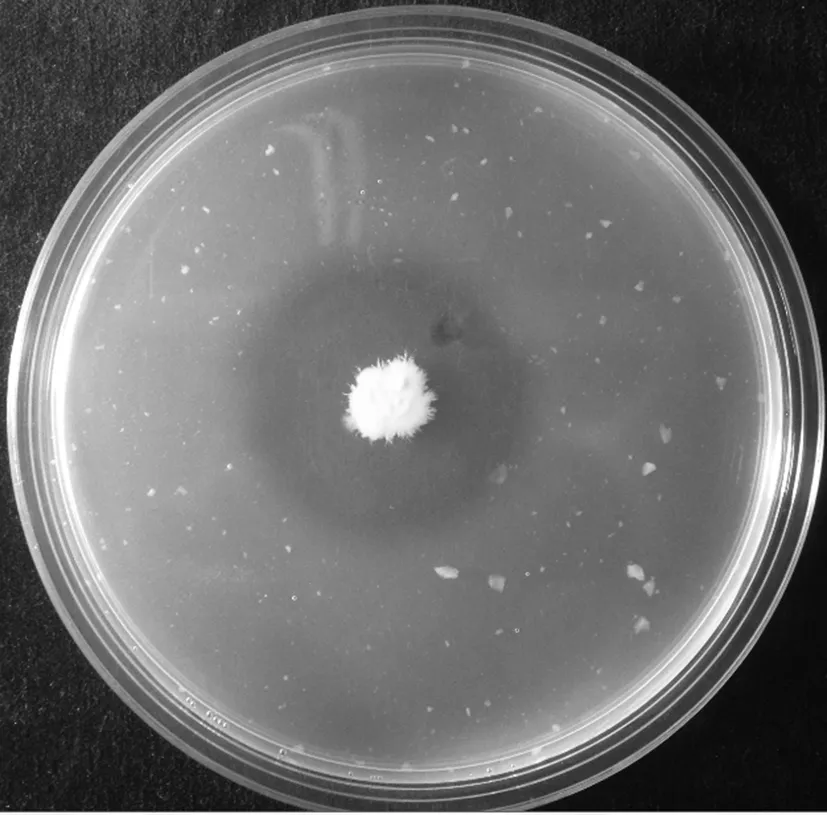
图3 EEQS-7D菌株产生蛋白酶情况
2.4 菌株EEQS-7D的鉴定结果
2.4.1 菌落及菌体特征 EEQS-7D菌株在100倍光学显微镜下,菌体细胞呈圆柱形或腊肠形(8~10)μm×(20~40)μm,单个,具有运动性;在YPD培养基上菌落呈现浅褐色,湿润,黏稠,易挑起,表面光滑,随着培养时间增长,菌落变厚,边缘整齐,菌落上无褶皱,颜色变深(图4)。
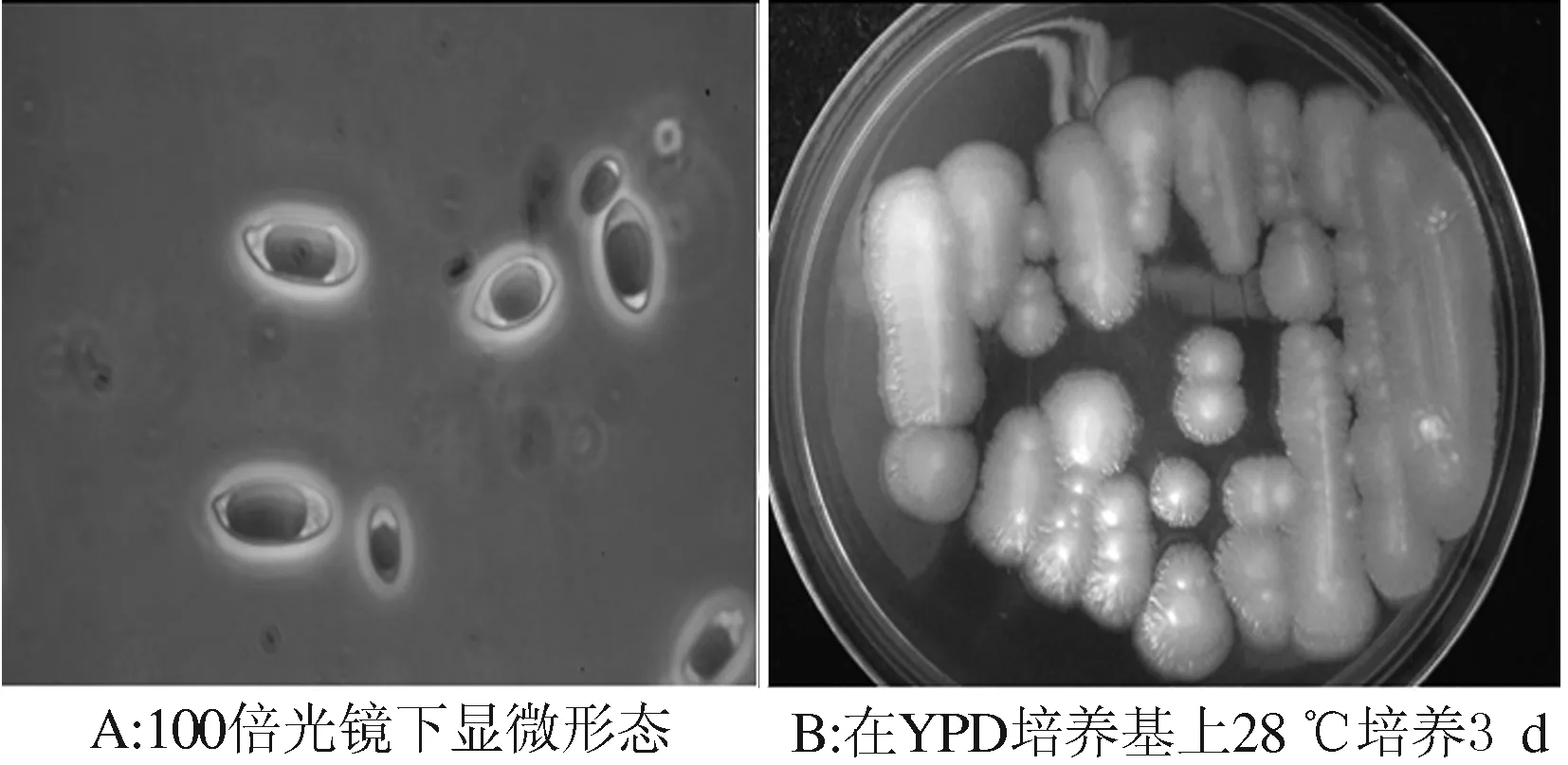
图4 EEQS-7D菌株的菌体及菌落形态
2.4.2 生理生化特征 从表3可知,EEQS-7D菌株是一株耐碱性酵母菌,在pH值 7.5~9.5的环境下正常生长。其能利用葡萄糖、半乳糖、蔗糖、棉子糖、可溶性淀粉、纤维二糖、麦芽糖、L-阿拉伯糖和D-阿拉伯糖,对海藻糖、松三糖、肌醇、木糖和鼠李糖可微弱利用。在35 ℃和37 ℃下生长良好,40 ℃下不能生长。
2.4.3 分子鉴定 以EEQS-7D菌株基因组DNA

表3 EEQS-7D菌株的生理生化特性测定结果
注:“+”表示阳性反应;“-”表示阴性反应;“W”表示反应弱。
为模板,采用酵母通用引物NL1-f/NL4-r扩增其26S rDNA序列,扩增产物为616 bp的单一条带。经序列测定,得到EEQS-7D菌株的26S rDNA序列,选取同源性较高的菌株序列进行比对后,构建系统发育树(图 5)。从图5可以看出,EEQS-7D菌株与出芽短梗霉菌株的26S rDNA序列处于同一分支,相似度达到了99%。综合形态观察以及生理生化特性测定结果,最终确定菌株EEQS-7D为出芽短梗霉(Aureobasidiumpullulans)。

图5 菌株EEQS-7D的26S rDNA序列系统发育树
3 结论与讨论
根据国内外相关报道,出芽短梗霉是一种具有广谱抑菌活性的生防酵母菌株,其对多种病原菌均具有不同程度的拮抗作用[23]。研究表明,其主要通过营养和空间竞争、诱导抗性以及分泌抑菌活性代谢产物等[24]达到抑制病原菌的效果。这种抑制作用既可以抑制病原菌的增殖,还可以避免病原菌产生抗性而降低防治效果。出芽短梗霉广泛分布于植物[25]和腐烂的苹果、葡萄、樱桃等水果表面[26],此外,其在食品工业中也得到了广泛的应用,这些都表明出芽短梗霉是一类对人体无害的菌株。因此,它符合人们对于生防酵母菌种的选择标准。
本研究成功筛选出了一株对桃褐腐病菌抑菌效果较好的出芽短梗霉EEQS-7D。活体试验中,接种桃褐腐病菌的桃子经EEQS-7D处理6 d后,病斑直径为28.89 mm。这与Mari等[23]的研究结果相一致。在他们的试验中,采用相同浓度(1×108cfu/mL)的出芽短梗霉L1和L8菌悬液对桃果实进行处理,6 d后桃子上的病斑直径分别为27 mm和43 mm。EEQS-7D的抑菌效果低于L1而高于L8,说明同种酵母之间的抑菌效果也具有明显的差异。这可能是因为不同来源的菌株其结构和生理不同,因而造成了其对桃褐腐病菌的抑制率产生很大的差异。
经过验证,EEQS-7D能够大量分泌蛋白酶,表明它可能主要通过分泌蛋白酶达到抑制病原菌的效果,这与Zhang等[27]的研究结果相接近。Zhang等[27]筛选出一株能够产生葡聚糖酶、几丁质酶和蛋白酶等水解酶的出芽短梗霉PL5,其对桃褐腐病具有较为显著的防治效果。
尽管EEQS-7D是一株较为有效的生防酵母菌株,但目前只对它的抑菌效果进行了初步验证,要将该菌株大规模地应用于桃褐腐病的防治,还需对其安全性、生防菌剂的研制、菌剂浓度对防效的影响、作用机制及规模化防效等进行深入的研究。
[1] Cursey D G,Booth R H.The postharvest phytopathology of perishable tropical produce[J].Rev Plant Pathology,1972,51(12):751-765.
[2] Ogawa J M,Zehr E I,Bird G W,etal.Compendium of stone fruit diseases[M].St.Paul,MN,USA:APS Press,1995.
[3] Zhang D P,Lu C G,Zhang T T,etal.Candidaprunisp.nov.is a new yeast species with antagonistic potential against brown rot of peaches[J].Archives of Microbiology,2014,196(7):525-530.
[4] 李美霞,冯晓元,邓西民,等.植物提取物对桃采后褐腐病的防治研究[J].保鲜与加工,2004,4(3):27-29.
[5] Janisiewicz W J,Korsten L.Biological control of postharvest diseases of fruits[J].Annual Review of Phytopathology,2002,40(1):411-441.
[6] Melgarejo P,Carrillo R,Sagasta E.Potential for biological control ofMonilinialaxain peach twigs[J].Crop Protection,1986,5(6):422-426.
[7] Hong C X,Michailides T J,Holtz B A.Effects of wounding,inoculum density,and biological control agents on postharvest brown rot of stone fruits[J].Plant Disease,1998,82(11):1210-1216.
[8] Spotts R A,Cervantes L A,Facteau T J.Integrated control of brown rot of sweet cherry fruit with a preharvest fungicide,a postharvest yeast,modified atmosphere packaging,and cold storage temperature[J].Postharvest Biology and Technology,2002,24(3):251-257.
[9] Karabulut O A,Baykal N.Biological control of postharvest diseases of peaches and nectarines by yeasts[J].Journal of Phytopathology,2003,151(3):130-134.
[10] Fiori S,Fadda A,Giobbe S,etal.Pichiaangustais an effective biocontrol yeast against postharvest decay of apple fruit caused byBotrytiscinereaandMoniliafructicola[J].FEMS Yeast Research,2008,8(6):961-963.
[11] 张清霞,何玲玲,单海焕,等.桃褐腐病生防细菌FD6硝吡咯菌素合成基因簇的克隆及prnA功能分析[J].园艺学报,2016,43(8):1473-1481.
[12] 杨海清,刘正坪,刘素花,等.桃褐腐病生防细菌的筛选及抑菌作用研究[J].北京农学院学报,2006,21(4):29-32.
[13] Bonaterra A,Mari M,Casalini L,etal.Biological control ofMonilinialaxaandRhizopusstoloniferin postharvest of stone fruit byPantoeaagglomeransEPS125 and putative mechanisms of antagonism[J].International Journal of Food Microbiology,2003,84(1):93-104.
[14] Fan Q,Tian S P.Postharvest biological control of rhizopus rot of nectarine fruits byPichiamembranefaciens[J].Plant Disease,2000,84(11):1212-1216.
[15] Droby S,Chalutz E.Mode of action of biocontrol agents for postharvest diseases//Wilson C L,Wisniewski M E.Biological control of postharvest diseases of fruits and vegetables—Theory and practice[M].Boca Raton,FL:CRC Press,1994:63-75.
[16] 刘慧,张红星.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006:262-265.
[17] 王俊丽,卢彩鸽,刘伟成,等.一株芽孢杆菌QD-10的鉴定及生防特性分析[J].中国生物防治学报,2014,30(4):564-572.
[18] 耿月锋,李跃,高巍.瓜类根腐病生防菌的筛选及效果测定[J].山西农业科学,2014,42(5):486-489.
[19] 陈凡.水生拉恩氏菌HX2菌株防治葡萄根癌病的初步研究[D].北京:中国农业大学,2007.
[20] Saitou N,Nei M.The neighbor-joining method:A new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution,1987,4:406-425.
[21] Tamura K,Peterson D,Peterson N,etal.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum par-simony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[22] 巴尼特 J A,佩恩 R W,亚罗 D.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991.
[23] Mari M,Martini C,Guidarelli M,etal.Postharvest biocontrol ofMonilinialaxa,MoniliniafructicolaandMoniliniafructigenaon stone fruit by twoAureobasidiumpullulansstrains[J].Biological Control,2012,60(2):132-140.
[24] Liu X P,Wang J Y,Gou P,etal.In vitro inhibition of postharvest pathogens of fruit and control of gray mold of strawberry and green mold of citrus by aureobasidin A[J].International Journal of Food Microbiology,2007,119(3):223-229.
[25] Urzì C,de Leo F,Lo Passso C,etal.Intra-specific diversity ofAureobasidiumpullulansstrains isolated from rocks and other habitats assessed by physiological methods and by random amplified polymorphic DNA (RAPD)[J].Journal of Microbiological Methods,1999,36(1/2):95-105.
[26] Lima G,de Curtis F,Castoria R,etal.Integrated control of apple postharvest pathogens and survival of biocontrol yeasts in semi-commercial conditions[J].European Journal of Plant Pathology,2003,109(4):341-349.
[27] Zhang D P,Spadaro D,Garibaldi A,etal.Selection and evaluation of new antagonists for their efficacy against postharvest brown rot of peaches[J].Postharvest Biology and Technology,2010,55(3):174-181.
Screening and Identification of Yeast Strains to Control Brown Rot of Postharvest Peaches
WANG Chen1,2,LU Caige2,LIU Dewen2,LIU Weicheng2,LIU Ya1,ZHANG Dianpeng2*
(1.College of Food,Shihezi University,Shihezi 832000,China; 2.Institute of Plant and Environment Protection,Beijing Academy of Agriculture and Forestry Science,Beijing 100094,China)
In order to choose yeast strains with strong antagonistic activity againstMoniliniafructicola,which causes peach brown rot,7 yeast strains were selected by the dural culture method from 102 yeast strains collected from 12 sampling sites in northern Xinjiang.In particular,the strain EEQS-7D was the best among these 7 strains,which reduced the growth ofM.fructicolaby 78.90%.The result ofinvivotest illustrated that this strain could significantly reduce the incidence of brown rot on peaches by 51.83%.The strain was capable of producing protease,and the transparent circle diameter reached 34.5 mm,which indicated that EEQS-7D could inhibit peach brown rot disease mainly by secreting protease.The strain EEQS-7D was identified asAureobasidiumpullulansbased on its morphological observation,physiological and biochemical determination and 26S rDNA sequence analysis.
peach brown rot; biological control; yeast; selection; identification;Aureobasidiumpullulans
2016-11-17
北京市自然科学基金项目(6154026);北京市科委科技计划课题(Z141100002614006)
王 晨(1991-),男,新疆吐鲁番人,在读硕士研究生,研究方向:农产品加工及贮藏工程。 E-mail:524490731@qq.com
*通讯作者:张殿朋(1980-),男,河南周口人,副研究员,博士,主要从事果蔬采后病害生防菌剂研究及产品开发。 E-mail:dreamstar26@126.com
S436.621.1;S476
A
1004-3268(2017)05-0090-05
