饲料中添加磷虾水解物对大菱鲆幼鱼生长性能、体组成及相关酶活性的影响
2017-05-16张莉莉梁萌青徐后国柳茜郑珂珂
张莉莉梁萌青徐后国柳 茜郑珂珂
(1. 中国水产科学研究院黄海水产研究所, 青岛 266071; 2. 上海海洋大学, 上海 201306)
饲料中添加磷虾水解物对大菱鲆幼鱼生长性能、体组成及相关酶活性的影响
张莉莉1,2梁萌青1徐后国1柳 茜1,2郑珂珂1
(1. 中国水产科学研究院黄海水产研究所, 青岛 266071; 2. 上海海洋大学, 上海 201306)
选取初始体重为(9.46±0.01) g的大菱鲆(Scophthalmus maximus L.)为研究对象, 以30%鱼粉组为对照, 分别添加5%磷虾水解物(LKH)和10%磷虾水解物(HKH)以替代鱼粉蛋白, 配制3组等氮等脂的饲料, 在室内流水养殖系统进行为期10周的养殖实验, 旨在探究饲料中添加磷虾水解物对大菱鲆幼鱼生长性能、体组成及相关酶活性的影响。结果显示, HKH组大菱鲆幼鱼的特定生长率(SGR)、饲料效率(FE)、蛋白质效率比(PER)、蛋白质沉积率(PPV)均显著高于对照组(P<0.05), 但摄食率(FI)显著低于对照组(P<0.05); LKH、HKH组大菱鲆幼鱼肌肉总氨基酸含量和必需氨基酸含量显著高于对照组(P<0.05); LKH、HKH组肝脏谷草转氨酶(GOT)活性显著高于对照组(P<0.05), 而血清GOT活性与对照组无显著性差异(P>0.05); HKH组肝脏谷丙转氨酶(GPT)活性显著高于对照组和LKH组(P<0.05), 但血清GPT活性显著低于LKH组和对照组(P<0.05); HKH组肠道淀粉酶活性显著高于对照组(P<0.05), 同时随着磷虾水解物添加量的升高, 肠道及幽门盲囊胰蛋白酶活性先降低后升高, 且在HKH组显著高于对照组(P<0.05)。综上结果表明, 在饲料中添加10%磷虾水解物能够提高大菱鲆幼鱼的生长性能, 促进其氨基酸代谢和消化吸收。
磷虾水解物; 大菱鲆; 生长; 谷丙转氨酶; 谷草转氨酶; 消化酶
南极磷虾(Euphausia superba)是一种生活在南极洲水域的小型海洋浮游甲壳类动物, 其资源量丰富, 是全球最大的蛋白质库[1]。南极磷虾含有丰富的蛋白质和必需氨基酸, 成为水产饲料中优质的饲料原料, 但因南极路途遥远、渔场环境恶劣、产品的开发产业链条尚未成熟等使得南极磷虾的开发利用受到一定的限制[2]。国内外已开展了关于南极磷虾粉的研究, 发现在饲料中添加适量的南极磷虾粉能够促进鱼虾的生长[3—9], 但由于南极磷虾对氟具有较强的富集性, 较多的研究集中于不同加工形式的南极磷虾产品[10—15], 旨在更好地替代鱼粉的同时不影响鱼虾健康及食用安全。
此外, 目前已有一些关于海洋性蛋白源替代鱼粉的研究, 研究较多的是水解鱼蛋白。在牙鲆[16,17](Paralichthys olivaceus)、大菱鲆[18—20](Scophthalmus maximus L.)、中国对虾[21](Penaeus chinensis)、虹鳟[22](Oncorhynchus mykiss)、半滑舌鳎[23](Cynoglossus semilaeviss Günther)、大西洋鲑[24,25](Salmo salar L.)、真鲷[26](Pagrus major)等鱼类上的研究均表明饲料中添加适量的水解鱼蛋白能够促进鱼虾生长。国内外关于磷虾水解物对鱼虾影响的研究鲜有见之, 目前已有的研究表明磷虾水解物能够促进鱼虾的生长: Kousou-laki等[10]研究发现在饲料中添加磷虾水解物能够显著促进大西洋鲑的生长, Co’rdova-Murueta等[11]对南美白对虾(Peraeus Vannamei)的研究也表明磷虾水解物具有促生长的作用, 但关于磷虾水解物在大菱鲆上的研究未见报道。本实验以大菱鲆为研究对象, 在饲料中添加不同比例的磷虾水解物以替代部分鱼粉, 旨在探究对大菱鲆幼鱼生长性能、体组成及相关酶活性的影响, 以期为磷虾水解物在大菱鲆幼鱼配合饲料的应用以及寻找合适的鱼粉替代源, 降低鱼粉用量提供理论参考。
1 材料与方法
1.1 磷虾水解物的制备
实验所用南极磷虾, 购自辽宁远洋渔业有限公司(中国, 大连)。磷虾水解物的制备参考Zheng等[16]的方法, 选用碱性蛋白酶和风味蛋白酶双酶水解,过滤, 3500 r/min离心10min, 取上清, 吸除上层漂浮油脂后经浓缩得磷虾水解物。磷虾水解物营养组成及氨基酸组成如表 1。

表 1 磷虾水解物化学组成及氨基酸组成(%干物质)Tab. 1 The proximate chemical composition and amino acid composition of krill hydrolysates (% dry matter)
1.2 实验饲料
以鱼粉、植物蛋白源(豆粕、谷朊粉、玉米蛋白粉)及磷虾水解物为主要蛋白源, 鱼油为主要脂肪源, 制作3组等氮等脂的配合饲料, 饲料配方及营养组成如表 2。实验以30%鱼粉为对照组(Control),分别添加5% (LKH)、10% (HKH)磷虾水解物以替代相应鱼粉蛋白。实验所用原料均粉碎过80目筛网, 以逐级扩大法充分混匀后, 制成粒径为3 mm的颗粒饲料, 于55℃烘箱内12h烘干, –20℃保存备用。
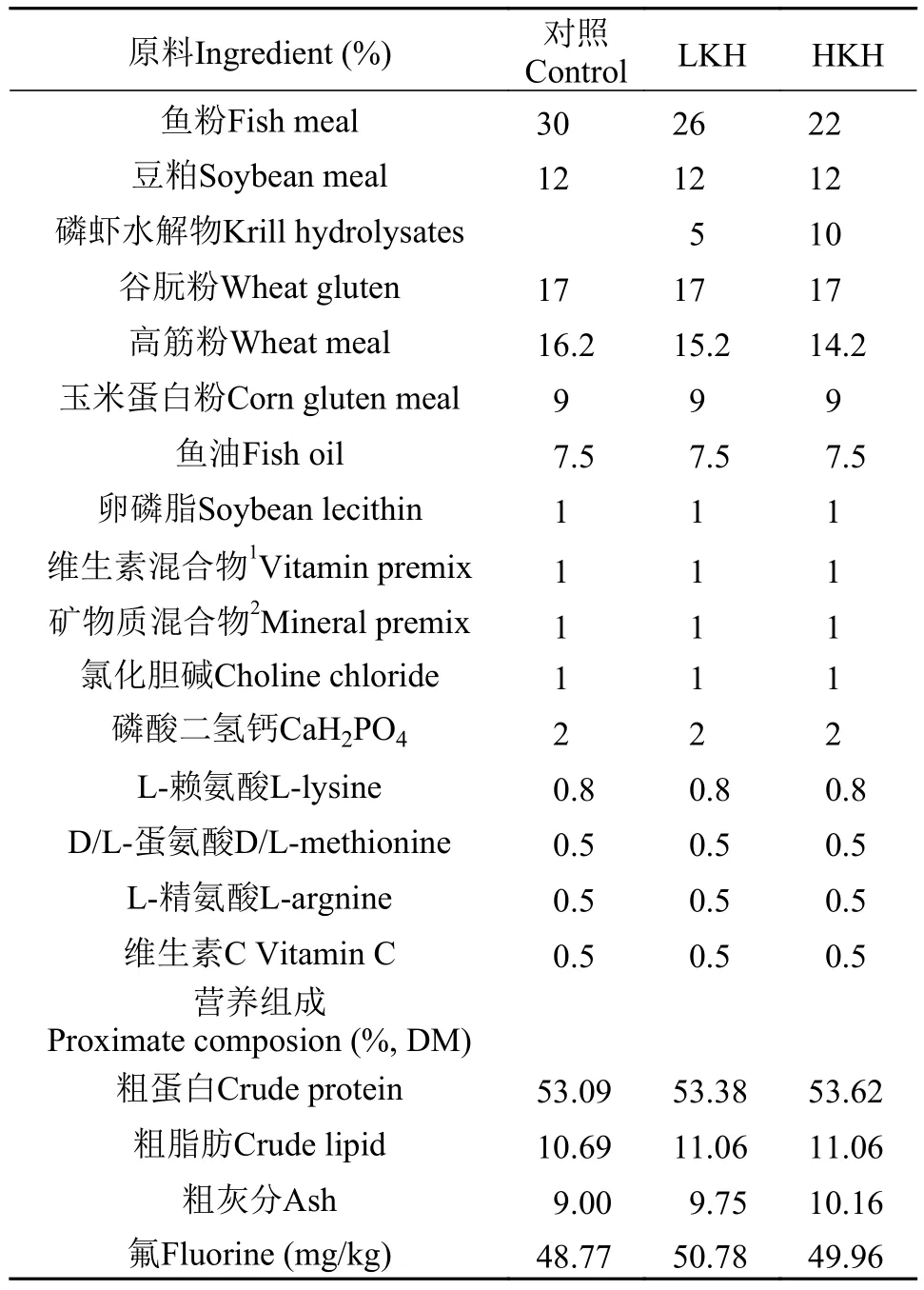
表 2 实验饲料配方及营养组成Tab. 2 Formulation and proximate chemical composition of experimental diets (%)
1.3 实验鱼与饲养管理
实验所用大菱鲆幼鱼购自山东烟台天源水产有限公司(中国, 烟台)。在生长实验开始时, 停食24h, 挑选270尾大小均匀、体格健壮且体表无病,平均体重为(9.46±0.01) g的大菱鲆幼鱼, 随机分配于9个塑料桶(120 L)内, 实验设3个处理, 每个处理设3个重复, 每个重复30尾鱼。实验采用自然光照下室内流水养殖系统, 水源为深井过滤海水, 流速为2 L/min, 水温(14±0.5)℃, 连续充气, 溶氧高于7 mg/L, 盐度(30±0.5)‰, pH 7.5—8.0。实验期间,每天饱食投喂两次(6:30和16:30), 投喂结束30min后, 对残饵进行统计, 根据100粒饲料的平均重量计算残饵的重量。养殖周期为10周。
1.4 样品采集和分析
在实验结束后, 停食24h, 每桶鱼计数并称重;每桶取5尾鱼, 保存于–20℃用于鱼体成分分析; 每桶取5尾鱼, 用肝素钠润过的注射器从尾静脉取血, 4℃下静置24h, 3500 r/min离心10min, 取血清并储存在–20℃待测; 每桶取3尾鱼, 分别取其肌肉、肝脏、幽门盲囊及全肠, 保存于–20℃待测。

表 3 实验饲料氨基酸组成(%干物质)Tab. 3 The amino acid composition of experimental diets (% dry matter)
饲料和鱼体的样品在105℃烘干至恒重, 采用失重法测定水分含量; 粗蛋白质的测定采用凯氏定氮法(VELP, UDK-142 Automatic Distillation Unit,意大利); 粗脂肪的测定采用索氏抽提法, 以石油醚为抽提液, 用丹麦FOSS脂肪测定仪SOXTEC 2050测定; 灰分在马弗炉550℃中燃烧3h, 失重法测定; 氨基酸的测定是样品在6 mol/L HCL中110水解22—24h, 每个样品3个重复, 采用日立8900全自动氨基酸测定仪(Hitachi L-8900 automatic amino acid analyzer, Hitachi, 日本)测定。
1.5 血清及肝脏谷草转氨酶和谷丙转氨酶和消化酶活性的测定
胰蛋白酶活性的测定参考Eranlger等[27]的方法,以N-α-benzoyl DL-arginine p-nitroanilide (BAPNA)作为测定的底物, 步骤如下: 150 μL BAPNA溶液中加入27 μL的双蒸水, 于25℃平衡5min。然后加入3 μL样品, 25℃反应10min。最后加入30 μL 30%乙酸终止反应, 在酶标仪上读取OD410值, 通过标准曲线计算胰蛋白酶含量。标准曲线制作时, 将3 μL样品换成3 μL 0—400 μg/mL胰蛋白酶梯度溶液, 其余步骤相同。
淀粉酶、谷草转氨酶和谷丙转氨酶的测定使用南京建成试剂盒, 用酶标仪(Tecan Infinite M200瑞士)检测。
1.6 计算及统计分析方法
特定生长率(Specific growth rate, SGR, %/d)= 100×[Ln(终末体重)–Ln(初始体重)]/实验天数
摄食率(Feeding intake, FI, %/d)=100×总干物质摄食量/[实验天数×(初始体重+终末体重)/2]
饲料效率(Feed efficiency, FE)=鱼体增重(湿重)/总干物质摄食量
蛋白效率比(Protein efficiency ratio, PER)=(终末体重–初始体重)/蛋白摄入量
蛋白质沉积率(Protein productive value, PPV, %)=100×鱼体蛋白质贮存量/蛋白摄入量
实验数据采用SPSS17.0统计软件进行单因素方差分析(One-way ANOVA), 当差异达到显著水平(P<0.05), 进行Tukey’s检验, 所有数据均表示为平均值±标准误(mean±SE)。
2 结果
2.1 饲料中添加磷虾水解物对大菱鲆幼鱼生长性能的影响
由表 4可知, 各实验组大菱鲆幼鱼的成活率无显著性差异, 均达到97%以上(P>0.05); HKH组大菱鲆幼鱼的特定生长率(SGR)、饲料效率(FE)、蛋白质效率比(PER)、蛋白质沉积率(PPV)均显著高于对照组(P<0.05), 但摄食率(FI)显著低于对照组(P<0.05); LKH组大菱鲆幼鱼SGR、FE、PER、PPV及FI均与对照组无显著性差异(P>0.05)。
2.2 饲料中添加磷虾水解物对大菱鲆幼鱼血清及肝脏谷草转氨酶和谷丙转氨酶活性的影响
由表 5可知, 随着饲料中磷虾水解物含量增加,血清谷草转氨酶(GOT)活性逐渐降低, 但3组之间无显著性差异(P>0.05), 而肝脏GOT活性随着磷虾水解物含量增加呈升高趋势, 且LKH、HKH组肝脏谷草转氨酶(GOT)活性均显著高于对照组(P<0.05),但两组之间差异不显著(P>0.05); HKH组血清谷丙转氨酶活性显著低于对照组和LKH组(P<0.05), 与此相反, 肝脏谷丙转氨酶(GPT)活性显著高于对照组和LKH组(P<0.05); LKH组血清及肝脏谷丙转氨酶活性与对照组相比无显著性差异(P>0.05)。

表 4 饲料中添加磷虾水解物对大菱鲆幼鱼生长性能的影响(平均值±标准误)Tab. 4 The effects of dietary krill hydrolysates on growth performance of juvenile turbot (mean±SE)
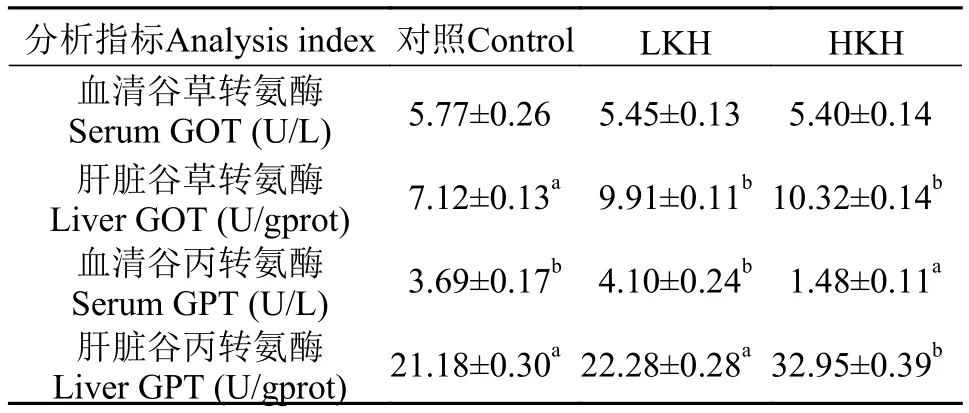
表 5 饲料中添加磷虾水解物对大菱鲆幼鱼血清及肝脏谷草转氨酶和谷丙转氨酶活性的影响(平均值±标准误)Tab. 5 The effects of dietary krill hydrolysates on GOT activities and GPT activities in serum and liver of juvenile turbot (mean±SE)
2.3 饲料中添加磷虾水解物对大菱鲆幼鱼消化酶活性的影响
由表 6可知, 各处理组之间幽门盲囊淀粉酶活性无显著性差异(P>0.05), 但HKH组肠道淀粉酶活性显著高于对照组(P<0.05), LKH组肠道淀粉酶活性略高于对照组, 但无显著性差异(P>0.05), 同时随着磷虾水解物添加量的升高, 肠道及幽门盲囊胰蛋白酶活性呈先降低后升高的趋势, 且在HKH组显著高于对照组(P<0.05)。
2.4 饲料中添加磷虾水解物对大菱鲆鱼体组成的影响
由表 7可知, 各处理组之间鱼体粗灰分含量无显著性差异(P>0.05); HKH组鱼体水分及粗蛋白含量均显著高于对照组(P<0.05), LKH组鱼体水分及粗蛋白含量略高于对照组, 但无显著性差异(P>0.05); LKH、HKH组鱼体粗脂肪含量显著高于对照组(P<0.05); 随着磷虾水解物添加量的增加, 大菱鲆幼鱼肌肉氟含量呈升高趋势, 但各处理组无显著性影响(P>0.05)。
由表 8可知, 在大菱鲆幼鱼肌肉所测得的17种氨基酸中, 除组氨酸外, 其他氨基酸在3组之间均产生显著差异(P<0.05)。在必需氨基酸中, HKH组缬氨酸、异亮氨酸、亮氨酸含量显著高于其他两组(P<0.05); LKH、HKH组苏氨酸、赖氨酸和精氨酸含量显著高于对照组(P<0.05), 但两组之间无显著性差异(P>0.05)。随着磷虾水解物添加量的增加,大菱鲆幼鱼肌肉总氨基酸和必需氨基酸含量显著升高(P<0.05); 3组之间必需氨基酸占总氨基酸的比值均大于40%, 必需氨基酸与非必需氨基酸比值均大于90%, 且均在LKH组显著高于对照组(P<0.05),其他两组之间无显著性差异(P>0.05)。

表 6 饲料中添加磷虾水解物对大菱鲆幼鱼消化酶活性的影响(平均值±标准误)Tab. 6 The effects of dietary krill hydrolysates on digestive enzymes activities of juvenile turbot (mean±SE)

表 7 饲料中添加磷虾水解物对大菱鲆幼鱼体化学组成及肌肉氟残留的影响(平均值±标准误)Tab. 7 The effects of dietary krill hydrolysates on body chemical composition and retention of fluorine in muscle of juvenile turbot (mean±SE)
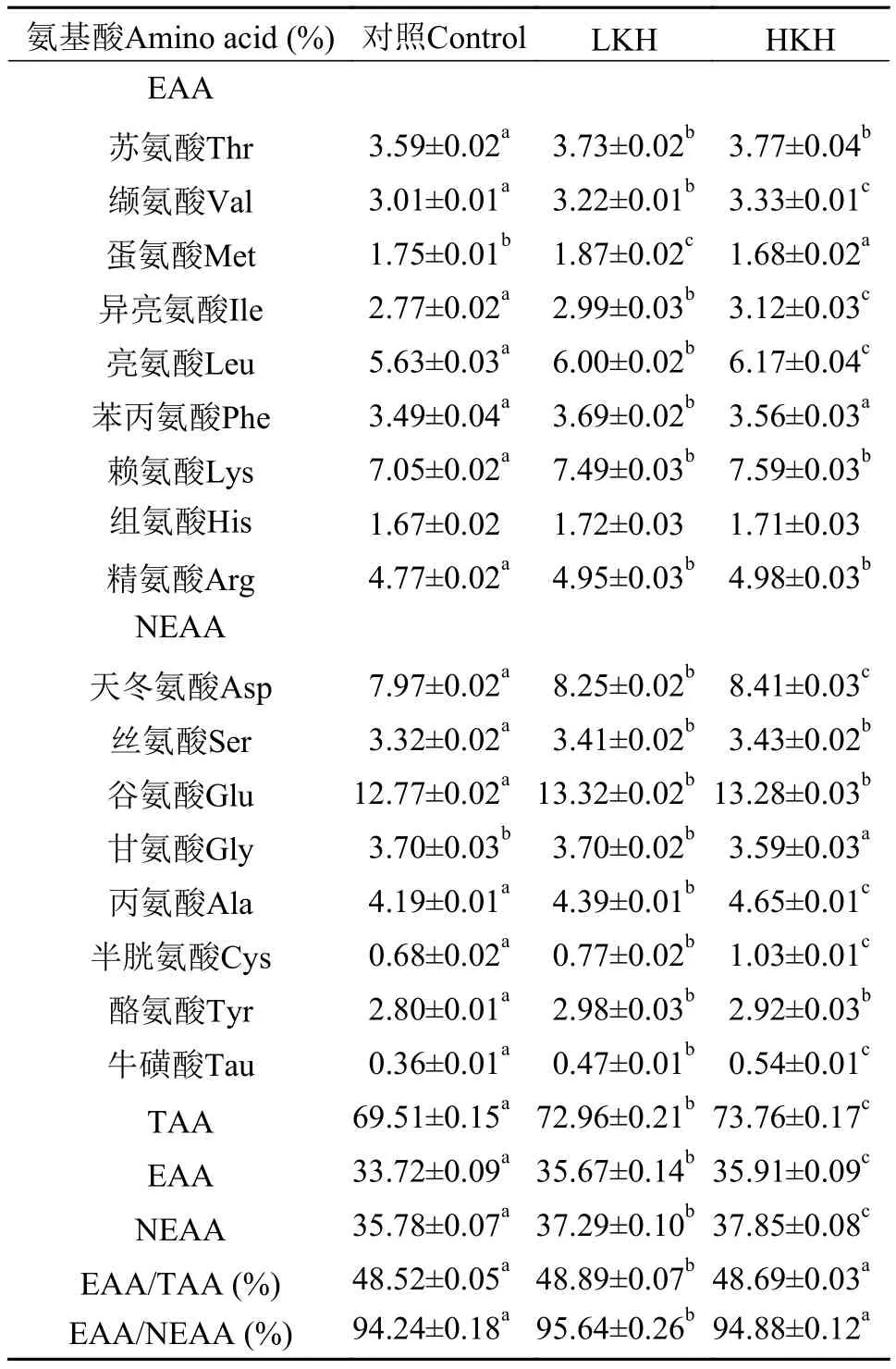
表 8 饲料中添加磷虾水解物对大菱鲆幼鱼肌肉氨基酸组成的影响(%)(平均值±标准误)Tab. 8 The effects of dietary krill hydrolysates on amino acid composition in muscle of juvenile turbot (%) (mean±SE)
3 讨论
3.1 饲料中添加磷虾水解物对大菱鲆幼鱼生长性能及饲料利用的影响
在本实验中, 饲料中添加10%磷虾水解物替代鱼粉, 显著提高了大菱鲆幼鱼的增重率、特定生长率、饲料效率、蛋白质效率比和蛋白质沉积率, 表明磷虾水解物可以替代部分鱼粉, 并提高大菱鲆的生长性能和饲料利用。Córdova-Murueta等[11]添加磷虾水解物分别替代饲料总蛋白的3%、9%和15%,以商品饲料为对照, 对南美白对虾进行研究, 结果发现不同梯度磷虾水解物组南美白对虾增重率均显著升高, 饲料系数均显著降低, 这与本实验结果一致。Kousoulaki等[10]研究表明磷虾水解物可以提高大西洋鲑的末重和蛋白质效率比, 同时降低饲料系数, 但各组之间不存在显著性差异, 这可能在于养殖周期较短(42d), 本实验养殖周期为10周, 则发现饲料中添加10%磷虾水解物能够促进大菱鲆的生长。孔凡华等[3]在饲料中添加不同梯度的磷虾粉替代鱼粉蛋白, 饲喂大菱鲆幼鱼后, 发现磷虾粉替代20%—40%鱼粉对大菱鲆幼鱼特定生长率没有显著性影响, 这与本实验结果不同, 可能在于磷虾水解物中含有较多的小肽和游离氨基酸, 有利于大菱鲆的生长。本实验室团队对水解鱼蛋白的研究发现, 在饲料中添加5%左右的水解鱼蛋白能够显著促进牙鲆[17]、大菱鲆[18]及中国对虾[21]的生长, 而在饲料中添加10%或更高水平的水解鱼蛋白则抑制牙鲆[17]、大菱鲆[19]及中国对虾[21]的生长, 这与本实验结果不同, 可能在于磷虾水解物相比于水解鱼蛋白, 含有较高的脂肪, 而磷脂脂肪中含有大量的磷脂[28], 已有研究表明, 南极磷虾的磷脂对于鱼类的生长非常重要。Taylor等[29]对大西洋鲑不同生长阶段(1—20 g)的研究发现, 相比于大豆卵磷脂, 饲料中添加2.6%磷虾磷脂能够显著提高大西洋鲑的生长速率。在本实验水平上继续增加磷虾水解物的添加量是否能促进大菱鲆的生长有待进一步研究。
较多的研究表明, 不同处理的磷虾粉均能促进鱼类摄食, 提高鱼类摄食率[4,12]。但在本实验中, 与对照组相比, 添加5%磷虾水解物对大菱鲆的摄食率无显著性影响, 而添加10%磷虾水解物则显著降低大菱鲆的摄食率。Kousoulaki等[10]在磷虾水解物游离氨基酸对大西洋鲑的研究中发现, 添加19%和38%磷虾水解物组平均日摄食率无显著性差异, 这与本实验结果相似。相似地, Zheng等[18]在饲料中添加3.7%超滤水解鱼蛋白没有影响大菱鲆的摄食率。Anders等[22]也发现, 高植物蛋白饲料中添加14%水解鱼蛋白组大西洋鲑摄食率显著低于鱼粉组, 但与添加7%水解鱼蛋白组无显著性差异, 与本实验结果一致, 这表明磷虾水解物或水解鱼蛋白的诱食性可能不是影响鱼类生长的主要因素。
3.2 饲料中添加磷虾水解物对大菱鲆幼鱼血清及肝脏谷草转氨酶和谷丙转氨酶活性的影响
谷丙转氨酶和谷草转氨酶是2种主要的转氨酶。在正常情况下, 脊椎动物血清中只有少量转氨酶, 当肝脏功能受损时, 谷丙转氨酶和谷草转氨酶被释放到血液中, 导致血清中两种转氨酶浓度突然上升, 因此谷丙转氨酶和谷草转氨酶活性变化常作为反映肝细胞受损的主要敏感指标[30]。在本实验中, LKH、HKH组血清GOT活性均低于对照组, HKH组GPT活性低于对照组, 且LKH组GPT活性与对照组无显著性差异, 这表明磷虾水解物的添加并没有对大菱鲆幼鱼的肝脏造成损伤。与本实验结果相似, 魏佳丽等[12]也发现珍珠龙胆石斑鱼(♀Epinephelus fuscoguttatus×♂Epinephelus lanceolatu)摄食酶解磷虾粉没有对其肝脏造成代谢负担, 但在对星斑川鲽(Platichthys stellatus)饲喂磷虾粉的研究中, 发现磷虾粉替代75%鱼粉组血清谷草转氨酶活性显著升高, 说明替代比例过高会对星斑川鲽幼鱼肝脏有一定的损伤, 这也可能是因为在本实验水解过程中过滤掉较多虾壳, 减少了磷虾水解物中氟含量, 从而降低对肝脏的损伤。
转氨酶在动物体内参与机体内蛋白质的代谢,催化氨基酸与酮酸之间氨基的转移, 谷丙转氨酶能催化谷氨酸与丙酮酸之间的转氨作用, 谷草转氨酶能催化谷氨酸与草酰乙酸之间的转氨作用[31]。GPT活性升高表明氨基酸代谢旺盛, 其合成代谢增强, 蛋白质分解减弱, 有利于氮在体内的沉积, 而GOT活性升高则说明尿素生成加快, 从而降低了氨基酸代谢产物对机体的毒害, 所以GOT、GPT的高低反映了机体对蛋白质合成和分解代谢的状况[32]。在本实验中, LKH组肝脏GOT活性显著高于对照组, 而肝脏GPT活性与对照组无显著性差异, 这表明添加5%磷虾水解物不能有效促进氨基酸代谢,但也不会对肝脏造成损伤; HKH组肝脏GOT活性和GPT活性均显著高于对照组和LKH组, 这说明添加10%磷虾水解物能够促进氨基酸代谢, 有利于蛋白质沉积, 这与生长结果相一致。
3.3 饲料中添加磷虾水解物对大菱鲆幼鱼消化酶活性的影响
鱼类对食物的消化吸收主要是依赖于消化酶的催化分解作用。从口腔开始的整个消化道内都有消化酶的分布, 这些酶来源于消化道黏膜分泌细胞和消化腺, 食物在消化酶的作用下被水解成可被消化道上皮细胞吸收的成分[33], 因此消化酶活性的高低可以反映鱼类对营养物质的消化吸收能力。
在本实验中, 各处理组之间幽门盲囊淀粉酶活性无显著性差异, HKH组肠道淀粉酶活性显著高于对照组, 这表明添加10%磷虾水解物提高了大菱鲆对糖类的消化吸收能力。Hansen等[13]研究了磷虾粉和脱壳磷虾粉全部替代鱼粉对大西洋鲑生长的影响, 发现磷虾粉全部替代鱼粉组前肠和中肠胰蛋白酶活性显著降低, 而脱壳磷虾粉全部替代鱼粉组与对照组无显著性差异, 这表明磷虾粉经脱壳后,更易于被大西洋鲑消化吸收, 这可能在于磷虾壳中含有较多几丁质, 不利于鱼类的利用。在本实验中,随着磷虾水解物添加量的升高, 肠道及幽门盲囊胰蛋白酶活性先降低后升高, 且在HKH组显著高于对照组, 这说明添加10%磷虾水解物能够促进鱼体对蛋白质的消化吸收。但Córdova-Murueta等[11]对南美白对虾的研究发现, 饲料中不同比例磷虾水解物不会影响对虾中肠胰蛋白酶活性, 推测其原因可能在于鱼虾消化系统和消化能力不同。张珊等[23]在水解鱼蛋白对半滑舌鳎仔稚鱼的研究中发现, 低分子量水解鱼蛋白和水解鱼蛋白的添加不会影响半滑舌鳎仔稚鱼的胰蛋白酶活性, 相似地, 牟玉超等[19]研究发现, 饲料中添加8.9%水解鱼蛋白对大菱鲆幼鱼消化酶活性无显著性差异, 这与本实验研究结果不同, 可能在于磷虾水解物中可能存在一些与水解鱼蛋白不同的小肽等物质, 能够促进大菱鲆的消化吸收, 具体原因尚待进一步分析。
3.4 饲料中添加磷虾水解物对大菱鲆鱼体组成的影响
鱼体组成变化可以反映饲料蛋白源优劣, 也在一定程度上反映了动物对不同饲料蛋白源营养成分和能量利用的差异。一般来说, 优质蛋白源中的蛋白质易被鱼类消化吸收, 并及时用来作为机体的生长和组织的更新, 有利于鱼类快速生长[34]。在本实验中, 磷虾水解物的添加影响了大菱鲆鱼体组成,与对照组相比, LKH、HKH组鱼体粗脂肪含量显著升高; HKH组鱼体水分及粗蛋白含量均显著升高,而LKH组鱼体水分及粗蛋白含量无显著性差异, 这与生长指标相一致, 说明磷虾水解物是一种优质蛋白源, 有利于鱼体的粗蛋白和粗脂肪的沉积, 促进鱼体快速生长。相关研究也表明, 饲料中添加水解鱼蛋白[17—19]能够提高鱼体的粗蛋白和粗脂肪含量,促进鱼体对粗蛋白和粗脂肪的累积, 这表明经水解所得的水解鱼蛋白及磷虾水解物更有利于鱼类的利用。与本实验结果相似, 黄艳青等[5]对点带石斑鱼幼鱼利用南极大磷虾粉的研究中, 40%南极大磷虾粉替代鱼粉组肌肉粗蛋白和粗脂肪含量均显著高于对照组。Córdova-Murueta等[11]也发现磷虾水解物的添加能够促进南美白对虾蛋白质的沉积。但魏佳丽等[12]对磷虾粉在星斑川鲽的研究中, 发现鱼体粗蛋白含量无显著差异, 粗脂肪含量降低, 这与磷虾粉在虹鳟[6,7]和黄尾[8](Seriola quinqueradiata)的研究结果一致, 作者认为可能是磷虾虾壳中的几丁质, 尤其是壳聚糖抑制了鱼类对脂肪的沉积,也可能在于酶解产生的小肽也能阻碍鱼体吸收脂肪, 并促进脂质的代谢[35]。本实验磷虾水解物的添加促进了鱼体脂肪的沉积, 可能在于水解过滤掉了磷虾虾壳等不能被水解的物质, 使得几丁质含量减少, 也可能与水解物中残留少量磷脂等脂肪有关。这也可能是不同的酶酶解得到的小肽不同, 使鱼体对脂肪的沉积效应不同所造成, 具体原因需要进一步研究分析。
本实验对鱼体肌肉氨基酸的分析发现, 在所测得的17种氨基酸中, 除组氨酸外, 其他氨基酸在三组之间均产生显著差异, 且随着磷虾水解物添加量的增加, 大菱鲆幼鱼肌肉总氨基酸和必需氨基酸含量显著升高, 这表明磷虾水解物的添加能够改善鱼体的肌肉氨基酸组成, 促进鱼体内氨基酸的沉积。与本实验结果相似, Kousoulaki等[10]对大西洋鲑的研究中, 磷虾水解物的添加对肌肉游离氨基酸组成产生影响。而魏佳丽等[12]对星斑川鲽和珍珠龙胆鱼的研究发现, 磷虾粉或酶解磷虾粉的添加对鱼体肌肉非必需氨基酸组成产生影响, 而对鱼体肌肉的必需氨基酸组成、总必需氨基酸含量和总氨基酸含量无显著性影响。这可能与磷虾粉加工方式以及鱼的种类的不同有关。这与对水解鱼蛋白的研究相似, 研究表明水解鱼蛋白的添加能够影响鱼类的肌肉氨基酸组成[19,20], 但Hevrøy等[24]研究发现饲料中添加不同水平的水解鱼蛋白对大西洋鲑肌肉氨基酸组成无显著性影响, 这可能是研究鱼类的不同造成对水解鱼蛋白的利用不同。此外, 根据FAO/WHO的理想模式, 质量较好的蛋白质其组成氨基酸中必需氨基酸占总氨基酸的比值为40%左右, 必需氨基酸与非必需氨基酸的比值在60%以上[36], 在本实验中, 3组鱼体肌肉必需氨基酸占3组之间必需氨基酸占总氨基酸的比值均大于40%, 必需氨基酸与非必需氨基酸比值均大于90%, 表明大菱鲆幼鱼肌肉氨基酸组成较好, 这也说明磷虾水解物的添加不会影响大菱鲆幼鱼肌肉的营养价值。
3.5 饲料中添加磷虾水解物对大菱鲆肌肉氟残留的影响
研究表明, 氟的生物活性随着水体硬度的升高而降低, 水生动物对氟的累积主要集中于骨骼, 而氟对鱼类的毒害作用主要是以氟离子形式作用于酶的作用位点, 抑制酶的活性, 从根本上阻碍糖酵解和蛋白质合成等代谢过程, 此外, 氟的毒性与机体氟浓度, 水温成正比, 而与水中钙、氯离子浓度成反比[37]。一般来说, 淡水鱼比海水鱼对氟的毒性更敏感[6—8]。南极磷虾壳对氟具有较强的富集能力, 在南极磷虾死后, 虾壳中的氟会很快渗透到虾肉中, 使得南极磷虾肉因含氟量过高而失去食用价值[38]。目前, 在对珍珠龙胆石斑鱼[12]、虹鳟[6,7]、大西洋鲑[9,13,14]、斑马鱼[15](Brachydanio rerio)、大西洋鳕鱼[39](Gadus morhua)、庸蝶[39](Hippoglossus hippoglossus)的研究中发现, 添加磷虾粉对鱼类肌肉氟含量无显著性影响, 这与本实验结果一致。另外, 在本实验中, 各试验组肌肉中氟残留量均低于1 mg/kg, 而根据食品中氟允许量标准GB4809-84规定, 肉类和鱼类(淡水)氟含量≤2.0 mg/kg, 这表明饲料中添加磷虾水解物不会影响大菱鲆的食用安全。
综上所述, 饲料中添加10%磷虾水解物能够替代部分鱼粉, 有利于提高大菱鲆的生长性能和饲料利用, 提高消化酶活性, 促进机体氨基酸代谢和消化吸收。
[1]Chang Q, Qin B Y, Kong F H, et al. Application of Antarctic Krill in Aquatic Feed [J]. Chinese Journal of Animal Nutrition, 2013, 25(2): 256—262 [常青, 秦帮勇, 孔繁华,等. 南极磷虾在水产饲料中的应用. 动物营养学报, 2013, 25(2): 256—262]
[2]Liu L. Biological Characteristics and Development Prospect of Antarctic Krill [J]. Farm Products Processing, 2015, (3): 60—61 [刘丽. 南极磷虾的生物特性及其开发前景. 农产品加工, 2015, (3): 60—61]
[3]Kong F H, Liang M Q, Wu L X, et al. Effect of different level of Antarctic krill meal on growth, non-specific immunity and fluoride retention in diets of turbot, Scophthalmus maximus [J]. Progress in Fishery Sciences, 2012, 33(1): 54—60 [孔凡华, 梁萌青, 吴立新, 等. 南极磷虾粉对大菱鲆生长、非特异性免疫及氟残留的影响. 渔业科学进展, 2012, 33(1): 54—60]
[4]Suontama J, Ø KARLSEN, Moren M, et al. Growth, feed conversion and chemical composition of Atlantic salmon (Salmo salar L.) and Atlantic halibut (Hippoglossus hippoglossus L.) fed diets supplemented with krill or amphipods [J]. Aquaculture Nutrition, 2007, 13(4): 241—255
[5]Huang Y Q, Gong Y Y, Lu J X, et al. Effect of Antarctic krill powder on tissue fluoride accumulation and growth of juvenile grouper (Epinephelus malabaricus) [J]. Marine Sciences, 2015, 39(6): 32—38 [黄艳青, 龚洋洋, 陆建学, 等. 南极大磷虾粉对点带石斑鱼幼鱼氟蓄积的影响. 海洋科学, 2015, 39(6): 32—38]
[6]Yoshitomi B, Aoki M, Oshima S I, et al. Evaluation of krill (Euphausia superba) meal as a partial replacement for fish meal in rainbow trout (Oncorhynchus mykiss) diets [J]. Aquaculture, 2006, 261(1): 440—446
[7]Yoshitomi B, Aoki M, Oshima S I. Effect of total replacement of dietary fish meal by low fluoride krill (Euphausia superba) meal on growth performance of rainbow trout (Oncorhynchus mykiss) in fresh water [J]. Aquaculture, 2007, 266(s 1-4): 219—225
[8]Bunji Y, Ichiro N. Effect of dietary fluoride derived from Antarctic krill (Euphausia superba) meal on growth of yellowtail (Seriola quinqueradiata) [J]. Chemosphere, 2012, 86(9): 891—897
[9]Julshamn K, Malde M K, Bjorvatn K, et al. Fluoride retention of Atlantic salmon (Salmo salar) fed krill meal [J]. Aquaculture Nutrition, 2004, 10(1): 9—13
[10]Kousoulaki K, Rønnestad I, Olsen H J, et al. Krill hydrolysate free amino acids responsible for feed intake stimulation in Atlantic salmon (Salmo salar) [J]. AquacultureNutrition, 2013, 19(Supplement s1): 47—61
[11]Córdova-Murueta J H, Garcı́A-Carreño F L. Nutritive value of squid and hydrolyzed protein supplement in shrimp feed [J]. Aquaculture, 2002, 210(1): 371—384
[12]Wei J L. Application effects of krill meal in feeds for juvenile starry flounder (Platichthys stellatus) and pearl gentian grouper (♀Epinephelus fuscoguttatus×♂Epinephelus lanceolatu) [D]. Thesis for Master of Science. Shanghai Ocean University, Shanghai. 2015 [魏佳丽. 磷虾粉在星斑川鲽和珍珠龙胆石斑鱼幼鱼饲料中的应用研究. 硕士学位论文, 上海海洋大学, 上海. 2015]
[13]Hansen J Ø, Penn M, Øverland M, et al. High inclusion of partially deshelled and whole krill meals in diets for Atlantic salmon (Salmo salar) [J]. Aquaculture, 2010, 310(s 1-2): 164—172
[14]Hansen J Ø, Shearer K D, Øverland M, et al. Replacement of LT fish meal with a mixture of partially deshelled krill meal and pea protein concentrates in diets for Atlantic salmon (Salmo salar) [J]. Aquaculture, 2011, 315(3-4): 275—282
[15]Liang B, Liu Y, Jiang G L, et al. The effect of dietary Antarctic krill peptide on growth and blood biochemical indices of zebrafish, Brachydanio rerio [J]. Feed Research, 2014, (17): 42—45 [梁冰, 刘云, 姜国良. 南极磷虾肽对斑马鱼生长及生理生化指标的影响. 饲料研究, 2014, (17): 42—45]
[16]Zheng K, Liang M, Yao H, et al. Effect of dietary fish protein hydrolysate on growth, feed utilization and IGF-I levels of Japanese flounder (Paralichthys olivaceus) [J]. Aquaculture Nutrition, 2012, 18(3): 297—303
[17]Xu T H, GAO X P, Liang M Q, et al. Effects of small size-fractionated fish protein hydrolysate substitution of fish meal in high plant protein diets on the growth performance and non-specific immunity of Japanese flounder, Paralichthys olivaceus [J]. Progress in Fishery Sciences, 2012, 33(3): 60—69 [许团辉, 高湘萍, 梁萌青,等. 高植物蛋白饲料中以低分子水解蛋白替代鱼粉对牙鲆生长性能及非特异性免疫的影响. 渔业科学进展, 2012, 33(3): 60—69]
[18]Zheng K K, Liang M Q, Yao H B, et al. Effect of sizefractionated fish protein hydrolysate on growth and feed utilization of turbot (Scophthalmus maximus L.) [J]. Aquaculture Research, 2013, 44(44): 895—902
[19]Mu Y C. Effects of protein hydrolysates on growth performance and related gene expression of juvenile turbot (Scophthalmus maximus L.) [D]. Thesis for Master of Science. Shanghai Ocean University, Shanghai. 2015 [牟玉超. 饲料中蛋白水解物对大菱鲆幼鱼生长性能及相关基因表达的影响. 硕士学位论文, 上海海洋大学, 上海. 2015]
[20]Wei Y L, Liang M Q, Zheng K K, et al. The effects of fish protein hydrolysate on the digestibility of juvenile turbot (Scophthalmus maximus L.) [J]. Acta Hydrobiologica Sinica, 2014, 38(5): 910—920 [卫育良, 梁萌青, 郑珂珂, 等. 水解鱼蛋白对大菱鲆幼鱼消化率的影响. 水生生物学报, 2014, 38(5): 910—920]
[21]Teng Y Q, Liang M Q, Wang Z L, et al. Effects of fish protein hydrolysate in the diet on the non-specific immune response of Penaeus chinensis [J]. Progress in Fishery Sciences, 2011, 32(5): 84—91 [滕玉清, 梁萌青,王正丽, 等. 饲料中水解鱼蛋白对中国对虾非特异免疫的影响. 渔业科学进展, 2011, 32(5): 84—91]
[22]Aksnes A, Hope B, Jonsson E, et al. Size-fractionated fish hydrolysate as feed ingredient for rainbow trout (Oncorhynchus mykiss) fed high plant protein diets. I. Growth, growth regulation and feed utilization [J]. Aquaculture, 2006, 216(1): 305—317
[23]Zhang S. Effects of crystalline amino acid and fish hydrolysate on growth performance, digestive enzymes and PepT1 gene expression in tongue sole (Cynoglossus semilaeviss Günther) larvae [D]. Thesis for Master of Science. Ocean University of China, Qingdao. 2013 [张珊. 晶体氨基酸与水解鱼蛋白对半滑舌鳎稚鱼的生长、消化酶活力及PepT1基因表达的影响. 硕士学位论文, 中国海洋大学, 青岛. 2013]
[24]Hevrøy E M, Espe M, Waagbø R, et al. Nutrient utilization in Atlantic salmon (Salmo salar L.) fed increased levels of fish protein hydrolysate during a period of fast growth [J]. Aquaculture Nutrition, 2005, 11(4): 301—313
[25]Kousoulaki K, Olsen H J, Albrektsen S, et al. High growth rates in Atlantic salmon (Salmo salar L.) fed 7.5% fish meal in the diet. Micro-, ultra- and nano-filtration of stickwater and effects of different fractions and compounds on pellet quality and fish performance [J]. Aquaculture, 2012, s 338-341(4): 134—146
[26]Sanaz Khosravi, Samad Rahimnejad, Mikaël Herault, et al. Effects of protein hydrolysates supplementation in low fish meal diets on growth performance, innate immunity and disease resistance of red sea bream Pagrus major [J]. Fish & Shellfish Immunology, 2015, 45(2): 858—868
[27]Erlanger B F, Kokowsky N, Cohen W. The preparation and properties of two new chromogenic substrates of trypsin [J]. Archives of Biochemistry & Biophysics, 1961, 95(2): 271—278
[28]Saito H, Kotani Y, Keriko J M, et al. High levels of n -3 polyunsaturated fatty acids in Euphausia pacifica, and its role as a source of docosahexaenoic and icosapentaenoic acids for higher trophic levels [J]. Marine Chemistry, 2002, 78(1): 9—28
[29]Taylor J F, Martinez-Rubio L, Pozo J D, et al. Influence of dietary phospholipid on early development and performance of Atlantic salmon (Salmo salar) [J]. Aquaculture, 2015, 448: 262—272
[30]Zheng Y H, Pu F Y. Effect of mercury on transaminase activities of tissues in C. parpio & C. auratus [J]. Journal of Southwest Agricultural University (Natural Sciences), 1997, (1): 41—45 [郑永华, 蒲富永. 汞对鲤鲫鱼组织转氨酶活性的影响. 西南大学学报(自然科学版), 1997, (1): 41—45]
[31]Wu L F, Qin G X, Liu C L, et al. Effects of dietary soybean protein on the activity of digestive enzyme and blood biochemical parameters of carp [J]. Journal ofNorthwest A & F University, 2009, (8): 63—69 [吴莉芳,秦贵信, 刘春力, 等. 饲料大豆蛋白对鲤鱼消化酶活力和血液主要生化指标的影响. 西北农林科技大学学报:自然科学版, 2009, (8): 63—69]
[32]YAN Q, Xie S Q, Zhu X, et al. Dietary methionine requirement for juvenile rockfish, Sebastes schlegeli [J]. Aquaculture Nutrition, 2007, 13(3): 163—169
[33]Mai K S. Nutrition and Feed of Aquatic Animal [M]. Beijing: Chinese Agricultural Press. 2011, 247—248 [麦康森. 水产动物营养与饲料学. 北京: 中国农业出版社. 2011, 247—248]
[34]Li E C, Chen L Q, Gu S Z, et al. A review on methodology for evaluation of an aquaculture dietary protein source [J]. Marine Science, 2009, 33(7): 113—117 [李二超, 陈立侨, 顾顺樟, 等. 水产饲料蛋白源营养价值的评价方法. 海洋科学, 2009, 33(7): 113—117]
[35]Wang J Y, Jiang J K, Zhang L M, et al. Effects of dietary chitosan on growth, lipid deposition and antioxidant capacity of juvenile starry flounder (Platichthys stellatus) [J]. Chinese Agricultural Science Bulletin, 2013, 29(8): 64—70 [王际英, 蒋锦坤, 张利民, 等. 壳聚糖对星斑川鲽幼鱼生长、脂肪含量及抗氧化能力的影响. 中国农学通报, 2013, 29(8): 64—70]
[36]Ji D W, Li M Y, Shi Y H, et al. The Nutritional Composition and Evaluation in Muscle of Acrossocheilus fasciatus [J]. Acta Nutrimenta Sinica, 2009, 31(3): 298—300 [冀德伟, 李明云, 史雨红, 等. 光唇鱼的肌肉营养组成与评价. 营养学报, 2009, 31(3): 298—300]
[37]Camargo J A. Fluoride toxicity to aquatic organisms: a review [J]. Chemosphere, 2003, 50(3): 251—64
[38]Yue D D, Wang L M, Huang H L, et al. Status of development and countermeasures on utilization technology of Antarctic krill resources in China [J]. Journal of Agricultural Science & Technology, 2015, (3): 159—166 [岳冬冬, 王鲁民, 黄洪亮, 等. 我国南极磷虾资源开发利用技术发展现状与对策. 中国农业科技导报, 2015, (3): 159—166]
[39]Moren M, Malde M K, Olsen R E, et al. Fluorine accumulation in Atlantic salmon (Salmo salar), Atlantic cod (Gadus morhua), rainbow trout (Onchorhyncus mykiss) and Atlantic halibut (Hippoglossus hippoglossus) fed diets with krill or amphipod meals and fish meal based diets with sodium f [J]. Aquaculture, 2007, 269(s 1-4): 525—531
EFFECTS OF DIETARY KRILL HYDROLYSATES ON GROWTH PERFORMANCE, BODY COMPOSITION AND RELATED ENZYME ACTIVITIES OF JUVENILE TURBOT (SCOPHTHALMUS MAXIMUS L.)
ZHANG Li-Li1,2, LIANG Meng-Qing1, XU Hou-Guo1, LIU Xi1,2and ZHENG Ke-Ke1
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. Shanghai Ocean University, Shanghai 201306, China)
The current study investigated the effects of dietary krill hydrolysates on growth performance, body composition and related enzyme activities of juvenile turbot (Scophthalmus maximus L.) with a 10-week feeding trial using indoor flowing-through seawater system. Three isonitrogenous and isolipidic diets were formulated to contain 0 (Control), 5% (LKH), 10% (HKH) krill hydrolysates for substitution of fish meal protein in basal diet that includes 30% fish meal, respectively. The results showed that the specific growth rate (SGR), feed efficiency rate (FE), protein efficiency ratio (PER) and protein productive value (PPV) in HKH group were significantly higher than those in the control group, but the feed intake (FI) was significantly lower than that of the control group. HKH supplementation had significantly higher whole-body moisture, whole-body crude protein contents and whole-body lipid contents than those in the control group (P<0.05). Both LKH and HKH groups significantly enhanced the muscle total amino acids contents and essential amino acids content compared with control group (P<0.05). Compared with the control group, both LKH and HKH significantly induced glutamic oxalacetic transaminase (GOT) activities in liver but not GOT activities in serum. HKH group showed the highest glutamic-pyruvic transaminase (GPT) activities in liver and the lowest GPT activities in serum. HKH group significantly increased amylase activity in intestines. The increasing amount of krill hydrolysates supplied in diet first decreased and then increased trypsin activities in pyloric caecum and intestines, and HKH group had significantly higher trypsin activities in pyloric caecum and intestines than those in the control group. In conclusion, 10% krill hydrolysates supplementation in diets could promote growth performance, amino acid metabolism as well as digestion and absorption of juvenile turbot.
Krill hydrolysates; Turbot; Growth; Glutamic-pyruvic transaminase; Glutamic oxalacetic transaminase; Digestive enzymes
S896
A
1000-3207(2017)03-0497-09
10.7541/2017.64
2016-06-22;
2016-10-27
公益性行业专项(201303053); 国家自然科学基金项目(31172423)资助 [Supported by the Special Fund in the Public Interest (201303053); the National Natural Science Foundation of China (31172423)]
张莉莉(1992—), 女, 河南省漯河市人; 硕士; 主要从事水产动物营养与饲料学研究。E-mail: 582658678@qq.com
梁萌青(1963—), 女, 研究员; Tel: 0532-85822914; E-mail: liangmq@ysfri.ac.cn
