慢性功能性便秘患者的肠道菌群分析
2017-05-16黄林生高仁元严雪冰祝琦潘成尹明明李豪孔程张鹏沈通一秦环龙
黄林生 高仁元 严雪冰 祝琦 潘成 尹明明 李豪孔程 张鹏 沈通一 秦环龙
慢性功能性便秘患者的肠道菌群分析
黄林生1,2,3高仁元2,3严雪冰2,3祝琦2,3潘成2,3尹明明2,3李豪2,3孔程2,3张鹏2,3沈通一2,3秦环龙1,2,3
目的 探讨慢性功能性便秘患者与健康对照组之间肠道菌群的差异。方法 选取便秘组和健康对照组共计20人,留取新鲜粪便样本,冰块运送至实验室并存放于-80度冰箱。采用16S rRNA测序技术检测V4区鉴定菌群。结果 发现两组人群的菌群丰富度差异有统计学意义(P<0.05),菌群多样性差异无统计学意义。便秘患者与健康对照组之间的肠道细菌组成在门和属水平差异均存在显著统计学意义(P<0.05)。在门水平,便秘患者肠道中放线菌门(Actinobacteria)丰度显著增加(Z=-3.10,P<0.05),而变形菌门(Proteobacteria)丰度显著降低(Z=-2.42,P<0.05),在属水平发现20个菌属差异存在统计学意义(P<0.05)。其中,Coprobacillus(Z=-2.10,P<0.05)、Hungatella(Z=-2.31,P<0.05)、Holdemanella(Z=-2.32,P<0.05)、Anaerostipes(Z=-3.78,P<0.01)、Bacteroidales_S24-7_group_norank(Z=-2.15,P<0.05)、Bacteroides(Z=-3.78,P<0.01)、Blautia(Z=-3.78,P<0.05)、Collinsella(Z=-3.02,P<0.05)、Dorea(Z=-2.95,P<0.05)、[Eubacterium]_ruminantium_group(Z=-2.70,P<0.05)、Erysipelotrichaceae_UCG-003(Z=-3.10,P<0.05)、Ruminococcaceae_uncultured(Z=-2.50,P<0.05)、Parabacteroides(Z=-2.87,P<0.05)菌属在便秘患者的肠道中丰度明显增多,而Megasphaera(Z=-2.31,P<0.05)、Paraprevotella(Z=-2.94,P<0.05)、Prevotella_2(Z=-3.10,P<0.05)、Prevotella_9(Z=-3.68,P<0.01)、Enterococcus(Z=-2.27,P<0.05)、Catenibacterium(Z=-2.48,P<0.05)、Clostridium_sensu_stricto_1(Z=-2.50,P<0.05)菌属在健康对照组的肠道中丰度明显增多。结论 慢性功能性便秘患者的肠道菌群与健康人群的菌群存在较大差异,通过改变肠道菌群可能成为治疗慢性功能性便秘的新策略。
便秘; 肠道菌群失调; 菌群丰度; 16S rRNA
随着生活节奏的加快以及饮食结构的改变,便秘已经成为一种常见的肠道疾病。Mugie等[1]对涉及便秘的58篇流行病学文章进行系统性回顾发现,成人中便秘的平均患病率为16%,而在60岁以上的老年人中患病率高达33.5%,且女性患病率比男性高,约为1.5:1。便秘是一种以排便次数减少、排便困难和费力以及排便不尽感为主要临床表现的肠道疾病。而慢性功能性便秘是指排除肠道器质性病变和全身系统性的疾病以及药物作用因素所致的便秘。长期的便秘不仅影响个体的正常生活,还会增加心脑血管疾病、大肠癌的患病风险[2]。针对便秘的治疗方法有很多,传统的泻剂治疗方式存在诸多的局限性,不能从根本上解决便秘的病因。随着研究的不断深入,越来越多的证据表明慢性功能性便秘患者肠道菌群往往存在不同程度的比例失调。本研究旨在对慢性功能性便秘患者和健康人群的肠道菌群进行比较,以期发现一些具有疾病特征性的菌群,从而为便秘相关的菌群研究提供基础,也为便秘的微生态治疗提供理论基础和实践依据。
资料与方法
一、临床资料
选取2016年1月至2016年12月在上海市第十人民医院微生态门诊收治的10名便秘患者和在社区招募的10例健康人群为研究对象。本研究通过了上海市第十人民医院伦理委员会审核,所有参与研究的患者均签署了知情同意书。
(一)便秘病人纳入标准
1.符合便秘罗马Ⅲ诊断标准[3]:(1)在就诊之前三个月内出现2种或2种以上的情况:a.至少25%的排便感到费力;b.至少25%的排便为干球粪或硬粪;c.至少25%的排便有不尽感;d.至少25%的排便有肛门直肠梗阻感和(或) 堵塞感;e.至少25%的排便需手法辅助(如用手指协助排便、盆底支持);f.每周排便少于3次。(2)在未使用泻剂的情况下很少能出现稀便。(3)没有达到肠易激综合征(IBS)的标准;2.在确诊之前至少有6个月的临床症状;3.近三个月未使用抗生素、益生菌和导致便秘的药物;4.近3个月经肠镜检查或在入组前加做肠镜检查排除了肠道器质性的病变;5.经直肠指检和结肠传输试验符合便秘辅助检查要求的。
(二)健康组的人群纳入标准
1.没有便秘的疾病;2.近三个月没有服用抗生素、药物和益生菌制剂。
二、方法
在门诊对便秘组人群和健康对照组人群分别留取新鲜粪便样本,并放在-80度冰箱保存,在实验室进行分装后送检,采用16S rRNA细菌检测技术鉴定肠道菌群,并对两组样本进行菌群差异分析。
(一)16 RNA细菌检测方法
(1)首先对样本进行基因组DNA抽提,完成后利用1%琼脂糖凝胶电泳检测抽提的基因组DNA;(2)进行PCR扩增,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测;(3)参照电泳初步定量结果,将PCR产物用QuantiFluor™ -ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合;(4)Illumina平台文库构建与Illumina平台测序。
(二)生物学信息学分析
分析前先对原始数据进行过滤处理,得到优化序列。然后在去除嵌合体序列后进行OTU聚类分析,对OTU的代表序列作分类学分析。基于OTU聚类分析结果,再对OTU进行丰度(Ace和Chao指数)和多样性(Shannon和Simpson指数)分析以及对测序深度的检测;基于分类学信息,再对各个分类水平上进行群落结构的统计分析。
三、统计学分析
所有实验数据均使用SPSS17.0统计软件和GraphPa rism7.0软件分析。计量资料(两组人群的身高、体重、BMI指数、平均每周排便次数、平均便秘时间指标)均采用均数±标准差表示,样本比较采用t检验。两组样本的菌群差异性比较(门、属水平)均采用非参数检验(Mann-Whitney U秩和检验)。P<0.05为差异有统计学意义。
结 果
一、人群基本信息
本研究中便秘组纳入男性7例,女性3例,年龄38~85岁,平均年龄(71.00±4.89)岁;平均身高(168.70±2.30)cm,平均体重(63.20±3.24)千克,BMI指数(22.13±0.82)kg/m2,平均每周排便次数为(1.80±0.21)次,平均便秘时间(105.60± 35.95)个月。健康对照组中男性8例,女性2例,年龄60~75岁,平均(71.40±0.67)岁,平均身高(166.40±2.01)cm,平均体重(68.30±2.42)千克,BMI指数为(24.64±0.65)kg/m2,平均每周排便(6.70±0.15)次,均无便秘病史。两组在年龄、身高、体重方面差异无统计学意义(t=0.08,P=0.93;t=0.74,P=0.45;t=1.26,P=0.22),但是两组在BMI指数、每周排便次数、排便时间上差异存在统计学意义(t=2.40,P=0.03;t=5.6,P<0.0001;t=2.90,P=0.01)(表1)。
二、两组肠道菌群丰度和多样性比较
Chao指数和Ace指数是估计样品中所含OTU数目的指数,常用于评估菌群的丰富度。对两组的肠道菌群在进行统一聚类和抽平后进行分析,发现两组在丰富度(Ace指数和Chao指数)上差异存在统计学意义,健康组的肠道菌群丰度明显增高,而慢性功能性便秘患者的肠道菌群丰度显著降低。两组在多样性上差异无统计学意义(Shannon指数和Simpson指数)(表2,图1)。
三、菌群在门、属水平的差异性比较
在门水平,两组在变形菌门(Z=-2.42,P<0.05)和放线菌门(Z=-3.10,P<0.05)差异存在统计学意义(表3)。在便秘人群中Actinobacteria水平较高,但在健康人群中Proteobacteria水平较高(图2)。在属水平,Coprobacillus、Hungatella、Holdemanella、Anaerostipes、Bacteroidales_S24-7_group_ norank、Bacteroides、Blautia、Collinsella、Dorea、[Eubacterium]_ruminantium_group、Erysipelotrichaceae_UCG-003、Ruminococcaceae_ uncultured、Parabacteroides菌属在便秘病人的肠道中明显增多,Megasphaera、Paraprevotella、Prevotella_2、Prevotella_9、Enterococcus、Catenibacterium、Clostridium_sensu_stricto_1菌属在正常人群的肠道菌群中明显增高群中明显增高,20个菌属差异均存在统计学意义。取菌属所占比>0.01为有阈值水平,共计3个菌属存在差异(图3)。
表1 人群的基本信息(±s)
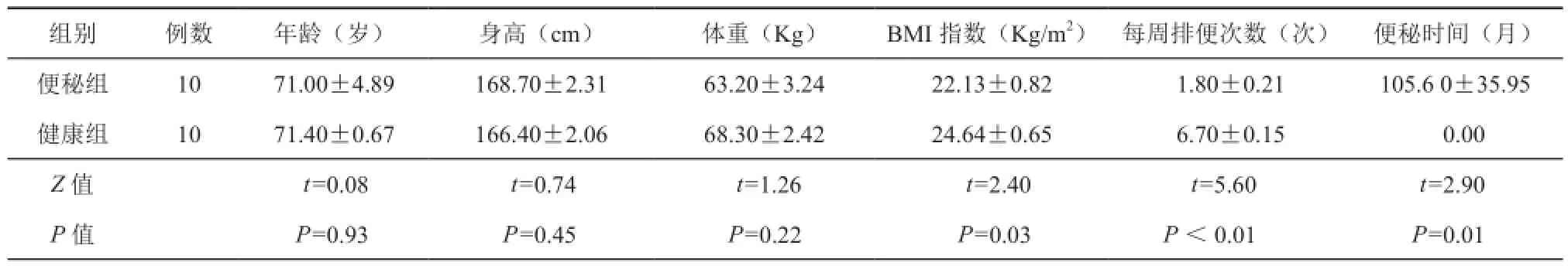
表1 人群的基本信息(±s)
组别例数年龄(岁)身高(cm)体重(Kg)BMI指数(Kg/m2)每周排便次数(次)便秘时间(月)便秘组1071.00±4.89168.70±2.3163.20±3.2422.13±0.821.80±0.21105.6 0±35.95健康组1071.40±0.67166.40±2.0668.30±2.4224.64±0.656.70±0.150.00 Z值t=0.08t=0.74t=1.26t=2.40t=5.60t=2.90 P值P=0.93P=0.45P=0.22P=0.03P<0.01P=0.01
讨 论
目前慢性功能性便秘微生态研究正不断受到研究人员的关注。目前研究发现慢性便秘不仅与机体解剖、肠道动力以及其他生理功能改变有关,而且与肠道微生态的改变密切相关。由于饮食结构、生活方式和遗传的差异性,使肠道菌群具有较大的个体差异,因此需要找出便秘人群具有特征性的可能致病菌群具有十分重要的意义。
本研究发现便秘患者的排便频率显著少于正常组,通过16S rRNA测序发现,便秘组的肠道菌群丰度显著低于健康组,而多样性无明显差异。这与Tim等[4]在儿童中研究的结论一致。在门水平,本研究发现放线菌门相对丰度在便秘组中显著增高,而变形菌门相对丰度在便秘组中显著降低。在属水平,本研究发现20种菌属在两组之间存在显著差异,按照相对丰度大于1%进行筛选,发现Paracteroides和Bacteroides在便秘组中显著富集,而Prevotella_9在便秘组中显著降低。既往的研究中发现便秘人群与健康人群有统计学意义的细菌也各有不同,Gopanandan等[5]在研究中发现患有结肠慢传输的便秘病人肠粘膜菌群与其他便秘病人和健康对照组有显著差异,拟杆菌属在便秘病人的结肠粘膜中显著增高,Firmicutes(Faecalibacterium,Lactococcus和Roseburia)能够促进结肠传输,粪便中的甲烷代谢产物影响了粪便的菌群构成,但不会影响结肠的传输。在本研究中Firmicutes在便秘组与健康组中却未发现统计学差异。Attaluri在对48例慢性传输性便秘(slow transi onstipation,ST)和48例非慢性传输型便秘 (norma ransi onstipation,NT) 和非便秘的人群进行比较时发现慢性传输型便秘的肠道内产甲烷梭菌(Methanogenus)的量明显增高,甲烷等代谢产物在ST的患者中是最高的,NT其次,在正常人中最低[6-7]。Zoppi等[8]在研究中发现便秘儿童中clostridia和bif i dobacteria菌属含量是增高的,在本次研究中未发现相似的改变。Tim等[4]在对76名便秘儿童的菌群与健康组进行对比分析发现,两组在拟杆菌属(脆弱拟杆菌、卵形拟杆菌)、长双岐杆菌、Parabacteroides、Alistipe i negoldii差异存在统计学意义。Parthasarathy等[5]在对25名便秘成人和25名健康人的结肠粘膜的菌群分析中发现Bacteriodetes菌属在便秘患者中是增高的。而在本次研究中发现Parabacteroides和拟杆菌属也在便秘人群的肠道中显著增加,说明本研究结果具有较好的可信度。
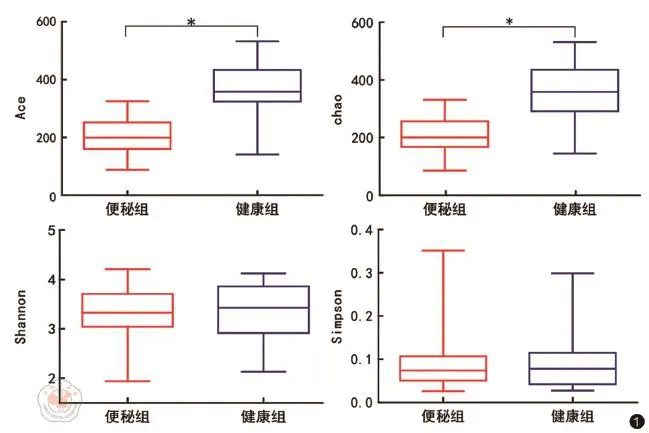
图1 图示便秘组和健康对照组之间丰度(Ace和Chao指数)和多样性(Shannon和Simpson指数)差异*P<0.05
Dan等[9]在对便秘病人服用合生元的试验中发现合生元能够显著改善病人的排便情况,使AGACHAN评分明显增高。Veronica等[10]在研究中通过对便秘病人使用Lactobacillu euteri菌发现益生菌能够显著改善便秘病人的排便状况。粪菌移植也逐渐成为便秘的另一种治疗方法,Tian等[11]在对24例慢性结肠传输型便秘的患者进行3天的鼻胃管灌注法粪菌移植后观察到在12周后,临床效果得到提高和缓解的比例分别达到50%和37.5%。可见针对便秘患者进行基于肠道菌群的疗法也具有一定的有效性。

图2 便秘组和健康对照组之间放线菌门(Actinobacteria)和变形菌门(Proteobacteria)的丰度差异*P<0.05
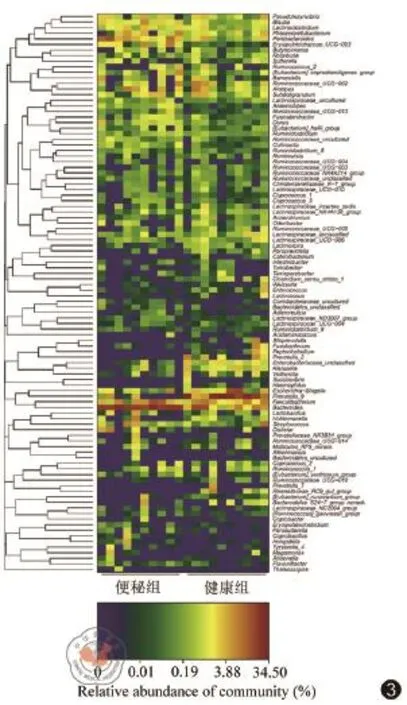
图3 便秘组和健康组菌群在属水平的Heatmap图

表2 CFC和HC在属水平显著差异菌群的相对丰度(%)
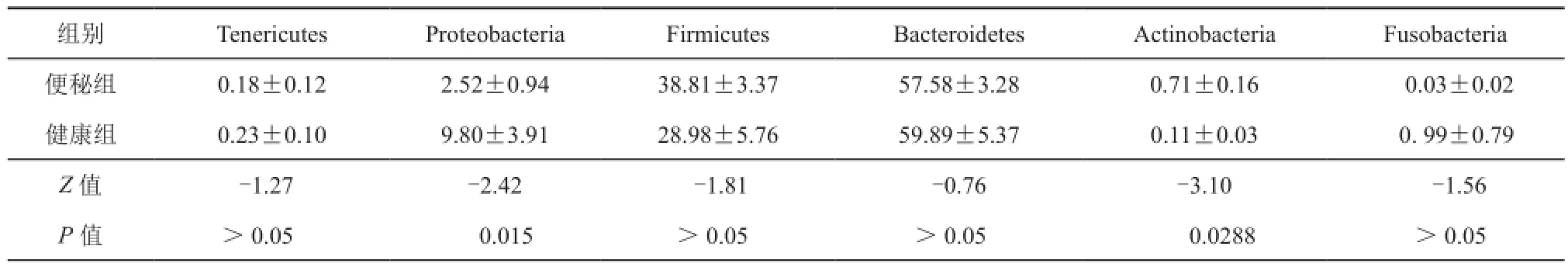
表3 CFC和HC在门水平菌群的相对丰度比较(%)
关于肠道菌群和胃肠道蠕动之间的关系,很多无菌老鼠的实验中揭示了胃肠道缺乏菌群定植与肠道运动障碍有紧密的联系[12-14],但是具体的病理机制仍然不明确,一种解释是细菌能够调控控制肠道蠕动相关基因的表达[15],另一种解释为肠道的蠕动依赖发酵产物形成的PH环境、菌群代谢产物形成的渗透作用、肠腔内的气体(二氧化碳,氢类,甲烷)增多反射性引起肠道平滑肌的收缩作用[16]。一些动物研究还发现了特定的菌群与肠道动力之间的关系,Bifidobacteriu ifidum、Lactobacillu euterii和Lactobacillu ci-dophilus菌群能够促进肠道的蠕动,Escherichia却对肠道蠕动有抑制作用[17-19]。
本研究仍存在一定的局限性,首先只选取了10例便秘病人和10例健康人群进行比较,样本的数量较少,其次本研究未能将地域、饮食习惯、生活方式的差异性等因素纳入研究。在本研究的基础上,针对便秘人群与健康人群存在的菌群差异,采用微生态治疗以改善慢性功能性便秘的症状和肠道菌群谱已经成为便秘治疗的一个重要方向。
总之,本研究初步发现在便秘人群和健康人群中存在显著差异的菌群,为便秘的进一步微生态研究提供实践支持。因此,针对有差异的菌群的研究基础,重新恢复便秘人群的肠道微生态有望未来成为便秘治疗一个重要方向。
[ 1 ] Mugie SM, Benninga C, Di Lorenzo. Epidemiolog onstipation i hildre n dults: ystemati eview [J]. Best Pract Res Clin Gastroenterol, 2011, 25(1): 3-18.
[ 2 ] 黄洋. 便秘的危害及防治. 中华中医药学会肛肠分会换届会议暨便秘专题研讨会. 2007.
[ 3 ] D Drossman. Th unctiona astrointestina isorder n he Rome II process [J]. Gut, 1999, 45(Suppl 2): II1-II5.
[ 4 ] Tim G J de Meij, Evelien FJ de Groot, Anat Eck, e l. Characterizatio f Microbiot n Childre ith Chronic Functional Constipation [J]. PLoS One, 2016, 11(10): e0164731.
[ 5 ] Gopanandan Parthasarathy, Jun Chen, Xianfeng Chen, et al.Relationship Between Microbiot he Colonic Mucos s Feces and Symptoms, Colonic Transit, and Methane Productio n Female Patients With Chronic Constipation [J]. Gastroenterology, 2016, 150(2): 367-379.
[ 6 ] Quigley EM. Th nteri icrobiot h athogenesi nd managemen onstipation [J]. Best Pract Res Clin Gastroenterol, 2011, 25(1): 119-126.
[ 7 ] Ashok Attaluri, Michelle Jackson, Jessica Paulson, et al.Methanogeni lor ssociate it ltere oloni ransit bu o too haracteristic onstipatio ithout IBS [J]. Am J Gastroenterol, 2010, 105(6): 1407-1411.
[ 8 ] G Zoppi, M Cinquetti, A Luciano, e l. Th ntestina cosyste n chroni unctiona onstipation [J]. Acta Paediatr, 1998, 87(8): 836-841.
[ 9 ] Waitzberg DL, Logullo LC, Bittencourt AF, e l. Effec ynbiotic i onstipate dul omen- andomized, double-blind, placebocontrolle tud linica esponse [J]. Clin Nutr, 2013, 32(1): 27-33.
[ 10 ] Ojetti V, Ianiro G, Tortora A, e l. Th ffec f Lactobacillu euteri supplementatio dult it hroni unctiona onstipation: andomized, double-blind, placebo-controlle rial [J]. J Gastrointestin Liver Dis, 2014, 23(4): 387-391.
[ 11 ] Tian H, Ding C, Gong J, e l. Treatmen f Slow Transit Constipation With Fecal Microbiota Transplantation: A Pilot Study [J]. J Clin Gastroenterol, 2016, 50(10): 865-870.
[ 12 ] BarbaraG, Stanghellini V, Brandi G, e l. Interaction etween commensa acteri n u ensorimoto unctio ealt nd disease [J]. Am J Gastroenterol, 2005, 100(11): 2560-2568.
[ 13 ] Kashyap PC, Marcobal A, Ursell LK , e l. Comple nteractions amon iet, gastrointestina ransit, an u icrobiot umanized mice [J]. Gastroenterology, 2013, 144(5): 967-977.
[ 14 ] Caenepeel P, Janssens J, Vantrappen G, e l. Interdigestive myoelectri omple erm-fre ats [J]. Dig Dis Sci, 1989, 34(8): 1180-1184.
[ 15 ] Hooper LV, Wong M, H.Thelin A, e l. Molecula nalysi f commensa ost-microbia elationship h ntestine [J]. Science, 2001, 291(5505): 881-884.
[ 16 ] Bar F, Von Koschitzky H, Roblick U, e l. Cell-fre upernatants of Escherichi oli Nissle 1917 modulat uma oloni otility: evidenc ro itr rga at tudy [J]. Neurogastroenterol Motil, 2009, 21(5): 559-566, e16-17.
[ 17 ] Husebye E, Hellstrom P, M.Sundler F, e l. Inf l uenc icrobial specie mal ntestina yoelectri ctivit n ransi ermfre ats [J]. Am J Physiol Gastrointest Liver Physiol, 2001, 280(3): G368-380.
[ 18 ] Ma X, Mao YK, Wang B, e l. Lactobacillu euter ngestion prevent yperexcitabilit olonic DRG neuron nduce y noxiou timuli [J]. Am J Physiol Gastrointest Liver Physiol, 2009, 296(4): G868-875.
[ 19 ] Wang B, Mao YK, Diorio C, e l. Lactobacillu euter ngestion and IK(Ca) channe lockad av imila ffect a olon motilit n yenteri eurones [J]. Neurogastroenterol Motil, 2010, 22(1): 98-107, e33.
Structure analysis of the gut microbiota in chronic functional constipation patients
Huang Linsheng1,2,3,Gao Renyuan2,3, Yan Xuebing2,3, Zhu Qi2,3, Pan Cheng2,3, Yin Mingming2,3, Li Hao2,3, Kong Cheng2,3, Zhang Peng2,3, Shen Tongyi2,3, Qin Huanlong1,2,3.1Shanghai Tenth People′s Hospital Clinical College of Anhui Medical University;
2Department of General Surgery, Shanghai Tenth People′s Hospital, Tongji University School of Medicine;3Research Institute for Intestinal Diseases of Tongji University School of Medicine, Shanghai 200072, China
Correspondence author: Qin Huanlong, Email: qinhuanlong@126.com
Objective T nvestigat h ifference u icrobiot etwee atient ith chroni unctiona onstipation (CFC) an ealt ontrols (HC). Methods 16S rRNA highthroughout pyrosequencin n V4 regio a mploye xamin h ifferenc u icrobiot rof i le etween 10 CFC patient nd 10 HCs. Th btaine at er nalyze sin ioinformatics. Results Th ichness analysi uggeste hat HC av iche u icrobiot han CFC patients (all P<0.05), whil ignif i cant differenc a bserve h iversit nalysis.Ther a signif i can tructur ifferenc u icrobiota between CFC patient nd HC ot h hylu n enu evels (all P<0.05). A h hylu evel,Actinobacteri n CFC patient iche ha ha n HCs, but Proteobacteri pposite (all P<0.05). A he genu evel, 20 gu icrobiot er oun av change elativ bundanc etween CFC patient nd HCs, i hich Coprobacillus, Hungatella, Holdemanella, Anaerostipes, Bacteroidales_S24-7_group_norank, Bacteroides, Blautia, [Eubacterium]_ruminantium_group, Collinsella, Dorea, Erysipelotrichaceae_UCG-003, Parabacteroide nd Ruminococcaceae_unculture er ncrease n CFC patient hile Megasphaera, Paraprevotella, Prevotella_2, Prevotella_9, Enterococcus, Catenibacteriu nd Clostridium_sensu_stricto_1 were increase n HCs. Conclusion Ther a signif i can tructur ifferenc u icrobiot etween CFC patient nd HCs. Therefore, targetin h u icrobiot ysbiosi a promisin herapeuti trategy for CFC patients.
Constipation; Intestina lor ysregulation; Bacteri bundance; 16S rRNA, richness
2016-12-19)
(本文编辑:赵志勋)
10.3877/cma.j.issn.2095-3224.2017.02.008
国家自然科学基金项目(No.81230057;No.81472262;No.81302066);上海新兴前沿技术联合攻关项目(No.SHDC12012106)
200072 上海,安徽医科大学上海十院临床学院1;200072 上海,同济大学附属第十人民医院普外科2;200072 上海,同济大学医学院肠道疾病研究所3
秦环龙,Email:qinhuanlong@126.com
