牡丹籽壳中白藜芦醇的分离及结构表征
2017-05-15张红玉王成章原姣姣张昌伟王志宏
张红玉,王成章,2,原姣姣,张昌伟,王志宏
(1.中国林业科学研究院林产化学工业研究所,国家林业局林产化学工程重点开放性实验室,南京210042;2.中国林业科学研究院林业新技术研究所,北京100091)
综合利用
牡丹籽壳中白藜芦醇的分离及结构表征
张红玉1,王成章1,2,原姣姣1,张昌伟1,王志宏1
(1.中国林业科学研究院林产化学工业研究所,国家林业局林产化学工程重点开放性实验室,南京210042;2.中国林业科学研究院林业新技术研究所,北京100091)
采用乙酸乙酯萃取牡丹籽壳70%乙醇提取物,获得牡丹籽壳乙酸乙酯部位提取物。采用硅胶色谱柱将其分离,然后采用高效液相色谱(HPLC)、紫外光谱(UV)、红外光谱(IR)和核磁共振谱(NMR)等波谱技术对分离获得的白藜芦醇进行鉴定和结构表征。结果表明:分离所得为较高纯度的白藜芦醇单体,纯度为96.25%。
牡丹籽壳;白藜芦醇;分离;结构表征
白藜芦醇(Resveratrol,Res)又称为芪三酚,非黄酮类多酚化合物。白藜芦醇(C14H12O3)结构为3′,4,5′-三羟基-1,2-二苯乙烯(3′,4,5′-tri-hydroxylstillbene),无色针状晶体。白藜芦醇有顺式和反式两种结构,植物中主要以反式结构存在。白藜芦醇是一种天然的植物抗毒素,广泛存在于红葡萄皮、花生、桑葚以及其他一些药用植物中,其中在种皮中含量极高。王崑仑等[1]研究发现紫斑牡丹的叶、侧枝、茎以及根中均不含白藜芦醇,但是紫斑牡丹籽和果荚中却含有白藜芦醇,其含量分别为0.87%和0.26%。研究还发现紫斑牡丹籽中白藜芦醇的含量远远高于花生以及巨峰葡萄的各个部位中的含量。有研究人员从牡丹籽中分离和鉴定出了反式白藜芦醇[2-5]。近年来,随着牡丹籽油产业的兴起,产生了大量的牡丹籽壳副产物。牡丹籽壳部分被用作肥料,但是更多的是被丢弃,利用率极低。目前,国内外关于从牡丹籽壳中提取高附加值白藜芦醇的研究报道极少,仅仅研究了其中芍药苷和丹皮酚的检测方法。深度开发丰富且廉价的牡丹籽壳资源,获得较高纯度且具有生物活性的物质——白藜芦醇,不仅能够变废为宝,更具有一定的社会经济效益。更多的研究发现,白藜芦醇还具有抗癌、抗肿瘤[6]、抗氧化[7]和保护心血管[8]等多种生理和药理活性。
常见的白藜芦醇提取方法有溶剂提取法、超声波辅助提取法、微波辅助提取法、酶法提取法和超临界流体萃取法[9]。在传统的溶剂提取法中,采用乙酸乙酯获得白藜芦醇的提取率相对较高[10]。白藜芦醇的纯化主要采用薄层层析[11-12]、柱层析[13-16]以及高速逆流色谱分离[17]。国内外已经有利用柱色谱法分离获得多酚单体化合物的研究报道。白藜芦醇的分析检测方法主要有高效液相色谱法[18-20]、化学发光法[21-22]、色谱-质谱法[23-24]、荧光法[25-26]以及毛细管电泳法[27-28]。化合物的结构鉴定主要采用紫外光谱(UV)、红外光谱(IR)和核磁共振谱(NMR)等波谱技术。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
牡丹籽壳,2014年来源于安徽亳州的丹凤牡丹籽,粉碎机粉碎,过0.250 mm筛。柱层析用硅胶(精细型100~200目),来自青岛海洋化工分厂;甲醇为色谱纯;三氯化铁、铁氰化钾、乙醇、石油醚和正丁醇等为分析纯。
1.1.2 仪器与设备
Bruker 500 Mz核磁共振仪,Nicolet iS10傅里叶变换红外光谱仪,LC-20AT型高效液相色谱仪,EL 204电子天平,RE52CS旋转蒸发器,SHB-3A循环水多用真空泵,Hypersil GOLD aQ色谱柱(Thermo),冷冻干燥机,ZF-8型四用紫外分析仪,UV-1800PC紫外可见分光光度计。
1.2 实验方法
1.2.1 样品的制备
称取一定量粉碎好的牡丹籽壳,按25∶1液料比加入70%乙醇溶液,于60℃水浴超声提取80 min。将提取液过滤,然后将过滤液离心(1 000 r/min),取上清液,于45℃减压浓缩,获得浓缩浸膏。将浓缩浸膏于-40℃真空冷冻干燥,获得牡丹籽壳70%乙醇提取物。称取一定量牡丹籽壳70%乙醇提取物,加入适量60℃的超纯水,超声充分溶解,得到水悬浮液,然后将水悬浮液转移至分液漏斗中。分液漏斗中再加入一定量的石油醚,振荡摇匀,然后静置,上层为石油醚层,下层为水层,再多次用石油醚萃取下层水层,直至石油醚层无色。最终下层水层中加入一定量乙酸乙酯,按同样方法萃取多次,将上层乙酸乙酯层溶液减压浓缩、冷冻干燥后,获得乙酸乙酯部位提取物,即为待分离样品。
1.2.2 硅胶装柱与上样
硅胶层析柱采用湿法装柱。将硅胶加入烧杯中,加入硅胶1倍体积的石油醚,并用玻璃棒充分搅拌成浆,然后静置6 h。将层析柱底部用棉花塞紧,倒入1/3柱体积的石油醚,打开活塞,并将浸泡好的硅胶搅拌成匀浆,然后加入层析柱中。当柱内溶液接近硅胶面时,关闭活塞,待用。准确称取20.0 g待分离样品溶于少量的乙酸乙酯中,然后加入适量的干硅胶。将拌有样品的硅胶减压浓缩成为干粉,并用研钵研细为粉末,然后均匀加入硅胶层析柱中,使拌有样品的硅胶均匀平铺于层析柱硅胶的表面。
1.2.3 柱层析分离样品
样品采用拌样法上样后,以石油醚和乙酸乙酯溶剂体系进行梯度洗脱(石油醚与乙酸乙酯体积比从9.5∶0.5依次增大)。每500 mL洗脱液收集,经薄层硅胶(TLC)检测,合并相同组分洗脱液。将不同组分洗脱液减压浓缩,冷冻干燥后,采用高效液相色谱定性检测。将石油醚-乙酸乙酯为7∶3的洗脱液经减压浓缩后获得白色粉末样品。
1.2.4 白藜芦醇的定性检测
白藜芦醇具有一些特征的颜色反应,可以用来作为白藜芦醇的初步定性检测依据。将层析柱后获得的样品溶于适量的甲醇中,分别观察在可见光和紫外光照射时的溶液颜色。向柱层析后样品的甲醇溶液中加入三氯化铁,然后在可见光下观察颜色反应。柱层析后样品的甲醇溶液中加入铁氰化钾并于紫外光下观察颜色变化。利用BUCHI B-540熔点测定仪,测定样品的熔点。
1.2.5 白藜芦醇标准品高效液相色谱分析
称取适量白藜芦醇标准品,溶于甲醇中,采用高效液相色谱分析。将柱层析后样品溶于甲醇中,经过0.45 μm微孔有机滤膜过滤,进行高效液相色谱分析,与标准品白藜芦醇高效液相色谱图进行比较。
高效液相色谱条件:Hypersil GOLD aQ色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇与0.5%冰醋酸水溶液(体积比4∶6);紫外检测器波长为306 nm;柱温为30℃;流速为1 mL/min;进样量为15 μL。
1.2.6 牡丹籽壳白藜芦醇全波长扫描
将柱层析后样品溶于甲醇,经过0.45 μm微孔有机滤膜过滤。在波长为200~776 nm范围内,进行全波长扫描。
1.2.7 白藜芦醇的结构表征
核磁共振:利用Bruker 500 Mz核磁共振仪,采用氘代甲醇作为溶剂,测定核磁共振氢谱(1H NMR)和核磁共振碳谱(13C NMR)。红外光谱:利用Nicolet iS10傅里叶变换红外光谱仪,样品在4 000~500 cm-1的波长下扫描。
2 结果与分析
2.1 牡丹籽壳白藜芦醇的定性分析
结合白藜芦醇的一些特征颜色反应,对其进行初步的定性检测。其中,柱层析后样品的甲醇溶液,在可见光照射时溶液为淡黄色,在紫外光照射时溶液呈紫色荧光。分别加入三氯化铁和铁氰化钾于柱层析后样品的甲醇溶液,呈现暗绿色和血红色的特征颜色。这些颜色反应与白藜芦醇的特征颜色反应一致,并且测定柱层析后样品熔点约为254℃,可以初步推测待测物可能为白藜芦醇。
2.2 牡丹籽壳白藜芦醇高效液相色谱分析
2.2.1 白藜芦醇标准品的高效液相色谱图
白藜芦醇标准品高效液相色谱保留时间为19.375 min,检测波长为306 nm。其液相色谱图见图1。
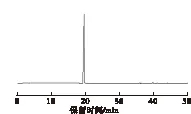
图1 白藜芦醇标准品液相色谱图
2.2.2 牡丹籽壳白藜芦醇高效液相色谱图
牡丹籽壳白藜芦醇柱层析后样品的高效液相色谱图中只有1个能识别的色谱峰,其保留时间为19.388 min。其液相色谱图见图2。

图2 牡丹籽壳白藜芦醇样品液相色谱图
牡丹籽壳白藜芦醇样品在306 nm检测波长下,保留时间为19.388 min的色谱峰,其峰纯度为1.0。保留时间与白藜芦醇标准品的保留时间基本相同。并且通过高效液相色谱的面积归一化法,测定纯度为96.25%。
2.3 牡丹籽壳白藜芦醇全波长扫描
牡丹籽壳白藜芦醇柱层析后样品在波长范围200~776 nm内扫描,其中最大吸收波长为218 nm和306 nm,其紫外可见光谱全波长扫描图见图3。

图3 牡丹籽壳白藜芦醇全波长扫描图
2.4 牡丹籽壳白藜芦醇结构鉴定
2.4.1 薄层层析
柱层析后样品与白藜芦醇标准品的薄层层析色谱图对比发现,Rf基本一致。
2.4.2 红外光谱
3 300.00、1 609.91 cm-1和964.55 cm-1均为白藜芦醇化学结构的特征吸收峰,并且具有1 441.84、1 462.83、1 511.84、1 580 cm-1等苯环的特征吸收峰。并与相关文献对照,符合白藜芦醇的红外光谱图。
2.4.3 核磁共振
1H NMR(δ):9.38(1H,s,OH-4′),9.18(2H,s,OH-3,5),7.35(2H,d,H-2′,6′),6.84(1H,d,J=16.3 Hz,α-H),6.78(1H,d,J=16.3 Hz,β-H),6.73(2H,d,H-3′,5′),6.34(2H,d,H-3′,5′),6.07(1H,t,H-4)。以及在化学位移为6.84和6.78处的双键偶合常数与报道文献中白藜芦醇相关数据一致。
13C NMR(δ):159.05(C-3,5),157.78(C-4′),139.81(C-1′),128.58(C-1),128.46(C-α),128.40(C-2′,6′),126.18(C-β),116.05(C-10,14),104.82(C-2,6),102.28(C-4)。
综合1H NMR和13C NMR与已报道文献中白藜芦醇相关参数比较,鉴定为白藜芦醇。
3 结 论
牡丹籽壳乙酸乙酯极性部位提取物,经柱色谱梯度洗脱后获得单体化合物。经过特征颜色反应以及高效液相色谱(与白藜芦醇标准品比照)分析,初步判断为白藜芦醇。进一步利用红外光与核磁共振波谱分析方法,鉴定柱层析后化合物为白藜芦醇。分离获得的牡丹壳白藜芦醇,经高效液相色谱测定纯度为96.25%,且得率为2.85%(相对乙酸乙酯极性部位提取物)。对榨取牡丹籽油后的副产物——牡丹籽壳,加以有效利用,分离得到了白藜芦醇纯品。进而获得了从牡丹籽壳中制备白藜芦醇的方法。
[1] 王崑仑,赵修华,祖元刚,等. 白藜芦醇在几种植物中各部位的分布[J]. 植物研究,2015,35(4):638-640.
[2] 吴静义. 牡丹籽化学成分研究[D]. 北京:北京中医药大学,2014.
[3] SARKER S D,WHITING P,DINAN L,et al. Identification and ecdysteroid antagonist activity of three resveratrol trimers (suffruticosols A,B and C) fromPaeoniasuffruticosa[J]. Tetrahedron,1999,55(2):513-524.
[4] KIM H J,HA S C,CHOI S W. Inhibition of tyrosinase and lipoxygenase activities by resveratrol and its derivatives from seeds ofPaeonialactiflora[J]. J Food Sci Nutr,2002,7(4):447-450.
[5] 何春年,肖伟,李敏,等. 牡丹种子化学成分研究[J]. 中国中药杂志,2010,35(11):1428-1431.
[6] MANNA S K,MUKHOPADHYAY A,AGGARWAL B B. Resveratrol suppresses TNF-induced activation of nuclear transcription factors NF-kappa B,activator protein-1,and apoptosis:potential role of reactive oxygen intermediates and lipid peroxidation[J]. Nutrient,2000,4(11):1723-1739.
[7] FRANCESCO C,JOSEPH T,ADRIE V E,et al. Structural basis for antioxidant activity oftrans-resveratrol:ab initio calculations and crystal and molecular structure[J]. J Agric Food Chem,2004,52(24):7279-7285.
[8] 余丽,李国达,方凌燕,等. 白藜芦醇心血管保护作用机制及临床研究进展[J]. 中国心血管杂志,2016,21(1):76-79.
[9] 张贵娟,杨涛,罗非君,等. 白藜芦醇的提取与检测方法研究进展[J]. 食品与机械,2013,29(2):234-237.
[10] 李婷. 葡萄皮渣中白藜芦醇提取工艺研究及葡萄材料中白藜芦醇含量的差异性分析[D]. 兰州:甘肃农业大学,2008.
[11] 孟昭仁,奚洪民,刘进帮. 白藜芦醇的提取和纯化及分析方法研究进展[J]. 化学世界,2002,43(10):511-513.
[12] 丁永胜,何丽一. 薄层荧光扫描法测定小叶买麻藤等植物中类化合物含量[J]. 药学学报,2000,35(6):454-456.
[13] 苏文强,杨磊,朱明华,等. 中压柱层析法分离白藜芦醇的研究[J]. 林产化学与工业,2004,24(1):39-42.
[14] 朱立贤,金征宇. 虎杖中白藜芦醇提取分离工艺的研究[J]. 安徽农业科学,2005,33(1):77-78.
[15] 曹庸. 虎杖中白藜芦醇提取、纯化技术研究[D]. 长沙:湖南农业大学,2001.
[16] 向海艳,周春山,钟世安,等. 白藜芦醇分子印迹聚合物合成及其对中药虎杖提取液活性成分的分离[J]. 应用化学,2005,22(7):739-743.
[17] 陈雷,杨福全,张天佑,等. 虎杖中白藜芦醇和白藜芦醇甙的高速逆流色谱分离提纯及其分析[J]. 分析测试学报,2000,19(4):60-62.
[18] 向阳,张彤,张煊,等. 高效液相色谱法测定葡萄皮和葡萄籽中白藜芦醇的含量[J]. 卫生研究,2003,32(5):490-492.
[19] 朱鸿津. HPLC法测定虎杖中白藜芦醇的含量[J]. 中国野生植物资源,2001,20(1):49-50.
[20] 曾建国,侯团章,张胜. 高效液相色谱法测定虎杖提取物中白藜芦醇的含量[J]. 中国中医药科技,2000(3):175.
[21] JUAN J R,HAI Y L,PIN G H,et al. Determination of resveratrol in red wine by solid phase extraction-flow injection chemiluminescence method[J]. Chinese Chem Lett,2007,18(8):985-988.
[22] 冯琳,李丽. 高锰酸钾-甲醛-荧光素流动注射化学发光法测定白藜芦醇[J]. 理化检验(化学分册),2010(6):694-695.
[23] CHEN C,JIANG X,HU Y,et al. The protective role of resveratrol in the sodium arsenite-induced oxidative damage via modulation of intracellular GSH homeostasis[J]. Biol Trace Elem Res,2013,155(1):119-131.
[24] DOMINGUEZ C,GUILLEN D A,BARROSO C G. Automated solid-phase extraction for sample preparation followed by high-performance liquid chromatography with diode array and mass spectrometric detection for the analysis of resveratrol derivatives in wine[J]. J Chromatogra A,2001,918(2):303-310.
[25] 陈敏,舒友琴,何计国,等. 薄层荧光扫描法测定葡萄酒中的白藜芦醇及其糖苷异构体[J]. 分析化学,2005,33(5):635-638.
[26] MOLINA G L,RUIZ M A. An automatic optosensing device for the simultaneous determination of resveratrol and piceid in wines[J]. Analytica Chimica Acta,2011,689(2):226-233.
[27] 刘芳华,彭友元,叶建农. 毛细管电泳-电化学检测法测定葡萄和葡萄酒中的白藜芦醇[J]. 分析测试学报,2005,24(3):125-127,130.
[28] 陈宪,林美羡,陈国南. 毛细管电泳-安培检测法同时测定白藜芦醇及虎杖甙[J]. 福州大学学报(自然科学版),2006,34(6):903-907.
Isolation and structure characterization of resveratrol from peony seed shell
ZHANG Hongyu1, WANG Chengzhang1,2, YUAN Jiaojiao1,ZHANG Changwei1, WANG Zhihong1
(1.Key and Open Lab of Forest Chemical Engineering, State Forestry Administration,Institute of Chemical Industry of Forest Products, Chinese Academy of Forestry, Nanjing 210042, China;2. Institute of Forestry New Technology, Chinese Academy of Forestry, Beijing 100091, China)
The 70% ethanol solution extract of peony seed shell was extracted by ethyl acetate to obtain peony seed shell ethyl acetate extract. The ethyl acetate extract was separated by silica gel column chromatography. The resveratrol isolated was identified and characterized by high performance liquid chromatography (HPLC), ultraviolet spectroscopy (UV), infrared spectroscopy (IR) and nuclear magnetic resonance spectrum (NMR). The results showed that the resveratrol monomer was obtained with higher purity of 96.25%.
peony seed shell; resveratrol; isolation; structure characterization
2016-05-18;
2016-11-14
国家国际科技合作专项项目(2014DFR31300)
张红玉(1989),女,硕士研究生,研究方向为天然资源化学与利用(E-mail)chemicalzhy@163.com。
王成章,研究员,博士生导师(E-mail)wangczlhs@sina.com。
TS229;TS218
A
1003-7969(2017)02-0116-04
