血红蛋白研究
——近、现代生命科学发展的一个微观缩影
2017-05-12任衍钢白冠军宋玉奇卫红萍
任衍钢 白冠军 宋玉奇 卫红萍
(阳泉师范高等专科学校 山西平定 045200)
血红蛋白是研究生物化学和分子生物学的重要实验材料,是阐述生命大分子结构和功能的经典物质。血红蛋白是人类最早推测出分子量的蛋白质,也是人类最早较系统地阐明结构和功能的生命类重要化合物,最早人类分子病发生的原因阐明即是基于对血红蛋白的研究。本文简要回顾从血红蛋白发现到其分子结构和生理机制揭示的历史过程。
1 血红蛋白的发现与早期的研究
对血红蛋白的研究最早可追溯到1825年。化学家恩格尔哈德(Johann Friedrich Engelhard)发现动物血红蛋白中铁的比例总是恒定的。根据铁原子的质量,他计算出血红蛋白的分子量为4×16 000。这是历史上首次确定的蛋白质分子量。这个“草率的结论”在当时遭到其他学者的嘲笑,他们不相信任何分子的分子量会如此大。1925年是恩格尔哈德推测血红蛋白分子量100周年,英国科学家代尔(Gilbert Smithson Adair)用 1877年德国植物学家菲费尔(Wilhelm Pfeffer)发明的渗透压测定大分子量的方法证实了恩格尔哈德的结果。代尔还预测血红蛋白分子是一个四聚体化合物,其意义在于首先证实了蛋白质大分子内部不都是通过共价键相结合的。
1.1 血红素的发现——从有机化学开始早在1746年,意大利学者梅纽因(Vincenzo Menghini)用含有磁力的刀片检测到动物器官燃烧后形成的灰分中含有铁元素。他发现将动物器官内的血液析出后铁元素的量会减少,由此推测血液中含有铁元素。梅纽因还通过将血液分离成3部分的实验证实,铁元素主要存在于血红细胞之中[1]。1831年,法国化学家勒卡努(Louis René Lecanu)在研究血液呈现颜色的原因时,发现血液的颜色与血红蛋白有关。他将血红蛋白分解成2个部分后,发现了一种仅占血红蛋白4%的物质。通过实验进一步发现该化合物中含有铁。为此,他采用法国化学家谢弗勒尔(Chevreul Michel Eugene)给予的名字 “hematosine”(高铁血红素,现称为血红素)进行命名[2]。随后科学家发现,血红素除去铁离子后,剩余部分可进一步分裂成大致相当于血红素1/4大小的碎片,这些碎片后被鉴定是吡咯(吡咯最早是从煤焦油中提取的)。吡咯如何组成血红素?直到20世纪20年代这项工作才取得实质性的突破。1921年德国科学家汉斯·费歇尔(Hans Fischer)在研究胆汁色素时发现,当把胆汁中的胆红素分裂成一半时,在胆汁色素中就有血红素的成分存在。同时他发现血红素的结构与吡咯有一定的联系,于是想到如果能将4个吡咯合在一起,也许就能发现血红素的结构。不久,费歇尔成功地得到了一种四环化合物,并称之为“卟吩”。由于分解血红素时,吡咯是含有一些侧链的,所以在合成卟吩时,也就形成了一些不同侧链的卟吩衍生物,这些含侧链的卟吩衍生物就有了一个新的名字:“卟啉”(“卟啉”一词是其英文名称porphyrin的音译,其英文名源于希腊语单词,意为紫色,因此卟啉也被称作紫质)。血色素是哪一种卟啉?费歇尔打算从他合成的15种卟啉化合物中挑选。经过他和学生的反复比较和甄别,终于找出了与天然血色素一样的卟啉。费歇尔由于在合成血色素方面杰出的贡献,荣获1930年的诺贝尔化学奖。此后,费歇尔将注意力转移到研究叶绿素结构,通过多方面的研究,于1940年阐明了叶绿素a的结构。
1.2 血红蛋白功能的发现——生物化学的奠定血红蛋白晶体最早是由德国莱比锡大学生物化学家许内费尔德(Friedrich Ludwig Hünefeld)于1840年发现的。他将蚯蚓的血液制成涂片放在显微镜下,观察到了针状多簇的晶体,经分析确定,这是血红蛋白形成的单晶结构(也有记载是观察女性经血)。这项研究开启了蛋白质晶体研究的先河[3]。 1851—1852 年,德国生理学家芬克(Otto Funke)发表了一系列通过用纯水、酒精溶液、醇或醚溶剂以缓慢蒸发的方法从蛋白质溶液获得氧合血红蛋白单晶结构的文章,为此,芬克被认为是蛋白质晶体研究的先驱。随后,德国生理学家霍普·塞勒(Felix Hoppe-Seyler)于 1866年在研究血红细胞功能时,将细胞内的蛋白质化合物命名为hemoglobin或haemoglobin。英文血红蛋白来自希腊语“haima”(血液)和“globule”(小球或水珠)。 霍普·塞勒还发现氧合血红蛋白与非氧合血红蛋白之间在吸收光谱的波段上存在差异,从而揭示了血红蛋白与氧结合及分离的过程,并指出氧与血红蛋白的结合是以分子而不是以原子形式进行的。为此,他又创造了氧合血红蛋白这一术语(英文为oxyhemoglobin)。正是由于对血红蛋白功能的认识,人类开始认识到血红细胞的功能是运输氧气[注:血红细胞最早是由荷兰生物学家斯瓦默丹(Jan Swammerdam)于1658年用显微镜观察蛙血时发现的。1674年,另一个荷兰显微学家列文虎克(Anton van Leeuwenhoek)对红血球进行了更加详细的描述[4]]。霍普·塞勒还发现一氧化碳也能与血红蛋白稳定结合。最早对一氧化碳毒性进行研究的是法国著名的生理学家克劳德·伯纳德(Claude Bernard)。1846年,克劳德让狗吸入这种气体,发现狗的血液变成“樱桃红色”,即一氧化碳中毒症状,最早解释了煤气中毒的原因。克劳德对血红蛋白研究的论文多达30余篇。其中一个有趣的发现是,若在压缩空气下工作的工人突然回到正常状态下,会由于血液中氧气迅速的流失而引起死亡,而如果让他们渐渐地回到正常的大气压下则会避免这种灾难的发生,这一发现挽救了许多人的生命。他还说明了机体氧化的最终场所是机体组织而不是血液。作为生物化学的先驱,霍普·塞勒在1877年首先使用“生物化学(德语:biochemie。英文中的biochemistry首次出现在1848年)”一词,标志着生物化学学科的诞生[5]。
2 血红蛋白结构和机制的揭示——分子生物学的研究
由于血红蛋白易于提取和结晶,并且与一些贫血症状有关,科学家对血红蛋白的研究兴趣愈发浓厚,从而使血红蛋白成为揭开蛋白质分子结构和功能的重要实验材料。
2.1 血红蛋白一级结构的研究——分子生物学的开端 血红蛋白一级结构的揭示是对一种镰刀型细胞贫血症的疾病研究引发的。1910年,美国芝加哥医生赫里克(James B.Herrick)注意到了一位来自加勒比海贫血症患者,患者血液中的红细胞呈现“镰刀形”。1927 年,哈恩(E.V.Hahn)和吉莱斯皮(E.B.Gillespie)通过实验证实镰刀型贫血与缺氧有关[6]。1940年,著名科学家霍普金斯(Johns Hopkins)的学生谢尔曼(Irving Sherman)发现,脱氧红细胞会出现双折射现象,因而推测缺氧会使血红蛋白改变形状[7]。1948年,著名的美国科学家鲍林(Linus Pauling)和哈维·板野 (Harvey Itano)通过电泳技术分析方法发现镰刀型细胞贫血症患者的血红蛋白与正常人存在差异,这使他们在1949年首次提出了分子病的概念,这也是人类发现的第1种分子疾病。正常血红蛋白与镰刀型血红蛋白差异究竟在哪里?1959年,德籍美国科学家弗农·英格拉姆(Vernon Ingram)揭开了这个谜底。英格拉姆发明了酶解图谱法或称指纹图谱法的特殊纸上层析技术。该技术是先将血红蛋白用胰蛋白酶水解,制成胰蛋白酶的水解产物,然后采取横向和纵向的双向分离方法将氨基酸尽可能都分开,这样就发现在1个点上,正常血红蛋白与镰刀型血红蛋白存在明显差异。这个差异只是1个氨基酸,即正常的谷氨酸被异常的缬氨酸替代了,正可谓“差之毫厘谬以千里”,1个氨基酸的差错就导致了镰刀型贫血症。紧接着英格拉姆用著名科学家桑格(Frederick Sanger)发明的测定胰岛素一级结构氨基酸顺序的方法,确定是血红蛋白β链中从N端数第6个氨基酸谷氨酸被缬氨酸所取代。英格拉姆因其卓越的贡献被科学界称为分子医学之父。此外,为了弄清血红蛋白的一级结构,德国科学家布劳恩 (Gerhard Braunitzer)从1956年开始着手这项工作,经过5年的努力,于1961年在莫斯科第5届国际生化代表大会上宣读了关于正常人血红蛋白A化学组成的论文,并于同年发表在《Hopp-Seyler生理化学杂志》上,详尽列出血红蛋白A的α链 (141个氨基酸)、β链(146个氨基酸)和肌红蛋白(155个氨基酸)等一级结构的全部氨基酸顺序。由此阐明血红蛋白A(α2β2)含有 574 个氨基酸,分子量为 64 450[8]。血红蛋白一级结构的研究为分子生物学的研究提供了经典案例,也为血红蛋白空间结构的研究奠定了基础。布劳恩也因其卓越贡献被公认是分子生物学的先驱之一。
2.2 血红蛋白空间结构的研究——分子生物学的深入 1951年,鲍林在研究血红蛋白结构的基础上,结合他对肽链和肽平面化学结构的理论,提出了α螺旋和β折叠的蛋白质二级结构的理论(鲍林凭此杰出的贡献荣获了1954年的诺贝尔化学奖)。同年,英国科学家马克斯·佩鲁茨(Max Perutz)首次用X射线衍射的方法证实了鲍林的蛋白质二级结构模型。1953年,佩鲁茨发现,通过浸泡的方法可将重原子引入蛋白质中,然后用同晶置换的方法就能解决多年一直未能解决的蛋白质结构相位问题,这种方法为他们研究血红蛋白空间结构提供了一个新途径,并为以后更进一步确定蛋白质空间结构迈出了关键一步,从而使对生物大分子的认识深入到了原子水平。1957年,在佩鲁茨领导下从事研究的英国科学家约翰·肯德鲁(John Kendrew)从鲸肌红蛋白入手,对肌红蛋白晶体的X射线衍射斑点进行分析。鉴于整个衍射图涉及到几万个衍射斑点,他使用了当时最先进的计算机,确定了肌红蛋白分子约2 600个原子的空间位置,并于1958年完成了肌红蛋白结构的模型。佩鲁茨从1937年开始便将研究重心放在血红蛋白的结构上,并在1958年完成了血红蛋白分辨率较低的三维结构的测定。由于肯德鲁和佩鲁茨杰出的贡献,他们分享了1962年的诺贝尔化学奖。在获得诺贝尔化学奖后,佩鲁茨继续研究血红蛋白结构与功能的关系。1967年,佩鲁茨完成了对血红蛋白的高分率测定。这项工作从开始到完成历时30年,终于画上了圆满句号[9]。血红蛋白空间结构的测定,使科学家对血红蛋白功能的了解更加深入。早在1938年,豪若威兹(Felix Haurowitz)就发现氧合血红蛋白与脱氧血红蛋白的晶体在结构上有差异[10]。1962年,佩鲁茨等通过将脱氧血红蛋白与氧合血红蛋白的晶体比较后发现,氧合血红蛋白与脱氧血红蛋白的空间结构不同。在有氧条件下,血红蛋白的四级结构会发生变化,2个α、β二聚体之间可以做相对位置的移动,氧合血红蛋白比脱氧血红蛋白的结合更加紧密。当氧合血红蛋白失去氧时,它又缓慢地重新恢复到脱氧血红蛋白的构象。由于血红蛋白与氧的这种相互运动犹如肺的呼吸运动,因此有人称之为“分子肺”。1970年,佩鲁茨进一步发现,血红蛋白构象之间的互变有利于与氧的结合和释放。当第1个氧分子与血红素上的铁原子结合后,会促进其他氧分子与这个血红蛋白中其他血红素上的铁原子结合;同样,当第1个氧分子从血红素上释放以后,会促进其他氧分子从这个血红蛋白的其他血红素上的释放。但这种效应在单聚体和二聚体中都不发生,只有四聚体通过构象变化才表现这种协同作用。血红蛋白的构象就是这样在氧分压高或低时进行亚基的运动,循环往复地进行[11]。25年后,约克大学盖·多德森(Gug Dodson)教授的研究生玛森姆·保利(Massime Paoli)证实了这一结论[12]。在评价佩鲁茨的贡献时,科学界认为,如果说DNA双螺旋的发现标志着现代生物学的开始,血红蛋白分子结构的解析则标志着分子生物学的开端,佩鲁茨被Nature等杂志尊称为 “分子生物学之父”[13]。
还需要指出的是,20世纪90年代,科学家发现血红蛋白中亚铁血红素附近的三级结构变化会引起二聚体间作用力的变化,进而导致四级结构发生可逆性的改变,并形成低氧合力和高氧合力之间的平衡[14]。近几年,科学家发现,高海拔蜂鸟高亲和性的血红蛋白主要是由于2个氨基酸位置的突变,改变了血红蛋白与氧的结合能力[15]。总之,血红蛋白是脊椎动物高海拔低氧适应代谢通路上最重要、研究最多的功能蛋白,其本身的结构功能进化也代表一定的脊椎动物进化规律。
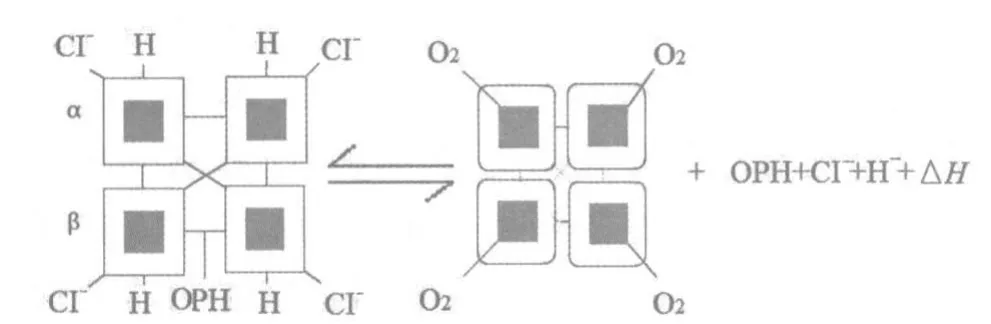
图1 血红蛋白变构平衡下的可逆氧结合(仿Projecto等[15])
综上所述,血红蛋白研究的历史是生物化学和分子生物学发展的一个微观缩影。有关它的每一项研究,都见证了生物化学和分子生物学的进步,折射了近、现代生物学的发展历程。生物化学与分子生物学既是生命科学的基础,又是生命科学的前沿,是目前自然科学中发展最迅速、最具活力的前沿领域,二者在分子水平探讨生命的本质,前者侧重于代谢与生理功能的联系,后者侧重于研究生命大分子的结构和功能。因此,分子生物学是从生物化学中深化和延伸出的一门重要的前沿学科,尤其是在分子生物学发展初期,对血红蛋白质结构和功能的研究起到了先导作用。
主要参考文献
[1]Alex D Sheftel,Anne B.mason,Prem Ponka.The long history of iron in the universe and in health and disease.Biochimica et BIOphisica Acta,2012,193(3):167.
[2]Noel G Coley.Early blood chemistry in Britain and France.Clinical Chemistry,2001,47(12):2166.
[3]Brian Clegg.Chemistry in its element-haemoglobin.Chemistry World.https://www.chemistry world.com/podcasts/haemoglobin/3005794.article.
[4]Steven I Hajdu.A note from history:the discoveryofblood cell.Annals of clinical&laboratory science,2003,33(2):237.
[5]Albert P Mathews.The life and work of felix hoppe-seyler.Popular Science Monthly,1898,53(8):525.
[6]D Desai,H Dhanani.Sickle cell disease:History and origin.The Internet Journal of Hematology,2003,1(2):1.
[7]Debra Stamper.Sickle cell anemia:a fictional reconstruction.national center for case study teaching in science.Buffalo:Sebastian Kaulitzki|Fotolia.com,2010(2):1.
[8]卢义钦.血红蛋白结构研究的先驱:Gerhard Braunitzer.生命的化学,1991,11(4):34.
[9]Ann Roller.Discovering the basis of life.杨庆尧,徐思顺,译.上海:上海教育出版社,1985:126.
[10]J T Edsal.Hemoblobin and the origins of the concept of allosterism U.S.National library of medicine.Fed Proc.1980,39(2):226.
[11]阎隆飞,孙之荣.蛋白质分子结构.北京:清华大学出版社,1999.
[12]张春美.马克斯·佩鲁茨:科学不是一种平静的生活.自然辩证法通讯,2004,26(4):86.
[13]施一公,饶毅.第3次生命科学革命:中国,准备好了吗?——评MIT校长的演讲.文汇报,2009-6-15.
[14]朱筱佳,管玉艳,雷富民.血红蛋白与脊椎动物高海拔适应进化.中国科学:生命科学,2016,46(1):84.
[15]Projecto-Garcia J1 and so on.Repeated elevational transitions in hemoglobin function during the evolution of Andean hummingbirds.Proceedings of the National Academy of Sciences of the United States of America,2013,110(51):20669.
