甲基苯基碳酸酯歧化反应动力学的研究
2017-05-12白元盛王公应
付 嫱,白元盛,姜 伟,曾 毅,姚 洁,王公应
(1.中国科学院 成都有机化学研究所,四川 成都 610041;2.中国科学院 成都有机化学有限公司,四川 成都 610041;3.中国科学院大学,北京 100049)
甲基苯基碳酸酯歧化反应动力学的研究
付 嫱1,3,白元盛1,2,姜 伟1,2,曾 毅1,2,姚 洁1,2,王公应1,2
(1.中国科学院 成都有机化学研究所,四川 成都 610041;2.中国科学院 成都有机化学有限公司,四川 成都 610041;3.中国科学院大学,北京 100049)
甲基苯基碳酸酯(MPC)是碳酸二甲酯(DMC)与苯酚酯交换合成碳酸二苯酯(DPC)路线的中间体,MPC歧化反应生成DPC是该路线的关键步骤。以Bu2SnO为催化剂,考察了催化剂用量、内外扩散、反应温度等对MPC歧化反应的影响,根据不同反应条件下MPC转化率随时间的变化建立了动力学模型。实验结果表明,MPC歧化反应正反应和逆反应均为二级反应,正反应的活化能为79.047 kJ/mol、指数前因子为8.908×106m3/(mol·min);逆反应的活化能为78.377 kJ/mol、指数前因子为4.167×107m3/(mol·min)。在实验条件范围内对所得的动力学方程进行了验证。
甲基苯基碳酸酯;碳酸二甲酯;碳酸二苯酯;动力学;岐化反应
碳酸二苯酯(DPC)是一种重要的有机中间体,最重要的用途是代替剧毒的光气与双酚A反应合成性能优良的聚碳酸酯[1-3]。采用碳酸二甲酯(DMC)代替光气与苯酚酯交换合成DPC,副产物甲醇可回收利用,无三废排放,是一条清洁生产路线[4-6]。一般认为,DMC与苯酚酯交换合成DPC分两步进行[7],第一步由DMC与苯酚酯交换合成甲基苯基碳酸酯(MPC);第二步由MPC继续与苯酚发生酯交换反应合成DPC,或由MPC自身歧化反应生成DPC。但MPC歧化反应的平衡常数(0.19,25 ℃)远大于MPC与苯酚酯交换的平衡常数(1.2×10-5,25 ℃)[8-9],所以通常工艺条件和流程设计是通过MPC歧化反应生成DPC。
苯酚与DMC酯交换生成的中间产物MPC的歧化反应速率直接影响DPC的产率,研究MPC催化反应动力学,构建所使用催化剂的催化反应速率和操作工艺条件间的关系对合成DPC工业装置的设计有着重要意义,但目前为止关于该反应动力学的研究报道甚少。陶昭才等[10]用PbO做催化剂,以自制的MPC为原料对MPC歧化反应动力学过程进行研究,得到了MPC的歧化反应动力学方程式,认为该反应的正逆反应均为一级反应,在逆反应中,DPC为零级,DMC为一级,但该文章关于实验数据的获取并未说明具体的实验步骤。罗智[11]以二丁基氧化锡(Bu2SnO)为催化剂,以自制的MPC为原料,得到了类似的结论,但所得动力方程学方程并未进行动力学验证。与均相催化剂相比,多相催化剂具有可重复利用、容易与产物分离的优点,但由于多相催化剂存在不稳定、传质等问题,反应速率较低[12-13]。
本工作以Bu2SnO为催化剂,对MPC催化歧化反应动力学进行初步考察,建立了表观动力学方程,并得到了正、逆反应活化能等动力学参数。并在实验条件范围内对所得的动力学方程进行了验证。
1 实验部分
1.1 试剂
MPC:纯度大于98.5%,自制;Bu2SnO催化剂:纯度大于98%,Acros化学有限公司;丙酮:纯度大于99.5%,广东光华科技股份有限公司。
1.2 实验方法
MPC歧化反应在装有温度计、冷凝管的500 mL三口圆底烧瓶中进行,冷凝管上部接球形干燥器,内装填无水CaCl2固体,防止空气中的水进入反应器;实验采用集热式恒温磁力搅拌器(DF-101S 型)控制温度和转速。
在常压下,开启集热式恒温磁力搅拌装置和冷凝水,用氮气导管置换反应装置中的空气,定量称取250 g的MPC,在氮气保护下加入到三口烧瓶中,然后将三口圆底烧瓶浸入集热式恒温加热磁力搅拌器的油浴中加热至反应温度并开启磁力搅拌,当温度升到设定温度时加入催化剂并开始计时。实验过程中,每隔一定时间用注射器取样约1 mL迅速用丙酮冲稀并立即移至冰水浴中使反应停止,所有试样在2 h内采用气相色谱分析其反应混合物浓度。
1.3 分析方法
采用安捷伦公司Agilent Technologies 7820A型气相色谱仪,FID检测,Agilent 19091J-413 HP-5色谱柱(30 m×0.32 mm×0.25 mm),氮气为载气,柱流量2 mL/min,进样量0.2 μL。分析条件:初始柱温100 ℃,以20 ℃/min的升温速率升至120 ℃,停留1 min;以50 ℃/min的升温速率升至280 ℃,停留3 min;进样器温度280 ℃,检测器温度300 ℃。称取标样制作标准曲线,面积归一化法进行定量分析。
2 结果与讨论
2.1 传质影响
采用均相催化剂,故不考虑内扩散影响,而考察外扩散传质对反应速率的影响。在适宜的反应温度范围内,液相反应区的DMC由于沸点较低易逃逸至气相,因此反应过程中伴有轻组分的气液相间传质,为消除这种外扩散影响,考察了搅拌转速对反应速率的影响。图1为搅拌转速对常压实验MPC转化率的影响。由图1可知,反应速率随搅拌转速的变化并不明显,随搅拌转速的增大,反应速率仅略有增大,说明该体系外扩散的影响很容易消除。因此,为了最大限度地减少搅拌转速对反应速率的影响,选用搅拌转速为600 r/min。

图1 搅拌转速对常压实验MPC转化率的影响Fig.1 Effect of stirring speed on the conversion of methyl phenyl carbonate(MPC).
2.2 反应液总量影响
图2为反应液总量对MPC转化率的影响。由图2可知,在同一反应温度下,50 g和250 g的反应结果近似相同,说明反应液总量的多少对反应速率的影响甚微,由于MPC自身合成的复杂性,所以后期实验采用50 g反应液总量进行实验。
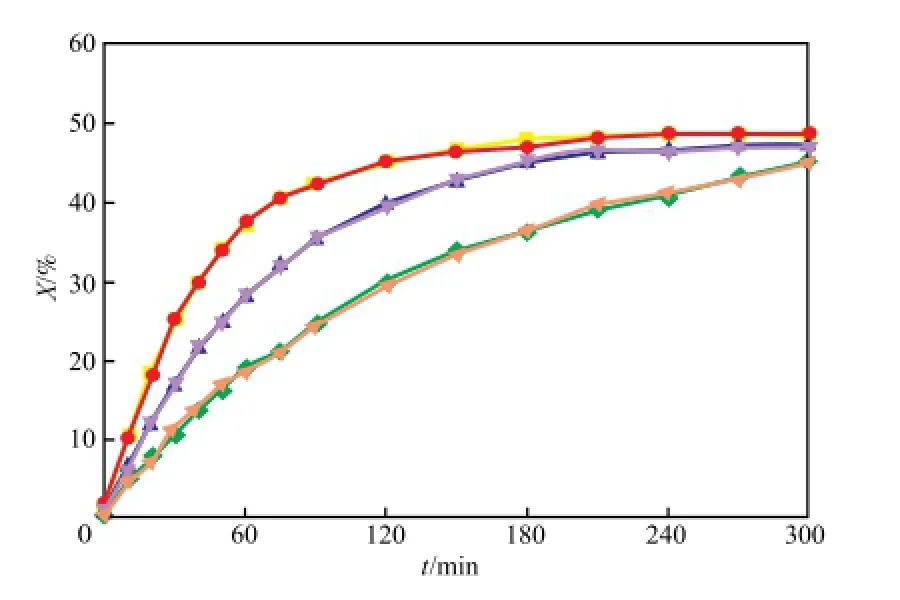
图2 反应液总量对MPC转化率的影响Fig.2 Effects of the reactant gross mass on the conversion of MPC. Reaction conditions:xcat= 0.006 2,600 r/min.
2.3 重复性实验
为确保所获取的动力学数据可靠,首先考察实验装置和操作步骤的可行性。图3为歧化反应重复性实验结果。由图3可知,三次实验结果吻合良好,说明该实验装置及操作方式可获取可靠的动力学数据。

图3 歧化反应重复性实验结果Fig.3 Repetitive experimental results of the disproportionation reaction.
2.4 催化剂用量的影响
图4为催化剂用量(xcat=n(Bu2SnO)∶n(MPC))对MPC转化率的影响。由图4可知,无催化剂时基本不反应;随着xcat的增加,反应速率加快,平衡时间缩短;xcat=0.016时,反应约120 min即可达到平衡。
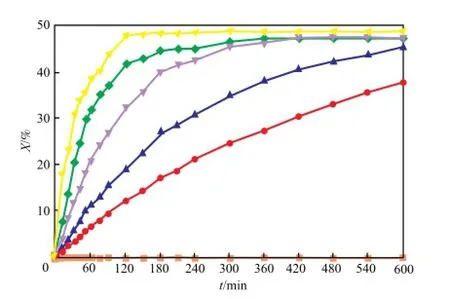
图4 413.15 K下催化剂用量对MPC转化率的影响Fig.4 Effect ofxcaton the conversion of MPC at 413.15 K.
另外,对MPC浓度随时间变化数据进行微分处理可得其初始反应速率(dcMPC/dt),然后将其与xcat做图,见图5。由图5可知,在所研究的催化剂用量范围内,dcMPC/dt与xcat呈现出线性关系。

图5 413.15 K下dcMPC/dt与xcat间的关系Fig.5 Relationship between dcMPC/dt(the initial rate of the disproportionation reaction)withxcatat 413.15 K.
这种线性关系不仅是反应初期的一个规律,将反应达到95%平衡时所需时间与1/xcat作图,如图6所示。由图6可知,反应在接近95%的平衡时,这种线性关系仍旧存在。由此可推测,在整个反应过程中反应速率与xcat间均可呈现这种线性关系。

图6 歧化反应达到95%平衡所需时间与1/xcat间关系Fig.6 Time when the disproportionation reaction reached 95% equilibrium versus 1/xcat.
2.5 温度的影响
图7为反应温度对MPC转化率的影响。由图7可知,随着反应温度的升高,MPC歧化反应速率明显增大,这是因为MPC的歧化反应是吸热过程,升高温度有利于反应向正反应方向进行。温度为433.15 K时,反应120 min即可达到平衡。

图7 反应温度对MPC转化率的影响Fig.7 Effects of temperature on the conversion of MPC. React ion condition:xcat=0.006 2.
2.6 动力学计算
2.6.1 MPC反应动力学模型的建立
MPC歧化反应的反应方程见式(1)。

殷霞[14]对逆歧化反应进行了本征动力学研究,以逆歧化反应为基元反应建立了动力学模型,鉴于基元反应的质量作用定律,正逆反应均符合拟二级反应。模拟结果表明,逆歧化反应的指数前因子(A)为2.26×1010,活化能(Ea)为65.76 kJ/mol,该模型在实验条件下表现出良好的预测效果。本工作以歧化反应为基元反应,采用二级均相可逆动力学模型来拟合实验数据[15]。
反应速率方程式为:

式中,c为反应物浓度;t为反应时间;k+,k-分别为歧化反应的正、逆反应速率常数。
因为,转化率(X)可表示为:

式中,c0为反应物初始浓度。
所以,反应速率方程式中各物质浓度可表示为:
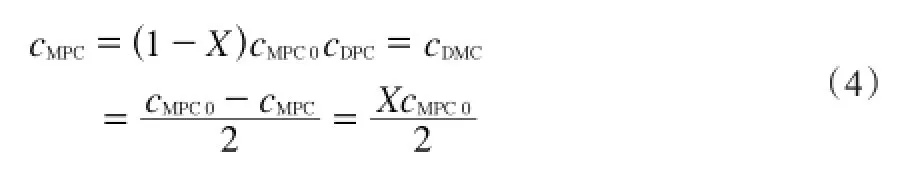
则反应速率方程式变为:

反应达到平衡时:
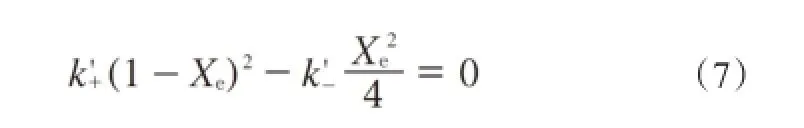
式中,Xe为反应达到平衡时的转化率。
从而得到:

所以,

两边积分得:

解得:

即:
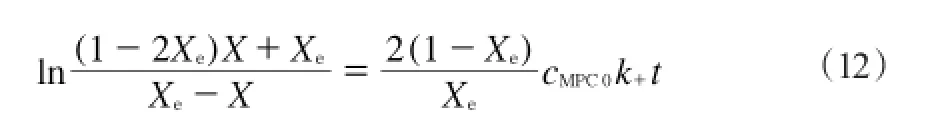

图8 不同温度下二级速率方程曲线Fig.8 Curves of the second-order reaction rate equation at different temperature.

图9 不同温度下二级速率方程曲线Fig.9 Curves of the second-order reaction rate equation at different temperature.
表1为不同温度下的速率常数。由表1可知,方程的拟合优度(R2)的值均在0.99以上,说明各参数的精确度较高,表明模型较为理想。
根据Arrhenius公式,对不同温度下lnk~1/T做图,见图10。由图10可知,数据的线性相关度较好。对于正反应,相关系数(R)=0.984,斜率(-Ea/R)为-9 507.68。由此计算可得到正反应活化能为79.047 kJ/mol,正反应指数前因子为8.908×106m3/(mol·min);同理可得逆反应活化能为78.377 kJ/mol,逆反应指数前因子为4.167×107m3/(mol·min)。可见,MPC歧化的正、逆反应活化能均较低,反应较易发生。
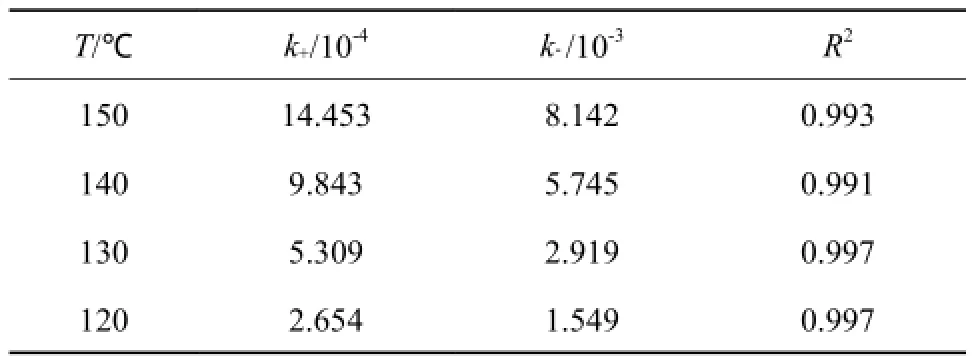
表1 不同温度下的速率常数Table 1 Reaction rate constants at different temperature
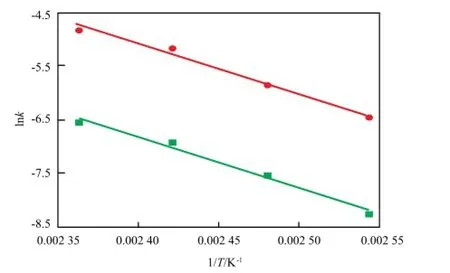
图10 lnk~1/T曲线Fig.10 lnk-1/Tcurve.
综上可知,MPC歧化反应的动力学方程见式(13)。

2.6.2 动力学方程验证
图11为423.15 K下歧化反应动力学模型计算值与实验值的比较。使用lsqnonlin最小二乘法,根据反应速率的实验值和计算值的残差平方和最小原则作为约束条件来估算模型参数。由图11可知,实验模型计算值与实验值吻合良好,相对误差在5%以内。因此,假设的二级动力学模型可较真实地描述MPC歧化反应的反应过程。
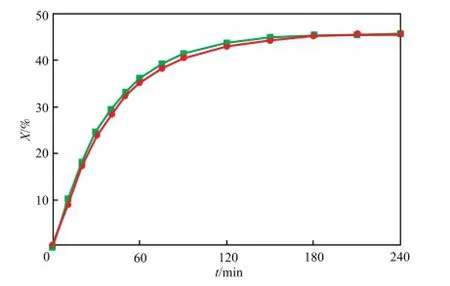
图11 423.15 K下歧化反应动力学模型计算值与实验值的比较Fig.11 Comparison between experimental values and calculated values at 423.15 K.
3 结论
1)实验条件下,内外扩散的影响可忽略。对实验数据进行非线性拟合,回归得到动力学方程。通过实验值与模型计算值的比较,说明动力学模型与实验数据吻合良好,在实验范围内可信度较高。
2)正、逆反应均为二级反应,正反应的活化能为79.047 kJ/mol,指数前因子为8.908×106m3/(mol ·min);逆反应的活化能为78.377 kJ/ mol,指数前因子为4.167×107m3/(mol·min)。
3)MPC歧化反应的动力学方程的表达式见下式。

[1] Shaikh A A,Sivaram S. Organic carbonates[J].Chem Rev,1996,96(3):951-976.
[2] Fukuoka S,Tojo M,Hachiya H,et al. Green and sustainable chemistry in practice:Development and industrialization of a novel process for polycarbonate production from CO2without using phosgene[J].Polym J,2007,39(2):91-114.
[3] Kim Won Bae,Joshi Upendra A,Lee Jae Sung. Making polycarbonates without employing phosgene:An overview on catalytic chemistry of intermediate and precursor syntheses for polycarbonate[J].Ind Eng Chem Res,2004,43(9):1897-1914.
[4] Vavasori A,Toniolo L. The promoting effect of chelating ligands in the oxidative carbonylation of phenol to diphenyl carbonate catalyzed by Pd-Co-benzoquinone system[J].J Mol Catal A:Chem,2000,151(1):37-45.
[5] Mei Fuming,Li Guangxing,Nie Jin,et al. A novel catalyst for transesterification of dimethyl carbonate with phenol to diphenyl carbonate:Samarium trifluoromethanesulfonate[J].J Mol Catal A:Chem,2002,184(1/2):465-468.
[6] Niu Hongying,Yao Jie,Wang Yue,et al. Transesterification of dimethyl carbonate and phenol to diphenyl carbonate catalyzed by titanocene complexes[J].Catal Commun,2006,8(3):355-358.
[7] Ono Y. Catalysis in the production and reactions of dimethyl carbonate,an environmentally benign building block[J].Appl Catal,A,1997,155(2):133-166.
[8] Haubrock J,Raspe M,Versteeg G F,et al. Reaction from dimethyl carbonate to diphenyl carbonate:Ⅰ. Experimental determination of the chemical equilibria[J].Ind Eng Chem Res,2008,47(24):9854-9861.
[9] Haubrock J,Wermink W,Versteeg G F,et al. Reaction from dimethyl carbonate(DMC) to diphenyl carbonate(DPC): Ⅱ. Kinetics of the reactions from DMC via methyl phenyl carbonate to DPC[J].Ind Eng Chem Res,2008,47(24):9862-9870.
[10] 陶昭才,田恒,朱云峰. 碳酸苯甲酯歧化反应动力学的研究[J].安徽理工大学学报:自然科学版,2003,23(4):56-67.
[11] 罗智. 金属氧化物催化甲基苯基碳酸酯歧化反应研究[D].成都:中国科学院有机化学研究所,2008.
[12] Keller T,Holtbruegge J,Niesbach A,et al. Transesterification of dimethyl carbonate with ethanol to form ethyl methyl carbonate and diethyl carbonate:A comprehensive study on chemical equilibrium and reaction kinetics[J].Ind Eng Chem Res,2011,50(19):11073-11086.
[13] Yin Xia,Zeng Yi,Yao Jie,et al. Kinetic modeling of the transesterification reaction of dimethyl carbonate and phenol in the reactive distillation reactor[J].Ind Eng Chem Res,2014,53(49):19087-19093.
[14] 殷霞. 碳酸二甲酯与苯酚酯交换反应动力学及汽液相平衡研究[D].北京:中国科学院大学,2015.
[15] 张濂. 化学反应工程原理[M].上海:华东理工大学出版社,2001:77-79.
[16] 李绍芬. 反应工程[M].北京:化学工业出版社,2009:21.
(编辑 杨天予)
Kinetics of the disproportionation reaction of methyl phenyl carbonate
Fu Qiang1,3,Bai Yuansheng1,2,Jiang Wei1,2,Zeng Yi1,2,Yao Jie1,2,Wang Gongying1,2
(1.Chengdu Institute of Organic Chemistry,Chinese Academy of Sciences,Chengdu Sichuan 610041,China;2.Chengdu Organic Chemicals Co.,Ltd.,Chinese Academy of Sciences,Chengdu Sichuan 610041,China;3.University of Chinese Academy of Sciences,Beijing 100049,China)
Methyl phenyl carbonate(MPC) is the intermediate for the synthesis of diphenyl carbonate(DPC) by the transesterification of dimethyl carbonate and phenol,and the disproportionation of MPC to DPC is a key step in this route. The effects of dibutyl tin oxide catalyst dosage,internal/ external diffusion and reaction temperature on the disproportionation were investigated. A kinetic model was established by measuring the change of the MPC conversion with reaction time. The results showed that both the forward and reverse reactions of the MPC disproportionation were second-order reactions. The pre-exponential factor and activation energy are 8.908×106m3/(mol·min) and 79.047 kJ/mol for the forward reaction,and the pre-exponential factor and activation energy are 4.167×107m3/(mol·min) and 78.377 kJ/mol for the backward reaction,respectively. The results calculated by this model were confirmed under the experimental conditions.
methyl phenyl carbonate;dimethyl carbonate;diphenyl carbonate;kinetics;disproportionation reaction
1000-8144(2017)03-0303-06
TQ 225.52
A
10.3969/j.issn.1000-8144.2017.03.007
2016-09-20;[修改稿日期]2016-12-08。
付嫱(1992—),女,山东省聊城市人,硕士生,电话 15528282196,电邮 royla528@163.com。联系人:王公应,电话028-85215405,电邮 gywang@cioc.ac.cn。
十二五国家科技支撑计划(2013BAC11B05);四川省“千人计划”顶尖创新团队;“成都人才计划”顶尖创新团队。
