慢性乙型肝炎患者不同免疫状态及抗病毒治疗早期外周血NK细胞亚群变化特点
2017-05-12潘志耘曹淑凤王贵阳
潘志耘, 曹淑凤, 黄 睿, 王贵阳, 田 辰, 吴 超
1. 南京医科大学鼓楼临床医学院感染科, 江苏 南京 210008; 2. 南京大学医学院鼓楼医院感染科
慢性乙型肝炎患者不同免疫状态及抗病毒治疗早期外周血NK细胞亚群变化特点
潘志耘1, 曹淑凤1, 黄 睿2, 王贵阳2, 田 辰2, 吴 超1
1. 南京医科大学鼓楼临床医学院感染科, 江苏 南京 210008; 2. 南京大学医学院鼓楼医院感染科
目的 观察慢性乙型肝炎(chronic hepatitis B, CHB)患者不同免疫状态下外周血NK细胞亚群特点,比较聚乙二醇干扰素及核苷(酸)类似物抗病毒治疗早期外周血NK细胞亚群变化差异。方法 收集门诊不同免疫状态下的CHB患者81例,其中免疫耐受期(immune-tolerance phase, IT)患者22例,免疫活化期(immune-activation phase, IA)患者52例,非活动携带组(inactive carry phase, IC)7例,同时纳入健康志愿者(healthy controls, HC)39例作为对照。对27例符合抗病毒治疗标准的患者进行抗病毒治疗,并完成随访。其中22例采用核苷(酸)类似物治疗,5例采用聚乙二醇干扰素治疗。流式细胞术检测患者抗病毒治疗0周、4周、8周、12周及24周外周血NK细胞亚群的比例。结果 免疫耐受组、非活动携带组NK细胞总数较健康对照组明显上升(P<0.05)。非活动携带组CD56dimNK细胞比例较健康对照组升高(P=0.02)。免疫耐受组及免疫活化组患者外周血CD56brightNK细胞以及CD56bright/CD56dimNK比值与健康对照组相比均明显升高(P<0.05);比较CHB患者聚乙二醇干扰素及核苷(酸)类似物抗病毒治疗各时间点外周血NK亚群比例发现,CD56dimNK细胞比例无明显差异。聚乙二醇干扰素组CD56brightNK细胞比例在8周、12周、24周时明显高于核苷(酸)类似物组,差异有统计学意义(P<0.05)。结论 外周血NK细胞亚群可能与慢性HBV持续感染相关。在抗HBV治疗过程中,聚乙二醇干扰素可能通过上调CD56brightNK细胞发挥免疫调节作用。
慢性乙型肝炎;自然杀伤细胞亚群;抗病毒
慢性乙型肝炎(chronic hepatitis B, CHB)是严重危害我国人民生活健康的重大疾病之一,机体免疫功能受损是CAB持续感染的重要原因。特异性免疫,尤其是T淋巴细胞在清除HBV感染中发挥关键作用[1-2]。但是,越来越多的研究发现,机体的非特异性免疫在 HBV 持续感染中也同样重要[3],自然杀伤细胞(Natural killer cell,NK)是非特异性免疫中的重要组成部分,在HBV感染过程中,其亚群、功能均发生改变,但抗病毒治疗过程中外周血NK细胞亚群变化特点尚不清楚。本研究旨在观察CHB患者不同免疫状态下外周血NK细胞亚群特点,比较聚乙二醇干扰素及核苷(酸)类似物抗病毒治疗早期外周血NK细胞亚群变化差异。
1 资料与方法
1.1 一般资料 收集2009年1月-2014年12月南京鼓楼医院肝炎门诊随访患者,CHB感染不同免疫状态符合2010年《慢性乙型肝炎防治指南》[4]诊断标准,共81例CHB患者,其中免疫耐受期(immune tolerant phase, IT)患者22例,男11例,女11例,年龄18~57岁;免疫活化期(immune reactive phase, IA)患者52例,男42例,女10例,年龄14~35岁;非活动携带组(inactive carry phase, IC)7例,全部为男性,年龄22~41岁。对27例符合抗HBV治疗标准的患者分组,抗病毒治疗24周,并完成随访。其中22例为核苷(酸)类似物组,男18例,女4例,年龄20~55岁,5例为干扰素组,男3例,女2例,年龄22~69岁。所有患者均未接受过抗病毒治疗和免疫治疗,排除其他肝炎病毒及重叠感染等。纳入健康志愿者39名为对照组,男18名,女21名,年龄22~69岁,所有受试者均签署了自愿参加实验的知情同意书。
1.2 药物、试剂及仪器 小鼠抗人CD3-PerCP单克隆抗体(美国eBioscience 公司);小鼠抗人CDl6-FITC及CD56-PE单克隆抗体(美国BD公司),红细胞裂解液(美国BD公司);淋巴细胞分离液(天津灏洋生物制品公司);BD FACSCantoTM流式细胞仪(美国BD公司)。
1.3 抗病毒治疗和随访 干扰素组予聚乙二醇干扰素α-2a注射液(派罗欣 )180 μg/周,核苷(酸)类似物组根据患者的情况予恩替卡韦(博路定)0.5 mg/d、替比夫定(素比伏)600 mg/d、阿德福韦酯(贺维力)10 mg/d、拉米夫定(贺普丁)0.1 g/d单用或联合治疗。共随访24周,分别在抗病毒治疗前,抗病毒治疗后2周、4周、8周、12周、24周,检测各组患者外周血NK细胞亚群比例。
1.4 实验方法 流式细胞术检测外周血NK细胞亚群比例:充分混匀的50 μl新鲜EDTA抗凝外周血中加入CD3-PerCP、CDl6-FITC和CD56-PE抗体,4 ℃避光孵育20 min。加入红细胞裂解液500 μl,4 ℃避光孵育10 min。加入1 000 μl PBS,1 500 r/min离心5 min。洗涤2次,上流式细胞仪检测NK细胞亚群比例,其中P3表示CD56强阳性而CD3阴性细胞为CD56brightNK细胞,P2表示CD56弱阳性而CD3阴性细胞为CD56dimNK细胞(见图1)。
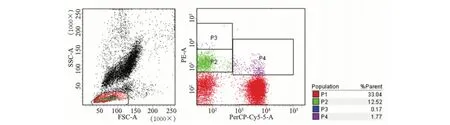
图1 外周血NK细胞亚群流式细胞图

2 结果
2.1 临床资料 81例不同免疫状态的慢性HBV感染者及39名健康对照者血清学特点见表1。与非活动携带组相比,免疫耐受组及免疫活化组HBVDNA水平均明显升高,差异有统计学意义(P<0.05)。非活动携带者HBV-DNA水平低于检测下限。免疫活化组ALT水平明显高于健康对照组,免疫耐受组、非活动携带者ALT水平与健康对照组比较差异无统计学意义(P>0.05)。27例抗病毒患者血清学特点如表2所示,与干扰素组相比,核苷(酸)类似物ALT、HBV-DNA水平均较高,差异无统计学意义(P>0.05)。

表1 不同免疫状态CHB患者与健康对照者血清学特点±s)
注:与健康对照组相比,*P<0.05;与非活动携带组比较,▲P<0.05。

表2 不同抗病毒治疗患者血清学特点±s)
2.2 不同免疫状下慢性HBV感染者外周血NK细胞亚群比例 免疫耐受组外周血总NK细胞比例、CD56brightNK细胞比例、CD56bright/CD56dim比值均高于健康对照组(F=6.13,P=0.03;F=18.42,P<0.001;F=9.42,P=0.01);免疫活化组外周血CD56brightNK细胞比例、CD56bright/CD56dim比值均高于健康对照组(F=17.01,P<0.001;F=10.77,P<0.001);非活动携带组外周血NK细胞总数、CD56dimNK细胞比例均高于健康对照组(F=7.01,P=0.03;F=7.81,P=0.02)。免疫耐受组、免疫活化组、非活动携带组各组间NK细胞各亚群间差异无统计学意义(P>0.05,见图2)。

图2 不同免疫状态CHB患者外周血NK细胞亚群比例比较
2.3 外周血NK细胞亚群与DNA载量及ALT水平相关性分析 CHB患者外周血CD56dimNK细胞比例与血清ALT水平负相关性(r=-0.284,P=0.01);与血清HBV-DNA载量无相关性(r=-0.12,P=0.28); CD56brightNK细胞比例与HBV-DNA载量和ALT水平均无相关性(r=0.119,P=0.289;r=-0.077,P=0.50)。
2.4 CHB患者抗病毒治疗过程中NK细胞亚群变化 27例接受抗病毒的CHB患者根据治疗方案的不同分为聚乙二醇干扰素组与核苷(酸)类似物组,随访24周。结果提示,抗病毒治疗后干扰素组CD56brightNK细胞占淋巴细胞比例逐渐升高,在8周、12周、24周时明显高于核苷(酸)类似物组(F=5.88,P=0.027;F=7.27,P=0.016;F=11.18,P=0.003)。干扰素组CD56bright/CD56dim比值在8周、12周、24周也明显高于核苷(酸)类似物组(F=10.55,P=0.003;F=9.71,P=0.005;F=60.11,P=0.001)。但两组外周血总NK细胞比例及CD56dimNK细胞比例在各随访时间点无明显差异(见图3)。

图3 聚乙二醇干扰素与核苷(酸)类似物抗病毒治疗24周NK细胞亚群变化比较
Fig 3 The changes of peripheral blood NK cell subsets during antiviral treatment 24 weeks by pegylated interferon-α or nucleos(t)ide analogues
3 讨论
CHB 的发病机制复杂,病毒复制与宿主免疫反应的相互作用决定了 HBV 感染的预后和转归[5]。近年来,固有免疫在HBV感染发病机的制研究越来越受关注。NK细胞是机体重要的固有免疫系统的效应细胞,它可直接发挥抗感染、抗肿瘤、免疫调节及免疫监视的作用。成熟的NK 细胞根据细胞表面分化抗原CD56表达水平不同,将NK 细胞分为CD56bright和CD56dim两大亚群,二者在表型及功能等方面均存在显著差异[6]。外周血中90%NK 细胞表型为CD56dim,能够通过合成、释放穿孔素、颗粒酶等细胞毒物质,介导靶细胞溶解与结构破坏,直接杀伤靶细胞。而CD56brightNK 细胞占外周血中10%,通过释放INF-α、IFN-γ、IL-10 等一系列细胞因子调节免疫应答。越来越多的研究发现,NK细胞在清除肝炎病毒感染中发挥重要作用[7]。既往很多研究集中在HCV,在慢性HCV感染过程中,HCV患者的NK细胞数量降低,表型及功能发生改变[8]。然而,NK细胞在慢性HBV感染的细胞亚群变化,特别是抗病毒治疗后的变化研究尚少。
本研究观察了81例CHB患者NK细胞亚群比例,结果发现,不同免疫状态下,CHB患者NK细胞亚群比例与健康对照组不同。非活动携带期患者CD56dimNK细胞比例较健康对照组明显升高;CD56brightNK细胞为CD56dimNK细胞的前体细胞,我们推测,在非活动携带状态下,机体免疫处于平衡阶段,CD56brightNK可能向CD56dimNK细胞转化升高,引起CD56dimNK细胞升高,目前尚无研究报道,需进一步研究证实。免疫活化组患者CD56brightNK细胞比例高于健康对照者,CD56dimNK细胞变化不明显。Peppa等[9]观察64例CHB患者同样发现,CD56brightNK 细胞在CHB中上升明显,但其分泌IFN γ能力明显抑制,病毒载量的下降可以恢复NK细胞亚群比例[10]。以上研究提示,NK细胞及其亚群可能参与HBV的感染过程,不同免疫状态影响NK细胞亚群的比例。
目前用于抗HBV治疗的药物主要有核苷(酸)类似物和干扰素两大类。本研究中我们动态观察了两类不同抗病毒方案治疗下早期NK细胞亚群的比例变化特点,结果发现,与核苷(酸)类似物组相比,干扰素治疗第8周时,外周血CD56brightNK细胞亚群比例明显上调,且随着治疗时间推移,差异逐渐显著。这可能与两类抗病毒药物抗病毒机制不同有关。核苷(酸)类似物主要通过模拟天然核苷(酸)的结构,与ATP竞争性地结合HBV的DNA聚合酶和反转录酶的ATP位点,嵌入正在合成的病毒DNA链,终止DNA链的延长,从抑制HBV-DNA聚合酶和反转录酶的复制,最终抑制病毒复制。而干扰素能够结合到特定的细胞表面受体触发一系列信号传导事件,导致抗病毒蛋白的产生,降低病毒mRNA,从而抑制病毒复制[11]。同时干扰素能够加强NK细胞、巨噬细胞、T淋巴细胞活性,参与免疫调节。干扰素是NK细胞有效的活化剂,在小鼠的病毒感染模型中,它可以诱导NK细胞分化增殖,增强NK细胞毒性[12]。在HCV治疗过程中,干扰素能够迅速活化NK细胞,上调TRAIL的表达清除病毒感染[13]。本研究发现,IFN除直接抑制病毒复制外,还能够通过上调CD56brightNK细胞亚群比例,参与免疫调节作用,发挥抗病毒效果。Micco等[14]对19例e抗原阴性CHB患者干扰素治疗48周,并检测外周血NK细胞亚群,结果发现,CD56brightNK细胞亚群比例在治疗后明显上调,NK细胞活化受体NKP46增强,伴随TRAIL和IFN-γ水平表达上升。Stelma等[15]的研究也发现,CHB 患者 PEG-IFN 联合阿德福韦酯治疗过程中CD56brightNK 细胞比例及绝对数量呈逐渐上升的趋势,且完全应答者治疗后其CD56brightNK 细胞 IFN-γ的分泌的能力也明显强于未应答者。以上研究表明,CD56brightNK细胞亚群在抗病毒过程中发挥重要作用,而干扰素可以通过上调CD56brightNK细胞亚群比例,参与固有免疫反应。但本次研究因样本量较小,且时间周期较短,未能观察其与HBeAg及HBsAg血清转换之间的关系,我们也未对NK细胞亚群的功能进行研究。
综上所述,CHB患者不同免疫状态下NK细胞亚群的比例发生变化,其中免疫活化期CD56brightNK细胞亚群比例明显高于健康对照,提示NK细胞亚群参与了慢性HBV感染的免疫调控。干扰素可能通过上调外周血CD56brightNK细胞亚群比例调节CHB患者的免疫反应发挥治疗作用,但其对CD56brightNK细胞功能的影响还需要进一步研究。
[1]Tan A, Koh S, Bertoletti A. Immune response in hepatitis B virus infection [J]. Cold Spring Harb Perspect Med, 2015, 5: a021428.
[2]Guidotti LG, Isogawa M, Chisari FV. Host-virus interactions in hepatitis B virus infection [J]. Curr Opin Immunol, 2015, 36: 61-66
[3]Busca A, Kumar A. Innate immune responses in hepatitis B virus (HBV) infection [J]. Virol J, 2014, 11: 22.
[4]中华医学会肝病分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].胃肠病学和肝病学杂志, 2011, 20(2):Ⅰ-ⅩⅣ. Chinese Souiety of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association.The guideline of prevention and treatment for chronic hepatitis B(2010 version)[J]. Chin J Gastroenterol Hepatol, 2011, 20(2): Ⅰ-ⅩⅣ. [5]Guidotti LG, Isogawa M, Chisari FV. Host-virus interactions in hepatitis B virus infection [J]. Curr Opin Immunol, 2015, 36: 61-66.
[6]Shi FD, Ljunggren HG, La Cava A, et al. Organ-specific features of natural killer cells [J]. Nat Rev Immunol, 2011, 11(10): 658-671.
[7]Tian Z, Chen Y, Gao B. Natural killer cells in liver disease [J]. Hepatology, 2013, 57(4): 1654-1662.
[8]Golden-Mason L, Madrigal-Estebas L, Mc Grath E, et al. Altered natural killer cell subset distributions in resolved and persistent hepatitis C virus infection following single source exposure [J]. Gut, 2008, 57(8): 1121-1128
[9]Peppa D, Micco L, Javaid A, et al. Blockade of immunosuppressive cytokines restores NK cell antiviral function in chronic hepatitis B virus infection [J]. PLoS Pathog, 2010, 6(12): e1001227.
[10]Tjwa ET, van Oord GW, Hegmans JP, et al. Viral load reduction improves activation and function of natural killer cells in patients with chronic hepatitis B [J]. J Hepatol, 2011, 54(2): 209-218.
[11]Perry ST, Buck MD, Lada SM, et al. STAT2 mediates innate immunity to Dengue virus in the absence of STAT1 via the type I interferon receptor [J].PLoS Pathog, 2011,7 (2): e1001297.
[12]Nguyen KB, Salazar-Mather TP, Dalod MY, et al. Coordinated and distinct roles for IFN-alpha beta, IL-12, and IL-15 regulation of NK cell responses to viral infection [J]. J Immunol, 2002, 169(8): 4279-4287
[13]Ahlentiel G, Titerence RH, Koh C, et al. Naturalkiller cells are polarized toward cytotoxicity in chronic hepatitis C in aninterferon-alfa-dependent manner [J]. Gastroenterology, 2010,138(1): 325-335, e1-e2.
[14]Micco L, Peppa D, Loggi E, et al. Differential boosting of innate and adaptive antiviral responses during pegylated-interferon-alpha therapy of chronic hepatitis B [J]. J Hepatol, 2013, 58(2): 225-233.
[15]Stelma F, de Niet A, Tempelmans Plat-Sinnige MJ, et al. Natural killer cell characteristics in patients with chronic hepatitis B virus (HBV) infection are associated with HBV surface antigen clearance after combination treatment with pegylated interferon alfa-2a and adefovir [J]. J Infect Dis, 2015, 212(7): 1042-1051.
(责任编辑:王全楚)
Characteristics of peripheral blood natural killer cell subsets in patients with chronic hepatitis B during the early phase of antiviral treatment
PAN Zhiyun1, CAO Shufeng1, HUANG Rui2, WANG Guiyang2, TIAN Chen2, WU Chao1
1. Department of Infectious Diseases, Drum Tower Clinical Medicine College, Nanjing Medical University, Nanjing 210008; 2. Department of Infectious Diseases, Nanjing Drum Tower Hospital, Nanjing University, China
Objective To observe the characteristics of peripheral blood natural killer (NK) cell subsets in patients with chronic hepatitis B (CHB) during different immune status, and to compare the changes of peripheral blood NK cell subsets during early phase of antiviral treatment by pegylated interferon-α (PEG-IFN-α) or nucleos(t)ide analogues (NAs). Methods Eighty-one patients with CHB including 22 patients in immune-tolerance phase (IT), 52 patients in immune-activation phase (IA) and 7 patients in inactive carry phase (IC). Thirty-nine healthy volunteers were included as healthy controls (HC). Twenty-seven patients underwent antiviral therapy and were followed for 24 weeks. Twenty-two patients were treated with NAs and 5 patients were treated with PEG-IFN-α. The proportion of peripheral blood NK cells subsets were assessed at five time points of antiviral therapy: 0 weeks, 4 weeks, 8 weeks, 12 weeks and 24 weeks by flow cytometry.Results The proportion of peripheral blood NK cells in IT and IC groups were markedly increased than that in healthy controls (P<0.05); The proportion of CD56dimNK cells in IC group was higher than those in HC (P=0.02). The proportion of CD56brightNK cells and CD56bright/CD56dimNK ratio in IT and IA were higher than those in HC (P<0.05); there was no significant difference about the proportion of CD56dimNK cells between PEG-IFN-α group and NAs group. The CD56brightNK cells of PEG-IFN-α group were higher than those in NAs group at 8 weeks, 12 weeks and 24 weeks (P<0.05). Conclusion The peripheral blood NK cells subsets may be associated with chronic HBV persistency. The PEG-IFN-α may play a role in immune regulation by up-regulating the proportion of CD56brightNK cells during the antiviral treatment of CHB.
Hepatitis B virus; NK cell subsets; Antiviral
国家自然科学基金(81470093);江苏省临床医学科技专项(BL2012034);江苏省医学领军人才与创新团队资助项目(LJ201154)第一作者简介:潘志耘,住院医师,硕士,研究方向:慢乙肝免疫机制。E-mail:15695217533@163.com
吴超,主任医师,教授,研究方向:病毒性肝炎的免疫调节机制及细菌的耐药特征与治疗控制。E-mail: dr.wu@nju.edu.cn
10.3969/j.issn.1006-5709.2017.04.021
R575.1
A
1006-5709(2017)04-0444-05
2016-9-27
