干旱胁迫对柴胡中柴胡皂苷合成途径关键酶活性及柴胡皂苷含量的影响
2017-05-11韩晓伟冯红冯建明严玉平张丹郑开颜郑玉光
韩晓伟 冯红 冯建明 严玉平 张丹 郑开颜 郑玉光
摘要:目的 研究干旱脅迫对柴胡中柴胡皂苷合成途径关键酶活性及皂苷含量的影响,从蛋白水平揭示柴胡对干旱胁迫的响应。方法 通过盆栽控水试验,设置土壤饱和含水量的70%~80%、60%~70%、40%~50%、20%~30%共4个水平栽培柴胡。采用酶联免疫法检测6个月和1年生柴胡根中4种柴胡皂苷合成途径关键酶3-羟基-3-甲基-戊二酸单酰辅酶A还原酶(HMGR)、异戊烯基焦磷酸异构酶(IPPI)、法尼基焦磷酸合酶(FPS)和β-香树素合成酶(β-AS)的活性,采用HPLC检测不同土壤饱和含水量情况下样品中柴胡皂苷a、d的含量。结果 柴胡苗在饱和含水量40%~50%时4种酶的活性最高,在饱和含水量60%~70%、70%~80%时次之,在饱和含水量20%~30%时最低,柴胡皂苷a、d含量变化与酶活性变化趋势相似。结论 40%~50%土壤饱和含水量能显著提高柴胡皂苷合成途径关键酶活性,且柴胡皂苷含量与酶活性之间呈显著正相关,说明在干旱胁迫下,柴胡通过调节柴胡皂苷合成途径关键酶活性来调节柴胡皂苷的合成,对干旱胁迫作出响应。
关键词:干旱胁迫;柴胡;酶活性;柴胡皂苷
DOI:10.3969/j.issn.1005-5304.2017.05.017
中图分类号:R284.1 文献标识码:A 文章编号:1005-5304(2017)05-0071-05
Effects of Drought Stress on Activity of Key Enzyme in Saikosaponin Biosynthesis Passway and Saponins Content in Bupleurum chinense HAN Xiao-wei1, FENG Hong2, FENG Jian-ming1, YAN Yu-ping1, ZHANG Dan1, ZHENG Kai-yan1, ZHENG Yu-guang1 (1. Hebei University of Chinese Medicine, Shijiazhuang 050200, China; 2. Anguo Digital Materia Medica Testing Center Co., LTD., Anguo 071200, China)
Abstract: Objective To research the effects of drought stress on activity of key enzyme in saikosaponin biosynthesis and saponins content in Bupleurum chinense; To reveal response of Bupleurum chinense to drought stress from protein level. Methods Bupleurum chinense was cultivated in potted water control experiment with 70%–80%, 60%–70%, 40%–50% and 20%–30% saturated soil water contents. The enzyme activities of 3-hydroxy-3-methyl-glutaryl-coenzyme A reductase (HMGR), isoprenyl-based coke (IPPI), farnesyl pyrophosphate synthase (FPS) and β-carotenoid synthase (β-AS) of six months and one year old Bupleurum chinense were measured. The contents of saikosaponins a and d in samples of different soil water contents were determined by HPLC. Results When the saturated moisture was 40%–50%, the enzymatic activities of HMGR, IPPI, FPS and β-AS were the highest, followed by saturated moisture 60%–70%、70%–80% and 20%–30%. The trend of saikosaponin was similar to that of the activity of key enzyme. Conclusion 40%– 50% soil saturated water content can significantly increase the activity of the key enzymes in the saikosaponin synthesis pathway. The saponin content and enzyme activity show a significant positive correlation, indicating that under drought stress, Bupleurum chinense regulates the synthesis of saikosaponin by regulating the key enzyme activity of saikosaponin synthesis pathway to respond drought stress.
Key words: drought stress; Bupleurum chinense; activity of enzyme; saikosaponin
柴胡Bupleurum chinense DC.为伞形科柴胡属植物,是《中华人民共和国药典》规定的药用柴胡主要来源之一[1]。柴胡所含的主要有效成分柴胡皂苷是一种齐墩果烷类型的三萜皂苷,主要为柴胡皂苷a和柴胡皂苷d。柴胡皂苷属于次生代谢产物,是柴胡抵御胁迫的产物,也是主要的药效成分[2-3]。柴胡皂苷合成的途径主要由3部分组成[4],首先合成前体物质异戊烯焦磷酸(IPP)、二甲基丙烯基焦磷酸(DMAPP)、法呢基焦磷酸(FPP),在此基础上合成2,3-角鲨烯氧化物环化合成齐墩果烷型或达玛烷型三萜骨架,最后是三萜类骨架在细胞色素P450、糖基转移酶和糖苷酶等酶的修饰下形成皂苷[5-6]。在上述过程中,HMG-CoA还原酶(HMGR)催化3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)生成甲羟戊酸(MVA),MVA在MVA激酶、磷酸MVA激酶和脱羧酶的作用下形成IPP,异戊烯焦磷酸异构酶(IPPI)催化IPP和DMAPP之间的可逆转化,法呢基焦磷酸合酶(FPS)催化FPP的形成,β香树脂合成酶(β-AS)催化形成β-香树素[7],这些酶均为柴胡皂苷合成途径中关键的限速酶。
干旱是影响植物生长、生存和分布的重要环境因子之一。柴胡主要分布在我国干旱和半干旱地区,目前,随着全球暖干化,干旱胁迫普遍存在,而且呈现出加剧的趋势,因此,研究柴胡对干旱胁迫的响应机理就显得尤为重要。黄璐琦等[8]研究逆境胁迫对药材的作用后提出了道地药材形成的逆境效应理论,即药用植物在适度的逆境下可以提高其药效成分的积累。近年来,国内外对柴胡的研究主要集中在柴胡的药理作用[9]、真伪鉴定[10-15]和栽培[16]等方面,而对柴胡干旱胁迫下的分子响应机制研究较少,因此,本研究通过设置土壤的含水量人为模拟干旱条件,探讨干旱胁迫对柴胡皂苷合成途径关键酶活性的影响,从而为进一步研究干旱胁迫对柴胡皂苷积累的影响奠定基础。
1 仪器与试药
GL-20G-II型冷冻离心机,上海安亭科学仪器厂;EPOCH酶标仪购自美国伯腾仪器公司;Eppendorf移液枪;MGC-P型光照培养箱,上海一恒科学仪器有限公司;赛默飞OMS100烘箱;沃特世2695高效液相色谱系统。
植物HMGR、β-AS、FPS和IPPI酶联免疫分析试剂盒(批号均为201512),上海酶联生物科技有限公司;柴胡皂苷a对照品(批号110777-201510)、柴胡皂苷d对照品(批号110778-201510),中国食品药品检定研究院;乙腈为色谱纯,氨水、甲醇为分析纯。
6个月和1年生柴胡幼苗,河北省邯郸市涉县农牧局提供,经河北中医学院郑玉光教授鉴定为北柴胡Bupleurum chinese DC.。
2 方法
2.1 植物材料的处理
选取生长良好整齐的柴胡苗,移栽到花盆中,花盆口径29 cm、底径19 cm、高20 cm、质量295 g,每个花盆下有一塑料托盘。土壤为沙壤土、营养土和蛭石按1∶1∶1混合均匀。6个月和1年生柴胡幼苗分别于2015年12月和2016年5月移栽于盆中,每盆4穴,每穴2株。移栽后正常浇水,生长1个月后,选取正常生长、一致的幼苗作为供试材料。
采用单因素完全随机区组试验设计,分别设置土壤饱和含水量的70%~80%、60%~70%、40%~50%、20%~30%共4个水平,采用称重法进行水分控制。控水期间每日17:00称取盆重,补充失去的水分,使各处理保持设定的相对含水量。每处理设置3个重复,控水处理1个月后采集样品测定各指标。
2.2 酶联免疫法检测4种酶活性
2.2.1 原理及方法 采用双抗体夹心法测定样品中HMGR、IPPI、FPS和β-AS的酶活性。以FPS为例,用纯化的植物FPS抗体包被微孔板,制成固相抗体,向包被单抗的微孔中依次加入植物FPS,再与辣根过氧化物酶(HRP)标记的FPS抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP的催化下转化成蓝色,并在酸的作用下转化成最终的黄色,颜色深浅与样品中的植物FPS呈正相关。用酶标仪在450 nm波长处测定吸光度(OD)值,通过标准曲线计算样品中植物FPS活性。HMGR、IPPI和β-AS活性测定方法与FPS相同。
2.2.2 粗酶的提取 将柴胡种苗从土壤中取出,用水冲洗数遍去除泥沙,再用吸水紙吸干多余水分,并去除茎叶部分,用电子天平准确称量每棵柴胡种苗根部的质量,按质量体积比1∶18加入0.01 mol/L PBS(pH 7.15),冰浴研磨成匀浆,放置冰箱浸提2 h,4 ℃、10 000 r/min离心20 min,去除沉淀取上清,重复上述步骤,离心后取上清。
2.2.3 酶活性测定 将试剂盒提供的原倍标准品分别稀释为60、30、15、7.5、3.75 IU/L。加样:分别设空白孔(不加样品及酶标试剂,其余操作相同)、标准孔、待测样品孔。在酶标包被板上标准孔准确加样50 ?L,待测样品孔中先加样品稀释液40 ?L,再加待测样品10 ?L(样品最终稀释度为5倍)。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。温育:用封板膜封板后置37 ℃温育30 min。配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用。洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,重复5次,拍干。加酶:每孔加入酶标试剂50 ?L,空白孔除外。温育(同上)。洗涤(同上)。显色:每孔先加入显色剂A 50 ?L,再加入显色剂B 50 ?L,轻轻震荡混匀,37 ℃避光显色10 min。终止:每孔加终止液50 ?L(此时蓝色立转黄色)。测定:以空白孔调零,450 nm波长依序测量各孔OD值。测定应在加终止液后15 min内进行。
2.2.4 数据处理 以标准品浓度为横坐标,OD值为纵坐标,绘制标准曲线,计算直线回归方程,将样品的OD值代入方程,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
2.3 HPLC测定柴胡皂苷a、d含量
皂苷含量测定条件参照2015年版《中华人民共和国药典》,方法参照张宇等[4]步骤进行。
3 结果
3.1 干旱对柴胡皂苷a、d含量的影响
不同土壤饱和含水量处理的6月龄和1年生柴胡苗柴胡皂苷a、d含量见图1。在干旱胁迫下,土壤饱和含水量为40%~50%时,6月龄和1年生柴胡苗柴胡皂苷a、d含量最高,土壤饱和含水量为60%~80%时次之,土壤饱和含水量为20%~30%时最低。说明适度干旱胁迫可以使柴胡皂苷a、d的积累量增加。
3.2 干旱对柴胡皂苷合成途径关键酶活性的影响
3.2.1 酶活性测定标准曲线 6月龄和1年生柴胡苗的FPS、β-AS、HMGR和IPPI酶活性检测具有不同的标准曲线,回归方程见表1。标准曲线的r2均为0.99左右,说明后续结果可信。
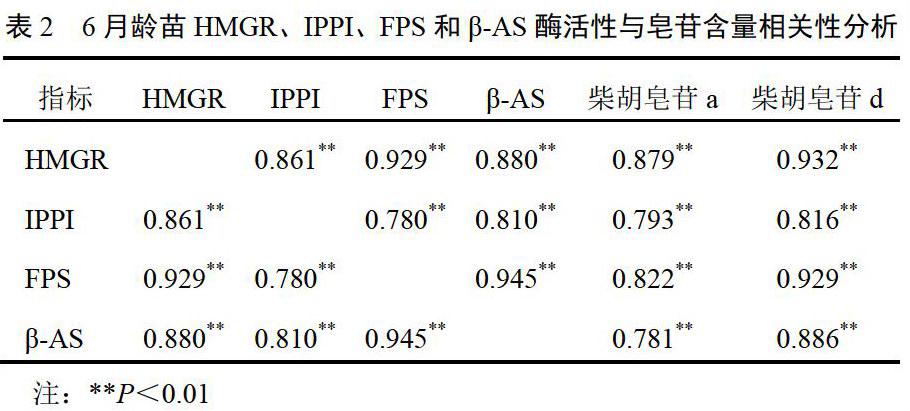
3.2.2 酶活性测定结果 6月龄柴胡苗β-AS的酶活性最高,达到20 000 IU/g左右;IPPI的酶活性较低,只有250 IU/g左右。在干旱处理条件下,40%~50%土壤饱和含水量使FPS、β-AS、HMGR和IPPI的酶活性达到最高,而土壤饱和含水量在70%~80%与60%~70%的情况下FPS、β-AS、HMGR和IPPI的酶活性相差不大,而当土壤饱和含水量降到20%~30%时,FPS、β-AS、HMGR和IPPI的酶活性明显降低。结果见图2。
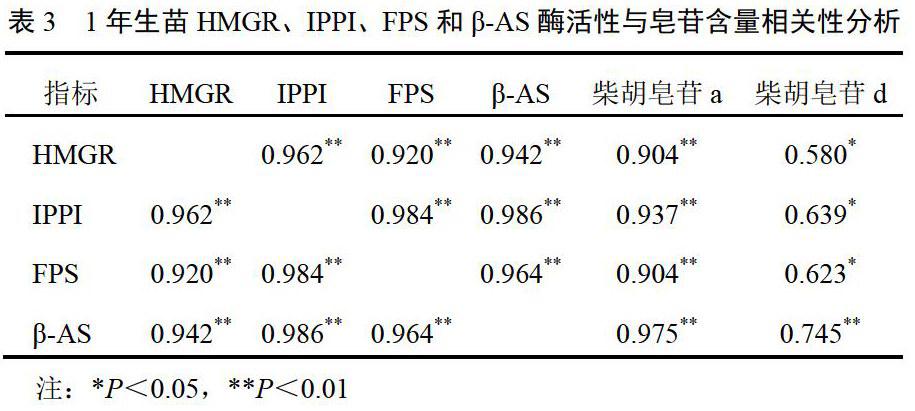
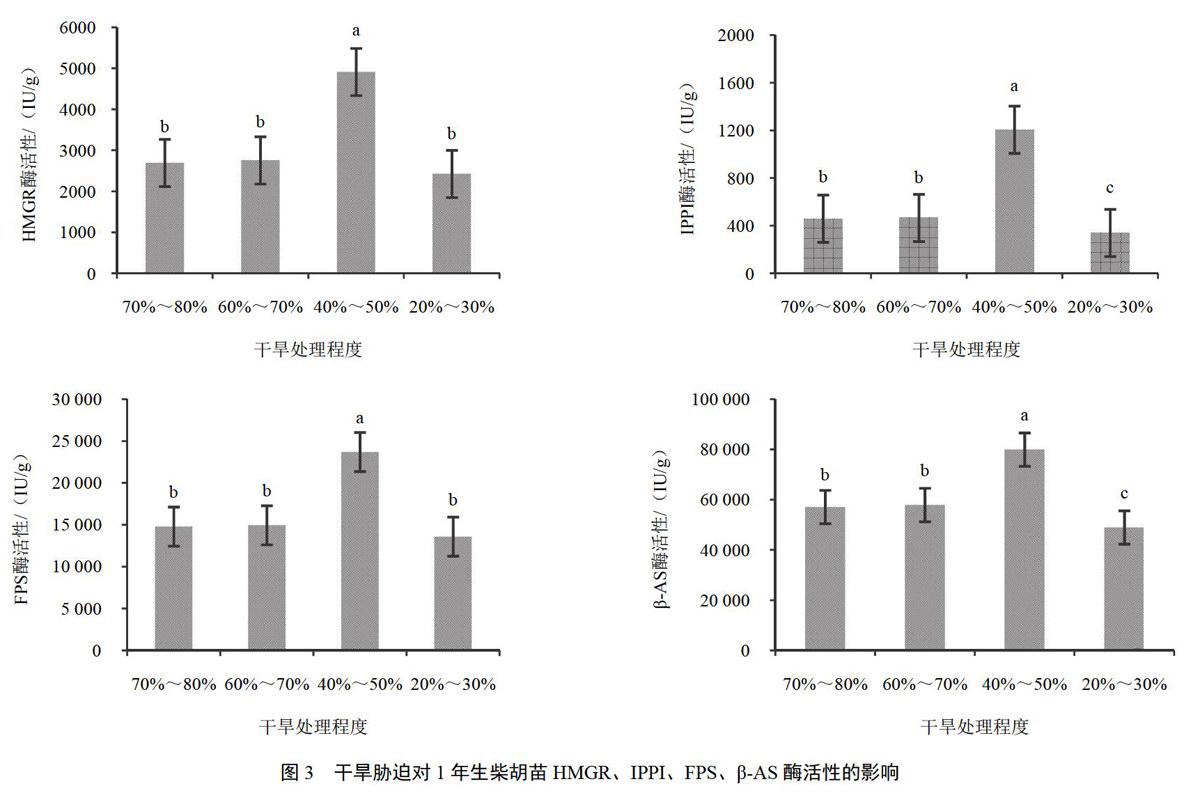
1年生柴胡苗在干旱胁迫条件下,土壤饱和含水量40%~50%时,FPS、β-AS、HMGR和IPPI的酶活性较高,而土壤饱和含水量70%~80%与60%~70%的情况下酶活性相差不大,土壤饱和含水量20%~30%时,FPS、β-AS、HMGR和IPPI的酶活性较低。结果见图3。
以上结果说明柴胡皂苷合成途径关键酶FPS、β-AS、HMGR和IPPI的酶活性在适度干旱条件下较高,水分过多或过少都会对酶活性产生不良的影响。
3.3 柴胡皂苷含量与酶活性的相关性
采用SPSS19.0软件分析不同处理下柴胡皂苷含量与HMGR、IPPI、FPS和β-AS酶活性的相关性,结果见表2、表3。6月龄苗的HMGR、IPPI、FPS和β-AS酶活性与柴胡皂苷a、d含量呈极显著的正相关(P<0.01);1年生柴胡苗HMGR、IPPI、FPS和β-AS酶活性与柴胡皂苷a含量呈极显著的正相关(P<0.01),与柴胡皂苷d的表达呈显著正相关(P<0.05)。6月龄和1年生柴胡苗的HMGR、IPPI、FPS和β-AS酶活性之间均呈极显著的正相关(P<0.01),说明作为柴胡皂苷合成途径的关键酶,每种酶的表达都与其下游酶活性相关,4种酶统一协调柴胡皂苷的合成过程。
4 讨论
张宇等[4]发现干旱胁迫能使HMGR、IPPI、FPS和β-AS的基因表达量上升,而基因表达的产物就是酶类,但基因表达升高并不一定代表酶活性的升高,酶活性能更直接地反映干旱胁迫与柴胡皂苷之间的关系。本研究结果表明,6月龄柴胡苗的酶活性虽然较1年生柴胡苗的酶活性低很多,但在干旱处理下其变化趋势是一致的。6月龄柴胡苗的HMGR酶活性约为1200 IU/g,而1年生柴胡苗的HMGR酶活性达到5000 IU/g,而且,无论是6月龄苗还是1年生苗其β-AS酶活性均明显高于另外3种酶,1年生苗的β-AS酶活性达到80 000 IU/g,较其他3种酶活性高出1个数量级。这说明随着外界温度的升高,柴胡皂苷的合成也在加速,另外,β-AS作为最靠近终产物的酶类,其活性在某种程度上代表了柴胡皂苷合成的多少。
6月龄和1年生柴胡苗对于干旱胁迫的响应趋势是一致的,在土壤饱和含水量为40%~50%时,FPS、β-AS、HMGR和IPPI的酶活性最高,土壤饱和含水量60%~70%与土壤饱和含水量70%~80%时的4种酶活性大致相当,土壤饱和含水量40%~50%应该是酶活性的最适水分。但是,干旱胁迫对于酶活性的增加是有限的,当土壤饱和含水量降至20%~30%时,酶活性迅速降低。在干旱胁迫下,柴胡皂苷含量的变化趋势与酶活性一致,说明柴胡皂苷含量的提高需要一定的干旱期。
另外,β-AS作为最靠近皂苷生成的酶,在干旱胁迫下其活性上调最明显,4种酶的活性呈显著正相关,说明上游酶類影响着下游酶类的表达,呈现逐级递增的趋势,积累到一定程度,就会表现为柴胡皂苷含量的增加。相关性分析也表明,4种酶的表达与柴胡皂苷的含量呈极显著的正相关。由此可知,适度的干旱胁迫能够促进柴胡皂苷合成途径关键酶的表达,进而影响柴胡皂苷的积累。
参考文献:
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:280.
[2] 张争,杨云,魏建和,等.环境因子导致的植物防御反应与药用次生代谢物的合成和积累[J].植物生理学通讯,2009,45(9):919-924.
[3] RAMAKRISHNA A, RAVISHANKAR G A. Influence of abiotic stress signals on secondary metabolites in plants[J]. Plant Signal Behav,2011,6(11):1720-1731.
[4] 张宇,周自云,夏鹏国,等.干旱胁迫对柴胡中皂苷合成关键酶基因表达及皂苷含量的影响[J].中国中药杂志,2016,41(4):643-647.
[5] ASHOUR M L, WINK M. Genus Bupleurum:a review of its phytochemistry, pharmacology and modes of action[J]. J Pharm Pharmacol,2011,63(3):305-321.
[6] LIN T Y, CHIOU C Y, CHIOU S J. Putative genes involved in saikosaponin biosynthesis in Bupleurum species[J]. Int J Mol Sci, 2013,14(6):12806-12826.
[7] 董乐萌.北柴胡柴胡皂苷合成相关基因的分子克隆与组织表达分析[M].北京:北京林业大学,2008.
[8] 黄璐琦,郭兰萍.环境胁迫下次生代谢产物的积累及道地药材的形成[J].中国中药杂志,2007,32(4):277-280.
[9] LAW B Y, MO J F, WONG V K. Autophagic effects of Chaihu (dried roots of Bupleurum Chinense DC or Bupleurum scorzoneraefolium WILD)[J]. Chin Med,2014,9:21.
[10] NEVES S S, WATSON M F. Phylogenetic relationships in Bupleurum (apiaceae) based on nuclear ribosomal DNA its sequence data[J]. Ann Bot,2004,93(4):379-398.
[11] 周琳,遲莹,张丽华,等.柴胡与4种伪品的DNA指纹研究[J].北华大学学报:自然科学版,2013,14(1):46-49.
[12] 迟莹,周琳,张丽华,等.柴胡及其常见伪品的DNA指纹鉴定[J].中国实验方剂学杂志,2013,19(15):143-146.
[13] 于俊林,赵莎,任明波,等.基于ITS2条形码鉴定柴胡与大叶柴胡[J].中国中药杂志,2014,39(12):2160-2163.
[14] 袁伯川,马永生,杨瑞,等.北柴胡与银州柴胡的ITS条形码鉴定研究[J].生物技术通讯,2016,27(1):101-105.
[15] 韩晓伟,严玉平,吴兰芳,等.柴胡及其伪品的DNA条形码鉴定研究[J].中草药,2016,47(9):1583-1588.
[16] 翟树林,李元富,李华斌,等.北柴胡人工栽培技术[J].安徽农业科学, 2016,44(3):151-152.
