探讨高低场强多参数MRI对PI-RADS(第2版)定性诊断前列腺临床显著癌的价值
2017-05-11赵承琳高歌李飞宇方冬王鹤王霄英
赵承琳, 高歌, 李飞宇, 方冬, 王鹤, 王霄英
·腹部影像学·
探讨高低场强多参数MRI对PI-RADS(第2版)定性诊断前列腺临床显著癌的价值
赵承琳, 高歌, 李飞宇, 方冬, 王鹤, 王霄英
目的:对比1.5T和3.0T多参数MRI(mpMRI)结合前列腺影像报告和数据系统(PI-RADS v2)对临床显著前列腺癌的诊断准确性。方法:从2010年12月至2013年12月行前列腺mpMRI检查的患者中,筛选出以定性诊断前列腺癌为目的、且在检查后3个月内取得经直肠超声引导下活检病理结果的447例患者纳入分析,年龄(68.7±9.0)岁,PSA(15.4±14) ng/mL。其中75例使用1.5T MR仪,372例使用3.0T MR仪。检查序列包括常规T2WI、DWI(b=0、800 s/mm2)和动态增强扫描。以病理结果作为金标准,Gleason评分≥7认为是临床显著癌。由两位放射科医师对入组病例使用PI-RADS v2进行独立阅片分析,将1.5和3.0T mpMRI的诊断结果进行诊断效能分析和一致性检验。结果:447例中经病理证实的临床显著前列腺癌195例(43.6%)。1.5T和3.0T两组的受试者工作特征(ROC)曲线下面积(AUC)分别为0.94和0.89,诊断敏感度分别为95.0%和85.8%,特异度分别为91.4%和80.7%,阳性预测值为92.7%和76.1%,阴性预测值为94.1%和88.8%;两组间诊断准确性的差异无统计学意义(P>0.05)。结论:不同场强多参数MRI对PI-RADS v2定性诊断前列腺临床显著癌的影响不显著。
多参数磁共振成像; 场强; 前列腺癌; 前列腺影像报告和数据系统; 诊断效能
前列腺癌是全球范围内男性中发病率居第二位的恶性肿瘤,由于东西方人群在种族、地域及饮食结构等方面的差异性,中国人群中前列腺癌的发病率和死亡率较欧美人群稍低,但近期文献报道显示其发病率和死亡率在中国男性群体中也呈上升趋势[1-2]。前列腺特异性抗原(prostate specific antigen,PSA)是目前最常用的检测和筛查前列腺癌的临床生化指标[3]。然而仅依靠PSA对前列腺疾病进行危险性评估和诊断会增加患者过度穿刺的风险,需结合其它的风险因素来帮助临床医师对患者进行前列腺癌危险性分层[4-6],如直肠指诊(digital rectal examination,DRE)、经直肠超声(transrectal ultrasound,TRUS)和MRI等,以提高临床诊断准确性、减少不必要的活检[5-11]。
多参数MRI(multiparametric MRI,mpMRI)不仅有助于前列腺癌的术前分期,还可进行术后监测,尤其是对高级别前列腺癌患者[12-16]。然而,由于国内外对前列腺疾病的mpMRI研究中使用的设备、扫描方案及诊断流程等存在一定差异,为了规范前列腺MRI检查及诊断流程,进一步提高诊断的准确性和一致性,欧洲泌尿生殖放射学会(European Society of Urogenital Radiology,ESUR)于2012年以专家共识的形式提出了前列腺影像报告和数据系统(Prostate Imaging Reporting and Data System,PI-RADS)[17],并基于大量临床病例的验证及实际临床工作中应用研究的反馈,于2014年12月发布了第二版(v2)PI-RADS[18],新版本的PI-RADS对前列腺临床显著癌(clinically significant prostate cancer,CSPCa)进行了定义。目前,对前列腺癌mpMRI中各成像要素的研究仍然较少,尤其是不同磁场强度是否会影响MRI对前列腺癌的检出能力尚有待研究,而经过优化的PI-RADS v2的诊断效能仍需要大量临床病例来进行验证。本研究通过回顾性分析,评价1.5T和3.0T mpMRI结合PI-RADS v2对前列腺临床显著癌的诊断效能。
材料与方法
1.病例材料
回顾性分析2010年11月-2013年12月因临床疑诊前列腺癌(PSA升高、DRE或TRUS发现结节等)而在本院行mpMRI的620例连续患者的病例资料。纳入标准:①有完整的mpMRI数据,包括T2WI、DWI和动态对比增强(dynamic contrast-enhanced,DCE)序列;②mpMRI检查后3个月内行超声引导下穿刺活检且病理结果完整。排除标准:①mpMRI检查前3个月内接受过前列腺穿刺检查;②既往有前列腺癌病史或初次MRI检查诊断为前列腺肉瘤;③检查前接受过内分泌、粒子植入、放疗或手术治疗。最终447例患者纳入本研究,平均年龄(68.7±9.0)岁,PSA(15.4±14.0) ng/mL。根据所使用的MR仪的磁场场强将患者分为1.5T组(1.5T)和3.0T组(372例)。1.5T组的平均年龄(69.7±8.0)岁,PSA (17.3±16.8) ng/mL;3.0T组平均年龄(68.5±9.2)岁,PSA(15.0±13.3) ng/mL。两组间患者的年龄及PSA的差异均无统计学意义(P>0.05)。本研究经医院伦理委员会审查同意。
将超声引导下前列腺系统穿刺活检的病理结果作为金标准进行对照。系统活检按照六分区法或五区13针法,部分患者加做病灶局部活检。由泌尿病理研究室医师对送检组织进行病理诊断及组织学分级,采用Gleason 5级10分制。Gleason评分≥7分者(包括3+4分,即包括次要生长方式为4分者)被认为是临床显著癌。
2.MRI扫描技术
患者检查前1天进食少渣饮食并口服缓泻剂(番泻叶5g)。使用GE Signa TwinSpeed 1.5T、Signa HD 3.0T、Discovery MR750 3.0T或Phillip Achivea 3.0T磁共振扫描仪和腹部相控阵线圈。患者取仰卧位,线圈外面用绑带固定以减少呼吸运动对图像的影响。mpMRI序列和扫描参数见表1。动态增强扫描对比剂为钆喷酸葡胺,剂量0.1 mmol/kg,注射流率2 mL/s,共扫描15个时相。
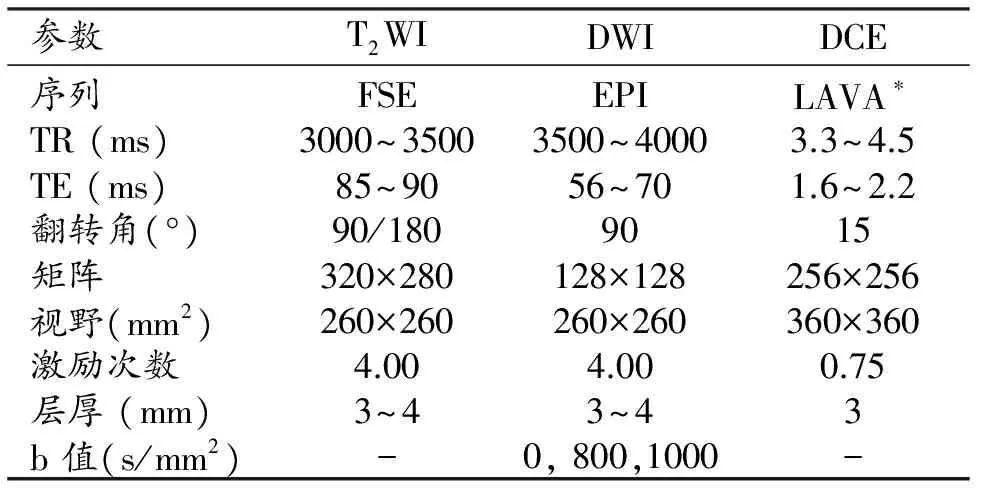
表1 mpMRI 扫描参数
注:*LAVA为肝脏容积加速采集序列(liver acquisition with volume acceleration)。
3.MRI诊断
对两位放射科医师(A和B)进行PI-RADS v2的阅片培训,培训完成后使用PI-RADS v2进行独立阅片,如果阅片结果存在差异,通过讨论达成一致意见。对前列腺病变采用5级评分制[18]。1分:肯定良性;2分:良性可能大;3分:良恶性无法鉴别;4分:恶性可能大;5分:肯定恶性。
4.统计学分析
使用SPSS 18.0和Medcalc 12.7.0.统计分析软件包。分别将1.5T和3.0T组的诊断结果进行诊断效能分析并绘制受试者工作特性(receiver operator characteristic,ROC)曲线,用约登指数得到最佳截断值,并计算最佳截断值条件下的ROC曲线下面积(area under curve,AUC),以及诊断的敏感度、特异度、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)。比较1.5T组和3.0T组应用PI-RADS评分系统诊断前列腺临床显著癌的诊断效能。P<0.05为具有统计学意义。
结 果
1.5T组中44例(58.7%)为前列腺癌,其中40例(53.3%)为临床显著癌;3.0T组中185例(49.7%)为前列腺癌,其中155例(41.7%)为临床显著癌。1.5T组和3.0T组基于PI-RADS v2的MRI诊断结果见表2。
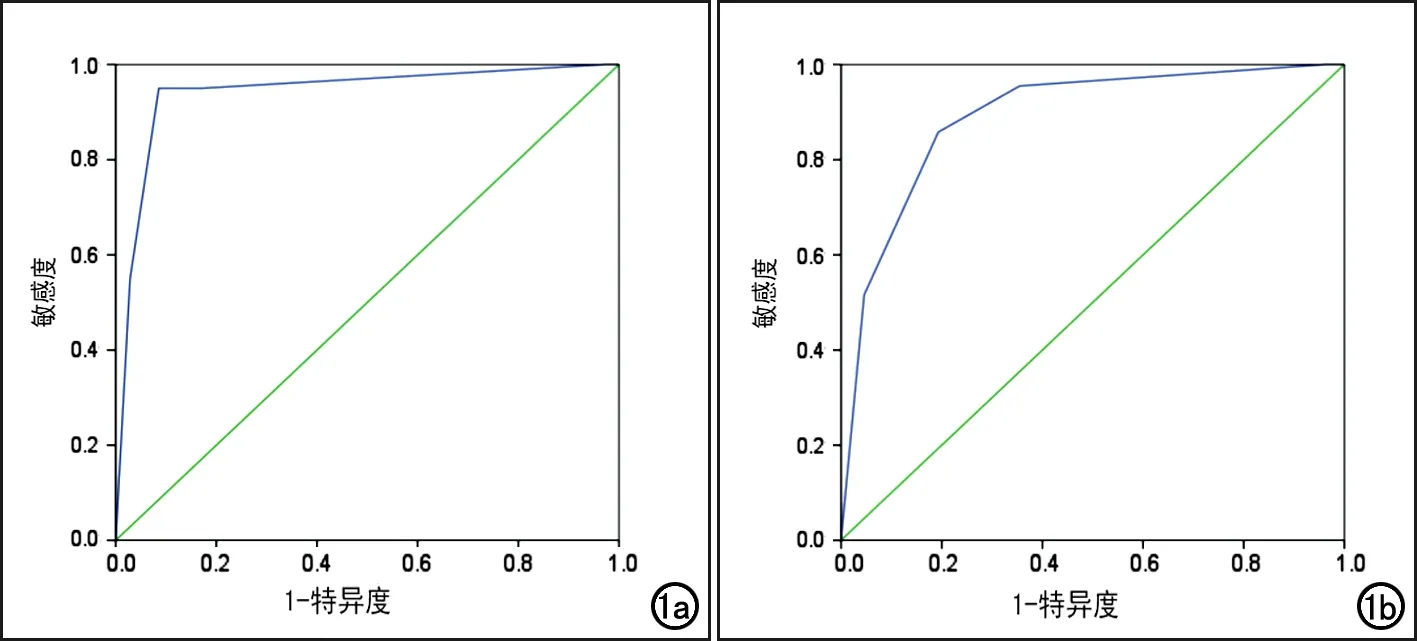
图1 两组基于PI-RADS v2的mpMRI诊断前列腺临床显著癌的ROC曲线。a)1.5T组;b)3.0T组。
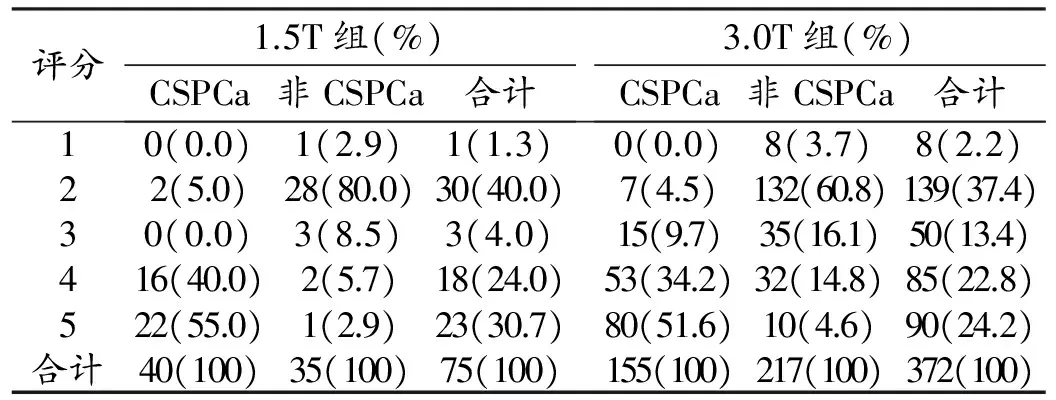
评分1.5T组(%)CSPCa非CSPCa合计3.0T组(%)CSPCa非CSPCa合计10(0.0)1(2.9)1(1.3)0(0.0)8(3.7)8(2.2)22(5.0)28(80.0)30(40.0)7(4.5)132(60.8)139(37.4)30(0.0)3(8.5)3(4.0)15(9.7)35(16.1)50(13.4)416(40.0)2(5.7)18(24.0)53(34.2)32(14.8)85(22.8)522(55.0)1(2.9)23(30.7)80(51.6)10(4.6)90(24.2)合计40(100)35(100)75(100)155(100)217(100)372(100)
注:括号内为构成比。
1.5T组和3.0T组中基于PI-RADS v2的mp MRI诊断前列腺临床显著癌的ROC曲线见图1,其它诊断效能指标值见表3。非参数检验(Mann-Whitney U检验)结果显示,两组的诊断符合率的差异无统计学意义(Z=-0.464,P=0.643>0.05)。
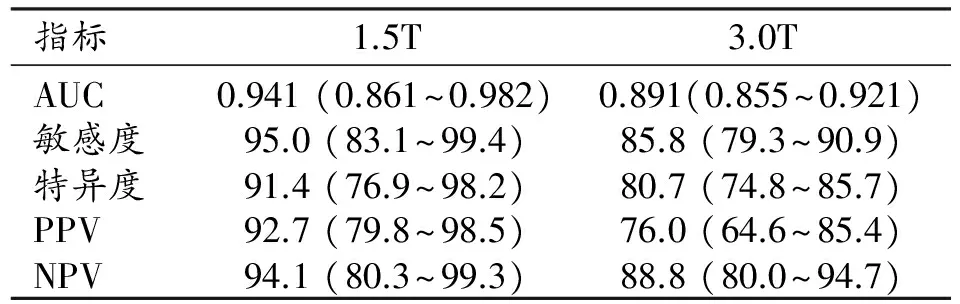
表3 两组的诊断效能指标值 (%)
注:括号内为95%可信区间。
讨 论
前列腺癌影像学检查的首要任务是病灶的检出和定位,对前列腺癌灶进行精准定位不仅可以增加活检的敏感度,更有助于帮助患者选择治疗计划及后续的主动监测,同时也能协助泌外科医师制定手术方案,争取在切除癌灶的同时尽可能的保留正常前列腺组织[19]。mpMRI在前列腺癌的检出及定位方面的能力得到了普遍认可[20-21]。越来越多的证据表明,mpMRI对前列腺癌的检出及定位与穿刺活检或前列腺癌根治术后病理检查结果(病灶位置及组织学特征如格里森评分、体积和结构等)间存在显著相关性[20]。
从理论角度分析,场强的增加与静电场(B0)的信号强度呈线性相关,在不影响图像噪声的情况下,场强越大,信号强度越强,故随着B0场强由1.5T提高到3.0T,图像的信噪比(signal-to-noise ratio,SNR),也会相应提高,3.0T成像仪还能够提高成像的空间分辨率和/或时间分辨率。因此,从理论上来讲,若要获得与1.5T同样的图像质量,3.0T可以实现更大的空间分辨率和/或更短的扫描时间,并能够在有限时间范围内获得更多的形态学、灌注和功能代谢方面的数据。
然而,实际上3.0T MRI的图像质量还受到其它因素的影响,如化学位移效应、RF磁场(B1)的不均匀性及磁敏感性增强等,因此需要选取合适的脉冲序列及扫描参数来保证图像质量。因为,化学位移伪影和磁敏感伪影会随着B0场的提高而增加,从而导致水-脂界面化学位移伪影的增加和局部信号的损失,通常需要增加接收带宽来避免化学位移的影响,然而增加带宽确实能够校正化学位移伪影、加快数据采集速度,但是也会在降低最短回波时间的同时增加图像噪声、降低SNR[22]。 PI-RADS委员会认为,扫描参数经过调整和优化后,1.5T和3.0T均能够提供满足临床诊断要求的图像,但大多数成员仍认为3.0T MR仪的扫描优势更大[18]。
本研究并未采用直肠内线圈。有文献报道,不论何等磁场强度,当采用直肠内线圈时,MRI的信噪比要优于体外相控阵线圈所提供的前列腺MRI图像[23]。而Bratan等[24]认为磁场强度及线圈的选择对于肿瘤的检测和评价作用并不显著。而部分老的1.5T MR设备若想获取高分辨率前列腺图像或者需要对前列腺病变进行影像学分期,则直肠内线圈(endorectal coil,ERC)被认为是不可或缺的重要条件。虽然目前尚缺少关于ERC和体外相控阵线圈在肿瘤的检测及分期方面的对照研究,但目前临床上多认为采用体外相控阵线圈的3.0T MR设备所获得的图像质量与应用了ERC的1.5T MR仪所获得的图像质量相当[25]。
本研究中1.5T和3.0T两组之间对诊断前列腺临床显著癌统计学差异不显著,ROC曲线下面积分别为0.941和0.891(P>0.05)。1.5T和3.0T两组诊断前列腺临床显著癌的敏感度为95.0%和85.8%,特异度为91.4%和80.7%,阳性预测值为92.7%和76.1%,阴性预测值为94.1%和88.8%,可见1.5T和3.0T mpMRI结合PI-RADS v2对诊断前列腺临床显著癌的诊断能力均较高。这与Junker等应用3.0T mpMRI结合PI-RADS的研究结果一致,对于外周带的病灶,T2WI、DWI、DCE的ROC曲线下面积>0.900;对于移行带病灶,T2WI及DWI的AUC>0.900,mpMRI对前列腺临床显著癌的诊断准确性较高[18]。
基于以上多种因素的考虑,尽管1.5T和3.0T对mpMRI结合PI-RADS v2 诊断前列腺临床显著癌方面的影响并不显著,但从临床应用角度来看,3.0T MRI设备进行扫描的优势更明显。
研究的不足之处:首先,本研究为单中心研究,多中心大样本量的研究势在必行。其次,本研究中采用的病理对照为穿刺活检的病理结果,缺少最后手术病理大切片的结果,这也许会对研究结果造成一定的偏倚。高低场强mpMRI对PI-RADS v2定性诊断前列腺临床显著癌的影响不显著。
[1] Zhu Y,Han CT,Chen HT,et al.Influence of age on predictiveness of genetic risk score for prostate cancer in a Chinese hospital-based biopsy cohort[J].Oncotarget,2015,6(26):22978-22984.
[2] Choi EP,Wong CK,Tsu JH,et al.Health-related quality of life of Chinese patients with prostate cancer in comparison to general population and other cancer populations[J].2016,24(4):1849-1856.
[3] Elshafei A,Chevli KK,Moussa AS,et al.PCA3-based nomogram for predicting prostate cancer and high grade cancer on initial transrectal guided biopsy[J].Prostate,2015,75(16):1951-1957.
[4] Ahn JH,Lee JZ,Chung MK,et al.Nomogram for prediction of prostate cancer with serum prostate specific antigen less than 10ng/Ml[J].J Korean Med Sci,2014,29(3):338-342.
[5] Lughezzani G,Lazzeri M,Haese A,et al.Multicenter European external validation of a prostate health index-based nomogram for predicting prostate cancer at extended biopsy[J].Eur Urol,2014,66(5):906-912.
[6] Wang JY,Zhu Y,Wang CF,et al.A nomogram to predict Gleason sum upgrading of clinically diagnosed localized prostate cancer among Chinese patients[J].Chin J Cancer,2014,33(5):241-248.
[7] DiBlasio CJ,Derweesh IH,Maddox MM,et al.Nomogram to predict prostate cancer diagnosis on primary transrectal ultrasound-guided prostate biopsy in a contemporary series[J].Curr Urol,2013,6(3):141-145.
[8] Eifler JB,Feng Z,Lin BM,et al.An updated prostate cancer sta-ging nomogram (Partin tables) based on cases from 2006 to 2011[J].BJU Intern,2013,111(1):22-29.
[9] Iremashvili V,Burdick-Will J,Soloway MS.Improving risk stratification in patients with prostate cancer managed by active surveillance:a nomogram predicting the risk of biopsy progression[J].BJU Intern,2013,112(1):39-44.
[10] Payton S.Prostate cancer:new nomogram predicts risk of Gleason upgrading[J].Nat Rev Urol,2013,10(10):553-559.
[11] Teo JK,Poh BK,Ng FC,et al.Detection rate of prostate cancer on the basis of the vienna nomogram:a singapore study[J].Kor J Urol,2014,55(4):245-248.
[12] Grey AD,Chana MS,Popert R,et al.Diagnostic accuracy of magnetic resonance imaging (MRI) prostate imaging reporting and data system (PI-RADS) scoring in a transperineal prostate biopsy setting[J].BJU Intern,2015,115(5):728-735.
[13] Hamoen EH,de Rooij M,Witjes JA,et al.Use of the Prostate Imaging Reporting and Data System (PI-RADS) for prostate cancer detection with multiparametric magnetic resonance imaging:a diagnostic Meta-analysis[J].Eur Urol,2015,67(6):1112-1121.
[14] Tewes S,Hueper K,Hartung D,et al.Targeted MRI/TRUS fusion-guided biopsy in men with previous prostate biopsies using a novel registration software and multiparametric MRI PI-RADS scores:first results[J].World J Urol,2015,33(11):1707-1714.
[15] Reisaeter LA,Futterer JJ,Halvorsen OJ,et al.1.5T multiparametric MRI using PI-RADS:a region by region analysis to localize the index-tumor of prostate cancer in patients undergoing prostatectomy[J].Acta Radiol,2015,56(4):500-511.
[16] Yacoub JH,Oto A,Miller FH.MR imaging of the prostate[J].Radiol Clin Nor Am,2014,52(4):811-837.
[17] Barentsz JO,Richenberg J,Clements R,et al.ESUR prostate MR guidelines 2012[J].Eur Radiol,2012,22(4):746-757.
[18] Junker D,Quentin M,Nagele U,et al.Evaluation of the PI-RADS scoring system for mpMRI of the prostate:a whole-mount step-section analysis[J].World J Urol,2015,33(7):1023-1030.
[19] Sciarra A,Barentsz J,Bjartell A,et al.Advances in magnetic resonance imaging:how they are changing the management of prostate cancer[J].Eur Urol,2011,59(6):962-977.
[20] Isebaert S,Van den Bergh L,Haustermans K,et al.Multiparametric MRI for prostate cancer localization in correlation to whole-mount histopathology[J].JMRI,2013,37(6):1392-1401.
[21] Rouviere O,Papillard M,Girouin N,et al.Is it possible to model the risk of malignancy of focal abnormalities found at prostate multiparametric MRI[J].Eur Radiol,2012,22(5):1149-1157.
[22] 邹利光,王文献.3.0T磁共振成像的特点和技术对策[J].重庆医学,2010,39(7):875-877.
[23] Bloch BN,Rofsky NM,Baroni RH,et al.3 Tesla magnetic resonance imaging of the prostate with combined pelvic phased-array and endorectal coils: initial experience[J].Acad Radiol,2004,11(8):863-867.
[24] Bratan F,Niaf E,Melodelima C,et al.Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI:a prospective study[J].Eur Radiol,2013,23(7):2019-2029.
[25] Turkbey B,Merino MJ,Gallardo EC,et al.Comparison of endorectal coil and nonendorectal coil T2W and diffusion-weighted MRI at 3 Tesla for localizing prostate cancer:correlation with whole-mount histopathology[J].JMRI,2014,39(6):1443-1448.
The value of multiparametric MRI examination using 1.5T and 3.0T with PI-RADS (version 2) in the qualitative diagnosis of clinically significant prostate cancer
ZHAO Cheng-lin,GAO Ge,LI Fei-yu,et al.
Department of Radiology,Peking University First Hospital,Beijing 100034,China
Objective:To compare the diagnostic accuracy of multiparametric MRI (mpMRI) using 1.5T and 3.0T scanner with Prostate Imaging Reporting and Data System (PI-RADS version 2) for clinically significant prostate cancer (CSPCa).Methods:447 consecutive patients [mean age:(68.7±9.0)y;PSA: (15.4±14.0) ng/mL] with suspected CSPCa who underwent transrectal ultrasound guided biopsy from December 2010 to December 2013 within 3 months after mpMRI examination were included in this study.Conventional T2WI,diffusion weighted imaging (b=0,800s/mm2) and dynamic contrast-enhanced MRI were performed at 1.5T (n=75) or 3.0T (n=372) scanner.The pathological results were considered as the golden standard,and the CSPCa was defined as Gleason score≥7.The mpMRI data were evaluated by two radiologists using PI-RADS version 2,and the diagnostic efficacy in 1.5T and 3.0T group were analyzed and compared.Results:There were 195 out of 447 (43.6%) CSPCa patients confirmed by pathology results.Receiver-operation characteristic curve (ROC) analysis showed that the area under curve (AUC) in 1.5T and 3.0T group was 0.94 and 0.89,diagnostic sensitivity was 95.0% and 85.8%,specificity was 91.4% and 80.7%,positive predictive value (PPV) was 92.7% and 76.1%,negative predictive value (NPV) was 94.1% and 88.8%,respectively.There was no significant difference of diagnostic accuracy between the two groups (P>0.05).Conclusion:Both 1.5T and 3.0T mpMRI using PI-RADS version 2 perform well for detecting clinically significant prostate cancer.
Multiparametric magnetic resonance imaging; Tesla: Prostate cancer; Prostate imaging and reporting archiving data system; Diagnostic efficacy
100034 北京,北京大学第一医院医学影像科(赵承琳、高歌、李飞宇、王鹤、王霄英),泌尿外科(方冬)
赵承琳(1985-),女,山东烟台人,博士研究生,主要从事影像诊断新技术研究工作。
王霄英,E-mail:cjr.wangxiaoying@vip.163.com
R445.2; R737.25
A
1000-0313(2017)04-0414-04
10.13609/j.cnki.1000-0313.2017.04.025
2016-07-20
2016-07-20)
