动态增强MRI在肺部结块病变中的诊断价值
2017-05-11周舒畅李志伟夏黎明王玉锦吴维
周舒畅, 李志伟, 夏黎明, 王玉锦, 吴维
·胸部影像学·
动态增强MRI在肺部结块病变中的诊断价值
周舒畅, 李志伟, 夏黎明, 王玉锦, 吴维
目的:探讨动态增强MRI在肺部结块样病变中的诊断价值。方法:66例经病理证实的肺结块样病变患者(恶性病变50例,良性病变16例)行常规MRI平扫及动态增强(DCE-MRI)检查,绘制时间-信号强度增强比曲线(TIC),并测量DCE-MRI参数:最大增强比(MER)、达峰时间(Tmax)、平均强化斜率(SLE)、最大强化斜率(SS)和廓清率。结果:本组病变的TIC分为4种类型:速升-下降型(A型)仅见于恶性肿瘤;速升-平台型和持续缓升型在良恶性结节中均可见,无明显强化型仅见于良性病变。肺鳞癌和小细胞癌的主要强化方式为环状强化,而腺癌为不均匀强化。DCE-MRI参数中,良性组Tmax明显较恶性组长(P<0.001),SLE明显小于恶性组(P=0.002)。Tmax对良恶性病变的鉴别最具价值,临界值取280s时其诊断敏感度、特异度和符合率分别为88.0%、63.5%和76.5%。结论:DCE-MRI能提供肺结节血流动力学方面的信息,对肺部良恶性肿瘤的鉴别诊断具有较高价值。
肺结节; 肺肿瘤; 磁共振成像; 动态增强扫描; 强化特征; 血流动力学; 鉴别诊断
肺部结节/肿块的良恶性分析一直是影像学诊断的重要目标,亦是难题,尽管对良恶性肺结块的术前评估最常用的无创性影像学检查方法主要是CT和FDG-PET,然而传统CT平扫和增强扫描无法提供病变血流动力学特征方面的信息,动态增强CT可以定量测量病灶的血流动力学参数,但存在电离辐射大的问题。FDG-PET对良恶性肺结节的诊断敏感度可达88%~100%[1],但对于炎性病变、结核、部分浸润性腺癌及类癌等其错判率仍较高[2-4],且它亦不能反映病变的血流动力学改变。MRI由于空间分辨率相对较低、软组织-空气界面所致的磁敏感伪影及呼吸心脏运动伪影等原因,尚未作为肺部扫描的常规方法。目前,已有学者将动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)应用于肺部结块的诊断[5],本研究通过进一步探讨肺结块的DCE-MRI表现,旨在为肺部结块提供更为精准的定性和定量诊断依据。
材料与方法
将2013年7月-2015年3月在本院住院的肺部结节及肿块(统称为结块)患者按纳入观察,所有患者均知情同意。纳入标准:①肺部结块最大横截面直径≥6 mm;②混杂密度者,钙化或空洞面积小于50%;③无MRI检查禁忌证; ④无严重器官功能不全等基础疾病,肾功能正常范围;⑤初诊患者,未接受过放化疗等治疗。符合条件的患者共66例,男52例,女14例,年龄29~76岁,平均(54.8±9.2)岁。所有患者经穿刺活检(8例)或手术病理证实(58例)。其中恶性50例(结节44例,肿块6例),良性16例(结节14例,肿块2例)。恶性结节中鳞癌11例(含4例肿块)、腺癌20例、小细胞癌8例(含2例肿块),腺鳞癌1例、大细胞癌1例、类癌2例、肉瘤样癌3例,未确定型4例(由于活检组织较少,仅确诊为恶性,无具体病理类型)。良性结节中肺结核5例、感染性病变5例(1例含肿块),骨化伴真菌感染1例,错构瘤1例,孤立性纤维性肿瘤1例,硬化性血管瘤1例,灶性出血1例,肺隔离症1例。
使用GE signa HDx 1.5T超导型磁共振扫描仪、8通道相控阵心脏线圈、呼吸门控和外周心电门控。先行常规MRI平扫。横轴面SE T1WI:TR 800 ms,TE 8 ms,层厚5.0 mm,层间距1.0 mm,视野41 cm×41 cm,矩阵320×160,扫描时间6 min。横轴面脂肪抑制FSE T2WI:呼吸触发,TR 7100~9236 ms,TE 90~110 ms,层厚5.0 mm,层间距1.0 mm,激励次数2,回波链长度18,视野41 cm×41 cm,矩阵320×224,扫描时间3.6 min。
DCE-MRI:横轴面快速容积采集序列,TR 4.2 ms,TE 2.0 ms,翻转角15°,层厚5 mm,矩阵256×160,视野35 cm×35 cm,带宽62.5kHz。扫描原则:参考平扫T1及T2图像,扫描范围覆盖病灶和纵隔,呼气末屏气扫描,单期扫描时间12~15 s。首先进行蒙片扫描,注射对比剂后15 s开始扫描,共扫描15个期相,总扫描时间约7 min。对比剂采用钆贝葡胺(Gd-BOPTA,莫迪司),标准剂量0.1 mmol/kg,注射流率2.5 mL/s,注药结束后注入生理盐水10 mL。
由两位具有7年以上MRI诊断经验的放射科医师在未知患者临床资料和病理结果的情况下独立评估图像,对每例的评估达成一致意见后作出诊断。选取结节的中心层面,为了减少呼吸运动所导致的病灶移位,在GE AW4.4工作站上手动勾画ROI,测量每个时相图像上病灶的信号强度(signal intensity,SI)。ROI覆盖60%以上实质性强化区域,避开肉眼可见的囊变、坏死、钙化及含气区。计算对比增强比(contrast enhancement ratio,CER),绘制病灶的时间-CER曲线(time-to SI CER curve,TIC)。
计算DCE-MRI参数:①最大增强比(maximum CER,MER):②达峰时间(Tmax);③平均强化斜率(slope of enhancement,SLE);④最大强化斜率(steepest slope,SS);⑤廓清率。计算公式如下:
(1)
(2)
(3)

(4)
SImax为团注对比剂后病灶的最大SI,SI0是注药之前的基线SI;SIstart、SIend分别为时间强化曲线上升段上最大线性斜率两端的SI,Tstart、Tend分别为相应的时间点;SIend为扫描终末时间点的病灶SI。
所有数据采用SPSS 16.0统计软件进行分析。分别比较良恶性组和良恶性亚组的MER、Tmax、SLE、SS和廓清率。两组间参数的比较,符合正态分布且方差齐性者采用独立样本t检验,不符合正态分布且方差不齐者,采用Mann-Whityney U 检验;对于多组间参数的比较,符合正态分布且方差齐性者,采用单因素方差分析,不符合正态分布且方差不齐者,采用Kruskal-Wallis检验。P<0.05为差异有统计学意义。对上述参数进行受试者工作特征(ROC)曲线分析,各参数有鉴别诊断意义者,计算ROC曲线下面积,并分别计算诊断敏感度、特异度、符合率以及阳性和阴性预测值。
结 果
1.MRI平扫特征
66例肺部病灶的直径7~42 mm,平均(3.86±1.25)cm。1例确诊为灶性出血的肺结节在MRI平扫上表现为短T1长T2信号,2例确诊为结核的结节在MRI平扫上表现为长T1短T2信号,其余病灶在MRI平扫上均表现为长T1长T2信号(图1a、b)。
2.不同肺部病变的动态增强模式
66例患者的病灶增强模式可分为4型:①均匀强化;②不均匀强化,结节增强后可见分布无规则的无强化或低强化区;③周边强化:强化主要或仅位于病灶的外周区域,又称环状强化,包括薄环状强化或网格状强化;④无强化。
11例鳞癌中,7例(63.6%)呈环状/网格状强化,1例为肿瘤实体(结节)均匀强化,2例为厚壁空洞均匀强化伴中心空洞形成,1例为周围环状强化、中心不均匀强化。20例腺癌中,15例(75%)呈不均匀强化(图1c),3例均匀强化,2例环状强化。8例小细胞癌中,4例呈环状强化,3例不均匀强化,1例(结节)均匀强化。2例类癌均呈实体均匀强化,3例肉瘤样癌均呈环状强化,大细胞癌呈不均匀强化,腺鳞癌呈均匀强化。

图1 右肺中叶中分化腺癌。a) SE-T1WI,示右肺中叶分叶状肿块(箭),信号欠均匀; b) T2WI示病灶呈不均匀稍高信号; c) 动态增强扫描图像,示病灶呈不均匀早期强化; d) TIC呈A型; e) 病理切片镜下示大量异形性的瘤细胞呈腺样排列(×100,HE)。
16例良性结节中,4例结核中可见环状强化2例,不均匀强化1例,不强化1例;炎性病变6例,均呈均匀强化;其它良性结节中1例孤立性纤维性肿瘤呈环状强化,1例硬化性血管瘤呈周边环状强化、中心不均匀强化,1例错构瘤呈环状强化,1例肺隔离症和1例灶性出血无明显强化。由此可见鳞癌和小细胞癌的主要强化方式为环状强化,而腺癌主要为不均匀强化。
3.TIC类型
分析全部病例的TIC,除有1例原位鳞癌者由于病灶小,且强化后与左侧肺门血管分辨欠清,测量强化曲线不准确,排除此病例,其余65个病例均可获得良好的时间-CER曲线,分为4型(图2)。①速升-下降型(A型):早期迅速强化,最大强化处曲线形态呈“山峰状”,随后明显或缓慢廓清(图1d)。本研究中恶性组中A型曲线21例,其中腺癌(图1d、e)10例、鳞癌3例、小细胞癌4例、类癌2例、未知类型肿瘤2例,良性组内未见A型曲线。②速升-平台型(B型):早期快速强化,随后呈钝圆形曲线到达最大强化峰值,此后进入平台期或可见轻微廓清。本研究中恶性组内B型曲线24例,其中腺癌10例、鳞癌6例、小细胞癌3例、肉瘤样癌3例、大细胞癌1例和腺鳞癌1例;良性组中B型曲线11例,包括炎性病变5例、结核3例、硬化性血管瘤1例、孤立性纤维性肿瘤1例和错构瘤1例。③持续缓升型(C型):曲线呈连续缓慢上升趋势。恶性组中可见C型曲线4例,分别为鳞癌1例、小细胞癌1例、未知病理类型肿瘤2例;良性组中可见C型曲线2例,包括真菌感染并骨化1例、结核1例。④无明显强化型(D型):病灶无明显强化,曲线基本位于基线水平,强化幅度<10%。D型曲线仅见于良性组,包括灶性出血1例、肺隔离症1例和结核1例。
4.DCE-MRI参数的比较
五个参数的测量结果及比较见表1、2。良恶性病变间仅Tmax和SLE值的差异有统计学意义(P<0.01)。
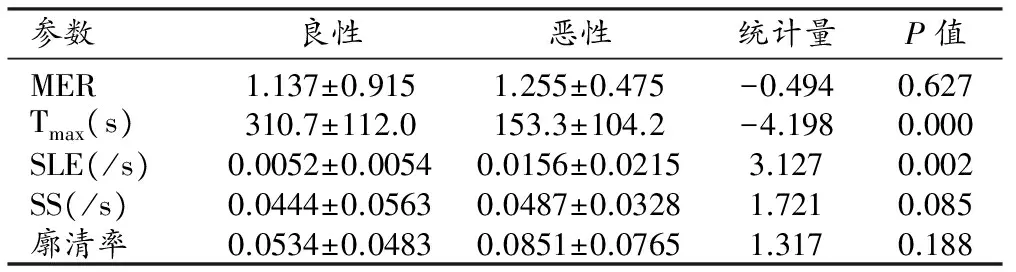
表1 良恶性病变组的DCE-MRI参数值
将所有患者分为炎性病变、其它良性病变和恶性病变三组进行分析,结果显示三组间MER、Tmax、SLE和SS的差异均有统计学意义(P<0.01),仅廓清率的差异无统计学意义(P=0.375)。
三组间进一步两两对比:MER值的差异均有统计学意义(P=0.000);对比分析恶性病变各亚组(鳞癌、腺癌、小细胞癌、其它恶性肿瘤)和良性各亚组(炎性、其它良性)之间的MER值,炎性病变组MER值均明显大于恶性各亚组和其它良性病变(P<0.01),而各恶性亚组间的差异无统计学意义(P>0.05)。恶性组Tmax值明显小于其它良性病变组(P<0.001),但在炎性组和其它良性病变组间差异无统计学意义(P=1.000)。恶性组SLE大于其它良性病变组(P<0.001),但炎性组与恶性组间、炎性组与其它良性组间的差异无统计学意义(P>0.05)。炎性病变和恶性组的SS值均大于其它良性病变组(P<0.01),但炎性组与恶性组间差异无统计学意义(P=0.485)。
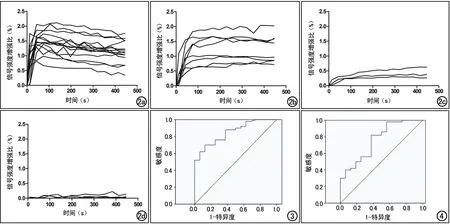
图2 四个类型的TIC。a) A型曲线,有锐利的强化峰,随即廓清; b) B型曲线,可见钝圆形强化峰,随后呈平台改变或轻微廓清; c) C型曲线,呈持续缓慢上升曲线; d) D型曲线,表现为无强化或弱强化,强化幅度<10%。 图3 Tmax鉴别良恶性病变的ROC曲线。 图4 SLE鉴别良恶性病变的ROC曲线。
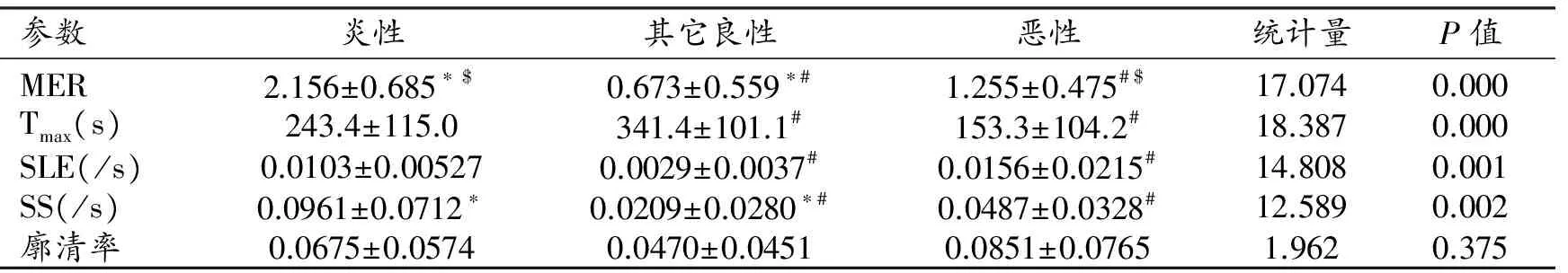
参数炎性其它良性恶性统计量P值MER2.156±0.685∗$0.673±0.559∗#1.255±0.475#$17.0740.000Tmax(s)243.4±115.0341.4±101.1#153.3±104.2#18.3870.000SLE(/s)0.0103±0.005270.0029±0.0037#0.0156±0.0215#14.8080.001SS(/s)0.0961±0.0712∗0.0209±0.0280∗#0.0487±0.0328#12.5890.002廓清率0.0675±0.05740.0470±0.04510.0851±0.07651.9620.375
注:*、#、$表示两组间的差异有统计学意义。
4.ROC曲线分析
对良恶性组之间差异有统计学意义的参数(Tmax和SLE)进行ROC曲线分析:Tmax的ROC曲线下面积为0.851(图3),Tmax临界值取280s时,诊断的敏感度、特异度和符合率分别为88.0%、63.5%和76.5%;SLE的ROC曲线下面积为0.761(图4),SLE临界值取0.00408/s时,其诊断的敏感度、特异度和符合率分别为82.0%、63.5%和78.6%。
对炎性组与恶性组之间差异有统计学意义的MER进行ROC曲线分析,得出ROC曲线下面积为0.892,取临界值1.751时,诊断的敏感度、特异度和符合率分别为88.0%、80.0%和82.6%。
讨 论
1.肺结节的时间-信号增强比曲线分布
不同病变由于病理生理基础不同,其血流动力学差异可使对比剂随时间变化的趋势有所不同。DCE-MRI最简单和最常用的方法是评价不同时间点病变内对比剂浓度的变化,获得时间-信号强度(TIC)曲线,此曲线分为两段,前段反映肿瘤血管生成,后段反映了肿瘤间质成分的信息[6]。在TIC曲线上信号强度的最初变化则反应了对比剂的首过转运过程,被认为主要与组织灌注(单位组织血流量)、可供对比剂聚集的细胞外间隙增加和血管通透性增加相关。此外,T1加权上MRI信号增强程度尚和一系列生理和物理因素相关,如组织本身的T1弛豫率,对比剂剂量(包括其蛋白结合方式),成像序列,成像参数,和其他机械相关因素等[10]。
本研究中,可将时间-信号增强比曲线分为A、B、C、D四种类型,A型仅见于恶性肿瘤中,B型在良恶性病变中均可见(68.6%为恶性,31.4%为良性),C型主要见于良性病变及部分的恶性病变,而D型仅见于良性病变(灶性出血、肺隔离症、结核),这一结果与文献报道基本符合[7-9]。通过观察时间-信号增强比曲线的形态,可更直观地对结节的性质进行预判,在临床工作中具有更快捷高效的诊断意义。
2.肺部结节的DCE-MRI参数比较
Fujimoto等[11]对DCE-MRI强化参数与肺肿瘤的相关性进行了研究,认为时间-信号增强比曲线上升阶段的参数(MER、SLE)与肿瘤新生血管生成(微血管密度)相关,而曲线下降阶段的参数(廓清率)则与肿瘤间质成分(弹性纤维和胶原蛋白的程度)相关。而活动性炎性病变主要有三种病理改变:①血管口径增大导致局部血流增加;②结构异常的新生微血管导致血浆蛋白和白细胞渗出;③白细胞从微循环中迁移至炎症局部。这些过程导致炎症活动期局部血流量及血管通透性增加。虽然恶性肿瘤和炎性病变的基本生物学机制不同,但两者在药代动力学和病理学上有一定相似之处,表现为局部血流灌注增加、毛细血管通透性增加,因此两者均可观察到增强后对比剂的快速聚集。
在本研究中,当不单独排除炎性病变,仅将病例分为良性组(含炎性病变)和恶性组时,仅发现Tmax和SLE两个指标具有鉴别诊断意义,恶性组的Tmax值明显短于良性组,而SLE则明显较良性组大,表明相对于良性病变,恶性病变的强化更为快速且单位时间内强化幅度更大。这个结果与部分学者的研究结果一致[12]。当Tmax临界值取280s时,其诊断敏感度、特异度和符合度为88.0%、63.5%和76.5%。当SLE临界值取0.00408/s时,其诊断敏感度、特异度和符合率分别为82%,63.5%和78.6%。而我们将病例分为炎性病变、其他良性病变和恶性肿瘤三组时, 曲线上升阶段的4个相关指标(MER、Tmax、SLE和SS)在炎性病变和恶性肿瘤中均明显高于其它良性病变,表明与其它良性病变相比,炎性病变和恶性肿瘤具有更大的强化幅度、更快的强化时间和更大的强化斜率。而炎性病变与恶性肿瘤相比,SLE和SS无明显差异,但炎性病变的MER值明显高于恶性肿瘤,表明炎性病变的最大强化幅度比恶性肿瘤更高,提示炎性病变在良性病变中为一混杂因素,与恶性肿瘤之间的DCE-MRI表现具有部分交叉,与前述药代动力学理论基础及部分研究结果相符[13]。且对于炎性病变和恶性肿瘤来说,MER最具有鉴别诊断意义,取临界值1.751时,其诊断的敏感度、特异读和符合率分别为88.0%、80.0%和82.6%。
综上所述,时间-信号增强比曲线与DCE-MRI各强化参数结合,对诊断肺部良恶性结节、炎性病变与恶性肿瘤具的鉴别具有较高的诊断价值,且能提供更多肺结节的血供、灌注及血流动力学方面的信息。
[1] Madsen PH,Holdgaard PC,Christensen JB,et al.Clinical utility of18F-FDG PET-CT in the initial evaluation of lung cancer[J].Eur J Nucl Med Mol Imaging,2016,43(11):2084-2097.
[2] Goldsmith S,Kostakoglu L.Nuclear medicine imaging of lung cancer[J].Radiol Clin North Am,2000,38(3):511-524.
[3] Goo JM,Im JG,Do KH,et al.Pulmonary tuberculoma evaluated by means of FDG PET:findings in 10 cases[J].Radiology,2000,216(1):117-121.
[4] Cheran SK,Nielsen ND,Patz EF.False-negative findings for primary lung tumors on FDG positron emission tomography:staging and prognostic implications[J].AJR,2004,182(5):1129-1132.
[5] 马晓玲,周舒畅,艾涛,等.动态增强磁共振在肺孤立性结节灶中的定量化研究[J].放射学实践,2014,29(10):1158-1162.
[6] Broncano J,Luna A,Sanchez-Gonzalez J,et al.Functional MR imaging in chest malignancies[J].Magn Reson Imaging Clin N Am,2016,24(1):135-155.
[7] Yu Z,Minming Z,Qidong W,et al.Quantitative investigation of solitary pulmonary nodules:dynamic contrast-enhanced MRI and histopathologic analysis[J].AJR,2008,191(1):252-259.
[8] Schaefer JF,Joachim V,Fritz S,et al.Solitary pulmonary nodules:dynamic contrast-enhanced MR imaging:perfusion differences in malignant and benign lesions[J].Radiology,2004,232(2):544-553.
[9] Coolen J,Vansteenkiste J,de Keyzer F,et al.Characterisation of solitary pulmonary lesions combining visual perfusion and quantitative diffusion MR imaging[J].Eur Radiol,2014,24(2):531-541.
[10] Jeswani T,Padhani AR.Imaging tumour angiogenesis[J].Cancer Imaging,2005,5(1):131-138.
[11] Fujimoto K.Usefulness of contrast-enhanced magnetic resonance imaging for evaluating solitary pulmonary nodules[J].Cancer Imaging,2008,8(1):36-44.
[12] Yoshiharu O,Hiroto H,Daisuke T,et al.Solitary pulmonary nodules:potential role of dynamic MR imaging in management initial experience[J].Radiology,2002,224(2):503-511.
[13] Kono R,Fujimoto KH,Muller N,et al.Dynamic MRI of solitary pulmonary nodules:comparison of enhancement patterns of malignant and benign small peripheral lung lesions[J].Diag Radiol,2007,2008(1):33-34.
Diagnostic value of dynamic contrast enhanced MRI in pulmonary nodules or masses.
ZHOU Shu-chang,LI Zhi-wei,XIA Li-ming,et al.
Department of Radiology,Tongji Hospitial,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective: The aim of this study was to investigate the value of dynamic contrast-enhanced MRI (DCE-MRI) in the diagnosis of pulmonary nodules or masses.Methods:A total of 66 patients with pulmonary nodules (50 cases with malignant nodules,16 cases with benign lesions) proved by pathology underwent both conventional unenhanced and DCE-MRI scan.Time to contrast enhancement ratio curve (TIC) was obtained,and hemodynamic parameters including maximum CER (MER),time at the peak enhancement ratio (Tmax),mean slope of enhancement (SLE),steepest slope (SS) and washout ratio were measured.Results:TICs in this study can be divided into four types:type A of rapid peak-descending pattern was only found in malignant lesions;type B of rapid peak-plateau pattern could be seen in benign and malignant nodules;type C of gradual increase pattern was mainly seen in benign group and few in malignant tumors;type D of flat pattern was only found in benign lesions.The main enhancement pattern of pulmonary small cell carcinoma and squamous carcinoma was ring-like enhanced.Heterogeneous enhancement was found in pulmonary adenocarcinoma.In the hemodynamic parameters,only Tmaxof benign group was significantly longer,and SLE of benign group was significantly lower compared with malignant group with significant statistical difference (P<0.001;P=0.002).Taking Tmax=280s as cutoff value,the sensitivity,specificity and accuracy for detecting malignant lesions were 88.0%,63.5% and 76.5%,respectively.Conclusion:DCE-MRI can provide perfusion and hemodynamic information of pulmonary nodules,and is of great value in differential diagnosis of benign and malignant tumors of lung,in which Tmaxis the most valuable parameter.
Pulmonary nodule; Pulmonary neoplasm; Magnetic resonance imaging; Dynamic contrast enhanced scan; Enhancement mode; Hemodynamic information; Differential diagnosis
430030 武汉,华中科技大学同济医学院附属同济医院放射科(周舒畅、夏黎明、王玉锦、吴维);572000 海南,海南省第三人民医院(李志伟)
周舒畅(1983-),女,湖北孝感人,博士,主治医师,主要从事胸部影像诊断和研究工作。
夏黎明,E-mail:cjr.xialiming@vip.163.com)
R445.2; R735.7
A
1000-0313(2017)04-0401-06
10.13609/j.cnki.1000-0313.2017.04.022
2016-12-01
2017-03-05)
