1株红树内生真菌Fusarium sp.代谢产物的研究
2017-05-11李文生周丹丽陆盈池钟浩然朱新伟丁唯嘉李春远
李文生, 周丹丽, 陆盈池, 钟浩然, 朱新伟, 丁唯嘉, 李春远
(华南农业大学 材料与能源学院,广东 广州 510642)
1株红树内生真菌Fusarium sp.代谢产物的研究
李文生, 周丹丽, 陆盈池, 钟浩然, 朱新伟, 丁唯嘉, 李春远
(华南农业大学 材料与能源学院,广东 广州 510642)
【目的】研究红树林镰刀菌属真菌Fusariumsp.R5的代谢产物。【方法】采用硅胶柱层析分离纯化代谢产物,波谱技术鉴定结构,滤纸片扩散法测试抗植物病原真菌活性。【结果】分离鉴定5-羟甲基-2-呋喃甲醛(化合物1),(3R,4R)-顺-4-羟基蜂蜜曲菌素(化合物2),(3R,4R)-顺-4,7-二羟基蜂蜜曲菌素(化合物3),Clavatol(化合物4),酒渣碱(化合物5),麦角甾-4, 6, 8(14), 22-四烯-3酮(化合物6),β-谷甾醇(化合物7)、3β-胆甾-5-烯-3-醇(化合物8)、丁二酸和顺丁烯二酸10个化合物。在250 μg·mL-1时,化合物5对香蕉炭疽菌Colletotrichummusae高度抗菌,化合物5和6对番茄枯萎菌F.oxysporum、小麦赤霉菌F.graminearum中度抗菌。【结论】从Fusarium属分离得到化合物1~8,其中,化合物5、6可作为相应农药抗菌先导化合物开展深入研究。
红树内生真菌;Fusariumsp.; 代谢产物; 抗真菌活性
各种真菌引起的病害对农业生产和食品保藏造成了严重的危害,如番茄枯萎病使番茄叶片自下而上变黄、变褐,从而造成果实质量下降或减产[1]。香蕉炭疽病使果实在短期内变黑、腐烂,在种植后期或贮运期间损失尤为严重[2],小麦赤霉病主要引起苗枯、茎基腐、秆腐和穗腐,其中穗腐造成了严重的小麦减产[3]。目前对植物真菌病害的防治主要是依靠化学合成农药,但长期频繁地使用化学合成农药,不仅使病原菌抗药性增强,而且带来了农药残留问题,造成环境污染[4]。为克服化学合成农药的缺点,有必要从天然植物或微生物代谢产物中寻找安全无公害的替代品。近年来,已从微生物代谢产物中分离到许多具有抗植物病原菌活性的化合物[5-7]。镰刀菌属真菌Fusariumsp.是一类在自然界分布广泛的微生物,已从该属菌中获得了抗植物病原菌、抗氧化、抗肿瘤等的活性物质[8-9]。在对采集自湛江沿海半红树植物苦槛蓝Myoporumbontioides内生真菌的研究中,丁唯嘉等[10]发现分离自根部的Fusariumsp. R5在液体培养时其粗提取物显示了较好的抗植物病原真菌活性。因此进一步开展了该菌代谢产物的研究,以寻找相应的抗菌先导化合物。本文研究了真菌Fusariumsp. R5代谢产物的分离、鉴定、抗菌活性测试等内容。
1 材料与方法
1.1 仪器与材料
AV 600核磁共振波谱仪(瑞士Bruker Biospin AG公司); APCI 2000液质联用仪(加拿大MDS SCIEX公司); SEPA-300旋光仪(日本Horiba公司);薄层层析和柱层析硅胶为青岛海洋化工厂生产,所用试剂均为市售分析纯。
真菌Fusariumsp. R5采集自广东湛江红树林植物苦槛蓝的根部,通过形态学进行了初步鉴定[10]。植物病原菌番茄枯萎菌F.oxysporumSchlecht. f. sp. lycopersici (Sacc.) W.C. Snyder et H.N. Hansen、小麦赤霉菌F.graminearumSchw.和香蕉炭疽菌Colletotrichummusae(Berk.&M. A. Curtis) Arx引种自华南农业大学农学院,以上菌株均保藏于华南农业大学材料与能源学院。
1.2 菌种鉴定及发酵
将纯的单孢菌接种在马铃薯蔗糖琼脂(PSA)培养基上,放置在28 ℃恒温培养箱中黑暗培养。4 d后观察其生长情况和菌落形态, 15 d后观察大、小型分生孢子。综合观察的形态特征,初步鉴定到属。接着采用PCR 扩增真菌核糖体ITS 基因区段进行真菌鉴定的方法[11],对菌株的菌属进行进一步验证。用CTAB法提取总DNA[12],用rDNA-ITS序列通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)与ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)[13]进行PCR反应。反应体系为:TaqPlus PCR MasterMix [天根生化(北京)科技有限公司] 25 μL,上游引物和下游引物各2 μL,模板DNA(10 ng) 1 μL,ddH2O 21 μL,总体积50 μL。反应程序为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸35 s,共30个循环,最后 72 ℃ 延伸10 min。扩增产物进行10 g·L-1的琼脂糖凝胶电泳。PCR产物送至深圳华大基因医学有限公司进行测序,根据测序的核苷酸序列在NCBI网站进行Blast相似性比对。在显示出的结果中,排列在最前面匹配最高的菌属鉴定为该样品菌属。最后综合2种方法结果确定菌株的菌属。
发酵培养基:葡萄糖10 g·L-1,蛋白胨2 g·L-1,酵母膏1 g·L-1,粗海盐2 g·L-1,pH为7。在500 mL锥形瓶中装入培养液300 mL,于121 ℃,0.1 MPa高温高压灭菌30 min后接种,28 ℃条件下静置培养30 d,过滤,收集发酵液和菌体,共培养150 L。
1.3 代谢物提取与分离
发酵液过滤除去菌丝后,用乙酸乙酯萃取,共萃取4次,减压浓缩萃取液,合并浓缩液,经硅胶柱层析, 以石油醚-乙酸乙酯(体积比100∶0~0∶100)、乙酸乙酯-甲醇(体积比100∶0~0∶100)系统梯度洗脱,在V(石油醚) ∶V(乙酸乙酯) = 35 ∶ 65时得到化合物1 (25 mg);在V(石油醚) ∶V(乙酸乙酯) = 65∶35时得到化合物2和3的粗品,再经硅胶制备薄层色谱,在V(石油醚) ∶V(乙酸乙酯) = 75∶25时得到化合物2 (5 mg)和3 (4 mg);在V(石油醚) ∶V(乙酸乙酯) = 75 : 25时得到化合物4的粗品,再经重结晶得到化合物4 (10 mg);在V(乙酸乙酯) ∶V(甲醇) =80∶20时分离得到化合物5 (8 mg);在V(石油醚) ∶V(乙酸乙酯)= 90∶10时得到化合物6 (25 mg);在V(石油醚) ∶V(乙酸乙酯) = 85∶15时得到化合物7和8的粗品,再经重结晶得到化合物7 (12 mg)和8 (14 mg);在V(石油醚) ∶V(乙酸乙酯)= 50∶50时得到化合物9 (18 mg)和10 (7 mg)。
1.4 化合物结构鉴定
通过分析化合物的氢谱(1HNMR)、碳谱(13C NMR)、质谱(ESIMS)等试验数据,与文献对照或与标准品对照薄层和熔点等,鉴定化合物1~10的结构。
1.5 化合物抗菌活性测试
采用滤纸片扩散法[14]测试部分化合物对番茄枯萎菌、香蕉炭疽菌、小麦赤霉菌的抗菌活性,接种后28 ℃条件下培养,番茄枯萎菌、香蕉炭疽菌培养48 h,小麦赤霉菌培养24 h,用多菌灵作为阳性对照,用溶解化合物的溶剂(体积分数为5%的二甲基亚砜)为空白对照。抑菌圈直径用十字交叉法测量,每种样品同一植物病原菌在每个培养皿上测试2组,重复3次,最终以6组抑菌圈数据的平均值±标准误表示。
1.6 数据处理
采用SPSS 17.0统计软件进行单因素方差(One-way ANOVA)和相关性分析,差异显著性分析采用邓肯氏多重差异比较(Duncan’s multiple range tests)。
2 结果与分析
2.1 菌株菌属鉴定结果
菌株在最初分离得到时已通过形态学进行了初步鉴定[10],其菌株培养性状为:在PSA培养基上,培养48 h菌落为白色,菌丝呈棉絮状,随后菌落颜色逐渐变红,颜色随时间延长而加深,约5 d后菌丝表面呈粉状,培养基表面和内部呈现玫瑰色,后期布满整个培养皿。形态特征: 培养15 d后大型分生孢子呈弯曲镰刀状,顶渐尖,足细胞较明显,5~10个隔膜,(6.8~8.9) μm × (40.7~44.6) μm。小型分生孢子数量多,呈链状、卵形、椭圆形、圆柱形,(2.9~4.9) μm × (1.5~2.8) μm,0~1个隔膜。与文献[15-16]对照符合镰刀菌属特征。进一步用PCR 扩增真菌核糖体ITS 基因区段的方法验证菌株的菌属,DNA测序结果与NCBI BLAST数据库中编号为FJ037750.1,EU797070.1,HM535409.1和KM231809.1的镰刀属菌相似度均为99%。此结果与形态学鉴定结果吻合,进一步证实该菌株属于镰刀菌属。菌株暂未鉴定到种。
2.2 化合物的试验波谱数据
本文共分离鉴定了10种化合物,分别为5-羟甲基-2-呋喃甲醛(化合物1),(3R,4R)-顺-4-羟基蜂蜜曲菌素(化合物2),(3R,4R)-顺-4,7-二羟基蜂蜜曲菌素(化合物3),Clavatol(化合物4),酒渣碱(化合物5),麦角甾-4, 6, 8(14), 22-四烯-3酮(化合物6),β-谷甾醇(化合物7),3β-胆甾-5-烯-3-醇(化合物8),丁二酸和顺丁烯二酸。其化合物1~8的波谱数据如下:
化合物1:黄色油状物。 ESIMS(m/z): 125 [M-H]-。1H NMR (600 MHz, CD3COCD3)δ9.59 (s, 1H), 7.37 (d, 3.6 Hz, 1H), 6.58 (d, 3.6 Hz, 1H), 4.63 (s, 2H)。13C NMR (150 MHz, CD3COCD3)δ178.1, 162.9, 153.4, 123.8, 110.2, 57.5。
化合物4:无色针状晶体。ESIMS(m/z): 179 [M-H]-。1H NMR (600 MHz, CD3COCD3)δ12.93 (s, 1H), 9.50 (s, 1H), 7.48 (s, 1H), 2.54 (s, 3H), 2.13 (s, 3H), 2.01(s, 3H)。13C NMR (150 MHz, CD3COCD3)δ203.1, 160.6, 160.6, 130.3, 115.9, 112.2, 110.3, 26.2, 16.2, 8.2。
化合物5:淡黄色针状晶体。 ESIMS(m/z): 309 [M+H]+。1H NMR (600MHz, CD3SOCD3)δ11.60 (s, 1H), 8.84 (s, 1H), 8.42 (dd, 7.8, 1.2 Hz, 1H), 7.82 (dd, 8.0, 1.2 Hz, 1H), 7.65 (t, 7.8, 8.0 Hz, 1H), 7.42 (d, 3.6 Hz, 1H), 7.35 (t, 7.8, 8.0 Hz, 1H), 6.62 (d, 3.6 Hz, 1H), 4.69 (s, 2H)。13C NMR (150 MHz, CD3SOCD3)δ166.9, 157.7, 151.7, 141.8, 137.4, 132.9, 132.3, 130.3, 129.4, 122.5, 121.4, 121.0, 116.2, 113.2, 111.5, 109.7, 56.4。
化合物6:黄色油状物。ESIMS(m/z): 393 [M+H]+。1H NMR (600 MHz, CDCl3)δ6.60 (d, 9.6 Hz, 1H), 6.02 (d, 9.6 Hz, 1H), 5.73 (s, 1H), 5.24 (dd, 7.5, 15.1 Hz, 1H), 5.18 (dd, 7.5, 15.1Hz, 1H,), 2.52 (m, 1H), 2.46 (m, 1H), 2.33 (m, 2H), 2.11 (m, 1H), 2.08 (m, 2H), 1.98 (m, 1H), 1.85 (m, 1H), 1.78 (m, 1H), 1.77 (m, 1H), 1.66 (m, 1H), 1.60 (m, 1H), 1.45 (m, 1H), 1.43 (m, 1H), 1.25(m, 1H),1.23 (m, 1H), 1.05 (d, 6.7 Hz, 3H), 0.99 (s, 3H), 0.96 (s, 3H), 0.93 (d, 6.8 Hz, 3H), 0.84 (d, 6.8 Hz, 3H), 0.83 (d, 6.8 Hz, 3H)。13C NMR (150 MHz, CDCl3)δ199.5, 164.3, 156.1, 135.0, 134.0, 132.5, 124.5, 124.4, 123.0, 55.7, 44.3, 44.0, 42.9, 39.3, 36.7, 35.6, 34.1, 34.1, 33.1, 27.7, 25.4, 21.2, 20.0, 19.6, 19.0, 18.9, 17.6, 16.6。
化合物7:无色针状晶体。ESIMS(m/z): 415 [M+H]+。1H NMR (600 MHz, CDCl3)δ5.35 (s, 1H), 3.57 (m, 1H), 1.25 (s, 3H), 0.92 (d, 6.9 Hz, 3H), 0.84 (t, 6.9 Hz, 3H), 0.82 (d, 7.0 Hz, 3H), 0.67 (s, 3H)。13C NMR ( 150 MHz, CDCl3)δ: 142.5, 121.7, 71.4, 57.6, 56.7, 51.0, 45.9, 43.2, 43.3, 39.9, 38.0, 37.0, 36.6, 34.6, 32.8, 32.6, 32.6, 29.8, 28.8, 26.6, 25.1, 23.6, 21.3, 20.0, 19.9, 19.6, 19.5, 12.2, 12.0。
化合物8:无色针状晶体。ESIMS(m/z): 387 [M+H]+。1H NMR (600 MHz, CDCl3)δ5.29 (d, 1H), 3.56 (q, 1H), 0.99 (s, 3H), 0.69 (s, 3H);13C NMR (150 MHz, CDCl3)δ140.7, 121.7, 71.8, 56.7, 56.4, 50.2, 42.5, 39.6, 39.7, 37.5, 36.5, 36.4, 35.7, 31.6, 31.6, 28.3, 28.2, 24.5, 23.6, 22.5, 22.5, 21.4, 19.1, 18.7, 11.5。
丁二酸和顺丁烯二酸数据略。
2.3 化合物结构鉴定
化合物1:1H NMRδ7.37 (d, 3.6 Hz, 1H), 6.58 (d, 3.6Hz, 1H)的芳香H从偶合常数和化学位移判断是呋喃3,4位上的H,δ9.59 (s, 1H)是醛基的H,4.63 (s, 2H)结合13C NMRδ57.5表明分子中存在1个羟甲基,波谱数据与文献[17]报道基本一致,鉴定化合物1为5-羟甲基糠醛。其分子结构见图1。
化合物2:1H NMRδ7.52 (dd, 8.4, 7.2 Hz, 1H), 7.02 (dd, 8.4, 1.2 Hz, 1H), 6.92 (dd, 1.2, 7.2 Hz, 1H),提示存在1, 2, 3-三取代苯环,δ10.97 (s, 1H)的高尖峰是与羰基形成分子内氢键的—OH信号,δ1.58 (d, 6.0 Hz, 3H)是和CH相连的甲基,δ4.68 (m, 1H), 4.58 (d, 2.4 Hz, 1H)是2个分别连氧的CH。以上数据结合13C NMR可判断分子为有取代2个羟基、1个甲基的二氢异香豆素类化合物,有关波谱数据及比旋光度与文献[18]报道基本一致,确定化合物2为(3R,4R)-顺-4-羟基蜂蜜曲菌素。其分子结构见图1。
化合物3:1H NMR从峰形和数据上看与化合物2类似,提示仍属于二氢异香豆素类,较明显的区别在于化合物3的1H NMR只显示δ7.18 (d, 9.0 Hz, 1H), 6.83 (d, 9.0 Hz, 1H)这2个互为邻位的芳香H,表明与化合物2相比,苯环上1个H被取代。由于碳谱未显示多余碳的信号,推测该取代基可能是羟基,波谱数据及比旋光度与文献[19]基本一致,鉴定化合物3为(3R,4R)-顺-4,7-二羟基蜂蜜曲菌素。其分子结构见图1。
化合物4:1H NMRδ7.48 (s, 1H)结合13C NMR 表明分子中存在1个五取代苯环,1H NMRδ12.93 (s, 1H), 9.50 (s, 1H)是2个羟基,其中δ12.93 (s, 1H)的高尖峰与羰基形成了分子内氢键,δ2.54 (s, 3H), 2.13 (s, 3H), 2.01(s, 3H)分别为3个甲基。由于分子中存在1个羰基,推测有其中1个甲基连在羰基上形成了1个乙酰基,另外2个甲基则直接连在苯环上。波谱数据与文献[20]基本一致,鉴定化合物4为Clavatol。其分子结构见图1。
化合物5:1H NMRδ11.60 (s, 1H), 8.84 (s, 1H), 8.42 (dd, 7.8, 1.2 Hz, 1H), 7.82 (dd, 8.0, 1.2 Hz, 1H), 7.65 (t, 7.8, 8.0 Hz, 1H), 7.35 (t, 7.8, 8.0 Hz, 1H)是典型的β-咔啉生物碱特征信号,δ7.42 (d, 3.6 Hz, 1H), 7.35 (t, 7.8, 8.0 Hz, 1H), 6.62 (d, 3.6 Hz, 1H), 4.69 (s, 2H)与化合物1进行对比,判断分子中存在1个2位被取代的5-羟甲基呋喃结构单元,波谱数据与文献[21]基本一致,鉴定化合物5为酒渣碱。其分子结构见图1。
化合物6:氢谱和碳谱提示属于甾醇类,1H NMRδ1.05 (d, 6.7 Hz, 3H), 0.93 (d, 6.8 Hz, 3H), 0.84 (d, 6.8 Hz, 3H), 0.83 (d, 6.8 Hz, 3H)是连在CH上的甲基,0.99 (s, 3H), 0.96 (s, 3H)是连在季碳上的甲基,1H NMRδ6.60 (d, 9.6 Hz, 1H), 6.02 (d, 9.6 Hz, 1H), 5.73 (s, 1H), 5.24 (s, 2H)及13C NMRδ1 164.3, 156.1, 135.0, 134.0, 132.5, 124.5, 124.4, 123.0说明分子中存在4个双键,13C NMRδ199.5的信号表明分子中存在1个α,β不饱和羰基。波谱数据与文献[22]基本一致,鉴定化合物6为麦角甾-4, 6, 8(14), 22-四烯-3酮。其分子结构见图1。
化合物7和8结构通过与实验室标准品进行核磁共振波谱、薄层层析及文献[23-24]对照,确定为β-谷甾醇、3β-胆甾-5-烯-3-醇。其分子结构见图1。
丁二酸和顺丁烯二酸通过与实验室标准品进行核磁共振波谱、薄层层析对照确定。
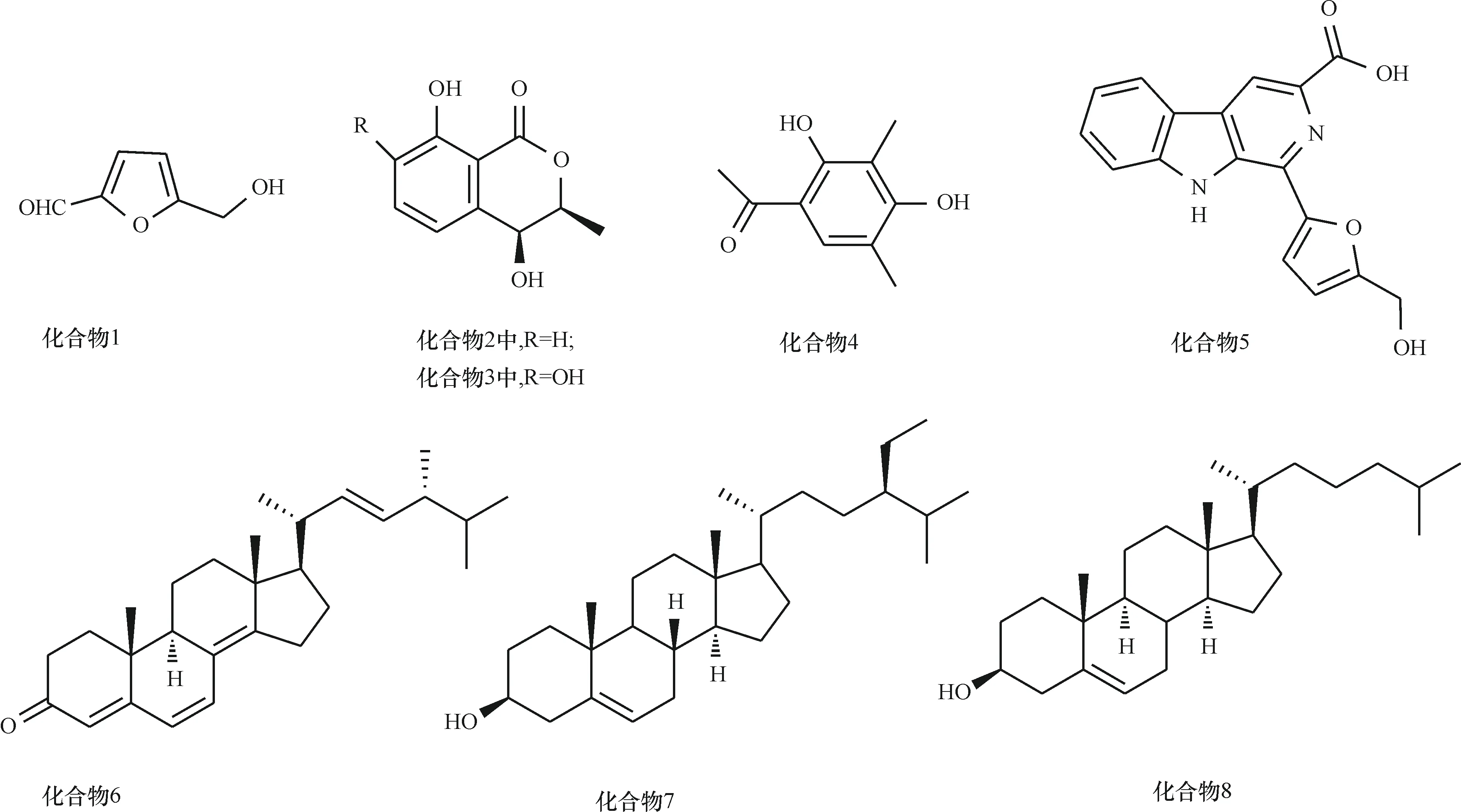
图1 化合物1~8的分子结构
2.4 抗植物病原菌活性测试结果
采用滤纸片扩散法测试了化合物1,2,4,5,6对番茄枯萎菌、香蕉炭疽菌和小麦赤霉菌的抗菌活性。一般认为,抑菌圈在6~10 mm之间表示对该菌株有轻度抗菌作用,11~15 mm为中度抗菌,16~20 mm为高度抗菌[25]。由表1可知,在质量浓度为250 μg·mL-1时,化合物5对香蕉炭疽菌显示了高度抗菌活性;化合物5和6对番茄枯萎菌和小麦赤霉菌显示中度抗菌作用;化合物6对香蕉炭疽菌显示轻度抗菌作用;其他测试化合物除化合物1对番茄枯萎菌无抗菌活性外,均对3种测试菌株显示了轻度抗菌活性。
表1 化合物1、2、4、5和6的抗植物病原菌活性1)
Tab.1 Antifungal activities of compounds 1, 2, 4, 5 and 6 against plant pathogens
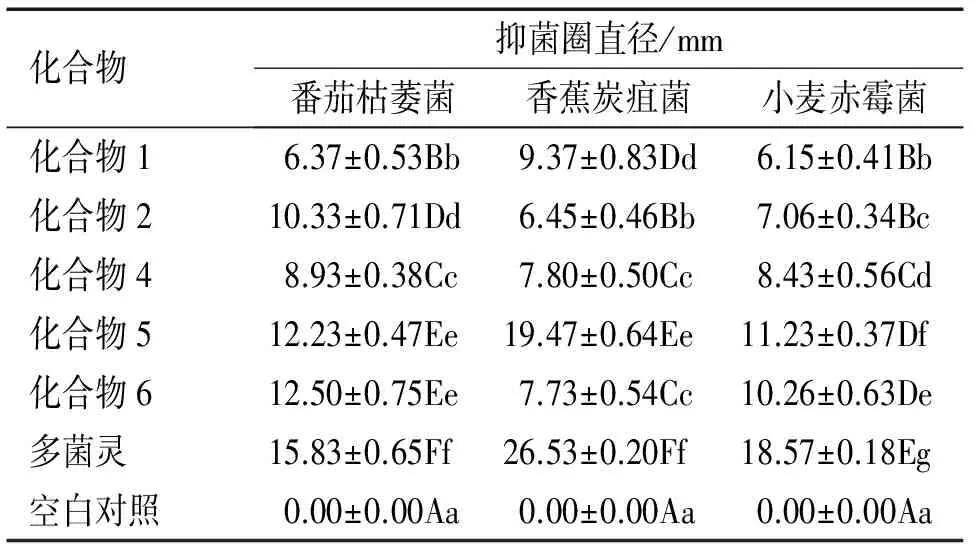
化合物抑菌圈直径/mm番茄枯萎菌香蕉炭疽菌小麦赤霉菌化合物16.37±0.53Bb9.37±0.83Dd6.15±0.41Bb化合物210.33±0.71Dd6.45±0.46Bb7.06±0.34Bc化合物48.93±0.38Cc7.80±0.50Cc8.43±0.56Cd化合物512.23±0.47Ee19.47±0.64Ee11.23±0.37Df化合物612.50±0.75Ee7.73±0.54Cc10.26±0.63De多菌灵15.83±0.65Ff26.53±0.20Ff18.57±0.18Eg空白对照0.00±0.00Aa0.00±0.00Aa0.00±0.00Aa
1) 表中数据为6组数据的平均值±标准误;同列数据后凡是具有一个相同大、小写字母者,表示0.01、0.05水平差异不显著(Duncan’s法)。
3 讨论与结论
从该红树内生真菌共分离鉴定了10种化合物,结构类型具有多样性,有呋喃衍生物、异香豆素、生物碱、甾醇等。其中化合物2、3、4、5鲜见从Fusarium属真菌中分离得到。滤纸片扩散法抗菌活性测试表明,在质量浓度为250 μg·mL-1时,化合物5对香蕉炭疽菌显示了高度抗菌活性,对番茄枯萎菌和小麦赤霉菌显示了中度抗菌作用;化合物6对番茄枯萎菌和小麦赤霉菌显示中度抗菌作用,推测它们是提取物显示抗植物病原菌的重要原因之一。据文献报道,化合物1有抗氧化及抑制皮肤黑色素瘤细胞和结肠癌细胞增殖活性[26],化合物2对P388小鼠白血病细胞和枯草芽孢杆菌有很高的抑制活性[27],化合物4对金黄色葡萄球菌,耐甲氧西林金黄色葡萄球菌和多药耐药金黄色葡萄球菌有中度抗菌活性[19],化合物5有很强的抑制HL-60细胞增殖活性[28],化合物6对HL-60细胞显示强细胞毒活性[29],但鲜见上述化合物对这3种植物病原菌的抗菌活性报道,本文的研究丰富了天然微生物源农药抗菌化合物库。
[1] SARKER A, SULTANA N, ISLAM M R, et al. Efficacy of some rhizosphere microorganisms in controllingFusariumwilt of tomato (Lycopersiconesculentum)[J]. Agriculturists, 2013, 11(2): 96-103.
[2] INTAN SAKINAH M A, SUZIANTI I V, LATIFFAH Z. Phenotypic and molecular characterization ofColletotrichumspecies associated with anthracnose of banana (Musaspp.) in Malaysia[J]. Genet Mol Res, 2014, 13(2): 3627-3637.
[3] AVOZANI A, REIS E M, TONIN R B.Invitrosensitivity reduction ofFusariumgraminearumto DMI and QoI fungicides[J]. Summa Phytopathol, 2014, 40(4): 358-364.
[4] MAHLO S M, MCGAW L J, ELOFF J N. Antifungal activity of leaf extracts from South African trees against plant pathogens[J]. Crop Prot, 2010, 29(12): 1529-1533.
[5] WANG X M, RADWAN M M, TARAWNEH A H,et al. Antifungal activity against plant pathogens of metabolites from the endophytic fungusCladosporiumcladosporioides[J]. J Agric Food Chem,2013, 61(19): 4551-4555.
[6] ZHANG J, WANG X J, YAN Y J, et,al. Isolation and identification of 5-hydroxyl-5-methyl-2-hexenoic acid fromActinoplanessp. HBDN08 with antifungal activity[J]. Bioresour Technol, 2010, 101(21): 8383-8388.
[7] ZHANG W, WEI W, SHI J,et al. Natural phenolic metabolites from endophyticAspergillussp. IFB-YXS with antimicrobial activity[J]. Bioorg Med Chem Lett, 2015, 25(13): 2698-2701.
[8] 胡晓兰,徐文峰,卢轩,等. 植物内生真菌Fusariumssp. LC-1次级代谢产物的研究[J]. 中国药学杂志, 2013,48(1): 17-21.
[9] 宋双,薛艳钰,陆勇军,等. 南海红树林内生真菌Fusariumsolani387#次级代谢产物研究[J]. 中山大学学报(自然科学版), 2015, 54(5): 67-71.
[10]丁唯嘉,张穗强,龚兵,等. 半红树植物苦槛蓝内生真菌的分离及抗植物病原菌活性研究[J]. 广东农业科学, 2014, 41(3): 74-78.
[11]孙静,谢淑娜,刘佳中,等. 河南省玉米茎基部镰刀菌的形态和分子鉴定[J]. 植物病理学报, 2014, 44(1): 8-16.
[12]王娜,钱冠兰,李晓捷,等. 海带配子体克隆中一株镰刀菌的分离鉴定[J]. 微生物学通报, 2010, 37(10): 1491-1494.
[13]郭鹏豪,刘秀丽,崔颖鹏,等. 真菌通用引物Its1和Its4在丝状真菌鉴定中的价值评价[J]. 中国微生态学杂志, 2013, 25(8): 922-924.
[14]CHEN M, ZHOU J R, LI C Y,et al. Isolation, identification and bioactivity of allelochemicals ofStreptomycessp. strain 6803[J]. Allelopathy J, 2009, 23(2): 411-424.
[15]魏景超. 真菌鉴定手册[M].上海:上海科学技术出版社, 1979.
[16]蒋桂芝,刘静,李国华. 镰刀菌引起的橡胶树两种新病害[J]. 西南大学学报(自然科学版), 2015, 37(3): 42-47.
[17]李医明,蒋山好,高文运,等. 玄参的脂溶性化学成分[J]. 药学学报, 1999, 34(6): 448-450.
[18]KROHN K, KOCK I, ELSSSER B, et al. Bioactive natural products from the endophytic fungusAscochytasp. fromMeliotusdentatus:Configurational assignment by solid-state CD and TDDFT calculations[J]. Eur J Org Chem, 2007(7): 1123-1129.
[19]OLIVEIRA C M, REGASINI L O, SILVA G H, et al. Dihydroisocoumarins produced byXylariasp. andPenicilliumsp., endophytic fungi associated withPiperaduncumandAlibertiamacrophylla[J]. Phytochem Lett, 2011, 4(2): 93-96.
[20]YANG G H, NENKEP V N , SIWE X N,et al. An acetophenone derivative, clavatol, and a benzodiazepine alkaloid, circumdatin A, from the marine-derived fungus cladosporium[J]. Nat Prod Sci, 2009, 15(3): 130-133.
[21]SU B N, CHANG L C, PARK E J,et al. Bioactive constituents of the seeds ofBruceajavanica[J]. Planta Med, 2002, 68(8): 730-733.
[22]LEE W Y, PARK Y, AHN J K,et al. Cytotoxic activity of ergosta-4, 6, 8 (14), 22- tetraen-3-one from the sclerotia ofPolyporusumbellatus[J]. Bull Korean Chem Soc, 2005, 26(9): 1464-1466.
[23]ISAEV I M, MAMEDOVA R P, AGZAMOVA M A,et al. Triterpene glycosides fromAstragalusand their genins: LXXV: Sterols and triterpenoids fromAstragalusorbiculatus[J]. Chem Nat Comp, 2007, 43(3): 358-359.
[24]艾尼娃尔·艾克木,热娜·卡斯木. 新疆黑种草子的化学成分研究[J]. 中药材, 2007, 30(10): 1259-1261.
[25]李勇,李铭刚. 放线菌YIM31249发酵液萃取物的抗菌活性初步研究[J]. 化工时刊, 2004, 18(5): 45-46.
[26]赵玲,陈建平,李琳,等. 5-羟甲基糠醛抗氧化性及其抗细胞增殖活性的研究[J]. 现代食品科技, 2013, 29(11): 2638-2642.
[27]SANTIAGO C, SUN L, MUNRO M H G, et al. Polyketide and benzopyran compounds of an endophytic fungus isolated fromCinnamomummollissimum: Biological activity and structure[J].Asian Pac J Trop Biomed, 2014, 4(8): 627-632.
[28]NISHIO M, YUASA K, OKIMURA K,et al. Cellular effects of tamari soy sauce-derived 1-[5-(Hydroxymethyl)furan-2-yl]-9H- pyrido[3,4-b]indole-3-carboxylic acid (Flazin)[J]. Food Sci Technol Res, 2012, 18(6): 919-922.
[29]THAO N P, LUYEN B T T, DIEP C N,et al.Invitroevaluation of the antioxidant and cytotoxic activities of constituents of the mangroveLumnitzeraracemosaWilld.[J]. Arch Pharm Res, 2015, 38(4): 446-455.
【责任编辑 李晓卉】
Study on the metabolites of a mangrove endophytic fungusFusariumsp.
LI Wensheng, ZHOU Danli, LU Yingchi, ZHONG Haoran, ZHU Xinwei, DING Weijia, LI Chunyuan
(College of Materials and Energy, South China Agricultural University, Guangzhou 510642,China)
【Objective】 To study the metabolites of a mangrove fungusFusariumsp. R5. 【Method】The fermented filtrate of R5 fungus was isolated by silica gel column chromatography. The structures of the metabolites were characterized by spectral analyses. The antifungal activities were investigated using the paper disc-agar diffusion method. 【Result】Ten compounds were isolated and identified as 5-hydroxymethyl-2-furaldehyde (compound 1), (3R,4R)-cis-4-hydroxymellein (compound 2), (3R,4R)-cis-4,7-dihydroxymellein (compound 3), clavatol (compound 4), flazine (compound 5), ergosta-4, 6, 8(14), 22-tetraen-3-one (compound 6),β-sitosterol (compound 7), 3β-cholest-5-en-3-ol (compound 8), butanedioic acid and maleic acid. At the concentration of 250 μg·mL-1, compound 5 showed high inhibitory activity againstColletotrichummusae(Berk.&M. A. Curtis) Arx., compounds 5 and 6 showed moderate inhibitory activity againstF.oxysporumandF.graminearumSchw.【Conclusion】Compounds 1~8 are isolated fromFusariumsp. and among them, compounds 5 and 6 could be used as the lead compounds in antifungal agents.
mangrove endophytic fungus;Fusariumsp.; metabolite; antifungal activity
2016- 07- 01 优先出版时间:2017-04-12
李文生(1990—),男,硕士研究生,E-mail: 719831629@qq.com; 通信作者: 丁唯嘉(1979—),女,讲师,博士,E-mail: dwjzsu@scau.edu.cn;李春远 (1978—),男,教授,博士,E-mail: chunyuanli@scau.edu.cn
国家自然科学基金(21102049);广东省自然科学基金 (2015A030313405,9451064201003751);广东省科技计划(2016A020222019);教育部留学回国人员科研启动基金([2015]311);2017广州市科技计划科学研究一般项目(201707010342);广东省大学生科技创新训练计划(201610564225,201510564196)
O629
A
1001- 411X(2017)03- 0064- 06
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.s.20170412.1414.004.html
李文生, 周丹丽, 陆盈池, 等.1株红树内生真菌Fusariumsp.代谢产物的研究[J].华南农业大学学报,2017,38(3):64- 69.
